Hacer que el anillo aromático esté disponible para el ataque de nucleófilos
La mayoría de las preparaciones de compuestos aromáticos que hemos visto (como la sustitución aromática electrofílica, así como la reacción de Suzuki cubierta en la sección anterior) involucran el anillo aromático como nucleófilo, reaccionando con un reactivo electrofílico. Sustitución aromática nucleofílica (en 17.1.) involucra reactivos nucleofílicos, pero está limitado a anillos con grupos fuertes de extracción de electrones orto o para a un grupo saliente. La forma más versátil de hacer que los anillos aromáticos estén disponibles para el ataque nucleofílico es preparar sales de arenediazonio, que contienen el ion ArN2+. El siguiente diagrama muestra la variedad de reacciones posibles con sales de arenediazonio.

Las sales de arenediazonio se preparan fácilmente a partir de arilaminas (anilinas) mediante un proceso llamado diazotización. El proceso consiste en disolver la amina en un ácido adecuado, enfriarla en un baño de hielo a 0-5 oC, y luego agregar solución de nitrito de sodio (NaNO2). El ácido reacciona con el NaNO2 para formar ácido nitroso (HNO2), que luego reacciona con la arilamina para formar la sal de arenediazonio. La sal más común que se usa para estas reacciones es el cloruro (hecho con HCl como ácido), que es bastante soluble pero se descompone rápidamente a temperatura ambiente. Sin embargo, en algunas reacciones (como la formación de fenol) el ion cloruro puede interferir y sustituir a un Cl, por lo que en esos casos se utiliza el sulfato (hecho con H2SO4). Los sulfatos de diazonio son un poco más estables que los cloruros, pero también son generalmente menos solubles y, por lo tanto, más difíciles de usar. Los tetrafluoroboratos de diazonio se fabrican a partir de cloruros mediante la adición de HBF4; por lo general, son completamente insolubles, lo que permite filtrarlos y luego secarlos para descomponerlos sin agua presente para introducir un flúor en el anillo. Este método para introducir flúor en un anillo aromático se denomina reacción de Balz-Schiemann.
Las sales de arenediazonio son productos intermedios útiles, y fácilmente pierden nitrógeno y reaccionan con una variedad de nucleófilos, como se muestra en el diagrama anterior. Dado que el nitrógeno es muy estable y se pierde como gas, esto proporciona una poderosa fuerza impulsora para que ocurran estas reacciones. En el caso del ion yoduro o agua, el nucleófilo reacciona sin necesidad de catálisis. Sin embargo, muchas reacciones de sales de diazonio son catalizadas por cobre(I), en cuyo caso la reacción se conoce como reacción de Sandmeyer.
Una reacción que retiene los dos nitrógenos implica el acoplamiento a otro anillo aromático (rico en electrones), como se muestra en la parte izquierda del esquema de reacción. Esto es muy importante en la industria de tintes artificiales, que se estableció principalmente utilizando la producción de estos «colorantes azoicos» después del descubrimiento del malva de Perkin en 1856.
Uso en síntesis
La química de la sal de diazonio, basada en reactivos nucleofílicos utilizados con un anillo aromático electrofílico, es complementaria a la sustitución aromática electrofílica (EAS, que utiliza reactivos electrofílicos). Las sales de diazonio se preparan fácilmente a partir de compuestos aromáticos a través de una síntesis de tres pasos:

Si se necesitan otros sustituyentes, estos se pueden introducir durante la síntesis. Si se necesita un sustituyente meta, el sustituyente se introduce en o antes de la etapa nitro; para sustituyentes orto/para, esto se puede hacer en la etapa NH2. El grupo amino en una arilamina (anilina) es un activador muy poderoso, por lo que muchas reacciones EAS de arilaminas introducen rápidamente 2 o 3 sustituyentes a menos que la reactividad del grupo NH2 se modere mediante la formación de una amida – recuerde este método para la protección de aminas a través de la acetilación, del capítulo 16. En algunos casos, el nuevo sustituyente también puede reducirse durante la reducción del grupo nitro, como en esta síntesis de cloruro de meta-propilbencenodiazonio a partir de benceno:
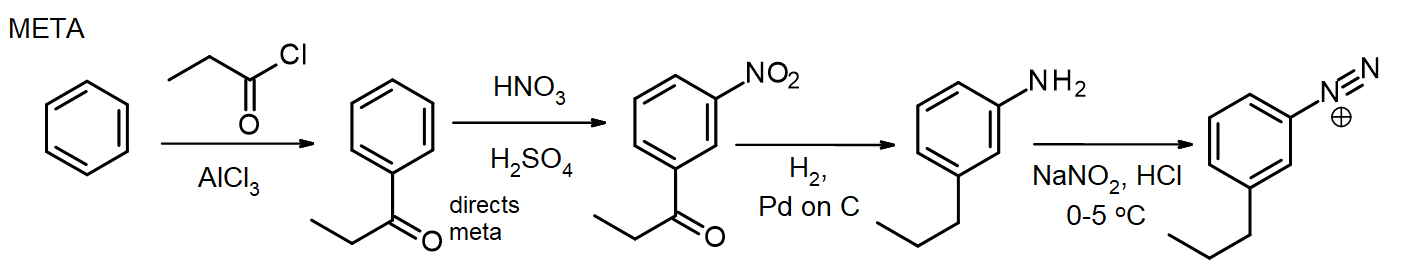
Para la síntesis del paraisómero, la arilamina se acetila antes de la reacción de Friedel-Crafts, luego se desacetila calentando con exceso de aq. HCl justo antes de la diazotización.

Esta síntesis de paraisómeros muestra el uso del grupo acetilo para controlar la reactividad del grupo amino. (Una síntesis alternativa podría evitar esto introduciendo el grupo propilo primero, antes de la nitración. Aunque estas síntesis parecen ser largas, implican pasos sintéticos que son confiables y reproducibles, y siguen un patrón estándar. Además, el hecho de que se puedan introducir diferentes sustituyentes en posiciones seleccionadas a lo largo del camino hace de este enfoque una secuencia sintética muy valiosa.