Hinweise basierend auf Informationen in ‚Basic practical microbiology‘ © Society for General Microbiology.
Informieren Sie sich über aseptische Techniken, bevor Sie mit dieser oder einer anderen praktischen mikrobiologischen Arbeit beginnen.
In einer Gießplatte wird eine kleine Menge Inokulum aus einer Brühkultur per Pipette in die Mitte einer Petrischale gegeben. Gekühltes, aber noch geschmolzenes Agarmedium in einem Reagenzglas oder einer Flasche wird dann in die Petrischale gegossen. Die Schale wird dann sanft gedreht oder hin und her bewegt (zuerst N-S, dann NW-SE, dann NE-SW), um sicherzustellen, dass die Kultur und das Medium gründlich gemischt werden und das Medium die Platte gleichmäßig bedeckt.
Gießplatten ermöglichen das Wachstum von Mikroorganismen sowohl an der Oberfläche als auch im Medium. Die meisten Kolonien wachsen innerhalb des Mediums und sind klein und können konfluent sein. Die wenigen Kolonien, die auf der Oberfläche wachsen, haben die gleiche Größe und das gleiche Aussehen wie die auf einer Streifenplatte.
Diese Platten könnten dann verwendet werden, um die antimikrobielle Wirkung verschiedener Substanzen zu testen. Weitere Informationen finden Sie unter Untersuchung der antimikrobiellen Wirkung.
Andernfalls könnten solche Platten Teil der Untersuchung der Bakterienpopulation in einer Probe sein. Die Kultivierung von seriellen Verdünnungen auf diese Weise erlaubt eine Berechnung der Populationsgröße einer Bakterienprobe. Wenn die Verdünnung und das Volumen des Inokulums, üblicherweise 1 cm3, bekannt sind, kann die lebensfähige Anzahl der Probe pro cm3 bestimmt werden. Die lebensfähige Anzahl ist die Anzahl der Bakterien oder Bakterienklumpen pro cm3. Die gewählten Verdünnungen müssen zwischen 30 und 100 separate zählbare Kolonien erzeugen. (Siehe auch Standardtechnik: Herstellung von Serienverdünnungen)
Gesundheit & Sicherheit und technische Hinweise
1 Verwenden Sie ein Wasserbad bei 50 ° C, um Flaschen mit geschmolzenem Agar aufzubewahren.
2 Achten Sie darauf, den geschmolzenen Agar in den Flaschen nicht mit Wasser aus dem Wasserbad zu verunreinigen. Zur Vermeidung von Verunreinigungen sicherstellen:
i dass das Wasser im Wasserbad in der richtigen Tiefe ist
ii dass die Flaschen aufrecht gehalten werden
iii dass die Außenseiten der Flaschen abgewischt werden, bevor sie verwendet werden.
3 Bei einer gleichmäßig verteilten Gießplatte muss der Boden der Platte bedeckt sein, Agar darf den Deckel der Platte nicht berühren und die Oberfläche muss glatt und blasenfrei sein.
4 CLEAPSS Laboratory handbook Abschnitt 15.2.12 schlägt einige alternative Methoden zur Herstellung einer Gießplatte vor und berücksichtigt deren Vor- und Nachteile.
Vorgehensweise
Inokulation mit einer Pasteur-Pipette
Halten Sie die Pipette stets so ruhig wie möglich.
a Lösen Sie den Deckel/ Wattestäbchen der Flasche mit dem Inokulum.
b Nehmen Sie die sterile Pasteurpipette aus dem Behälter, befestigen Sie den Sauger und halten Sie ihn in der rechten Hand.
c Heben Sie die Flasche/ das Reagenzglas mit dem Inokulum mit der linken Hand an.
d Entfernen Sie die Kappe/ den Wattestäbchen mit dem kleinen Finger Ihrer rechten Hand.
e Flammen Sie den Flaschen-/ Reagenzglashals auf.
f Den Zitzenkolben der Pipette ganz leicht zusammendrücken. Setzen Sie die Pipette in die Flasche / das Reagenzglas und ziehen Sie das erforderliche Volumen der Kultur auf. Drücken Sie den Zitzenkolben der Pipette nicht zusammen, nachdem er sich in der Brühe befindet, da dies Blasen und möglicherweise Aerosole verursachen kann.
g Entfernen Sie die Pipette und öffnen Sie den Hals der Flasche/ des Reagenzglases erneut. Ersetzen Sie die Kappe/ Watte Stecker.
h Stellen Sie die Flasche/ das Reagenzglas auf die Bank oder in das Regal.
Inokulieren der Petrischale
a Heben Sie den Deckel der Petrischale mit der rechten Hand leicht an und führen Sie die Pipette in die Petrischale ein. Geben Sie die erforderliche Menge Inokulum vorsichtig in die Mitte der Schüssel. Setzen Sie den Deckel wieder ein.
b Legen Sie die Pipette in einen Entsorgungsbehälter.
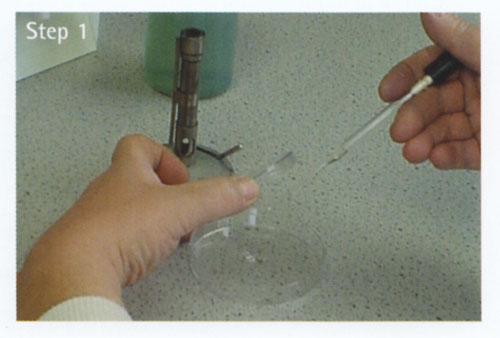
Gießen der Platte
a Nehmen Sie eine Flasche sterilen geschmolzenen Agars aus dem Wasserbad (Anmerkung 1 und 2).
b Halten Sie die Flasche in der rechten Hand. Entfernen Sie die Kappe mit dem kleinen Finger Ihrer linken Hand.
c Flammen Sie den Flaschenhals auf.
d Heben Sie den Deckel der Petrischale mit der linken Hand leicht an und gießen Sie den sterilen geschmolzenen Agar in die Petrischale. Setzen Sie den Deckel wieder ein.
e Öffnen Sie den Flaschenhals und setzen Sie den Verschluss wieder auf.


f Bewegen Sie die Schale vorsichtig, um die Kultur und das Medium gründlich zu mischen und sicherzustellen, dass das Medium die Platte gleichmäßig bedeckt (Anmerkung 3). Bewegen Sie die Schale entweder in drei Richtungen: zuerst N-S, dann NW-SE, dann NE-SW, oder drehen Sie sie, bis das Medium und das Inokulum gut vermischt sind und den Boden der Schale bedecken.
g Lassen Sie die Platte erstarren.
h Halten Sie die Platte geschlossen und inkubieren Sie in einer umgekehrten Position.
Weblinks
Ressourcen für Mikrobiologielehrer
Gesellschaft für Allgemeine Mikrobiologie – Quelle für grundlegende praktische Mikrobiologie, ein ausgezeichnetes Handbuch für Labortechniken und praktische Mikrobiologie für weiterführende Schulen, eine Auswahl bewährter Praktiken mit Mikroorganismen.
Microbiology online
MiSAC (Microbiology in Schools Advisory Committee) wird von der Gesellschaft für Allgemeine Mikrobiologie (siehe oben) unterstützt und ihre Websites enthalten weitere Sicherheitsinformationen und einen Link, um per E-Mail um Rat zu fragen.
(Webseiten aufgerufen im Oktober 2011)