Úvod
neurotrophin nervový růstový faktor (NGF) se podílí několik kritických procesů v rozvojových a zralé savčí nervový systém, včetně cílové inervace, diferenciaci buněk a neuronální přežití (Large et al., 1986; Li et al., 1995; Sofroniew et al., 2001; Lad et al., 2003). V dospělém mozku hraje NGF klíčovou roli v udržování a funkci bazálního předního mozku cholinergního systému (Lad et al., 2003). Úrovně NGF jsou nejvyšší v oblastech, které dostávají největší počet cholinergních projekcí bazálního předního mozku, jmenovitě hipokampus a kůra (Korsching et al ., 1985; Shelton a Reichardt, 1986), a receptory pro NGF v kůře jsou do značné míry omezeny na bazální přední mozek corticopetal projekce (Kordower et al., 1988; Sofroniew et al., 2001; Rossi a kol., 2002). Signalizace nervového růstového faktoru udržuje cholinergní kortikopetální projekce během dospělosti (Chen et al ., 1997; Debeir et al., 1999) a může zabránit degeneraci těchto neuronů po přetnutí jejich axony (Hefti, 1986; Tuszynski et al., 1990; Kordower et al., 1994). Kromě toho NGF zvyšuje uvolňování acetylcholinu z bazálních předních mozkových kultur (Auld et al., 2001) a může modulovat cholinergní funkci prostřednictvím fenotypové kontroly lokusu cholinergního genu (Rylett et al ., 1993; Hu et al., 1997).
bazálního předního mozku cholinergní systém ovlivňuje učení a zkušenosti-dependent plasticity v kůře (Bakin a Weinberger, 1996; Kilgard a Merzenich, 1998; Conner et al., 2003, 2005), a NGF signalizace byla vyslovena hypotéza, podpořit a případně zvýšit, bazálního předního mozku-zprostředkované učení a plasticity. Například blokáda NGF signalizace přes opakované injekce NGF protilátek v insulárním kortexu snižuje místní cholinergní inervace a narušuje pořízení dvou procesů, které jsou závislé na integritě cholinergní vstupy, podmíněné chuťové averze a inhibičního vyhýbání se učení (Gutierrez et al., 1997). Nedávná studie Conner et al. (2009) ukázala, že obě prostorové učení a hipokampu dlouhodobé potenciace (LTP) jsou rozšířeny po infuzích NGF do septální jádra, primární zdroj cholinergní inervaci hipokampu.
fokální aplikace NGF může také vyvolat rychlou expanzi lokálního zastoupení vousů v barelové kůře krys. Tento proces je závislý na cholinergních projekcích z bazálního předního mozku (Prakash et al ., 1996, 2004), což naznačuje, že kortikální signalizace NGF může stimulovat rychlou cholinergně závislou funkční reorganizaci. NGF se tedy kromě dlouhodobých trofických účinků na cholinergní buňky bazálního předního mozku může také podílet na krátkodobé remodelaci obvodu. Tento „dual-action“ hypotéza je podporována existence konstitutivní a činnosti závislé na uvolnění mechanismy NGF (Blochl a Thoenen, 1995; Lessmann et al., 2003), které jsou potenciálně základem dlouhodobých trofických a krátkodobých modulačních účinků NGF. Kromě toho byly pro NGF pozorovány jak retrográdní (dlouhodobé), tak lokální (krátkodobé) signální dráhy (Huang a Reichardt, 2003).
Buněk exprimujících NGF byly zjištěny v kůře, mozečku, hipokampu, thalamu, striatu, bazálního předního mozku a mozkového kmene (Gall a Isackson, 1989; Maisonpierre et al., 1990; Isackson et al., 1991; Conner a Varon, 1992; Hayashi a kol., 1993; Mufson a kol., 1994; Zhang et al., 2007). Ačkoli NGF mRNA byla údajně pozorována v astrocytech a jiných gliích, drtivá většina kortikálních NGF je produkována neurony (Sofroniew et al ., 2001). Specifické typy neuronů, které produkují NGF v kůře, však nejsou známy a ukázalo se, že cholinergní kortikopetální projekce inervují excitační i inhibiční neurony v kůře (Zaborszky et al ., 1999). V mimokortikálních oblastech, jako je hippocampus, striatum a bazální přední mozek, je produkce NGF převážně lokalizována na GABAergní inhibiční neurony (Lauterborn et al ., 1993, 1995; Pascual et al., 1998; Bizon a kol., 1999). Identifikace buněk produkujících NGF v kůře je důležitá pro identifikaci potenciálních mechanismů, které jsou základem modulace cholinergních kortikálních vstupů, a mechanismy kortikální plasticity. V současné studii identifikujeme podmnožinu kortikálních GABAergních buněk jako primární zdroj produkce NGF v dospělé kůře, s relativně vzácnou produkcí glutamatergickými neurony.
materiály a metody
všechny subjekty byly léčeny v souladu s institucionálními pokyny pro péči o zvířata. Vzhledem k nízké endogenní hladiny kortikální NGF výraz, který zakazuje identifikace specifických buněk–typ zdroje NGF v předchozích studiích, jsme provedli místní kolchicin čaje inhibují mikrotubulové polymerace, čímž blokuje NGF dopravy pryč z těla buňky a má za následek hromadění zjistitelné NGF antigen v soma produkovat buňky (Schubert et al., 1972; Hokfelt a kol., 1975; Hanson a Edström, 1978; Conner a Varon, 1992). Předchozí zprávy ukázaly, že léčba kolchicinem zvyšuje detekci NGF pomocí imunohistochemických technik(Conner a Varon, 1992). Kromě toho hladiny kolchicinu podobné hladinám použitým v současné studii nevyvolávají hrubé abnormality v neuronální distribuci člena rodiny neurotrofinů BDNF(Conner et al ., 1997).
Příprava Tkáně
Osm dospělých Fischer 344 potkanů (4 samci, 4 samice; Harlan Sprague Dawley) byly v narkóze s 2 ml/kg 25 mg/ml ketaminu, 1,3 mg/ml xylazinu, a 0,25 mg/ml acepromazin koktejl, a injekčně s 5.0 µl kolchicinu (10 µg / µl v aCSF) na níže uvedených kortikálních místech rychlostí 0, 5 µl/min za použití 10 µl Hamiltonovy stříkačky. Po infuzi zůstala jehla na místě po dobu čtyř minut, aby se umožnila dostatečná difúze do okolní tkáně. Čtyři zvířata obdržel bilaterální injekce v primární motorické kůry (M1) na +1,2 mm přední (A/P) a ±2,5 mm / boční (M/L) bregma. Polovina roztok byl nastříknut na 1,6 mm pod povrch mozku (D/V), a zbytek při 1,0 mm. Zbývající čtyři zvířata, všechny přijaté jednostranné injekce v prefrontální kůře (A/P: +3.0, M/L: +0.5, D/V: -2.3 a -1.8), temporální kůře (A/P: -6.5, M/L: +5.0, D/V: -7,5 a -7.0) a parietální kůře (A/P: -3.0, M/L: +5.0, D/V: -1.8 -1.3 a). Po 48 h, byla zvířata hluboce uspaný a transcardially perfundovaného s 250 ml studené fosfátem pufrovaného fyziologického roztoku (pH 7.4), následovaný 250 ml studeného 2% paraformaldehyd + 0.2% parabenzoquinone v 0,1 M fosfátovém pufru. Mozky byly extrahovány, postfixovány po dobu 2 hodin ve stejném fixativu a kryoproteovány v 0,1 m fosfátovém pufru obsahujícím 30% sacharózy po dobu nejméně 72 hodin při 4°C. Koronální části (40 µm) byly sníženy na zmrazení posuvné mikrotom a uloženy v ochranném (TCS) při 4°C, dokud dále zpracovávány pro imunohistochemii.
Double-Label Fluorescenční Imunohistochemie
Sekvenční double-label imunohistochemie byla použita k vizualizaci neuronů exprimujících NGF a buď Gabaergních nebo glutamátergní buněčné markery. Free-plovoucí řezy byly promyty v Tris pufru (TBS), permeabilized 0,25% Triton X-100, a nespecifické značení byl pak zablokován s 5% oslí sérum. Řezy byly inkubovány po dobu 72 hodin při teplotě 4°C v králičí anti-NGF protilátek (Conner a Varon, 1992) ředěné 1:1000 v TBS, 0.25% Triton X-100 a 5% oslí sérum. Následující primární protilátky inkubace, řezy byly inkubovány v donkey anti-rabbit biotin-konjugátu IgG (1:200; Vector Laboratories, Burlingame, CA, USA). Tyramide zesílení signálu (TSA; PerkinElmer, Waltham, MA, USA) byl použit k zesílení NGF signál, po kterém řezy byly promyty v TBS a inkubovány v Alexa Fluor 488 nebo 594-konjugovaný streptavidin (Invitrogen, Carlsbad, CA, USA) v poměru 1:200 po dobu 3 h při teplotě 4°C. Po krátkém mytí, řezy byly inkubovány v obou myší anti-hydrogen-glutamát dekarboxylázou (GAD) 65 (GAD-6, AntibodyRegistry:AB_528264,1:2000; Vývojové Studie, Hybridomu, Banky, Iowa City, IA, USA) a mouse anti-GAD67 (AnitbodyRegistry: AB_2278725, 1:1500; Millipore, Temecula, CA, USA), nebo v myší anti-parvalbumin (AntibodyRegistry: AB_2174013, 1:30000; Millipore, Temecula, CA, USA), myš anti-calbindin-D-28K (AntibodyRegistry: AB_476894, 1:1500; Sigma-Aldrich, St. Louis, MO, USA), nebo myší anti-Ca2+/kalmodulin-dependentní proteinkinázy Ii (CaMKIIa, AntibodyRegistry: AB_2067919, 1:1500; Millipore) za 72 h při teplotě 4°C. Konečně, sekce byly umyty, inkubovány v Alexa Fluor 594 nebo 488-konjugované donkey anti-mouse (Invitrogen) po dobu 3 h při pokojové teplotě, promyty znovu, namontované na sklíčka, a coverslipped v Fluoromount G (Jižní Biotech, Birminghan, AL, USA). Aby se maximalizovala identifikace GABAergních buněk, byly současně inkubovány protilátky GAD65 a GAD67. Podmnožina sekcí byla pokryta ProLong Gold s Dapi (Invitrogen) pro vizualizaci buněčných jader.
Charakterizace Protilátek
NGF protilátky použité v této studii je afinitně čištěné polyklonální vyrůstal v králíka proti čištěné myši NGF (Conner a Varon, 1992). Protilátka rozpoznává purifikovanou myš a rekombinantní lidský NGF, ale nekříží reaguje s rekombinantním BDNF nebo NT-3(Conner a Varon, 1996). Kromě toho, podobná vzor NGF výraz v mozku potkana odpovídá, že získaná z in-situ analýzu v mozku potkana (Conner a Varon, 1997).
monoklonálních protilátek GAD-65 (Vývojové Studie, Hybridomu, Banky, Gad-6) byl vyroben imunizací myší s GAD proteinů imunoafinitní-čistí z mozku potkana. Western blot analýza homogenáty potkaního mozku odhalil protilátky selektivně rozpozná GAD-65, ale ne GAD-67 (Chang a Gottlieb, 1988). Další studie ukázaly, že protilátka GAD-6 rozpoznává epitop umístěný mezi aminokyselinami 475-571 C-konce GAD-65 (Butler et al., 1993).
myš GAD-67 monoklonální (Millipore, MAB 5406, lot: 25010139) byla vznesena proti aminokyselinových zbytků 4-101 lidských GAD-67, a uznává jediného 67-kDa kapela na Western blot analýzy z mozku potkana (výrobce technické informace). Preinkubační protilátky s GST-GAD-67 fusion protein za následek žádné immunopositive signál v mozku (Ito et al., 2007).
myší monoklonální anti-CaMKIIa (Millipore, MAB 8699, hodně: LV1366080) výslovně uznává alfa podjednotku vápník/calmodulin-dependentní protein kinázy II. Western blot analýza ukazuje, že protilátka identifikuje jediný pás 50 kDa a rozpoznává fosforylované i nefosforylované formy (Erondu a Kennedy, 1985).
Monoklonální anti-calbindin-D-28k (Sigma–Aldrich, C9848, hodně: 088k4799) je odvozen z BALB/c myši byly imunizovány s čištěný bovinní ledviny calbindin-D-28k. Imunoblotingu ukázal protilátka rozpozná 28 kDa kapely, a nebude reagovat s podobnými molekulami, jako calbindin-D-9K, calretinin, myosin lehký řetězec, a parvalbumin (výrobce technické informace). Preabsorption s calbindin-D-27 kDa protein purifikován z kočka a krysa mozku bylo prokázáno, že k odstranění calbindin immunostaining v mozku (Pasteels et al., 1987).
Anti-parvalbumin (Millipore, MAB 1572, lot: LV1378387) byl odebrán z myší imunizovaných proti parvalbuminu purifikovanému z žabího svalu. Monoklonální protilátka je namířena proti epitopu na první Ca2+-vazebné místo a immunoblot analýza ukazuje, rozpozná mozku protein of 12 kDa (výrobce technické informace).
Konfokální Analýza
Snímky byly pořízeny pomocí Olympus AX70 s Magnafire software (verze 2.0; Karl Storz Imaging, Goleta, CA, USA). Protože NGF značení byla podstatně snížena přibližně 2 mm, přední/zadní, aby kolchicin injekce stránek, pravděpodobně kvůli nedostatku kolchicin difúze a výsledná absence somatických NGF akumulace, pouze úseky do 1,5 mm na každý kolchicin injekce byly analyzovány. Každý 10. úsek (400 µm) byl vyšetřen v kortikální oblasti. Buňky byly ručně počítány a nejméně tři sekce byly analyzovány v každé kortikální oblasti a kombinaci protilátek na subjekt. Pouze tři zvířata byla hodnocena v časové oblasti kvůli nedetekovatelnému značení NGF ve čtvrtém. Jednotlivé a dvojitě značené buňky byly kvantifikovány pomocí jednokanálových i dvoukanálových obrazů. K identifikaci značených buněk bylo použito několik kritérií, včetně velikosti, morfologie, signálu vs. pozadí a náhodného značení DAPI při hodnocení tkáně obarvené DAPI. V podskupině sekcí byly shromážděny 5 µm z-stohy pomocí Olympus Fluoview FV1000 pro zajištění neuronální lokalizace značeného objektu. Vzhledem k našemu zájmu o podíl, a nikoli absolutní počet, dvojitě značených buněk, nebyly použity stereologické metody.
procento dvojitě značených buněk na imunoreaktivní (IR) buněčnou skupinu bylo stanoveno pro každé obrazové pole. Průměrná ± standardní chyba byla vypočtena pro každou zkoumanou kortikální oblast. K vyhodnocení rozdílů mezi kortikálními oblastmi byla použita jednosměrná analýza rozptylu (ANOVA). Fisherovo HSD bylo použito pro post-hoc analýzu. Všechny statistické analýzy byly provedeny s SPSS 15.0 pro Windows.
kontroly protilátek
kontroly zahrnovaly vynechání primárních protilátek, vynechání sekundárních protilátek a nahrazení primární protilátky nespecifickou protilátkou (králičí IgG). Všechny manipulace měly očekávané účinky a podpořily tvrzení, že značené buňky představují skutečné značení antigenu jejich odpovídajícími protilátkami.
výsledky
IMUNOZNAČENÍ NGF
zřetelné značení NGF bylo viditelné v okruhu 1.5 mm od kolchicinových kortikálních míst vpichu. V těchto oblastech bylo značení NGF převážně omezeno na buněčné somata (Obrázek 1). Zřídka lze také rozlišit jeden nebo více buněčných procesů. Mimo tento poloměr 1,5 mm bylo značení NGF v kůře prakticky Nedetekovatelné. Protože kortikální exprese receptorů NGF TrkA a p75 jsou omezeny na cholinergní kortikopetální vlákna, pozorované značení NGF pravděpodobně neodráží endocytovanou NGF, ale místo toho svědčí o buňkách produkujících NGF (Holtzman et al., 1995; Rossi a kol., 2002; Stephens et al., 2005). Jak bylo uvedeno dříve (Ribak et al., 1978), léčba kolchicinem zesílila značení GAD v buněčných tělech i neuronálních procesech. Kolchicin neměl žádný detekovatelný účinek na označování parvalbuminu, kalbindinu nebo Kamkie.
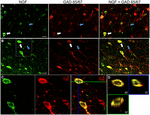
OBRÁZEK 1. Nervový růstový faktor se značně kolokalizuje pomocí inhibičních buněčných markerů. Imunoreaktivní buňky v (a) primární motorické kůře a (B) prefrontální kůře. Obrázky ukazují, že buňky označené NGF (zelené) se značně kolokalizují s buňkami značenými Gad 65/67 (červené). Bílé šipky ukazují příklad imunoreaktivní buňky pro NGF i GAD 65/67 v každé kortikální oblasti. Modré šipky ukazují buňky imunoreaktivní pouze pro GAD 65/67. (C) zvětšený obraz oblasti uvnitř bílého pole v (B). (D) x–Y-z rekonstrukce dvojitě značené buňky uvedené v (C). Zelené a modré čáry označují úrovně disekce v rovinách XZ a YZ. Stupnice = 25 µm .
NGF a Gabaergní Co-Lokalizace
Nervový růstový faktor co-lokalizované značně s Gabaergní buňky markery GAD65 a GAD67, bez ohledu na kortikální oblasti, zkoumal (Obrázek 1; Tabulka 1). Celkově 91 ± 0,9% kortikálních buněk značených NGF také značených pro GAD65 / 67. Procento NGF-označených buněk co-vyjádření GAD65/67 ukázal malý rozdíl mezi prefrontální (90.0 ± 1.5%), motor (91.7 ± 1.5%), temenní (89.6 ± 3.5%) a časové (93.4 ± 8.1%) kůry mozkové (one-way ANOVA; p = 0.78). Naopak, NGF co-lokalizované s pouze 55 ± 2.3% všech buněk značených GAD65 / 67. K určení, zda NGF výroba byla omezena na konkrétní podtyp Gabaergních neuronů, jsme společně označené tkáně pro NGF a buď parvalbumin, nebo calbindin (Obrázek 2). Bylo pozorováno, že buňky značené NGF kolokalizují s oběma markery. KOLOKALIZACE NGF s parvalbuminem (67,8 ± 3,6%) však byla o více než 2× větší než u kalbindinu (29,1 ± 3,9%). Kromě toho buňky NGF-IR tvořily méně než polovinu všech imunoreaktivních buněk parvalbuminu (47,7 ± 4,6%) a kalbindinu (25,7 ± 4,9%).

OBRÁZEK 2. NGF značené markery podtřídy inhibičních neuronů. Plátky motorické kůry byly označeny pro NGF a buď parvalbumin nebo kalbindin. (A) buňky vykazovaly rozsáhlé překrytí značení NGF a parvalbuminu (bílé šipky). B) naopak značení NGF a kalbindinu bylo méně časté. Stupnice = 25 µm .

TABULKA 1. NGF-a GAD65 / 67-imunoreaktivní buňky podle kortikální oblasti.
neurony exprimující nervový růstový faktor byly pozorovány ve všech kortikálních vrstvách. Předchozí studie uvádějí, nerovnoměrné rozložení NGF-označené neuronů v kortikálních lamely (Pitts a Miller, 2000; Patz a Wahle, 2006). Kvantitativní analýza vrstva nebyla provedena v aktuální studii, nicméně, jak NGF označování intenzita poklesla s rostoucí vzdáleností od kolchicin injekce.
NGF a Glutamátergní Co-Lokalizace
Označování pro CaMKIIa byla primárně pozorována v buněčné somata a proximální procesy (Obrázek 3). Na rozdíl od rozsáhlé ko-lokalizace viděn s NGF a Gabaergní značky, NGF-označené buňky zřídka ko-lokalizována s CaMKIIa-označené buňky (Obrázek 3; Tabulka 2). Celkem 4.9 ± 1,1% NGF-imunoreaktivních buněk byl co-označeny CaMKIIa protilátky. Ko-lokalizace výrazně lišila podle kortikální oblasti (one-way ANOVA; p = 0.03); Fisherův post hoc ukázal, že prefrontální kůra měla větší podíl double-označených buněk NGF (7.6 ± 2.1%) ve srovnání s primární motorické kůry (2.4 ± 1.0%; p = 0.02) a parietální kůry (2.9% ± 1.5; p = 0,01).

OBRÁZEK 3. Nervový růstový faktor kolokalizuje minimálně s markerem excitačních buněk Camkia. Imunoreaktivní buňky v prefrontální kůře. Buňky byly vzácně značeny pro NGF (zelená) a Camkia (červená), bez ohledu na zkoumanou kortikální oblast. Zlaté šipky ukazují příklad imunoreaktivní buňky pouze pro NGF. Stupnice = 25 µm .

TABULKA 2. NGF-a Camkia-imunoreaktivní buňky podle kortikální oblasti.
buňky imunoreaktivní pro Kamkii výrazně převyšovaly buňky označené protilátkami NGF. Celkový podíl buněk značených Camkiií současně exprimujících NGF signál byl 2 ± 0,6%. Toto procento se výrazně lišila podle regionu (one-way ANOVA p = 0.003), s prefrontálním kortexu, které vykazuje větší podíl dvojitě značené NGF/CaMKIIa buněk (3.7 ± 1.1%) než primární motorické kůry (0.8% ± 0.3; p = 0,001), parietální kůry (1.4% ± 0.6; p = 0,01), a temporální kůře (1.5 ± 0.6%; p = 0,01).
Diskuse
současná studie ukazuje, že drtivá většina (>90%), NGF-produkující neurony kůry jsou Gabaergní, zatímco polovina všech Gabaergní neurony colocalize s NGF. Naproti tomu markery excitačních neuronů vykazují pouze vzácnou lokalizaci s NGF. Tyto výsledky byly konzistentní ve více kortikálních oblastech analyzovaných v této studii, což naznačuje, že NGF je primárně produkován inhibičními interneurony v neokortexu potkanů.
ačkoli se imunoreaktivita NGF zřídka shodovala s markery excitačních buněk (Camkia), malé procento (~5%) bylo pozitivní na Kamkii ve všech zkoumaných kortikálních oblastech. Konfokální analýza potvrdila, že toto dvojité značení pochází ze stejné ohniskové roviny a nebylo způsobeno diskrétním signálem pocházejícím z překrývajících se buněk. Funkční význam exprese NGF v tak malé frakci excitačních buněk není znám, ale je možné, že tyto neurony produkující NGF představují dříve neidentifikovanou podtřídu excitačních neuronů v neokortexu.
Naše výsledky jsou v souladu s nálezy předchozích studií v dalších oblastech mozku prokazují, že NGF co-lokalizuje téměř výhradně s Gabaergní buňky striata, bazálním předním mozku a hipokampu (Lauterborn et al., 1993, 1995; Pascual et al., 1998; Bizon a kol., 1999). Produkce NGF Gabaergními buňkami tedy může být obecnou vlastností všech cílů, které dostávají cholinergní inervaci bazálního předního mozku (včetně samotného bazálního předního mozku). Tyto cholinergní neuronální populace vyžadují NGF pro udržení jejich fenotypu a projekcí (Rylett et al., 1993; Chen et al., 1997; Hu et al., 1997; Debeir et al., 1999). Napříč studiemi se inhibiční interneurony nyní objevují jako primární zdroj trofismu NGF pro cholinergní neurony bazálního předního mozku.
ačkoli bazální přední mozek cholinergní neurony inervují jak excitační, tak inhibiční kortikální sítě (Zaborszky et al ., 1999), zdroj trofické podpora je v drtivé většině od inhibiční populace, které je známo, že hrají klíčovou roli ve zprostředkování plasticity na kortikální okruhy (Hensch a Stryker, 2004; Yazaki-Sugiyama et al., 2009; Donato a kol., 2013). Zdá se, že cholinergní signalizace přispívá k diferenciální aktivaci různých inhibičních subpopulací, čímž moduluje excitačně-inhibiční rovnováhu (Xiang et al., 1998; Froemke a kol., 2007). NGF tak může sloužit jako zpětnovazební signál mezi vysoce plastickými inhibičními sítěmi a cholinergními vstupy, které je aktivují. NGF skutečně zvyšuje plasticitu a behaviorální učení prostřednictvím cholinergně závislých mechanismů (Prakash et al ., 1996, 2004; Gutierrez et al., 1997; Conner a kol., 2009). Uvolnění NGF závislé na aktivitě (Blochl a Thoenen, 1995; Lessmann et al., 2003), spárovaná se schopností NGF zvýšit cholinergní aktivitu (Rylett et al., 1993; Hu et al., 1997; Auld et al., 2001), naznačuje, že NGF může podporovat reorganizaci aktivních obvodů pomocí vylepšené cholinergní funkce.
Budoucí studie se pokusí určit, které podtřídy inhibičních neuronů express NGF a jak tento výraz přesně ovlivňuje kortikální obvody. Za tímto účelem jsme vzali předběžné kroky k určení, zda NGF ko-lokalizována s dva společné znaky inhibiční neurony, parvalbumin (primárně je jim přiřazen program koš a lustr buňky) a calbindin (spojené s mnoha inhibiční typy buněk; McBain a Fisahn, 2001; Markram et al., 2004). Naše výsledky ukazují, že NGF, byl primárně zjištěn v parvalbumin-imunoreaktivních buněk, ačkoli mnoho buněk označeny parvalbumin ne co-express NGF. Důležité je, že buňky NGF-IR jsou také kolokalizovány buňkami značenými kalbindinem, což naznačuje, že více než jedna podtřída inhibičního neuronu produkuje NGF.
V souhrnu, v rámci rat neokortexu NGF je především vyjádřena tím, že inhibiční neurony, vlastnost, která se zdá být zachovány z fylogeneticky starší oblasti mozku a které se mohou zobecnit na mozek jako celek. Naše výsledky naznačují, že kortikální inhibiční interneurony hrají zásadní roli při udržování cholinergních projekčních neuronů bazálního předního mozku. GABAergní interneurony tak mohou podporovat kortikální reorganizaci prostřednictvím regulované signalizace NGF.
Prohlášení o střetu zájmů
autoři prohlašují, že výzkum byl proveden bez jakýchkoli obchodních nebo finančních vztahů, které by mohly být vykládány jako potenciální střet zájmů.
Poděkování
Financován NIH (AG10435), Veterans Administration, Alzheimerovy Asociace a Dr. Miriam a Sheldon G. Adelson Medical Research Foundation.
Doplňkový Materiál
Doplňkový Materiál pro tento článek lze nalézt online na: http://www.frontiersin.org/journal/10.3389/fncel.2014.00220/abstract
Auld, D. S., Mennicken, F., a Quirion, R. (2001). Nervový růstový faktor, rychle vyvolává prodloužené uvolňování acetylcholinu z kultivované bazálního předního mozku neurony: diferenciace mezi neuromodulačním a neurotrofní vlivy. J. 21, 3375–3382.
Pubmed Abstrakt / Pubmed Plný Text
Bakin, J. S., and Weinberger, N. M. (1996). Indukce fyziologické paměti v mozkové kůře stimulací jádra bazalis. Proc. Natle. Acad. Věda. U. S. A. 93, 11219-11224. doi: 10.1073 / pnas.93.20.11219
CrossRef celý Text
Bizon, J. L., Lauterborn, J. C., a Gall, C. M. (1999). Subpopulace striatálních interneuronů lze rozlišit na základě exprese neurotrofického faktoru. J. Neurol. 408, 283–298. doi: 10.1002/(SICI)1096-9861(19990531)408:2<283::podpora-CNE9>3.0.CO;2-2
Pubmed Abstrakt / Pubmed Plný Text / CrossRef Plný Text
Blochl, A., and Thoenen, h. (1995). Charakterizace uvolňování nervového růstového faktoru (NGF) z hipokampálních neuronů: důkaz konstitutivní a nekonvenční regulované dráhy závislé na sodíku. Euro. J. 7, 1220–1228. doi: 10.1111 / j. 1460-9568.1995.tb01112.x
Pubmed Abstraktní | Pubmed Plný Text | CrossRef celý Text
Butler, M. H., Solimena, M., Dirkx, R. Jr., Hayday, A., a De Camilli, P. (1993). Identifikace dominantního epitop dekarboxyláza kyseliny glutamové (GAD-65) uznána autoprotilátky v stiff-man syndrom. J.Exp. Med. 178, 2097–2106. doi: 10.1084/jem.178.6.2097
Pubmed Abstrakt / Pubmed Plný Text / CrossRef Plný Text
Chang, Y. C., and Gottlieb, d. i. (1988). Charakterizace proteinů purifikovaných monoklonálními protilátkami proti dekarboxyláze kyseliny glutamové. J. 8, 2123–2130.
Chen, K. S., Nishimura, M. C., Armanini, M. P., Crowley, C., Spencer, S. D., a Phillips, H. S. (1997). Narušení jediné alely genu nervového růstového faktoru má za následek atrofii cholinergních neuronů bazálního předního mozku a deficity paměti. J. 17, 7288–7296.
Pubmed Abstraktní | Pubmed celý Text
Conner, J. M., Chiba, a. a., a Tuszynski, M. H. (2005). Bazální přední mozkový cholinergní systém je nezbytný pro kortikální plasticitu a funkční zotavení po poranění mozku. Neuron 46, 173-179. doi: 10.1016 / j. neuron.2005.03.003
Pubmed Abstrakt / Pubmed Plný Text / CrossRef Plný Text
Conner, J. M., Culberson, a., Packowski, C., Chiba, A. A., and Tuszynski, M. H. (2003). Léze bazálního předního mozku cholinergního systému zhoršují získávání úkolů a ruší kortikální plasticitu spojenou s učením motorických dovedností. Neuron 38, 819-829. doi: 10.1016/S0896-6273(03)00288-5
Pubmed Abstraktní | Pubmed Plný Text | CrossRef celý Text
Conner, J. M., Franks, K. M., Titterness, a. K., Russell, K., Merrill, D. a. Christie, B. R., et al. (2009). NGF je nezbytný pro hipokampální plasticitu a učení. J. 29, 10883–10889. doi: 10.1523/JNEUROSCI.2594-09.2009
Pubmed Abstraktní | Pubmed Plný Text | CrossRef celý Text
Conner, J. M., Lauterborn, J. C., Yan, Q., Gall, C. M., a Varon, S. (1997). Distribuce proteinu neurotrofického faktoru odvozeného z mozku (BDNF) a mRNA v normálním CNS dospělých potkanů: důkaz pro anterográdní axonální transport. J. 17, 2295–2313.
Pubmed Abstrakt / Pubmed Plný Text
Conner, Jm, and Varon, s. (1992). Distribuce imunoreaktivních neuronů podobných nervovému růstovému faktoru v mozku dospělých potkanů po léčbě kolchicinem. J. Neurol. 326, 347–362. DOI: 10.1002 / cne.903260304
Pubmed Abstrakt / Pubmed Plný Text / CrossRef Plný Text
Conner, Jm, and Varon, s. (1996). Charakterizace protilátek proti nervovému růstovému faktoru: variabilita v závislosti na testu zkřížené reaktivity s jinými neurotrofiny. J. Metody 65, 93-99. doi: 10.1016/0165-0270(95)00151-4
Pubmed Abstraktní | Pubmed Plný Text | CrossRef celý Text
Conner, J. M., a Varon, S. (1997). Vývojový profil imunoreaktivity NGF v mozku potkanů: možná role NGF při vytváření cholinergních terminálních polí v hipokampu a kůře. Mozek Res.Dev. Brain Res. 101, 67-79. doi: 10.1016/S0165-3806(97)00051-5
Pubmed Abstraktní | Pubmed Plný Text | CrossRef celý Text
Debeir, T., Saragovi, H. U., a Cuello, a. C. (1999). Nervový růstový faktor mimetický antagonista TrkA způsobuje stažení kortikálních cholinergních záchvatů u dospělých potkanů. Proc. Natle. Acad. Věda. U. S. A. 96, 4067-4072. doi: 10.1073 / pnas.96.7.4067
Pubmed Abstraktní | Pubmed Plný Text | CrossRef celý Text
Donato, F., Rompani, S. B., a Caroni, P. (2013). Parvalbumin-exprese koš-buněčná síť plasticita vyvolaná zkušeností reguluje vzdělávání dospělých. Příroda 504, 272-276. doi: 10.1038/nature12866
Pubmed Abstraktní | Pubmed Plný Text | CrossRef celý Text
Erondu, N. E., a. Kennedy, M. B. (1985). Regionální distribuce Ca2+/kalmodulin-dependentní proteinkinázy typu II v mozku potkanů. J. 5, 3270–3277.
Froemke, R. C., Merzenich, M. M., and Schreiner, C. E. (2007). Synaptická paměťová stopa pro plasticitu kortikálního receptivního pole. Příroda 450, 425-429. doi: 10.1038/nature06289
Pubmed Abstraktní | Pubmed Plný Text | CrossRef celý Text
Gall, C. M., a Isackson, P. J. (1989). Limbické záchvaty zvyšují neuronální produkci messengerové RNA pro nervový růstový faktor. Věda 245, 758-761. doi: 10.1126 / věda.2549634
CrossRef Plný Text
Gutierrez, h., Miranda, M. I., and Bermudez-Rattoni, F. (1997). Poruchy učení a cholinergní deafference po deprivaci růstového faktoru kortikálního nervu. J. 17, 3796–3803.
Pubmed Abstrakt / Pubmed Plný Text
Hanson, M., and Edström, a. (1978). Inhibitory mitózy a axonální transport. Int. Rev.Cytol. Pozn. 373–402.
Hayashi, m., Yamashita, a., Shimizu, k., Sogawa, K., and Fujii, y. (1993). Exprese genu pro nervový růstový faktor (NGF) v centrálním nervovém systému opice. Brain Res.618, 142-148. doi: 10.1016/0006-8993(93)90437-R
CrossRef Celý Text
Hefti, F. (1986). Nervový růstový faktor podporuje přežití septálních cholinergních neuronů po fimbriálních transekcích. J. 6, 2155–2162.
hensch, T. K., and Stryker, M. P. (2004). Sloupcová Architektura vytesaná obvody GABA při vývoji kočičí vizuální kůry. Věda 303, 1678-1681. doi: 10.1126 / věda.1091031
Pubmed Abstraktní | Pubmed Plný Text | CrossRef celý Text
Hokfelt, T., Kellerth, J. O., Nilsson, G., a Pernow, B. (1975). Experimentální imunohistochemické studie lokalizace a distribuce látky P v primárních senzorických neuronech kočky. Brain Res. 100, 235-252. doi: 10.1016/0006-8993(75)90481-3
Pubmed Abstraktní | Pubmed Plný Text | CrossRef celý Text
Holtzman, D. M., Kilbridge, J., Li, Y., Cunningham, E. T. Jr., Lenn, N. J., Clary, D. O., et al. (1995). Exprese TrkA v CNS: důkaz o existenci několika nových neuronů CNS reagujících na NGF. J. 15, 1567–1576.
Pubmed Abstrakt / Pubmed Plný Text
Hu, L., Pobřeží, S. L., a Cuello, a. C. (1997). Diferenciální modulace cholinergního fenotypu neuronů nucleus basalis magnocellularis aplikací NGF na buněčné tělo nebo kortikální terminální pole. Expo. Neurol. 143, 162–171. doi: 10.1006 / exnr.1996.6357
Pubmed Abstraktní | Pubmed Plný Text | CrossRef celý Text
Huang, E. J., a Reichardt, L. F. (2003). Trk receptory: role v transdukci neuronálních signálů. Annu. Páter Biochem. 72, 609–642. doi: 10.1146 / annurev.biochem.72.121801.161629
CrossRef celý Text
Isackson, P. J., Myslivec, M. M., Murray, K. D., a Gall, C. M. (1991). Exprese mRNA BDNF je zvýšena u předního mozku dospělých potkanů po limbických záchvatech: Časové vzorce indukce odlišné od NGF. Neuron 6, 937-948. doi: 10.1016 / 0896-6273 (91)90234-Q
Pubmed Abstrakt / Pubmed Plný Text / CrossRef Plný Text
ito, T., Hioki, h., Nakamura, k., Tanaka, y., Nakade, h., Kaneko, T., et al. (2007). Gama-aminomáselné kyseliny obsahující sympatické pregangliová neuronů u potkanů hrudní míchy posílat své axony do nadřazené cervikální ganglion. J. Neurol. 502, 113–125. DOI: 10.1002 / cne.21309
Pubmed Abstraktní | Pubmed Plný Text | CrossRef celý Text
Kilgard, M. P., a Merzenich, M. M. (1998). Reorganizace kortikální mapy umožněná aktivitou nucleus basalis. Věda 279, 1714-1718. doi: 10.1126 / věda.279.5357.1714
Pubmed Abstraktní | Pubmed Plný Text | CrossRef Celý Text
Kordower, J. H., Bartus, R. T., Bothwell, m., Schatteman, G., and Gash, D. M. (1988). Imunoreální aktivita receptoru nervového růstového faktoru u nelidského primátu (Cebus apella): distribuce, morfologie a kolokalizace cholinergními enzymy. J. Neurol. 277, 465–486. DOI: 10.1002 / cne.902770402
Pubmed Abstraktní | Pubmed Plný Text | CrossRef celý Text
Kordower, J. H., Winn, S. R., Liu, Y. T., Mufson, E. J. Sládka, J. R. Jr., Hammang, J. P., et al. (1994). Starý opičí bazální přední mozek: záchrana a klíčení axotomizovaných bazálních neuronů předního mozku po štěpech zapouzdřených buněk vylučujících lidský nervový růstový faktor. Proc. Natle. Acad. Věda. U. S. A. 91, 10898-10902. doi: 10.1073 / pnas.91.23.10898
Pubmed Abstraktní | Pubmed Plný Text | CrossRef celý Text
Korsching, S., Auburger, G. Heumann, R., Scott, J., a Thoenen, H. (1985). Hladiny nervového růstového faktoru a jeho mRNA v centrálním nervovém systému potkanů korelují s cholinergní inervací. EMBO J. 4, 1389-1393.
Pubmed Abstraktní | Pubmed celý Text
Mladík, S. P., Neet, K. E., a Mufson, E. J. (2003). Nervový růstový faktor: struktura, funkce a terapeutické důsledky pro Alzheimerovu chorobu. Curre. Lék cílí na Neurol CNS. Disord. 2, 315–334. doi: 10.2174/1568007033482724
Pubmed Abstraktní | Pubmed Plný Text | CrossRef celý Text
Velké, T. H., Bodary, S. C., Clegg, D. O., Weskamp, G., Otten, U., a Reichardt, L. F. (1986). Genová exprese nervového růstového faktoru v vyvíjejícím se mozku potkanů. Věda 234, 352-355. doi: 10.1126 / věda.3764415
CrossRef celý Text
Lauterborn, J. C., Bizon, J. L., Tran, T. M., a Gall, C. M. (1995). NGF mRNA je exprimována Gabaergními, ale ne cholinergními neurony v bazálním předním mozku potkanů. J. Neurol. 360, 454–462. DOI: 10.1002 / cne.903600307
Pubmed Abstraktní | Pubmed Plný Text | CrossRef celý Text
Lauterborn, J. C. Tran, T. M., Isackson, P. J., a Gall, C. M. (1993). Nervový růstový faktor mRNA je exprimován Gabaergními neurony v hippocampu potkanů. Neuroreport 5, 273-276. doi: 10.1097/00001756-199312000-00023
CrossRef celý Text
Lessmann, V. Gottmann, K., a Malcangio, M. (2003). Sekrece neurotrofinu: aktuální fakta a budoucí vyhlídky. Pořada. Neurobiol. 69, 341–374. doi: 10.1016/S0301-0082(03)00019-4
Pubmed Abstraktní | Pubmed Plný Text | CrossRef celý Text
Li, Y., Holtzman, D. M., Kromer, L. F., Kaplan, D. R., Chua-Couzens, J., Clary, D. O., et al. (1995). Regulace výrazu TrkA a chatu při vývoji bazálního předního mozku potkanů: důkaz, že jak exogenní, tak endogenní NGF regulují diferenciaci cholinergních neuronů. J. 15, 2888–2905.
Pubmed Abstraktní | Pubmed celý Text
Maisonpierre, P. C., Belluscio, L., Friedman, B., Alderson, R. F., Kopecký, S. J., Furth, M. E., et al. (1990). NT-3, BDNF a NGF ve vyvíjejícím se nervovém systému potkanů: paralelní i reciproční vzorce exprese. Neuron 5, 501-509. doi: 10.1016 / 0896-6273 (90)90089-X
Pubmed Abstrakt / Pubmed Plný Text / CrossRef Plný Text
Markram, h., Toledo-Rodriguez, m., Wang, y., Gupta, a., Silberberg, G., and Wu, C. (2004). Interneurony neokortikálního inhibičního systému. Adresa. Reverend Neurosci. 5, 793–807. doi: 10.1038 / nrn1519
Pubmed Abstrakt / Pubmed Plný Text / CrossRef Plný Text
McBain, CJ, and Fisahn, a. (2001). Interneurony bez závazků. Adresa. Reverend Neurosci. 2, 11–23. doi: 10.1038/35049047
Pubmed Abstraktní | Pubmed Plný Text | CrossRef celý Text
Mufson, E. J., Conner, J. M., Varon, a. S., a Kordower, J. H. (1994). Imunoreaktivní profily podobné nervovému růstovému faktoru v bazálním předním mozku primátů a hipokampu. J. Neurol. 341, 507–519. DOI: 10.1002 / cne.903410407
Pubmed Abstrakt / Pubmed Plný Text / CrossRef Plný Text
Pascual, m., Rocamora, N., Acsady, L., Freund, T. F., and Soriano, e. (1998). Exprese nervového růstového faktoru a neurotrophin-3 mRNAs v hipokampálních interneuronech: morfologická charakteristika, úroveň projevu, a colocalization nervového růstového faktoru a neurotrophin-3. J. Neurol. 395, 73–90. doi: 10.1002/(SICI)1096-9861(19980525)395:1<73::PODPORA-CNE6>3.0.CO;2-E
Pubmed Abstraktní | Pubmed Plný Text | CrossRef celý Text
Pasteels, B., Miki, N., Hatakenaka, a. S., a Pochet, R. (1987). Imunohistochemická zkřížená reaktivita a elektroforetická kombinace mezi kalbindinem d-27 kDa a visininem. Brain Res.412, 107-113. doi: 10.1016/0006-8993(87)91444-2
Pubmed Abstraktní | Pubmed Plný Text | CrossRef celý Text
Patz, a. S., a Wahle, P. (2006). Vývojové změny exprese neurotrofinové mRNA ve vrstvách zrakové kůry potkanů. Euro. J. 24, 2453–2460. doi: 10.1111 / j. 1460-9568. 2006. 05126.x
Pubmed Abstrakt / Pubmed Plný Text / CrossRef Plný Text
Pitts, a. F., and Miller, M. W. (2000). Exprese růstového faktoru nervů, mozku odvozený neurotrofický faktor, a neurotrophin-3 v somatosenzorické kůře zralý krysa: coexpression s vysokou afinitou neurotrophin receptory. J. Neurol. 418, 241–254. doi: 10.1002/(SICI)1096-9861(20000313)418:3<241::PODPORA-CNE1>3.0.CO;2-M
Pubmed Abstraktní | Pubmed Plný Text | CrossRef celý Text
Prakash, N., Cohen-Cory, S., a Frostig, R. D. (1996). Rychlé a opačné účinky BDNF a NGF na funkční organizaci dospělé kůry in vivo. Příroda 381, 702-706. doi: 10.1038/381702a0
Pubmed Abstraktní | Pubmed Plný Text | CrossRef celý Text
Prakash, N., Cohen-Cory, S., Penschuck, a. S., a Frostig, R. D. (2004). Bazální přední mozkový cholinergní systém se podílí na plasticitě vyvolané rychlým nervovým růstovým faktorem (NGF) v kůře sudu dospělých potkanů. J. Neurofyziol. 91, 424–437. doi: 10.1152 / jn.00489.2003
Pubmed Abstraktní | Pubmed Plný Text | CrossRef celý Text
Ribak, C. E., Vaughn, J. E., a Saito, K. (1978). Imunocytochemická lokalizace dekarboxylázy kyseliny glutamové v neuronálních somatech po inhibici kolchicinu axonálního transportu. Brain Res.140, 315-332. doi: 10.1016/0006-8993(78)90463-8
Pubmed Abstraktní | Pubmed Plný Text | CrossRef celý Text
Rossi, F. M., Sala, R., a Maffei, L. (2002). Exprese receptorů nervového růstového faktoru TrkA a p75NTR ve vizuální kůře krysy: vývoj a regulace cholinergním vstupem. J. 22, 912–919.
Pubmed Abstraktní | Pubmed celý Text
Rylett, R. J., Goddard, S., Schmidt, B. M., a Williams, L. R. (1993). Syntéza a uvolňování acetylcholinu po kontinuálním intracerebrálním podání NGF u dospělých a ve věku potkanů Fischer-344. J. 13, 3956–3963.
Pubmed Abstrakt / Pubmed Plný Text
Schubert, P., Kreutzberg, G. W., and Lux, h. d. (1972). Neuroplazmatický transport v dendritech: vliv kolchicinu na morfologii a fyziologii motoneuronů u kočky. Brain Res.47, 331-343. doi: 10.1016/0006-8993(72)90643-9
Pubmed Abstraktní | Pubmed Plný Text | CrossRef celý Text
Shelton, D. L., a Reichardt, L. F. (1986). Studie exprese genu beta nervového růstového faktoru (NGF) v centrálním nervovém systému: úroveň a regionální distribuce mRNA NGF naznačují, že NGF funguje jako trofický faktor pro několik odlišných populací neuronů. Proc. Natle. Acad. Věda. USA 83, 2714-2718. doi: 10.1073 / pnas.83.8.2714
Pubmed Abstraktní | Pubmed Plný Text | CrossRef celý Text
Sofroniew, M. V., Howe, C. L., a Mobley, W. C. (2001). Signalizace nervového růstového faktoru, neuroprotekce a neurální Oprava. Annu. Reverend Neurosci. 24, 1217–1281. doi: 10.1146 / annurev.neuro.24.1.1217
CrossRef celý Text
Stephens, H. E., Belliveau, a. C., Gupta, J. S., Mirkovic, a. S., a Kablar, B. (2005). Úloha neurotrofinů při udržování motorických neuronů míchy a proprioceptivních senzorických neuronů dorzálních kořenových ganglií. Int. J.Dev. Neurovědci. 23, 613–620. doi: 10.1016 / j. ijdevneu.2005.07.002
Pubmed Abstraktní | Pubmed Plný Text | CrossRef celý Text
Tuszynski, M. H., Armstrong, D. M., a Gage, F. H. (1990). Ztráta buněk bazálního předního mozku po transekci fimbria / fornix. Brain Res. 508, 241–248. doi: 10.1016/0006-8993(90)90402-W
CrossRef celý Text
Xiang, Z., Huguenardová, J. R., Princ, D. A. (1998). Cholinergní přepínání v neokortikálních inhibičních sítích. Věda 281, 985-988. doi: 10.1126 / věda.281.5379.985
Pubmed Abstrakt / Pubmed Plný Text / CrossRef Plný Text
Yazaki-Sugiyama, y., Kang, S., Cateau, h., Fukai, T., and Hensch, T. K. (2009). Obousměrná plasticita v rychloupínacích GABA obvodech vizuální zkušeností. Příroda 462, 218-221. doi: 10.1038/nature08485
Pubmed Abstraktní | Pubmed Plný Text | CrossRef celý Text
Zaborszky, L., Pang, K., Somogyi, J., Nadasdy, Z., a Kallo, I. (1999). Bazální přední mozkový kortikopetální systém se vrátil. Anna. N. Y. Acad. Věda. 877, 339–367. doi: 10.1111 / j. 1749-6632. 1999.tb09276.x
Pubmed Abstraktní | Pubmed Plný Text | CrossRef celý Text
Zhang, H. T., Li, L. Y., Zou, X. L., Song, X. B., Hu, Y. L., Feng, Z. T.,et al. (2007). Imunohistochemická distribuce NGF, BDNF, NT-3 a NT-4 u dospělých mozků opic rhesus. J. Histochem. Cytochem. 55, 1–19. doi: 10.1369/jhc.6A6952.2006
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text