- introduktion
- material och metoder
- vävnadspreparat
- Dubbel-etikett Fluorescensimmunohistokemi
- Antikroppskarakterisering
- konfokal analys
- Antikroppskontroller
- resultat
- NGF-Immunmärkning
- NGF och GABAergic Co-Localization
- NGF och Glutamatergisk samlokalisering
- diskussion
- intressekonflikt uttalande
- bekräftelser
- tilläggsmaterial
introduktion
neurotrophin nerv growth factor (NGF) är involverad i flera kritiska processer i det utvecklande och mogna däggdjursnervsystemet, inklusive mål innervation, celldifferentiering och neuronal överlevnad (Large et al., 1986; Li et al., 1995; Sofroniew et al., 2001; Lad et al., 2003). I den vuxna hjärnan spelar NGF en nyckelroll i underhållet och funktionen hos det basala kolinerga systemet för framhjärnan (Lad et al., 2003). Nivåerna av NGF är högst i områden som får det största antalet basala framhjärnkolinerga projektioner, nämligen hippocampus och cortex (Korsching et al., 1985; Shelton och Reichardt, 1986) och receptorer för NGF i cortex är till stor del begränsade till basala framhjärnan kortikopetala projektioner (Kordower et al., 1988; Sofroniew et al., 2001; Rossi et al., 2002). Nervtillväxtfaktorsignalering upprätthåller kolinerga kortikopetalprojektioner under vuxen ålder (Chen et al., 1997; Debeir et al., 1999) och kan förhindra degenerering av dessa neuroner efter transektion av deras axoner (Hefti, 1986; Tuszynski et al., 1990; Kordower et al., 1994). Dessutom förbättrar NGF frisättningen av acetylkolin från basala framhjärnkulturer (Auld et al., 2001) och kan modulera kolinerg funktion genom fenotypisk kontroll av den kolinerga genlokusen (Rylett et al., 1993; Hu et al., 1997).
det basala kolinerga systemet för framhjärnan påverkar inlärning och erfarenhetsberoende plasticitet i cortexen (Bakin och Weinberger, 1996; Kilgard och Merzenich, 1998; Conner et al., 2003, 2005) och NGF-signalering har antagits för att stödja och eventuellt förbättra basal framhjärnmedierad inlärning och plasticitet. Till exempel reducerar blockad av NGF-signalering via upprepade injektioner av NGF-antikroppar i den insulära cortex lokal kolinerg innervation och stör förvärv av två processer som beror på integriteten hos kolinerga ingångar, konditionerad smakaversion och hämmande undvikande lärande (Gutierrez et al., 1997). En ny studie av Conner et al. (2009) visade att både rumsligt lärande och hippocampal långsiktig potentiering (LTP) förbättras efter infusioner av NGF i septalkärnan, den primära källan till kolinerg innervation till hippocampus.
fokal applicering av NGF kan också inducera snabb expansion av den lokala morrhårsrepresentationen i råttans tunnbark. Denna process är beroende av kolinerga utsprång från den basala framhjärnan (Prakash et al., 1996, 2004), vilket tyder på att kortikal NGF-signalering kan stimulera snabb kolinergberoende funktionell omorganisation. Således kan NGF, förutom dess långsiktiga trofiska effekter på basala kolinerga celler i framhjärnan, också delta i kortvarig kretsombyggnad. Denna” dual-action ” – hypotes stöds av förekomsten av konstitutiva och aktivitetsberoende frisättningsmekanismer för NGF (Blochl och Thoenen, 1995; Lessmann et al., 2003), som potentiellt ligger till grund för de långsiktiga trofiska respektive kortvariga modulerande effekterna av NGF. Dessutom har både retrograde (långsiktiga) och lokala (kortsiktiga) signalvägar observerats för NGF (Huang och Reichardt, 2003).
celler som uttrycker NGF har detekterats i cortex, cerebellum, hippocampus, thalamus, striatum, basal framhjärna och hjärnstam (Gall och Isackson, 1989; Maisonpierre et al., 1990; Isackson et al., 1991; Conner och Varon, 1992; Hayashi et al., 1993; Mufson et al., 1994; Zhang et al., 2007). Även om NGF-mRNA enligt uppgift har observerats i astrocyter och annan glia, produceras den stora majoriteten av kortikal NGF av neuroner (Sofroniew et al., 2001). De specifika typerna av neuroner som producerar NGF i cortexen är emellertid inte kända, och kolinerga kortikopetalprojektioner har visat sig innervera både excitatoriska och hämmande neuroner i cortexen (Zaborszky et al., 1999). I extrakortiska regioner såsom hippocampus, striatum och basal framhjärna är NGF-produktion övervägande lokaliserad till Gabaergiska hämmande neuroner (Lauterborn et al., 1993, 1995; Pascual et al., 1998; Bizon et al., 1999). Identifiering av NGF-producerande celler i cortex är viktigt för att identifiera potentiella mekanismer som ligger bakom modulering av kolinerga kortikala ingångar och mekanismer för kortikal plasticitet. I den aktuella studien identifierar vi en delmängd av kortikala Gabaergiska celler som den primära källan till NGF-produktion i den vuxna cortexen, med relativt sällsynt produktion av glutamatergiska neuroner.
material och metoder
alla försökspersoner behandlades i enlighet med institutionella riktlinjer för djurvård. På grund av låga endogena nivåer av kortikalt NGF–uttryck som förbjöd identifiering av specifika celltypskällor för NGF i tidigare studier utförde vi lokala kolchicininfusioner för att hämma mikrotubulpolymerisation och därigenom blockera NGF-transport bort från cellkroppen och resulterar i ackumulering av detekterbart NGF-antigen i Soma av producerande celler (Schubert et al., 1972; Hokfelt et al., 1975; Hanson och Edstrubbicm, 1978; Conner och Varon, 1992). Tidigare rapporter har visat att kolchicinbehandling ökar detekteringen av NGF med immunhistokemiska tekniker (Conner och Varon, 1992). Dessutom, kolchicin nivåer som liknar den som används i den aktuella studien inte att inducera brutto avvikelser i neuronal fördelning av neurotrofin familjemedlem BDNF (Conner et al., 1997).
vävnadspreparat
åtta vuxna Fischer 344 råttor (4 hanar, 4 kvinnor; Harlan Sprague Dawley) bedövades med 2 ml/kg av en 25 mg/ml ketamin, 1,3 mg/ml xylazin och 0,25 mg/ml acepromazincocktail och injicerades med 5.0 kg kolchicin (10 kg / kg i aCSF) på de kortikala platser som anges nedan med en hastighet av 0,5 kg/min med en 10 kg Hamilton-spruta. Efter infusion förblev nålen på plats i fyra minuter för att möjliggöra tillräcklig diffusion till den omgivande vävnaden. Fyra djur fick bilaterala injektioner i primärmotorisk cortex (M1) vid +1,2 mm främre (A/P) och 2,5 mm i sidled (M/L) till bregma. Halva lösningen injicerades vid 1,6 mm under hjärnans yta (D/V) och resten vid 1,0
Dubbel-etikett Fluorescensimmunohistokemi
Sekventiell dubbel-etikett immunohistokemi användes för att visualisera neuroner som uttrycker NGF och antingen GABAergic eller glutamatergic cellmarkörer. Fritt flytande sektioner tvättades i Tris-buffrad saltlösning (TBS), permeabiliserad med 0,25% Triton X-100, och icke-specifik märkning blockerades sedan med 5% donkey serum. Sektioner inkuberades för 72 h vid 4 CCB i kanin anti – NGF antikropp (Conner och Varon, 1992) utspädd 1:1000 i TBS, 0,25% Triton X-100 och 5% donkey serum. Efter primär antikroppsinkubation inkuberades sektioner i donkey Anti-rabbit biotin-konjugerad IGG (1: 200; Vector Laboratories, Burlingame, CA, USA). Tyramid signalförstärkning (TSA; PerkinElmer, Waltham, MA, USA) applicerades för att förstärka NGF-signalen, varefter sektioner tvättades i TBS och inkuberades i Alexa Fluor 488 eller 594-konjugerad streptavidin (Invitrogen, Carlsbad, CA, USA) utspätt 1:200 för 3 h vid 4 msk C. Efter en kort tvätt inkuberades sektionerna i både anti-glutamatdekarboxylas (GAD) 65 (GAD-6, AntibodyRegistry:AB_528264, 1:2000; utvecklingsstudier Hybridoma Bank,Iowa City, IA, USA) och mus Anti-GAD67 (AnitbodyRegistry: AB_2278725, 1:1500; Millipore, Temecula, CA, USA) eller i mus Anti-parvalbumin (antibodyregistry: ab_2174013, 1:30000; Millipore, Temecula, CA, USA), mus Anti-calbindin-D-28K (antibodyregistry: Ab_476894, 1:1500; Sigma-Aldrich, St. Louis, MO, USA), eller mus anti-Ca2+/calmodulin-beroende proteinkinas IIA (camkiia, antibodyregistry: ab_2067919, 1:1500; Millipore) för 72 h vid 4 msk C. slutligen tvättades sektioner, inkuberades i Alexa Fluor 594 eller 488-konjugerad åsna anti-mus (Invitrogen) för 3 h vid rumstemperatur, tvättades igen, monterad på glasskivor och täckglas i Fluoromount-G (Southern Biotech, Birminghan, AL, USA). För att maximera identifieringen av Gabaergiska celler inkuberades GAD65-och GAD67-antikroppar samtidigt. En delmängd av sektioner täcktes i ProLong Gold med DAPI (Invitrogen) för visualisering av cellkärnor.
Antikroppskarakterisering
NGF-antikroppen som används i denna studie är en affinitetsrenad polyklonal uppvuxen i kanin mot renad mus NGF (Conner och Varon, 1992). Antikroppen känner igen renad mus och rekombinant human NGF men korsreagerar inte med rekombinant BDNF eller NT-3 (Conner och Varon, 1996). Vidare matchar det immunoreaktiva mönstret av NGF-uttryck i råtthjärnan nära det som erhållits från in-situ-analys i råtthjärnan (Conner och varon, 1997).
Den monoklonala antikroppen GAD – 65 (utvecklingsstudier Hybridoma Bank, Gad-6) producerades genom immunisering av möss med GAD-proteinimmunoaffinitetsrenad från råtthjärnan. Western blot-analys av råtthjärnhomogenater avslöjade antikroppen selektivt känner igen GAD – 65 men inte GAD-67 (Chang och Gottlieb, 1988). Ytterligare studier har visat att Gad-6-antikroppen känner igen en epitop belägen mellan aminosyror 475-571 i C-terminalen för GAD-65 (Butler et al., 1993).
Gad-67 mus monoklonal (Millipore, MAB 5406, mycket: 25010139) höjdes mot aminosyrarester 4-101 av humant GAD-67 och känner igen ett enda 67-kDa-band på Western blot-analys av råtthjärnan (tillverkarens tekniska information). Preinkubation av antikroppen med ett GST-GAD-67 fusionsprotein resulterade i ingen immunpositiv signal i hjärnan (ito et al., 2007).
musen monoklonal anti-CaMKIIa (Millipore, MAB 8699, lot: LV1366080) känner specifikt igen alfa-subenheten av kalcium/kalmodulinberoende proteinkinas II. Western blot-analys visar att antikroppen identifierar ett enda band på 50 kDa och känner igen både fosforylerade och unfosforylerade former (Erondu och Kennedy, 1985).
monoklonal anti-calbindin-D-28k (Sigma–Aldrich, C9848, lot: 088k4799) härrör från BALB/c-möss immuniserade med renad bovin njure calbindin-D-28k. Immunoblotting visade antikroppen känner igen ett 28-kDa-band, och reagerar inte med liknande molekyler, såsom calbindin-D-9K, calretinin, myosin lätt kedja, och parvalbumin (tillverkarens tekniska information). Preabsorption med ett calbindin-D-27 kDa-protein renat från kyckling-och råtthjärnor visade sig eliminera calbindin-immunfärgning i hjärnan (Pasteels et al., 1987).
Anti-parvalbumin (Millipore, MAB 1572, lot: LV1378387) samlades in från möss immuniserade mot parvalbumin renat från grodmuskel. Den monoklonala antikroppen riktas mot en epitop vid den första Ca2+-bindningsstället och immunoblot-analysen visar att den känner igen ett hjärnprotein på 12 kDa (tillverkarens tekniska information).
konfokal analys
bilder fångades med en Olympus AX70 med Magnafire-programvara (version 2.0; Karl Storz Imaging, Goleta, CA, USA). Eftersom NGF-märkning reducerades väsentligen ungefär 2 mm anterior / posterior till kolchicininjektionsställen, förmodligen på grund av brist på kolchicindiffusion och den resulterande frånvaron av somatisk NGF-ackumulering, analyserades endast sektioner inom 1,5 mm från varje kolchicininjektionsställe. Var 10: e sektion (400 oc-m) undersöktes inom en kortikal region. Celler räknades manuellt och minst tre sektioner analyserades i varje kortikal region och antikroppskombination per ämne. Endast tre djur utvärderades i den tidiga regionen på grund av odetekterbar NGF-märkning i den fjärde. Enkel-och dubbelmärkta celler kvantifierades med både enkel-och dubbelkanalbilder. Flera kriterier användes för att identifiera märkta celler, inklusive storlek, morfologi, signal vs. bakgrund och sammanfallande DAPI-märkning vid bedömning av DAPI-färgad vävnad. I en delmängd av sektioner samlades 5 accusm z-stackar med hjälp av en Olympus Fluoview FV1000 för att säkerställa neuronal lokalisering av det märkta objektet. På grund av vårt intresse för andelen, och inte det absoluta antalet, dubbelmärkta celler, användes inte stereologiska metoder.
andelen dubbelmärkta celler per immunoreaktiv (IR) cellgrupp bestämdes för varje bildfält. Medelvärdet för standardfelet för den undersökta delen av det kortikala området beräknades. Envägsanalys av varians (ANOVA) användes för att utvärdera skillnader mellan kortikala regioner. Fishers HSD användes för post-hoc-analys. Alla statistiska analyser utfördes med SPSS 15.0 för Windows.
Antikroppskontroller
kontroller inkluderade utelämnande av primära antikroppar, utelämnande av sekundära antikroppar och ersättning av primär antikropp med icke-specifik antikropp (kanin IgG). Alla manipuleringar hade de förväntade effekterna och stödde påståendet att märkta celler representerar sann antigenmärkning av deras motsvarande antikroppar.
resultat
NGF-Immunmärkning
distinkt NGF-märkning var synlig inom en radie av 1.5 mm från kolchicinkortikala injektionsställen. Inom dessa områden var NGF-märkning huvudsakligen begränsad till cell somata (Figur 1). Sällan kan en eller flera cellulära processer också särskiljas. Utanför denna 1,5 mm radie var NGF-märkning praktiskt taget odetekterbar i cortexen. Eftersom kortikalt uttryck av NGF-receptorerna TrkA och p75 är begränsade till kolinerga kortikopetalfibrer är det osannolikt att den observerade märkningen av NGF återspeglar endocytoserad NGF, men är istället en indikation på NGF-producerande celler (Holtzman et al., 1995; Rossi et al., 2002; Stephens et al., 2005). Som rapporterats tidigare (Ribak et al., 1978) intensifierade kolchicinbehandling Gad-märkning i cellkroppar såväl som neuronala processer. Kolchicin hade ingen detekterbar effekt på märkning för parvalbumin, calbindin eller CaMKIIa.
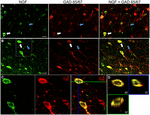
FIGUR 1. Nervtillväxtfaktor colocalizes i stor utsträckning med hämmande cellmarkörer. Immunoreaktiva celler i (A) primärmotorisk cortex och (B) prefrontal cortex. Bilder visar att NGF-märkta celler (grön) colocalize omfattande med GAD 65/67-märkta celler (röd). Vita pilar visar ett exempel cellimmunoreaktiv för både NGF och GAD 65/67 i varje kortikal region. Blå pilar visar celler immunoreaktiva endast för GAD 65/67. (C) förstorad bild av området inuti vit ruta i (B). (D) X–Y-Z-rekonstruktion av den dubbelmärkta cellen som anges i (C). Gröna och blå linjer indikerar dissektionsnivåer i XZ-respektive YZ-plan. Skala bars = 25 occurm.
NGF och GABAergic Co-Localization
nervtillväxtfaktor samlokaliserad i stor utsträckning med GABAergic cellmarkörer GAD65 och GAD67, oavsett det undersökta kortikala området (Figur 1; Tabell 1). Sammantaget 91 0,9% av 0,9% av NGF-märkta kortikala celler märktes också för GAD65/67. Procentandelen av NGF-märkta celler som uttrycker GAD65 / 67 visade liten skillnad mellan prefrontala (90,0 1,5% 1,5), motor (91,7 1,5% 1,5), parietal (89,6 3,5% 3,5) och temporala (93,4 8,1% 8,1) kortikor (enkelriktad ANOVA; p = 0,78). Omvänt, NGF samlokaliserad med endast 55 2.3% av alla GAD65 / 67-märkta celler. För att avgöra om NGF-produktionen var begränsad till en specifik subtyp av Gabaergisk neuron, co-märkt vi vävnad för NGF och antingen parvalbumin eller calbindin (Figur 2). NGF-märkta celler observerades att colocalize med båda markörerna. Emellertid var NGF-kolokalisering med parvalbumin(67,8 3,6%) 3,6% större än med kalbindin (29,1 3,9%). Dessutom utgjorde NGF-IR-celler mindre än hälften av alla parvalbumin (47,7 4,6% av 25,7 4,9% av alla immunoreaktiva celler (2,7 4,9% av alla) och kalbindin (25,7 4,9% av alla).

FIGUR 2. NGF colabeled med hämmande neuronunderklassmarkörer. Skivor av motorbarken märktes för NGF och antingen parvalbumin eller calbindin. (A) celler visade omfattande överlappning av NGF och parvalbumin märkning (vita pilar). (B) omvänt var colabeling av NGF och calbindin mindre vanligt. Skala Bars = 25 occurm.

TABELL 1. NGF-och GAD65 / 67-immunoreaktiva celler efter kortikal region.
Nervtillväxtfaktoruttryckande neuroner observerades i alla kortikala skikt. Tidigare studier har rapporterat ojämn fördelning av NGF-märkta neuroner i kortikala laminer (Pitts och Miller, 2000; Patz och Wahle, 2006). Kvantitativ analys av lager utfördes emellertid inte i den aktuella studien, eftersom NGF-märkningsintensiteten minskade med ökande avstånd från kolchicininjektionsstället.
NGF och Glutamatergisk samlokalisering
märkning för CaMKIIa observerades främst inom cell somata och proximala processer (Figur 3). Till skillnad från den omfattande samlokalisering som ses med NGF-och Gabaergiska markörer, NGF-märkta celler sällan samlokaliserade med CaMKIIa-märkta celler (Figur 3; Tabell 2). Totalt var 4,9 1,1% av NGF-immunoreaktiva celler Co-märkta med CaMKIIa-antikroppar. Samlokalisering skilde sig avsevärt från kortikal region (enkelriktad ANOVA; p = 0,03); Fishers post hoc avslöjade att prefrontal cortex hade en större andel dubbelmärkta NGF-celler (7,6 2,1% 2,1) jämfört med den primära motoriska cortexen (2,4 1,0% 1,02; p = 0,02) och parietal cortex (2,9% 1,5; p = 0,01).

FIGUR 3. Nervtillväxtfaktorn kolokaliserar minimalt med den excitatoriska cellmarkören CaMKIIa. Immunoreaktiva celler i prefrontal cortex. Celler var sällan colabeled för NGF (grön) och CaMKIIa (röd), oavsett kortikal region undersökt. Guldpilar visar ett exempel på en cellimmunreaktiv endast för NGF. Skala bars = 25 occurm.

TABELL 2. NGF-och CaMKIIa-immunoreaktiva celler genom kortikal region.
celler immunoreaktiva för CaMKIIa överträffade kraftigt de märkta med NGF-antikroppar. Den totala andelen CaMKIIa-märkta celler som samtidigt uttryckte NGF-signal var 2 0,6% av den totala andelen av camkiia-märkta celler. Denna procentsats skilde sig signifikant efter region (enkelriktad ANOVA p = 0,003), med prefrontal cortex som uppvisar en större andel dubbelmärkta NGF/CaMKIIa-celler (3,7 1,1% av den primära motoriska cortexen (0,8 0,3% av den, p = 0,001), parietal cortex (1,4 0,6% av den, p = 0,01) och temporal cortex (1,5 0,6% av den, p = 0,01).
diskussion
den aktuella studien visar att den stora majoriteten (>90%) av NGF-producerande neuroner i cortex är GABAergic, medan hälften av alla GABAergic neuroner colocalize med NGF. Däremot uppvisar markörer av excitatoriska neuroner endast sällsynt samlokalisering med NGF. Dessa resultat var konsekventa i flera kortikala regioner som analyserades i denna studie, vilket indikerar att NGF främst produceras av hämmande interneuroner i råttan neocortex.
även om NGF-immunoreaktivitet sällan sammanföll med excitatoriska cellmarkörer (CAMKIIa), var en liten procentandel (~5%) positiv för CaMKIIa i alla undersökta kortikala regioner. Konfokal analys bekräftade att denna dubbla märkning härstammar från samma fokalplan och inte berodde på diskret signal som härrör från överlappande celler. Den funktionella betydelsen av NGF-uttryck i en så liten fraktion av excitatoriska celler i inte känd men det är möjligt att dessa NGF-producerande neuroner representerar en tidigare oidentifierad underklass av excitatoriska neuroner i neocortex.
våra resultat överensstämmer med resultaten från tidigare studier i andra hjärnregioner som visar att NGF samlokaliserar nästan uteslutande med Gabaergiska celler i striatum, basal framhjärna och hippocampus (Lauterborn et al., 1993, 1995; Pascual et al., 1998; Bizon et al., 1999). Således kan NGF-produktion av Gabaergiska celler vara en allmän egenskap hos alla mål som får basal förhjärna kolinerg innervation (inklusive själva basalförhjärnan). Dessa kolinerga neuronpopulationer kräver NGF för underhåll av deras fenotyp och projektioner (Rylett et al., 1993; Chen et al., 1997; Hu et al., 1997; Debeir et al., 1999). Över studier, hämmande interneuroner framträder nu som den primära källan till NGF-trofism för basala kolinerga neuroner i framhjärnan.
även om basala främre hjärnkolinerga neuroner innerverar både excitatoriska och hämmande kortikala nätverk (Zaborszky et al., 1999) är källan till trofiskt stöd överväldigande från den hämmande befolkningen, som är känd för att spela en kritisk roll för att förmedla plasticitet i kortikala kretsar (Hensch och Stryker, 2004; Yazaki-Sugiyama et al., 2009; Donato et al., 2013). Kolinerg signalering verkar bidra till differentiell aktivering av olika hämmande subpopulationer och därigenom modulera excitatorisk-hämmande balans (Xiang et al., 1998; Froemke et al., 2007). NGF kan därmed fungera som en återkopplingssignal mellan högplasthämmande nätverk och de kolinerga ingångarna som aktiverar dem. Faktum är att NGF förstärker plasticitet och beteendeinlärning genom kolinerga beroende mekanismer (Prakash et al., 1996, 2004; Gutierrez et al., 1997; Conner et al., 2009). Aktivitetsberoende frisättning av NGF (Blochl och Thoenen, 1995; Lessmann et al., 2003), parat med förmågan hos NGF att öka kolinerg aktivitet (Rylett et al., 1993; Hu et al., 1997; Auld et al., 2001), föreslår att NGF kan främja omorganisation av aktiva kretsar via förbättrad kolinerg funktion.
framtida studier kommer att försöka identifiera vilka underklasser av hämmande neuroner som uttrycker NGF och hur detta uttryck exakt påverkar kortikala kretsar. För detta ändamål tog vi preliminära steg för att avgöra om NGF samlokaliserades med två vanliga markörer av hämmande neuroner, parvalbumin (främst associerad med korg-och ljuskronceller) och calbindin (associerad med många hämmande celltyper; McBain och Fisahn, 2001; Markram et al., 2004). Våra resultat visar att NGF främst detekterades i parvalbuminimmunoreaktiva celler, även om många celler märkta med parvalbumin inte samuttryckte NGF. Viktigt är att NGF-IR-celler också colocalized med calbindin-märkta celler, vilket tyder på att mer än en underklass av hämmande neuron producerar ngf.
Sammanfattningsvis uttrycks inom råtta neocortex NGF främst av hämmande neuroner, en egenskap som verkar bevaras från fylogenetiskt äldre hjärnområden och som kan generaliseras till hjärnan som helhet. Våra resultat tyder på att kortikala hämmande interneuroner spelar en viktig roll vid upprätthållandet av kolinerga projektionsneuroner i den basala förhjärnan. Gabaergiska interneuroner kan således främja kortikal omorganisation via reglerad NGF-signalering.
intressekonflikt uttalande
författarna förklarar att forskningen genomfördes i avsaknad av kommersiella eller finansiella relationer som kan tolkas som en potentiell intressekonflikt.
bekräftelser
finansierat av NIH (AG10435), Veterans Administration, Alzheimers Association och Dr.Miriam och Sheldon G. Adelson Medical Research Foundation.
tilläggsmaterial
Tilläggsmaterialet för denna artikel finns online på: http://www.frontiersin.org/journal/10.3389/fncel.2014.00220/abstract
Auld, D. S., Mennicken, F. och Quirion, R. (2001). Nervtillväxtfaktor inducerar snabbt förlängd acetylkolinfrisättning från odlade basala framhjärnneuroner: differentiering mellan neuromodulatoriska och neurotrofa influenser. J. Neurosci. 21, 3375–3382.
PubMed Abstrakt / Pubmed fulltext
Bakin, J. S. och Weinberger, N. M. (1996). Induktion av ett fysiologiskt minne i hjärnbarken genom stimulering av kärnbasalis. Proc. Natl. Acad. Sci. USA 93, 11219-11224. doi: 10.1073/pnas.93.20.11219
CrossRef Fullständig Text
Bizon, Jl, Lauterborn, JC och Gall, cm (1999). Subpopulationer av striatala interneuroner kan särskiljas på grundval av neurotrofiskt faktoruttryck. J. Comp. Neurol. 408, 283–298. doi: 10.1002 / (SICI)1096-9861(19990531)408:2<283::stöd-CNE9>3.0.CO;2-2
PubMed Abstrakt / Pubmed fulltext / CrossRef fulltext
Blochl, A. och Thoenen, H. (1995). Karakterisering av nervtillväxtfaktor (NGF) frisättning från hippocampala neuroner: bevis för en konstitutiv och en okonventionell natriumberoende reglerad väg. EUR. J. Neurosci. 7, 1220–1228. doi: 10.1111 / j. 1460-9568. 1995.tb01112.X
PubMed Abstrakt / Pubmed fulltext / CrossRef fulltext
Butler, M. H., Solimena, M., Dirkx, R. Jr., Hayday, A. och de Camilli, P. (1993). Identifiering av en dominerande epitop av glutaminsyradekarboxylas (GAD-65) erkänd av autoantikroppar i stiff-man syndrom. J. Exp. Med. 178, 2097–2106. doi: 10.1084 / jem.178.6.2097
Pubmed Abstrakt / Pubmed fulltext / CrossRef fulltext
Chang, YC och Gottlieb, D. I. (1988). Karakterisering av proteinerna renade med monoklonala antikroppar mot glutaminsyradekarboxylas. J. Neurosci. 8, 2123–2130.
Chen, K. S., Nishimura, M. C., Armanini, M. P., Crowley, C., Spencer, S. D. och Phillips, H. S. (1997). Störning av en enda allel av nervtillväxtfaktorgenen resulterar i atrofi av basala framhjärnkolinerga neuroner och minnesunderskott. J. Neurosci. 17, 7288–7296.
PubMed Abstrakt / Pubmed fulltext
Conner, J. M., Chiba, AA och Tuszynski, M. H. (2005). Det basala kolinerga systemet för framhjärnan är viktigt för kortikal plasticitet och funktionell återhämtning efter hjärnskada. Neuron 46, 173-179. doi: 10.1016 / j. neuron.2005.03.003
PubMed Abstrakt / Pubmed Fulltext / CrossRef Fulltext
Conner, J. M., Culberson, A., Packowski, C., Chiba, AA och Tuszynski, M. H. (2003). Lesioner av det basala framhjärnan kolinerga systemet försämrar uppgiftsförvärvet och avskaffar kortikal plasticitet i samband med motorisk färdighetsinlärning. Neuron 38, 819-829. doi: 10.1016 / S0896-6273(03)00288-5
Pubmed Abstrakt / Pubmed fulltext / CrossRef fulltext
Conner, J. M., Franks, K. M., Titterness, A. K., Russell, K., Merrill, D. A., Christie,B. R., et al. (2009). NGF är viktigt för hippocampal plasticitet och lärande. J. Neurosci. 29, 10883–10889. doi: 10.1523/JNEUROSCI.2594-09.2009
PubMed Abstrakt / Pubmed fulltext / CrossRef fulltext
Conner, J. M., Lauterborn, J. C., Yan, Q., Gall, C. M. och Varon, S. (1997). Distribution av hjärnderivat neurotrofisk faktor (BDNF) protein och mRNA i normal vuxen råtta CNS: bevis för anterograd axonal transport. J. Neurosci. 17, 2295–2313.
PubMed Abstrakt / Pubmed fulltext
Conner, J. M. och Varon, S. (1992). Distribution av nervtillväxtfaktorliknande immunoreaktiva neuroner i den vuxna råtthjärnan efter kolchicinbehandling. J. Comp. Neurol. 326, 347–362. doi: 10.1002 / cne.903260304
PubMed Abstrakt / Pubmed fulltext / CrossRef fulltext
Conner, J. M. och Varon, S. (1996). Karakterisering av antikroppar mot nervtillväxtfaktor: analysberoende variabilitet i korsreaktiviteten med andra neurotrofiner. J. Neurosci. Metoder 65, 93-99. doi: 10.1016/0165-0270(95)00151-4
Pubmed Abstrakt / Pubmed fulltext / CrossRef fulltext
Conner, J. M. och Varon, S. (1997). Utvecklingsprofil för NGF-immunreaktivitet i råtthjärnan: en möjlig roll av NGF i upprättandet av kolinerga terminalfält i hippocampus och cortex. Hjärnan Res. Dev. Hjärnan Res. 101, 67-79. doi: 10.1016 / S0165-3806(97)00051-5
Pubmed Abstrakt / Pubmed fulltext / CrossRef fulltext
Debeir, T., Saragovi, H. U. och Cuello, A. C. (1999). En nervtillväxtfaktor mimetisk TrkA-antagonist orsakar tillbakadragande av kortikala kolinerga boutoner hos den vuxna råttan. Proc. Natl. Acad. Sci. USA 96, 4067-4072. doi: 10.1073/pnas.96.7.4067
PubMed Abstrakt / Pubmed fulltext / CrossRef fulltext
Donato, F., Rompani, SB och Caroni, P. (2013). Parvalbumin-uttrycka korg-cell nätverk plasticitet inducerad av erfarenhet reglerar Vuxenutbildning. Natur 504, 272-276. doi: 10.1038 / nature12866
Pubmed Abstrakt / Pubmed fulltext / CrossRef fulltext
Erondu, N. E. och Kennedy, M. B. (1985). Regional fördelning av typ II Ca2+ / kalmodulinberoende proteinkinas i råtthjärnan. J. Neurosci. 5, 3270–3277.
Froemke, R. C., Merzenich, M. M. och Schreiner, C. E. (2007). Ett synaptiskt minnesspår för kortikal mottaglig fältplasticitet. Natur 450, 425-429. doi: 10.1038 / nature06289
Pubmed Abstrakt / Pubmed fulltext / CrossRef fulltext
Gall, C. M. och Isackson, P. J. (1989). Limbiska anfall ökar neuronal produktion av messenger RNA för nervtillväxtfaktor. Vetenskap 245, 758-761. doi: 10.1126/vetenskap.2549634
CrossRef Fullständig Text
Gutierrez, H., Miranda, M. I. och Bermudez-Rattoni, F. (1997). Inlärningssvårigheter och kolinerg deafferentation efter kortikal nervtillväxtfaktorbrist. J. Neurosci. 17, 3796–3803.
PubMed Abstrakt / Pubmed fulltext
Hanson, M., och Edstr Baccarat, A. (1978). Mitoshämmare och axonal transport. Int. Rev. Cytol. Suppl. 373–402.
Hayashi, M., Yamashita, A., Shimizu, K., Sogawa, K. och Fujii, Y. (1993). Uttryck av genen för nervtillväxtfaktor (NGF) i apans centrala nervsystem. 618, 142-148. doi: 10.1016/0006-8993 (93)90437-R
CrossRef Fullständig Text
Hefti, F. (1986). Nervtillväxtfaktor främjar överlevnad av septala kolinerga neuroner efter fimbriala transektioner. J. Neurosci. 6, 2155–2162.
Hensch, T. K. och Stryker, M. P. (2004). Kolonnarkitektur skulpterad av GABA-kretsar för att utveckla cat visual cortex. Vetenskap 303, 1678-1681. doi: 10.1126/vetenskap.1091031
PubMed Abstrakt / Pubmed fulltext / CrossRef fulltext
Hokfelt, T., Kellerth, J. O., Nilsson, G. och Pernow, B. (1975). Experimentella immunhistokemiska studier om lokalisering och distribution av substans P i cat primära sensoriska neuroner. Hjärnan Res. 100, 235-252. doi: 10.1016/0006-8993(75)90481-3
Pubmed Abstrakt / Pubmed fulltext / CrossRef fulltext
han är en av de mest kända och mest kända i världen. (1995). TrkA-uttryck i CNS: bevis för förekomsten av flera nya NGF-responsiva CNS-neuroner. J. Neurosci. 15, 1567–1576.
PubMed Abstrakt / Pubmed Fulltext
Hu, L., Cote, S. L. och Cuello, A. C. (1997). Differentiell modulering av den kolinerga fenotypen av nucleus basalis magnocellularis neuroner genom att applicera NGF vid cellkroppen eller kortikala terminalfält. Exp. Neurol. 143, 162–171. doi: 10.1006 / exnr.1996.6357
Pubmed Abstrakt / Pubmed fulltext / CrossRef fulltext
Huang, Ej och Reichardt, LF (2003). Trk-receptorer: roller i neuronal signaltransduktion. Annu. Pastor Biochem. 72, 609–642. doi: 10.1146/annurev.biochem.72.121801.161629
CrossRef Fullständig Text
Isackson, P. J., Huntsman, M. M., Murray, K. D. och Gall, C. M. (1991). BDNF-mRNA-uttryck ökar i vuxen råtta förehjärnan efter limbiska anfall: temporala induktionsmönster som skiljer sig från NGF. Neuron 6, 937-948. doi: 10.1016/0896-6273 (91)90234-Q
Pubmed Abstrakt / Pubmed fulltext / CrossRef fulltext
Ito, T., Hioki, H., Nakamura, K., Tanaka, Y., Nakade, H., Kaneko,T., et al. (2007). Gamma-aminosmörsyrainnehållande sympatiska preganglioniska neuroner i råtta bröstkorg ryggmärgen skickar sina axoner till överlägsen cervikal ganglion. J. Comp. Neurol. 502, 113–125. doi: 10.1002 / cne.21309
PubMed Abstrakt / Pubmed fulltext / CrossRef fulltext
Kilgard, M. P. och Merzenich, M. M. (1998). Kortikal karta omorganisation möjliggörs av nucleus basalis aktivitet. Vetenskap 279, 1714-1718. doi: 10.1126/vetenskap.279.5357.1714
Pubmed Abstrakt / Pubmed Fulltext / CrossRef Fulltext
Kordower, J. H., Bartus, R. T., Bothwell, M., Schatteman, G. och Gash, D. M. (1988). Nervtillväxtfaktorreceptorimmunoreaktivitet i det icke-humana primatet (Cebus apella): distribution, morfologi och kolokalisering med kolinerga enzymer. J. Comp. Neurol. 277, 465–486. doi: 10.1002 / cne.902770402
Pubmed Abstrakt / Pubmed fulltext / CrossRef fulltext
han är en av de mest kända och mest kända i världen. (1994). Den åldrade apan basal forebrain: räddning och spridning av axotomiserade basala framhjärnneuroner efter transplantat av inkapslade celler som utsöndrar mänsklig nervtillväxtfaktor. Proc. Natl. Acad. Sci. USA 91, 10898-10902. doi: 10.1073/pnas.91.23.10898
Pubmed Abstrakt / Pubmed fulltext / CrossRef fulltext
Korsching, S., Auburger, G., Heumann, R., Scott, J. och Thoenen, H. (1985). Nivåer av nervtillväxtfaktor och dess mRNA i råttans centrala nervsystem korrelerar med kolinerg innervation. EMBO J. 4, 1389-1393.
PubMed Abstrakt / Pubmed fulltext
Lad, S. P., Neet, K. E. och Mufson, Ej (2003). Nervtillväxtfaktor: struktur, funktion och terapeutiska konsekvenser för Alzheimers sjukdom. Curr. Läkemedel riktar sig mot CNS-Neurol. Disord. 2, 315–334. doi: 10.2174/1568007033482724
Pubmed Abstrakt / Pubmed fulltext / CrossRef fulltext
Large, T. H., Bodary, S. C., Clegg, D. O., Weskamp, G., Otten, U. och Reichardt, L. F. (1986). Nervtillväxtfaktorgenuttryck i den utvecklande råtthjärnan. Vetenskap 234, 352-355. doi: 10.1126 / vetenskap.3764415
CrossRef Fullständig Text
Lauterborn, JC, Bizon, Jl, Tran, TM och Gall, cm (1995). NGF mRNA uttrycks av GABAergic men inte kolinerga neuroner i råttbasal framhjärna. J. Comp. Neurol. 360, 454–462. doi: 10.1002 / cne.903600307
PubMed Abstrakt / Pubmed fulltext / CrossRef fulltext
Lauterborn, J. C., Tran, T. M., Isackson, P. J. och Gall, C. M. (1993). Nervtillväxtfaktor mRNA uttrycks av Gabaergiska neuroner i råtthippocampus. Neuroreport 5, 273-276. doi: 10.1097/00001756-199312000-00023
CrossRef Full Text
Lessmann, V., Gottmann, K. och Malcangio, M. (2003). Neurotrofinsekretion: aktuella fakta och framtidsutsikter. Prog. Neurobiol. 69, 341–374. doi: 10.1016 / S0301-0082(03)00019-4
Pubmed Abstrakt / Pubmed fulltext / CrossRef fulltext
L. F., Kaplan, D. R., Chua-Couzens, J., Clary,D. O., et al. (1995). Reglering av TrkA och Chattuttryck vid utveckling av råttbasal framhjärna: bevis för att både exogen och endogen NGF reglerar differentiering av kolinerga neuroner. J. Neurosci. 15, 2888–2905.
PubMed Abstrakt / Pubmed fulltext
han är en av de mest kända och mest kända i världen. (1990). NT-3, BDNF och NGF i det utvecklande råttnervsystemet: parallella såväl som ömsesidiga uttrycksmönster. Neuron 5, 501-509. doi: 10.1016/0896-6273 (90)90089-X
Pubmed Abstrakt / Pubmed fulltext / CrossRef fulltext
Markram, H., Toledo-Rodriguez, M., Wang, Y., Gupta, A., Silberberg, G. och Wu, C. (2004). Interneuroner i det neokortiska hämmande systemet. Nat. Rev Neurosci. 5, 793–807. doi: 10.1038 / nrn1519
Pubmed Abstrakt / Pubmed fulltext / CrossRef fulltext
McBain, C. J. och Fisahn, A. (2001). Internuroner obundna. Nat. Rev Neurosci. 2, 11–23. doi: 10.1038/35049047
Pubmed Abstrakt / Pubmed fulltext / CrossRef fulltext
Mufson, Ej, Conner, JM, Varon, S. och Kordower, J. H. (1994). Nervtillväxtfaktorliknande immunoreaktiva profiler i primatbasal framhjärna och hippocampalbildning. J. Comp. Neurol. 341, 507–519. doi: 10.1002 / cne.903410407
Pubmed Abstrakt / Pubmed fulltext / CrossRef fulltext
Pascual, M., Rocamora, N., Acsady, L., Freund, TF och Soriano, E. (1998). Uttryck av nervtillväxtfaktor och neurotrofin-3 mRNA i hippocampala interneuroner: morfologisk karakterisering, uttrycksnivåer och kolokalisering av nervtillväxtfaktor och neurotrofin-3. J. Comp. Neurol. 395, 73–90. doi: 10.1002 / (SICI)1096-9861(19980525)395:1<73::stöd-CNE6>3.0.CO; 2-e
PubMed Abstrakt / Pubmed fulltext / CrossRef fulltext
Pasteels, B., Miki, N., Hatakenaka, S. och Pochet, R. (1987). Immunohistokemisk korsreaktivitet och elektroforetisk comigration mellan calbindin D-27 kDa och visinin. Hjärnan Res. 412, 107-113. doi: 10.1016/0006-8993(87)91444-2
Pubmed Abstrakt / Pubmed fulltext / CrossRef fulltext
Patz, S. och Wahle, P. (2006). Utvecklingsförändringar av neurotrofin mRNA-uttryck i lagren av råttvisuell cortex. EUR. J. Neurosci. 24, 2453–2460. doi: 10.1111/j.1460-9568.2006. 05126.X
PubMed Abstrakt / Pubmed fulltext / CrossRef fulltext
Pitts, A. F. och Miller, M. W. (2000). Uttryck av nervtillväxtfaktor, hjärnhärledd neurotrofisk faktor och neurotrofin-3 i den mogna råttans somatosensoriska cortex: samuttryck med neurotrofinreceptorer med hög affinitet. J. Comp. Neurol. 418, 241–254. doi: 10.1002 / (SICI)1096-9861(20000313)418:3<241::stöd-CNE1>3.0.CO;2-M
PubMed Abstrakt / Pubmed fulltext / CrossRef fulltext
Prakash, N., Cohen-Cory, S. och Frostig, R. D. (1996). Snabba och motsatta effekter av BDNF och NGF på den funktionella organisationen av den vuxna cortex in vivo. Natur 381, 702-706. doi: 10.1038 / 381702a0
Pubmed Abstrakt / Pubmed fulltext / CrossRef fulltext
Prakash, N., Cohen-Cory, S., Penschuck, S. och Frostig, R. D. (2004). Basal forebrain kolinerga systemet är involverat i snabb nervtillväxtfaktor (NGF)-inducerad plasticitet i tunnbarken hos vuxna råttor. J. Neurofysiol. 91, 424–437. doi: 10.1152 / jn.00489.2003
PubMed Abstrakt / Pubmed fulltext / CrossRef fulltext
Ribak, C. E., Vaughn, J. E. och Saito, K. (1978). Immunocytokemisk lokalisering av glutaminsyradekarboxylas i neuronal somata efter kolchicininhibering av axonal transport. Hjärnan Res. 140, 315-332. doi: 10.1016/0006-8993(78)90463-8
Pubmed Abstrakt / Pubmed fulltext / CrossRef fulltext
Rossi, F. M., Sala, R. och Maffei, L. (2002). Uttryck av nervtillväxtfaktorreceptorerna TrkA och p75NTR i råttans visuella cortex: utveckling och reglering av den kolinerga ingången. J. Neurosci. 22, 912–919.
PubMed Abstrakt / Pubmed fulltext
Rylett, R. J., Goddard, S., Schmidt, B. M. och Williams, L. R. (1993). Acetylkolinsyntes och frisättning efter kontinuerlig intracerebral administrering av NGF hos vuxna och åldrade Fischer-344-råttor. J. Neurosci. 13, 3956–3963.
PubMed Abstrakt / Pubmed fulltext
Schubert, P., Kreutzberg, GW och Lux, HD (1972). Neuroplasmisk transport i dendriter: effekt av kolchicin på morfologi och fysiologi hos motoneuroner i katten. Hjärnan Res. 47, 331-343. doi: 10.1016/0006-8993(72)90643-9
Pubmed Abstrakt / Pubmed fulltext / CrossRef fulltext
Shelton, D. L. och Reichardt, L. F. (1986). Studier om uttrycket av beta-nervtillväxtfaktorn (NGF) – genen i centrala nervsystemet: nivå och regional fördelning av NGF-mRNA tyder på att NGF fungerar som en trofisk faktor för flera distinkta populationer av neuroner. Proc. Natl. Acad. Sci. USA 83, 2714-2718. doi: 10.1073/pnas.83.8.2714
Pubmed Abstrakt / Pubmed fulltext / CrossRef fulltext
Sofroniew, M. V., Howe, C. L. och Mobley, W. C. (2001). Nervtillväxtfaktorsignalering, neuroprotektion och neuralreparation. Annu. Rev Neurosci. 24, 1217–1281. doi: 10.1146/annurev.neuro.24.1.1217
CrossRef Fullständig Text
Stephens, H. E., Belliveau, A. C., Gupta, J. S., Mirkovic, S. och Kablar, B. (2005). Neurotrofinernas roll vid upprätthållandet av ryggmärgsmotorneuronerna och de dorsala rotganglierna proprioceptiva sensoriska neuroner. Int. J. Dev. Neurovetenskap. 23, 613–620. doi: 10.1016/j.ijdevneu.2005.07.002
PubMed Abstrakt / Pubmed fulltext / CrossRef fulltext
Tuszynski, M. H., Armstrong, D. M. och Gage, F. H. (1990). Basal hjärncellförlust efter fimbria / fornix-transektion. Brain Res. 508, 241–248. doi: 10.1016/0006-8993 (90)90402-W
CrossRef Fullständig Text
Xiang, Z., Huguenard, Jr och Prince, D. A. (1998). Kolinerg omkoppling inom neokortikala hämmande nätverk. Vetenskap 281, 985-988. doi: 10.1126/vetenskap.281.5379.985
Pubmed Abstrakt / Pubmed fulltext / CrossRef fulltext
Yazaki-Sugiyama, Y., Kang, S., Cateau, H., Fukai, T. och Hensch, T. K. (2009). Dubbelriktad plasticitet i snabbspikande GABA-kretsar genom visuell upplevelse. Natur 462, 218-221. doi: 10.1038 / nature08485
PubMed Abstrakt / Pubmed fulltext / CrossRef fulltext
Zaborszky, L., Pang, K., Somogyi, J., Nadasdy, Z. och Kallo, I. (1999). Den basala framhjärnan kortikopetal systemet revisited. Ann. N. Y. Acad. Sci. 877, 339–367. doi: 10.1111 / j. 1749-6632. 1999.tb09276.X
PubMed Abstrakt / Pubmed fulltext / CrossRef fulltext
Zhang, H. T., Li, L. Y., Zou, X. L., sång, X. B., Hu, Y. L., Feng,Z. T., et al. (2007). Immunohistokemisk fördelning av NGF, BDNF, NT-3 och NT-4 i vuxna rhesus apa hjärnor. J. Histochem. Cytochem. 55, 1–19. doi: 10.1369/jhc.6A6952.2006
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text