- wprowadzenie
- materiały i metody
- preparat tkankowy
- Dwuznakowa Immunohistochemia Fluorescencyjna
- charakterystyka przeciwciał
- Analiza konfokalna
- Kontrola przeciwciał
- wyniki
- IMMUNOLABELING NGF
- WSPÓŁLOKALIZACJA NGF i Gabaergiczna
- WSPÓŁLOKALIZACJA NGF i Glutaminergiczna
- dyskusja
- Oświadczenie o konflikcie interesów
- podziękowania
- Materiały uzupełniające
wprowadzenie
neurotrofin nerve growth factor (NGF) bierze udział w kilku krytycznych procesach w rozwijającym się i dojrzałym układzie nerwowym ssaków, w tym unerwieniu celu, różnicowaniu komórek i przeżywalności neuronów (Large et al., 1986; Li et al., 1995; Sofroniew et al., 2001; Lad et al., 2003). W dorosłym mózgu NGF odgrywa kluczową rolę w utrzymaniu i funkcjonowaniu podstawowego układu cholinergicznego przedmózgowia(Lad i wsp ., 2003). Poziomy NGF są najwyższe w obszarach otrzymujących największą liczbę podstawno-mózgowych projekcji cholinergicznych, a mianowicie hipokamp i kora mózgowa(Korsching et al., 1985; Shelton and Reichardt, 1986), a receptory dla NGF w korze mózgowej są w dużej mierze ograniczone do podstawowych projekcji kortykopetalu przedmózgowia (Kordower et al., 1988; Sofroniew et al., 2001; Rossi et al., 2002). Sygnalizacja czynnika wzrostu nerwów utrzymuje cholinergiczne projekcje kortykopetalu w wieku dorosłym (Chen et al., 1997; Debeir et al., 1999) i może zapobiegać degeneracji tych neuronów po przecięciu ich aksonów (Hefti, 1986; Tuszyński et al., 1990; Kordower et al., 1994). Ponadto, NGF zwiększa uwalnianie acetylocholiny z hodowli podstawowych przodomózgowia(Auld i in., 2001) i może modulować funkcję cholinergiczną poprzez fenotypową kontrolę locus genu cholinergicznego (Rylett et al., 1993; Hu et al., 1997).
podstawowy układ cholinergiczny przedmózgowia wpływa na plastyczność zależną od uczenia się i doświadczenia w korze mózgowej (Bakin and Weinberger, 1996; Kilgard and Merzenich, 1998; Conner et al., 2003, 2005), a sygnalizacja NGF została postawiona hipotezie, aby wspierać i ewentualnie wzmacniać uczenie się i plastyczność za pośrednictwem podstawowego móżdżku. Na przykład blokada sygnalizacji NGF poprzez wielokrotne zastrzyki przeciwciał NGF w korze wyspiarskiej zmniejsza miejscowe unerwienie cholinergiczne i zakłóca nabycie dwóch procesów, które zależą od integralności wejść cholinergicznych, uwarunkowanej awersji smakowej i hamującego uczenia się unikania (Gutierrez et al., 1997). Ostatnie badania przeprowadzone przez Conner et al. (2009) wykazał, że zarówno uczenie przestrzenne, jak i długotrwałe wzmacnianie hipokampa (LTP) są wzmocnione po wlewie NGF do jądra przegrody, głównego źródła unerwienia cholinergicznego hipokampa.
ogniskowe zastosowanie NGF może również wywołać szybką ekspansję lokalnej reprezentacji wąsów w korze baryłkowej szczurów. Proces ten jest zależny od projekcji cholinergicznych z podstawy przedmózgowia (Prakash et al., 1996, 2004), co sugeruje, że korowa sygnalizacja NGF może stymulować szybką, zależną od cholinergicznej reorganizację czynnościową. Tak więc, oprócz długotrwałego działania troficznego na komórki cholinergiczne podstawy przedmózgowia, NGF może również uczestniczyć w krótkotrwałej przebudowie obwodu. Ta hipoteza „podwójnego działania”jest wspierana przez istnienie konstytutywnych i zależnych od aktywności mechanizmów uwalniania NGF (Blochl and Thoenen, 1995; Lessmann et al., 2003), potencjalnie leżących u podstaw odpowiednio długoterminowego troficznego i krótkoterminowego efektu modulacyjnego NGF. Ponadto zaobserwowano zarówno wsteczny (długotrwały), jak i lokalny (krótkotrwały) szlak sygnalizacji dla NGF (Huang i Reichardt, 2003).
komórki wyrażające NGF zostały wykryte w korze mózgowej, móżdżku, hipokampie, wzgórzu, prążkowiu, podstawnym móżdżku przednim i pniu mózgu (Gall and Isackson, 1989; Maisonpierre et al., 1990; Isackson et al., 1991; Conner and Varon, 1992; Hayashi et al., 1993; Mufson et al., 1994; Zhang et al., 2007). Chociaż mRNA NGF zaobserwowano podobno w astrocytach i innych glejach, zdecydowana większość korowego NGF jest wytwarzana przez neurony(Sofroniew et al., 2001). Specyficzne typy neuronów wytwarzających NGF w korze mózgowej nie są jednak znane ,a projekcje cholinergiczne kortykopetalu wykazały unerwienie obu pobudzających i hamujących neuronów w korze mózgowej(Zaborszky i in., 1999). W rejonach pozaustrojowych, takich jak hipokamp, prążkowie i podstawy przedmózgowia, produkcja NGF jest głównie zlokalizowana w neuronach hamujących Gabaergicznie (Lauterborn et al., 1993, 1995; Pascual et al., 1998; Bizon et al., 1999). Identyfikacja komórek produkujących NGF w korze mózgowej jest ważna dla identyfikacji potencjalnych mechanizmów leżących u podstaw modulacji cholinergicznych wejść korowych oraz mechanizmów plastyczności korowej. W obecnym badaniu identyfikujemy podgrupę komórek korowych GABAergicznych jako główne źródło produkcji NGF w korze dorosłej, przy stosunkowo rzadkiej produkcji przez neurony glutaminergiczne.
materiały i metody
wszyscy pacjenci byli leczeni zgodnie z wytycznymi instytucjonalnymi dotyczącymi opieki nad zwierzętami. Ze względu na niskie endogenne poziomy ekspresji korowego NGF, które zabroniły identyfikacji specyficznych źródeł NGF typu komórkowego w poprzednich badaniach, wykonaliśmy lokalne napary kolchicyny w celu zahamowania polimeryzacji mikrotubul, blokując w ten sposób transport NGF z dala od ciała komórki i powodując akumulację wykrywalnego antygenu NGF w Somie komórek produkujących (Schubert et al., 1972; Hokfelt et al., 1975; Hanson and Edström, 1978; Conner and Varon, 1992). Wcześniejsze doniesienia wykazały, że leczenie kolchicyną zwiększa wykrywanie NGF przy użyciu technik immunohistochemicznych (Conner and Varon, 1992). Ponadto, poziomy kolchicyny podobne do tych stosowanych w obecnym badaniu nie powodują poważnych nieprawidłowości w dystrybucji neuronalnej członka rodziny neurotrofin BDNF (Conner i wsp ., 1997).
preparat tkankowy
osiem dorosłych szczurów Fischera 344 (4 samce, 4 samice; Harlan Sprague Dawley) znieczulono 2 ml/kg ketaminy 25 mg/ml, 1,3 mg/ml ksylazyny i 0,25 mg/ml koktajlu acepromazyny i wstrzyknięto 5.0 µl kolchicyny (10 µg/µl w aCSF) w miejscach korowych wymienionych poniżej z szybkością 0,5 µl/min przy użyciu strzykawki Hamilton o pojemności 10 µl. Po infuzji igła pozostawała na miejscu przez cztery minuty, aby umożliwić odpowiednią dyfuzję do otaczającej tkanki. Cztery zwierzęta otrzymały obustronne zastrzyki w pierwotnej korze ruchowej (M1) przy +1,2 mm przedniej (A/P) i ±2,5 mm bocznej (M/L) do bregma. Połowę roztworu wstrzyknięto 1,6 mm poniżej powierzchni mózgu (D / V), a resztę 1,0 mm. pozostałe cztery zwierzęta otrzymały jednostronne zastrzyki w korze przedczołowej (A/P: +3.0, M/L: +0,5, D / V: -2,3 i -1,8), kora skroniowa (A/P: -6,5, M/L: +5,0, D/V: -7,5 i -7,0) i kora ciemieniowa (A/P: -3,0, M/L: +5,0, D/V: -1,8 i -1,3). Po 48 godzinach zwierzęta poddano głębokiemu znieczuleniu i przezskórnie perfuzowano 250 ml soli fizjologicznej buforowanej zimnym fosforanem (pH 7,4), a następnie 250 ml zimnego 2% paraformaldehydu + 0,2% parabenzochinonu w 0,1 M buforze fosforanowym. Mózgi ekstrahowano, postfiksowano przez 2 godziny w tym samym utrwalaczu i krioprotekowano w 0,1 M buforze fosforanowym zawierającym 30% sacharozy przez co najmniej 72 godziny w temperaturze 4°C. Sekcje koronowe (40 µm) przecięto na zamrażającym mikrotomie ślizgowym i przechowywano w krioprotektancie (TCS) w temperaturze 4°C, aż do dalszego przetworzenia na immunohistochemię.
Dwuznakowa Immunohistochemia Fluorescencyjna
Sekwencyjna dwuznakowa immunohistochemia została użyta do wizualizacji neuronów wyrażających NGF i markerów GABAergicznych lub glutaminergicznych. Sekcje swobodne przemyto roztworem buforowanej soli fizjologicznej Tris (TBS), przepuszczono 0,25% Triton X-100, a niespecyficzne etykietowanie Zablokowano 5% osłem serum. Sekcje inkubowano przez 72 godziny w temperaturze 4°c w króliczym przeciwciale anty-NGF (Conner i Varon, 1992) rozcieńczonym 1:1000 W TBS, 0,25% Triton X-100 i 5% surowicy osła. Po inkubacji pierwszorzędowych przeciwciał, sekcje inkubowano w IgG sprzężonym z biotyną sprzężoną z osłem anty-króliczym (1: 200; Vector Laboratories, Burlingame, CA, USA). Wzmocnienie sygnału tyramidu (TSA; PerkinElmer, Waltham, MA, USA) zastosowano do wzmocnienia sygnału NGF, po czym sekcje przemyto w TBS i inkubowano w skoniugowanej streptawidynie Alexa Fluor 488 lub 594 (Invitrogen, Carlsbad, CA, USA) rozcieńczono 1:200 przez 3 godziny w 4°C. Po krótkim umyciu sekcje inkubowano zarówno w mysich anty-glutaminianowych dekarboksylazach (GAD) 65 (gad-6, Antybodyregistry:AB_528264, 1:2000; badania rozwojowe Hybridoma Bank,Iowa City, IA, USA), jak i mysich anty-GAD67 (AnitbodyRegistry: AB_2278725, 1:1500; Millipore, Temecula, CA, USA) lub w mysich anty-parwalbuminach (gad-6, Antybodyregistry: AB_528264, 1:2000; badania rozwojowe Hybridoma Bank, Iowa City, IA, USA). antybodyregistry: ab_2174013, 1:30000; Millipore, Temecula, CA, USA), Mysi anty-KALBINDIN-D-28K (antybodyregistry: Ab_476894, 1:1500; Sigma-Aldrich, St. Louis, MO, USA), lub mysi anty-CA2+/kalmodulinowa kinaza białkowa IIA (Camkiia, ANTYBODYREGISTRY: ab_2067919, 1: 1500; Na koniec sekcje przemywano, inkubowano w sprzężonym z osłem anty-mysim (Invitrogen) Alexa Fluor 594 lub 488 (Invitrogen) przez 3 godziny w temperaturze pokojowej, ponownie przemywano, montowano na szklanych szkiełkach i pokrywano w Fluoromount-G (Southern Biotech, Birminghan, AL, USA). W celu zmaksymalizowania identyfikacji komórek GABAergicznych, przeciwciała GAD65 i GAD67 inkubowano jednocześnie. Podzbiór sekcji zakrywano w złocie ProLong z DAPI (Invitrogen) w celu wizualizacji jąder komórkowych.
charakterystyka przeciwciał
przeciwciało NGF użyte w tym badaniu jest poliklonalem oczyszczonym z powinowactwem, wyhodowanym u królików przeciwko oczyszczonemu MYSIMU NGF (Conner and Varon, 1992). Przeciwciało rozpoznaje oczyszczony mysi i rekombinowany ludzki NGF, ale nie reaguje krzyżowo z rekombinowanym BDNF lub NT-3 (Conner and Varon, 1996). Ponadto, immunoreaktywny wzór ekspresji NGF w mózgu szczura ściśle odpowiada wzorcowi uzyskanemu z analizy in situ w mózgu szczura (Conner and Varon, 1997).
przeciwciało monoklonalne GAD – 65 (badania rozwojowe Hybridoma Bank, Gad-6) zostało wytworzone przez immunizację myszy oczyszczoną z mózgu szczura immunoaffinity białka gad. Analiza Western blot homogeniatów mózgu szczura wykazała, że przeciwciało selektywnie rozpoznaje GAD-65, ale nie GAD-67 (Chang i Gottlieb, 1988). Dodatkowe badania wykazały, że przeciwciało GAD-6 rozpoznaje epitop zlokalizowany pomiędzy aminokwasami 475-571 C-końca GAD – 65 (Butler i wsp ., 1993).
mysz gad-67 monoclonal (Millipore, MAB 5406, lot: 25010139) został podniesiony przeciwko reszt aminokwasowych 4-101 ludzkiego GAD-67 i rozpoznaje pojedynczy zespół 67-kDa w analizie Western blot mózgu szczura(informacje techniczne producenta). Preinkubacja przeciwciała białkiem fuzyjnym GST-GAD-67 nie spowodowała sygnału immunopozytywnego w mózgu (Ito i wsp., 2007).
mysi monoklonalny anty-CaMKIIa (Millipore, MAB 8699, lot: lv1366080) specyficznie rozpoznaje podjednostkę Alfa zależnej od wapnia/kalmoduliny kinazy białkowej II. Analiza Western blot pokazuje, że przeciwciało identyfikuje pojedyncze pasmo 50 kDa i rozpoznaje zarówno formy fosforylowane, jak i niefosforylowane (Erondu and Kennedy, 1985).
monoklonalna anty-kalbindyna-d-28K (Sigma–Aldrich, c9848, lot: 088k4799) pochodzi od myszy BALB/c immunizowanych oczyszczoną kalbindyną-d-28k nerki bydlęcej. Immunoblotting wykazał, że przeciwciało rozpoznaje pasmo 28-kDa i nie reaguje z podobnymi cząsteczkami, takimi jak kalbindyna-D-9K, kalretynina, lekki łańcuch miozyny i parvalbumin (informacje techniczne producenta). Wykazano, że przedabsorpcja z białkiem kalbindyny-D-27 kDa oczyszczonym z mózgów piskląt i szczurów eliminuje immunostawienie kalbindyny w mózgu (Pasteels et al., 1987).
anty-parwalbuminę (Millipore, MAB 1572, lot: lv1378387) zebrano od myszy immunizowanych przeciwko parwalbuminie oczyszczonej z mięśnia żaby. Przeciwciało monoklonalne jest skierowane przeciwko epitopowi w pierwszym miejscu wiązania Ca2+, a analiza immunoblotowa wykazuje, że rozpoznaje białko mózgu o masie 12 kDa (Informacja techniczna producenta).
Analiza konfokalna
obrazy zostały zarejestrowane przy użyciu aparatu Olympus AX70 z oprogramowaniem Magnafire (Wersja 2.0; Karl Storz Imaging, Goleta, CA, USA). Ponieważ znakowanie NGF zostało znacznie zmniejszone o około 2 mm w stosunku do miejsc wstrzyknięcia kolchicyny, prawdopodobnie z powodu braku dyfuzji kolchicyny i wynikającego z tego braku somatycznej akumulacji NGF, analizowano tylko odcinki w obrębie 1,5 mm każdego miejsca wstrzyknięcia kolchicyny. Co dziesiąty odcinek (400 µm) badano w obrębie obszaru kory. Komórki zliczano ręcznie i analizowano co najmniej trzy sekcje w każdym regionie korowym i kombinacji przeciwciał na osobnika. Tylko trzy zwierzęta zostały ocenione w obszarze czasowym z powodu niewykrywalnego oznakowania NGF w czwartym. Pojedyncze i Podwójnie znakowane komórki oznaczano ilościowo za pomocą obrazów jedno – i dwukanałowych. Do identyfikacji oznaczonych komórek wykorzystano kilka kryteriów, w tym Rozmiar, morfologię, sygnał vs.tło i przypadkowe etykietowanie DAPI podczas oceny tkanki barwionej DAPI. W podgrupie sekcji, 5 µm stosy z zebrano za pomocą Olympus Fluoview FV1000 w celu zapewnienia neuronalnej lokalizacji znakowanego obiektu. Ze względu na nasze zainteresowanie proporcją, a nie absolutną liczbą podwójnie znakowanych komórek, nie stosowano metod stereologicznych.
dla każdego pola obrazu oznaczono procent podwójnie znakowanych komórek na grupę komórek immunoreaktywnych (IR). Dla każdego badanego obszaru korowego obliczono średni ± błąd standardowy. Do oceny różnic między regionami korowymi wykorzystano jednokierunkową analizę wariancji (ANOVA). HSD Fishera wykorzystano do analizy post-hoc. Wszystkie analizy statystyczne zostały przeprowadzone przy użyciu SPSS 15.0 Dla Windows.
Kontrola przeciwciał
Kontrola obejmowała pominięcie przeciwciał pierwotnych, pominięcie przeciwciał wtórnych i zastąpienie przeciwciał pierwotnych przeciwciałami niespecyficznymi (królicze IgG). Wszystkie manipulacje przynosiły oczekiwane efekty i wspierały twierdzenie, że znakowane komórki reprezentują prawdziwe oznaczenie antygenu przez odpowiadające im przeciwciała.
wyniki
IMMUNOLABELING NGF
Wyraźne oznakowanie NGF było widoczne w promieniu 1.5 mm od miejsc wstrzyknięcia kory kolchicyny. W tych obszarach znakowanie NGF ograniczało się głównie do Somat komórkowych (rycina 1). Rzadko można wyróżnić jeden lub więcej procesów komórkowych. Poza promieniem 1,5 mm oznakowanie NGF było praktycznie niewykrywalne w korze mózgowej. Ponieważ ekspresja korowa receptorów NGF TrkA i p75 ogranicza się do cholinergicznych włókien kortykopetalu, zaobserwowane etykietowanie NGF jest mało prawdopodobne, aby odzwierciedlało ENDOCYTOZOWANE NGF, ale zamiast tego wskazuje na komórki produkujące NGF(Holtzman i wsp ., 1995; Rossi et al., 2002; Stephens et al., 2005). Jak informowaliśmy wcześniej (Ribak et al., 1978), leczenie kolchicyną zintensyfikowało etykietowanie GAD w ciałach komórkowych, a także w procesach neuronalnych. Kolchicyna nie miała wykrywalnego wpływu na etykietowanie parwalbuminy, kalbindyny lub Kamkiii.
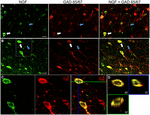
RYSUNEK 1. Nerwowy czynnik wzrostu kolokalizuje się intensywnie z hamującymi markerami komórkowymi. Immunoreaktywne komórki w (a) pierwotnej korze ruchowej i (B) korze przedczołowej. Obrazy pokazują, że komórki oznaczone NGF (zielone) kolokalizują się intensywnie z komórkami oznaczonymi GAD 65/67 (czerwone). Białe strzałki pokazują przykład immunoreaktywności komórek zarówno dla NGF, jak i GAD 65/67 w każdym regionie korowym. Niebieskie strzałki pokazują komórki immunoreaktywne tylko dla GAD 65/67. (C) powiększony obraz obszaru wewnątrz białego pola w (B). (D) rekonstrukcja X–Y–Z podwójnie znakowanej komórki wskazanej w (C). Zielone i niebieskie linie oznaczają poziomy rozwarstwienia odpowiednio w płaszczyznach XZ i YZ. Podziałka = 25 µm.
WSPÓŁLOKALIZACJA NGF i Gabaergiczna
czynnik wzrostu nerwów w znacznym stopniu współlokalizował się z markerami komórkowymi Gabaergicznymi GAD65 i GAD67, niezależnie od badanego obszaru kory (rycina 1; Tabela 1). Ogółem, 91 ± 0,9% komórek korowych znakowanych NGF również oznaczonych GAD65/67. Odsetek komórek znakowanych NGF współekspresujących GAD65/67 wykazywał niewielką różnicę między korą przedczołową (90,0 ± 1,5%), motoryczną (91,7 ± 1,5%), ciemieniową (89,6 ± 3,5%) i skroniową (93,4 ± 8,1%) (jednokierunkowa ANOVA; p = 0,78). Odwrotnie, NGF współlokowane tylko 55 ± 2.3% wszystkich komórek znakowanych GAD65/67. Aby ustalić, czy produkcja NGF była ograniczona do określonego podtypu neuronu Gabaergicznego, oznaczyliśmy tkankę dla NGF i parwalbuminy lub kalbindyny (fig. 2). Zaobserwowano kolokalizację komórek oznaczonych NGF za pomocą obu markerów. Jednak kolokalizacja NGF z parwalbuminą (67,8 ± 3,6%) była ponad 2× większa niż z kalbindyną (29,1 ± 3,9%). Ponadto komórki NGF-IR stanowiły mniej niż połowę wszystkich immunoreaktywnych komórek parwalbuminy (47,7 ± 4,6%) i kalbindyny (25,7 ± 4,9%).

RYSUNEK 2. NGF kolaborowane markerami podklasy neuronów hamujących. Plastry kory ruchowej oznaczono jako NGF i parwalbuminę lub kalbindynę. (A) komórki wykazywały rozległe nakładanie się oznakowania NGF i parvalbumin (białe strzałki). B) natomiast kolabelowanie NGF i kalbindyny było mniej powszechne. Podziałka = 25 µm.

TABELA 1. NGF-i GAD65 / 67-komórki immunoreaktywne przez region korowy.
neurony wykazujące ekspresję czynnika wzrostu nerwów obserwowano we wszystkich warstwach korowych. Wcześniejsze badania donoszą o nierównomiernym rozkładzie neuronów znakowanych NGF w warstwach korowych (Pitts and Miller, 2000; Patz and Wahle, 2006). W obecnym badaniu nie przeprowadzono jednak analizy ilościowej według warstw, ponieważ intensywność znakowania NGF zmniejszała się wraz ze wzrostem odległości od miejsca wstrzyknięcia kolchicyny.
WSPÓŁLOKALIZACJA NGF i Glutaminergiczna
znakowanie Kamkiii obserwowano głównie w somacie komórkowym i procesach proksymalnych (ryc. 3). W przeciwieństwie do rozległej Ko-lokalizacji obserwowanej z markerami NGF i Gabaergicznymi, komórki znakowane NGF rzadko Ko-zlokalizowane z komórkami znakowanymi CaMKIIa (ryc. 3; Tabela 2). Łącznie, 4,9 ± 1,1% komórek immunoreaktywnych NGF było znakowanych przeciwciałami CaMKIIa. Współlokalizacja znacząco różniła się w zależności od regionu korowego (jednokierunkowa ANOVA; p = 0,03); post hoc Fishera ujawnił, że kora przedczołowa miała większy odsetek podwójnie znakowanych komórek NGF (7,6 ± 2,1%) w porównaniu do pierwotnej kory ruchowej (2,4 ± 1,0%; p = 0,02) i kory ciemieniowej (2,9% ± 1,5; p = 0,01).

RYSUNEK 3. Czynnik wzrostu nerwów kolokalizuje się minimalnie z markerem pobudzającym komórki CaMKIIa. Immunoreaktywne komórki w korze przedczołowej. Komórki rzadko były kolaborowane dla NGF (zielony) i CaMKIIa (czerwony), niezależnie od badanego regionu korowego. Złote strzałki pokazują przykład immunoreaktywności komórek tylko dla NGF. Podziałka = 25 µm.

TABELA 2. NGF – i CaMKIIa-komórki immunoreaktywne przez region korowy.
komórki immunoreaktywne dla CaMKIIa znacznie przewyższają liczby oznaczane przez przeciwciała NGF. Ogólny odsetek komórek znakowanych CaMKIIa jednocześnie wyrażających sygnał NGF wynosił 2 ± 0,6%. Odsetek ten różnił się znacząco w zależności od regionu (jednokierunkowa ANOVA p = 0,003), przy czym kora przedczołowa wykazywała większy odsetek podwójnie znakowanych komórek NGF / CaMKIIa (3,7 ± 1,1%) niż pierwotna kora ruchowa (0,8% ± 0,3; p = 0,001), kora ciemieniowa (1,4% ± 0,6; p = 0,01) i kora skroniowa (1,5 ± 0,6%; p = 0,01)..
dyskusja
obecne badanie pokazuje, że zdecydowana większość (> 90%) neuronów wytwarzających NGF kory jest Gabaergiczna, podczas gdy połowa wszystkich neuronów GABAergicznych kolokalizuje się z NGF. Natomiast markery neuronów pobudzających wykazują tylko rzadką Ko-lokalizację z NGF. Wyniki te były spójne w wielu regionach korowych analizowanych w tym badaniu, co wskazuje, że NGF jest wytwarzany głównie przez interneurony hamujące w Korie nowej szczura.
chociaż immunoreaktywność NGF rzadko pokrywała się z markerami pobudzającymi komórki (CAMKIIa), niewielki odsetek (~5%) był dodatni dla CaMKIIa we wszystkich badanych regionach korowych. Analiza konfokalna potwierdziła, że to podwójne etykietowanie pochodzi z tej samej płaszczyzny ogniskowej i nie było spowodowane dyskretnym sygnałem wynikającym z nakładających się komórek. Funkcjonalne znaczenie ekspresji NGF w tak małej części komórek pobudzających nie jest znane, ale jest możliwe, że te neurony produkujące NGF reprezentują wcześniej niezidentyfikowaną podklasę neuronów pobudzających w Korie nowej.
nasze wyniki są zgodne z wynikami wcześniejszych badań w innych regionach mózgu wykazujących, że NGF współlokalizuje się prawie wyłącznie z komórkami Gabaergicznymi w prążkowiu, podstawnym przodomózgowiu i hipokampie (Lauterborn et al., 1993, 1995; Pascual et al., 1998; Bizon et al., 1999). Tak więc produkcja NGF przez komórki GABAergiczne może być ogólną własnością wszystkich celów otrzymujących podstawowe unerwienie cholinergiczne przedmózgowia (w tym samego podstawowego przedmózgowia). Te populacje neuronów cholinergicznych wymagają NGF do utrzymania ich fenotypu i projekcji (Rylett et al., 1993; Chen et al., 1997; Hu et al., 1997; Debeir et al., 1999). W różnych badaniach interneurony hamujące stają się obecnie głównym źródłem trofizmu NGF dla podstawowych neuronów cholinergicznych przedmózgowia.
chociaż podstawowe neurony cholinergiczne przedmózgowia unerwiają zarówno pobudzające, jak i hamujące sieci korowe (Zaborszky i wsp ., 1999), źródło wsparcia troficznego pochodzi głównie z populacji hamującej, która odgrywa kluczową rolę w mediowaniu plastyczności w obwodach korowych (Hensch and Stryker, 2004; Yazaki-Sugiyama et al., 2009; Donato et al., 2013). Wydaje się, że sygnalizacja cholinergiczna przyczynia się do różnicowej aktywacji różnych subpopulacji hamujących, modulując w ten sposób równowagę pobudzająco-hamującą (Xiang et al., 1998; Froemke et al., 2007). NGF może zatem służyć jako sygnał sprzężenia zwrotnego między wysoce plastycznymi sieciami hamującymi a aktywującymi je wejściami cholinergicznymi. Rzeczywiście, NGF zwiększa plastyczność i uczenie się behawioralne poprzez mechanizmy zależne od cholinergiczne (Prakash et al., 1996, 2004; Gutierrez et al., 1997; Conner et al., 2009). Zależne od aktywności uwalnianie NGF (Blochl and Thoenen, 1995; Lessmann et al., 2003), w połączeniu ze zdolnością NGF do zwiększania aktywności cholinergicznej (Rylett et al., 1993; Hu et al., 1997; Auld et al., 2001), sugeruje, że NGF może promować reorganizację aktywnych obwodów poprzez zwiększoną funkcję cholinergiczną.
przyszłe badania będą próbowały zidentyfikować, które podklasy neuronów hamujących wyrażają NGF i jak ta ekspresja precyzyjnie wpływa na obwody korowe. W tym celu podjęliśmy wstępne kroki w celu ustalenia, czy NGF współlokalizowane z dwoma wspólnymi markerami neuronów hamujących, parvalbumin (głównie związane z komórkami kosza i żyrandola)i calbindin (związane z licznymi typami komórek hamujących; McBain i Fisahn, 2001; Markram et al., 2004). Nasze wyniki pokazują, że NGF wykryto przede wszystkim w komórkach immunoreaktywnych parvalbumin, chociaż wiele komórek znakowanych przez parvalbumin nie współwystępowało NGF. Co ważne, komórki NGF-IR również kolokalizują się z komórkami znakowanymi kalbindyną, co sugeruje, że więcej niż jedna podklasa neuronów hamujących wytwarza NGF.
podsumowując, w obrębie nowej kory szczura NGF jest przede wszystkim wyrażany przez neurony hamujące, właściwość, która wydaje się być zachowana z filogenetycznie starszych obszarów mózgu i która może uogólniać się na mózg jako całość. Nasze wyniki sugerują, że interneurony hamujące korę odgrywają istotną rolę w utrzymaniu cholinergicznych neuronów projekcyjnych podstawy przedmózgowia. W ten sposób interneurony GABAergiczne mogą promować reorganizację korową poprzez regulowaną sygnalizację NGF.
Oświadczenie o konflikcie interesów
autorzy oświadczają, że badanie zostało przeprowadzone przy braku jakichkolwiek relacji handlowych lub finansowych, które mogłyby być interpretowane jako potencjalny konflikt interesów.
podziękowania
finansowane przez NIH (AG10435), Veterans Administration, Alzheimer ’ s Association i dr Miriam i Sheldon G. Adelson Medical Research Foundation.
Materiały uzupełniające
Materiały uzupełniające do tego artykułu można znaleźć w Internecie pod adresem: http://www.frontiersin.org/journal/10.3389/fncel.2014.00220/abstract
Auld, D. S., Mennicken, F., and Quirion, R. (2001). Czynnik wzrostu nerwu szybko indukuje przedłużone uwalnianie acetylocholiny z hodowanych neuronów podstawy przedmózgowia: rozróżnienie między wpływami neuromodulacyjnymi i neurotroficznymi. J. Neurosci. 21, 3375–3382.
PubMed Streszczenie | PubMed Pełny tekst
Bakin, J. S., and Weinberger, N. M. (1996). Indukcja pamięci fizjologicznej w korze mózgowej poprzez stymulację jądra basalis. Proc. Natl. Acad. Sci. U. S. A. 93, 11219-11224. doi: 10.1073 / pnas.93.20.11219
CrossRef Pełny tekst
Bizon, J. L., Lauterborn, J. C., and Gall, C. M. (1999). Subpopulacje interneuronów prążkowia można wyróżnić na podstawie ekspresji czynnika neurotroficznego. J. Komp. Neurol. 408, 283–298. doi: 10.1002 / (SICI)1096-9861(19990531)408:2<283::pomoc-CNE9>3.0.CO;2-2
PubMed Streszczenie / PubMed Pełny tekst / CrossRef Pełny tekst
Blochl, A., and Thoenen, H. (1995). Charakterystyka uwalniania czynnika wzrostu nerwów (NGF) z neuronów hipokampa: dowód na konstytutywny i niekonwencjonalny szlak regulowany zależny od sodu. Eur. J. Neurosci. 7, 1220–1228. doi: 10.1111 / j.1460-9568.1995.tb01112x
PubMed Streszczenie / PubMed Pełny tekst / CrossRef Pełny tekst
Butler, M. H., Solimena, M., Dirkx, R. Jr., Hayday, A., and De Camilli, P. (1993). Identyfikacja dominującego epitopu dekarboksylazy kwasu glutaminowego (gad-65) rozpoznawanego przez autoprzeciwciała w zespole sztywnego człowieka. J. Exp. Med. 178, 2097–2106. doi: 10.1084 / jem.178.6.2097
PubMed Streszczenie / PubMed Pełny tekst / CrossRef Pełny tekst
Chang, Y. C., and Gottlieb, D. I. (1988). Charakterystyka białek oczyszczonych przeciwciałami monoklonalnymi przeciw dekarboksylazie kwasu glutaminowego. J. Neurosci. 8, 2123–2130.
Chen, K. S., Nishimura, M. C., Armanini, M. P., Crowley, C., Spencer, S. D., and Phillips, H. S. (1997). Zaburzenie pojedynczego allelu genu czynnika wzrostu nerwów powoduje zanik podstawno-mózgowych neuronów cholinergicznych i deficyty pamięci. J. Neurosci. 17, 7288–7296.
PubMed Streszczenie | PubMed Pełny tekst
Conner, J. M., Chiba, A. A., and Tuszyński, M. H. (2005). Podstawowy układ cholinergiczny przedmózgowia ma zasadnicze znaczenie dla plastyczności kory mózgowej i regeneracji czynnościowej po uszkodzeniu mózgu. Neuron 46, 173-179. doi: 10.1016 / j.neuron.2005.03.003
PubMed Abstract / PubMed Full Text / CrossRef Full Text
Conner J. M., Culberson, A., Packowski, C., Chiba, A. A., and Tuszyński, M. H. (2003). Zmiany w układzie cholinergicznym podstawy przedmózgowia upośledzają przyswajanie zadań i likwidują plastyczność korową związaną z uczeniem się umiejętności motorycznych. Neuron 38, 819-829. doi: 10.1016 / S0896-6273(03)00288-5
PubMed Streszczenie / PubMed Pełny tekst / CrossRef Pełny tekst
2010-01-20 12: 45: 00 (2009). NGF jest niezbędny dla plastyczności hipokampa i uczenia się. J. Neurosci. 29, 10883–10889. doi: 10.1523 / JNEUROSCI.2594-09.2009
PubMed Streszczenie / PubMed Pełny tekst / CrossRef Pełny tekst
Conner, J. M., Lauterborn, J. C., Yan, Q., Gall, C. M., and Varon, S. (1997). Dystrybucja białka czynnika neurotroficznego pochodzenia mózgu (BDNF)i mRNA w normalnym OUN dorosłego szczura: dowody na transport aksonalny przeszczepu. J. Neurosci. 17, 2295–2313.
PubMed Streszczenie | PubMed Pełny tekst
Conner, J. M., and Varon, S. (1992). Dystrybucja neuronów immunoreaktywnych podobnych do czynnika wzrostu nerwów w mózgu dorosłego szczura po leczeniu kolchicyną. J. Komp. Neurol. 326, 347–362. doi: 10.1002 / cne.903260304
PubMed Streszczenie / PubMed Pełny tekst / CrossRef Pełny tekst
Conner, J. M., and Varon, S. (1996). Charakterystyka przeciwciał przeciwko czynnikowi wzrostu nerwów: zależna od testu zmienność reaktywności krzyżowej z innymi neurotrofinami. J. Neurosci. Metody 65, 93-99. doi: 10.1016/0165-0270(95)00151-4
PubMed Streszczenie / PubMed Pełny tekst / CrossRef Pełny tekst
Conner, J. M., and Varon, S. (1997). Profil rozwojowy immunoreaktywności NGF w mózgu szczura: możliwa rola NGF w tworzeniu cholinergicznych pól końcowych w hipokampie i korze mózgowej. Brain Res.Dev. Brain Res. 101, 67-79. doi: 10.1016 / S0165-3806(97)00051-5
PubMed Streszczenie / PubMed Pełny tekst / CrossRef Pełny tekst
Debeir, T., Saragovi, H. U., And Cuello, A. C. (1999). Mimetyczny antagonista czynnika wzrostu nerwów trka powoduje odstawienie korowych butonów cholinergicznych u dorosłych szczurów. Proc. Natl. Acad. Sci. U. S. A. 96, 4067-4072. doi: 10.1073 / pnas.96.7.4067
PubMed Streszczenie / PubMed Pełny tekst / CrossRef Pełny tekst
Donato, F., Rompani, S. B., and Caroni, P. (2013). Kosz wyrażający parwalbuminę-plastyczność sieci komórkowej wywołana doświadczeniem reguluje uczenie się dorosłych. Nature 504, 272-276. doi: 10.1038 / nature12866
PubMed Abstract | PubMed Full Text / CrossRef Full Text
Erondu, N. E., and Kennedy, M. B. (1985). Regionalna Dystrybucja kinazy białkowej typu II Ca2+/kalmodulina w mózgu szczura. J. Neurosci. 5, 3270–3277.
Froemke R. C., Merzenich, M. M., and Schreiner, C. E. (2007). Ślad pamięci synaptycznej dla plastyczności pola korowego. Nature 450, 425-429. doi: 10.1038 / nature06289
PubMed Abstract | PubMed Full Text / CrossRef Full Text
Gall, C. M., and Isackson, P. J. (1989). Napady limbiczne zwiększają neuronalną produkcję Posłańca RNA dla czynnika wzrostu nerwów. Science 245, 758-761. 10.1126 / nauka2549634
CrossRef Pełny tekst
Gutierrez, H., Miranda, M. I., and Bermudez-Rattoni, F. (1997). Upośledzenie uczenia się i głuchota cholinergiczna po deprywacji czynnika wzrostu nerwu korowego. J. Neurosci. 17, 3796–3803.
PubMed Streszczenie | PubMed Pełny tekst
Hanson, M., and Edström, A. (1978). Inhibitory mitozy i transport aksonalny. Int. Ks. Cytol. Suppl. 373–402.
Hayashi, M., Yamashita, A., Shimizu, K., Sogawa, K., and Fujii, Y. (1993). Ekspresja genu czynnika wzrostu nerwów (NGF)w ośrodkowym układzie nerwowym małp. Brain Res. 618, 142-148. doi: 10.1016/0006-8993 (93)90437-R
CrossRef Pełny Tekst
Hefti, F. (1986). Czynnik wzrostu nerwów wspomaga przeżycie neuronów cholinergicznych przegrody po transekcji fimbrialnych. J. Neurosci. 6, 2155–2162.
Hensch, T. K., and Stryker, M. P. (2004). Architektura kolumnowa wyrzeźbiona przez obwody GABA w rozwoju kociej kory wzrokowej. Nauka 303, 1678-1681. 10.1126 / nauka1091031
PubMed Streszczenie / PubMed Pełny tekst / CrossRef Pełny tekst
Hokfelt, T., Kellerth, J. O., Nilsson, G., and Pernow, B. (1975). Eksperymentalne badania immunohistochemiczne nad lokalizacją i dystrybucją substancji P w pierwotnych neuronach czuciowych kota. Brain Res. 100, 235-252. doi: 10.1016/0006-8993(75)90481-3
PubMed Streszczenie / PubMed Pełny tekst / CrossRef Pełny tekst
Holtzman, D. M., Kilbridge, J., Li, Y., Cunningham, E. T. Jr., Lenn, N. J., Clary,D. O., et al. (1995). Ekspresja TrkA w OUN: dowody na istnienie kilku nowych neuronów reagujących na NGF. J. Neurosci. 15, 1567–1576.
PubMed Streszczenie | PubMed Pełny Tekst
Hu, L., Cote, S. L., and Cuello, A. C. (1997). Różnicowa modulacja cholinergicznego fenotypu neuronów nucleus basalis magnocellularis poprzez zastosowanie NGF w ciele komórkowym lub polach końcowych kory. Exp. Neurol. 143, 162–171. doi: 10.1006 / exnr.1996.6357
PubMed Streszczenie / PubMed Pełny tekst / CrossRef Pełny tekst
Huang, E. J., and Reichardt, L. F. (2003). Receptory Trk: role w transdukcji sygnału neuronalnego. Annu. Rev. Biochem. 72, 609–642. doi: 10.1146 / annurev.biochem.72.121801.161629
CrossRef Pełny tekst
Isackson, P. J., Huntsman, M. M., Murray, K. D., and Gall, C. M. (1991). Ekspresja mRNA BDNF jest zwiększona u dorosłych szczurzych przodomózgowia po napadach limbicznych: czasowe wzorce indukcji różnią się od NGF. Neuron 6, 937-948. doi: 10.1016 | 0896-6273 (91)90234-Q
PubMed Streszczenie / PubMed Pełny tekst / CrossRef Pełny tekst
Ito, T., Hioki, H., Nakamura, K., Tanaka, Y., Nakade, H., Kaneko, T., et al. (2007). Współczulne neurony preganglionowe zawierające kwas Gamma-aminomasłowy w odcinku piersiowym rdzenia kręgowego szczura wysyłają swoje aksony do zwoju szyjnego górnego. J. Komp. Neurol. 502, 113–125. doi: 10.1002 / cne.21309
PubMed Streszczenie / PubMed Pełny tekst / CrossRef Pełny tekst
Kilgard, M. P., and Merzenich, M. M. (1998). Reorganizacja mapy korowej umożliwiona przez aktywność nucleus basalis. Nauka 279, 1714-1718. 10.1126 / nauka279.5357.1714
PubMed Streszczenie / PubMed Pełny Tekst / CrossRef Pełny Tekst
Kordower, J. H., Bartus, R. T., Bothwell, M., Schatteman, G., and Gash, D. M. (1988). Aktywność immunologiczna receptora czynnika wzrostu nerwów u naczelnych nieludzkich (Cebus apella): Dystrybucja, morfologia i kolokalizacja za pomocą enzymów cholinergicznych. J. Komp. Neurol. 277, 465–486. doi: 10.1002 / cne.902770402
PubMed Streszczenie / PubMed Pełny tekst / CrossRef Pełny tekst
Kordower, J. H., Winn,S. R., Liu, Y. T., Mufson, E. J., Sladek, J. R. Jr., Hammang, J. P., et al. (1994). Starzejąca się małpa podstawowa przednia: ratowanie i kiełkowanie aksotomizowanych neuronów podstawy przedmózgowia po przeszczepach zamkniętych komórek wydzielających ludzki czynnik wzrostu nerwów. Proc. Natl. Acad. Sci. U. S. A. 91, 10898-10902. doi: 10.1073 / pnas.91.23.10898
PubMed Streszczenie / PubMed Pełny tekst / CrossRef Pełny tekst
Korsching, S., Auburger, G., Heumann, R., Scott, J., and Thoenen, H. (1985). Poziom czynnika wzrostu nerwu i jego mRNA w ośrodkowym układzie nerwowym szczura koreluje z unerwieniem cholinergicznym. EMBO J. 4, 1389-1393.
PubMed Streszczenie | PubMed Pełny tekst
Lad, S. P., Neet, K. E., and Mufson, E. J. (2003). Czynnik wzrostu nerwów: struktura, funkcja i implikacje terapeutyczne dla choroby Alzheimera. Curr. Lek atakuje Neurol OUN. Disord. 2, 315–334. doi: 10.2174/1568007033482724
PubMed Streszczenie / PubMed Pełny tekst / CrossRef Pełny tekst
Large, T. H., Bodary, S. C., Clegg, D. O., Weskamp, G., Otten, U., And Reichardt, L. F. (1986). Ekspresja genu czynnika wzrostu nerwów w rozwijającym się mózgu szczura. Nauka 234, 352-355. doi: 10.1126 / nauki.3764415
CrossRef Pełny tekst
Lauterborn, J. C., Bizon, J. L., Tran, T. M., and Gall, C. M. (1995). MRNA NGF jest wyrażany przez neurony GABAergiczne, ale nie cholinergiczne u szczurzych podstawnych przodomózgowia. J. Komp. Neurol. 360, 454–462. doi: 10.1002 / cne.903600307
PubMed Abstract / PubMed Full Text / CrossRef Full Text
Lauterborn, J. C., Tran, T. M., Isackson, P. J., and Gall, C. M. (1993). Nerwowy czynnik wzrostu mRNA jest wyrażany przez neurony GABAergiczne w hipokampie szczura. Neuroreport 5, 273-276. doi: 10.1097/00001756-199312000-00023
CrossRef Pełny tekst
Lessmann, V., Gottmann, K., and Malcangio, M. (2003). Sekrecja neurotrofiny: aktualne fakty i perspektywy na przyszłość. Prog. Neurobiol. 69, 341–374. doi: 10.1016 / S0301-0082(03)00019-4
PubMed Streszczenie / PubMed Pełny tekst / CrossRef Pełny tekst
Li, Y., Holtzman, D. M., Kromer, L. F., Kaplan, D. R., Chua-Couzens, J., Clary,D. O., et al. (1995). Regulacja trka i ekspresji czatu w rozwoju szczurzego przodomózgowia: dowody na to, że zarówno egzogenny, jak i endogenny NGF regulują różnicowanie neuronów cholinergicznych. J. Neurosci. 15, 2888–2905.
PubMed Streszczenie | PubMed Pełny tekst
Maisonpierre, P. C., Belluscio, L., Friedman, B., Alderson, R. F., Wiegand, S. J., Furth,M. E., et al. (1990). NT-3, BDNF i NGF w rozwijającym się układzie nerwowym szczura: równoległe i wzajemne wzorce ekspresji. Neuron 5, 501-509. doi: 10.1016 | 0896-6273 (90)90089-X
PubMed Streszczenie / PubMed Pełny tekst / CrossRef Pełny tekst
Markram H., Toledo-Rodriguez, M., Wang, Y., Gupta, A., Silberberg, G., and Wu, C. (2004). Interneurony układu neokortykalnego hamującego. Nat. Ks. Neurosci. 5, 793–807. doi: 10.1038 / nrn1519
PubMed Abstract | PubMed Full Text / CrossRef Full Text
McBain, C. J., and Fisahn, A. (2001). Interneurony bez ograniczeń. Nat. Ks. Neurosci. 2, 11–23. doi: 10.1038/35049047
PubMed Streszczenie / PubMed Pełny tekst / CrossRef Pełny tekst
Mufson, E. J., Conner, J. M., Varon, S., and Kordower, J. H. (1994). Profile immunoreaktywne podobne do czynnika wzrostu nerwów w obrębie Naczelnej podstawy przedmózgowia i formacji hipokampa. J. Komp. Neurol. 341, 507–519. doi: 10.1002 / cne.903410407
PubMed Streszczenie / PubMed Pełny tekst / CrossRef Pełny tekst
Pascual, M., Rocamora, N., Acsady, L., Freund, T. F., and Soriano, E. (1998). Ekspresja czynnika wzrostu nerwu i mRNA neurotrofiny-3 w interneuronach hipokampa: charakterystyka morfologiczna, poziomy ekspresji i kolokalizacja czynnika wzrostu nerwu i neurotrofiny-3. J. Komp. Neurol. 395, 73–90. doi: 10.1002 / (SICI)1096-9861(19980525)395:1<73::pomoc-CNE6>3.0.CO; 2-E
PubMed Abstract / PubMed Full Text / CrossRef Full Text
Pasteels, B., Miki, N., Hatakenaka, S., and Pochet, R. (1987). Immunohistochemiczna reaktywność krzyżowa i komigracja elektroforetyczna między kalbindyną D-27 kDa a wizyniną. Brain Res. 412, 107-113. doi: 10.1016/0006-8993(87)91444-2
PubMed Streszczenie / PubMed Pełny tekst / CrossRef Pełny tekst
Patz, S., and Wahle, P. (2006). Zmiany rozwojowe ekspresji mRNA neurotrofin w warstwach kory wzrokowej szczura. Eur. J. Neurosci. 24, 2453–2460. doi: 10.1111 / j.1460-9568.2006.05126.x
PubMed Streszczenie / PubMed Pełny tekst / CrossRef Pełny tekst
Pitts, A. F., and Miller, M. W. (2000). Ekspresja czynnika wzrostu nerwów, czynnika neurotroficznego pochodzącego z mózgu i neurotrofiny-3 w korze somatosensorycznej dojrzałego szczura: współwystępowanie z receptorami neurotrofinowymi o wysokim powinowactwie. J. Komp. Neurol. 418, 241–254. doi: 10.1002 / (SICI)1096-9861(20000313)418:3<241::pomoc-CNE1>3.0.CO;2-M
PubMed Streszczenie / PubMed Pełny tekst / CrossRef Pełny tekst
Prakash, N., Cohen-Cory, S., and Frostig, R. D. (1996). Szybki i przeciwny wpływ BDNF i NGF na funkcjonalną organizację kory dorosłej in vivo. Nature 381, 702-706. doi: 10.1038 / 381702a0
PubMed Streszczenie / PubMed Pełny tekst / CrossRef Pełny tekst
Prakash, N., Cohen-Cory, S., Penschuck, S., and Frostig, R. D. (2004). Podstawowy układ cholinergiczny przedmózgowia jest zaangażowany w indukowaną przez czynnik szybkiego wzrostu nerwów (NGF) plastyczność w korze baryłkowej dorosłych szczurów. J. Neurofizjol. 91, 424–437. doi: 10.1152 / jn.00489.2003
PubMed Streszczenie / PubMed Pełny tekst / CrossRef Pełny tekst
Ribak, C. E., Vaughn, J. E., and Saito, K. (1978). Immunocytochemiczna lokalizacja dekarboksylazy kwasu glutaminowego w somacie neuronalnym po hamowaniu transportu aksonalnego przez kolchicynę. Brain Res. 140, 315-332. doi: 10.1016/0006-8993(78)90463-8
PubMed Streszczenie / PubMed Pełny tekst / CrossRef Pełny tekst
Rossi, F. M., Sala, R., and Maffei, L. (2002). Ekspresja receptorów czynnika wzrostu nerwów TrkA i p75NTR w korze wzrokowej szczura: rozwój i regulacja przez wkład cholinergiczny. J. Neurosci. 22, 912–919.
PubMed Streszczenie | PubMed Pełny tekst
Rylett, R. J., Goddard, S., Schmidt, B. M., and Williams, L. R. (1993). Synteza i uwalnianie acetylocholiny po ciągłym wewnątrzmózgowym podaniu NGF u dorosłych i starszych szczurów Fischer-344. J. Neurosci. 13, 3956–3963.
PubMed Streszczenie | PubMed Pełny tekst
Schubert, P., Kreutzberg, G. W., And Lux, H. D. (1972). Transport neuroplazmiczny w dendrytach: wpływ kolchicyny na morfologię i fizjologię motoneuronów u kota. Brain Res. 47, 331-343. doi: 10.1016/0006-8993(72)90643-9
PubMed Streszczenie / PubMed Pełny tekst / CrossRef Pełny tekst
Shelton, D. L., and Reichardt, L. F. (1986). Badania nad ekspresją genu beta nerve growth factor (NGF) w ośrodkowym układzie nerwowym: poziom i regionalny rozkład mRNA NGF sugerują, że NGF działa jako czynnik troficzny dla kilku różnych populacji neuronów. Proc. Natl. Acad. Sci. U. S. A. 83, 2714-2718. doi: 10.1073 / pnas.83.8.2714
PubMed Streszczenie / PubMed Pełny tekst / CrossRef Pełny tekst
Sofroniew, M. V., Howe, C. L., and Mobley, W. C. (2001). Sygnalizacja czynnika wzrostu nerwów, neuroprotekcja i naprawa nerwów. Annu. Ks. Neurosci. 24, 1217–1281. doi: 10.1146 / annurev.neuro.24.1.1217
CrossRef Pełny tekst
Stephens, H. E., Belliveau, A. C., Gupta, J. S., Mirkovic, S., and Kablar, B. (2005). Rola neurotrofin w utrzymaniu neuronów ruchowych rdzenia kręgowego i zwojów korzeni grzbietowych proprioceptywnych neuronów czuciowych. Int. J. Dev. Neurosci. 23, 613–620. doi: 10.1016 / j. ijdevneu.2005.07.002
PubMed Abstract / PubMed Full Text / CrossRef Full Text
Tuszyński, M. H., Armstrong, D. M., and Gage, F. H. (1990). Utrata komórek podstawy przedmózgowia po transekcji fimbria / fornix. Brain Res. 508, 241–248. doi: 10.1016 / 0006-8993 (90)90402-w
CrossRef Pełny tekst
Xiang, Z., Huguenard, J. R., and Prince, D. A. (1998). Przełączanie cholinergiczne w obrębie neokortykalnych sieci hamujących. Nauka 281, 985-988. 10.1126 / nauka281.5379.985
PubMed Streszczenie / PubMed Pełny tekst / CrossRef Pełny tekst
Yazaki-Sugiyama, Y., Kang, S., Cateau, H., Fukai, T., and Hensch, T. K. (2009). Plastyczność dwukierunkowa w szybko zwiększających się obwodach GABA dzięki doświadczeniu wzrokowemu. Nature 462, 218-221. doi: 10.1038 / nature08485
PubMed Streszczenie / PubMed Pełny tekst / CrossRef Pełny tekst
Zaborszky, L., Pang, K., Somogyi, J., Nadasdy, Z., and Kallo, I. (1999). Revisited the basal forebrain corticopetal system. Ann. N. Y. Acad. Sci. 877, 339–367. doi: 10.1111 / j. 1749-6632. 1999.tb09276x
PubMed Streszczenie / PubMed Pełny tekst / CrossRef Pełny tekst
Zhang, H. T., Li, L. Y., Zou, X. L., Song, X. B., Hu, Y. L., Feng,Z. T., et al. (2007). Dystrybucja immunohistochemiczna NGF, BDNF, NT-3 i NT-4 w mózgach dorosłych rezusów. J. Histochem. Cytochem. 55, 1–19. doi: 10.1369/jhc.6A6952.2006
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text