- Introducere
- materiale și metode
- preparat tisular
- imunohistochimie cu fluorescență dublă etichetă
- caracterizarea anticorpilor
- analiza confocală
- grupul de control pentru anticorpi
- rezultate
- marcarea imunologică NGF
- NGF și Co-localizarea GABAergică
- NGF și Co-localizarea Glutamatergică
- discuție
- Declarație privind conflictul de interese
- mulțumiri
- material suplimentar
Introducere
factorul de creștere a nervului neurotrofin (NGF) este implicat în mai multe procese critice în dezvoltarea și matur sistemul nervos al mamiferelor, inclusiv inervația țintă, diferențierea celulară și supraviețuirea neuronală (Large și colab., 1986; Li și colab., 1995; Sofroniew și colab., 2001; Lad și colab., 2003). În creierul adult, NGF joacă un rol cheie în menținerea și funcția sistemului colinergic bazal al creierului anterior (Lad și colab., 2003). Nivelurile de NGF sunt cele mai ridicate în zonele care primesc cel mai mare număr de proiecții colinergice bazale ale creierului anterior, și anume hipocampul și cortexul (Korsching și colab., 1985; Shelton și Reichardt, 1986) și receptorii pentru NGF din cortex sunt în mare parte limitați la proiecțiile corticopetale bazale ale creierului anterior (Kordower și colab., 1988; Sofroniew și colab., 2001; Rossi și colab., 2002). Semnalizarea factorului de creștere nervoasă menține proiecțiile corticopetale colinergice în timpul maturității (Chen și colab., 1997; Debeir și colab., 1999) și poate preveni degenerarea acestor neuroni în urma transecției axonilor lor (Hefti, 1986; Tuszynski și colab., 1990; Kordower și colab., 1994). Mai mult, NGF îmbunătățește eliberarea acetilcolinei din culturile bazale ale creierului anterior (Auld și colab., 2001) și poate modula funcția colinergică prin controlul fenotipic al locusului genei colinergice (Rylett și colab., 1993; Hu și colab., 1997).
sistemul colinergic bazal al creierului anterior influențează învățarea și plasticitatea dependentă de experiență în cortex (Bakin și Weinberger, 1996; Kilgard și Merzenich, 1998; Conner și colab., 2003, 2005), iar semnalizarea NGF a fost ipotezată pentru a sprijini și, eventual, a spori învățarea și plasticitatea mediată de creierul anterior bazal. De exemplu, blocarea semnalizării NGF prin injecții repetate de anticorpi NGF în cortexul insular reduce inervația colinergică locală și perturbă achiziția a două procese care depind de integritatea intrărilor colinergice, aversiunea gustului condiționat și învățarea de evitare inhibitoare (Gutierrez și colab., 1997). Un studiu recent realizat de Conner și colab. (2009) a demonstrat că atât învățarea spațială, cât și potențarea pe termen lung a hipocampului (LTP) sunt îmbunătățite în urma infuziilor de NGF în nucleul septal, sursa primară de inervație colinergică la hipocamp.
aplicarea focală a NGF poate induce, de asemenea, expansiunea rapidă a reprezentării mustății locale în cortexul baril al șobolanilor. Acest proces depinde de proiecțiile colinergice din creierul anterior bazal (Prakash și colab., 1996, 2004), sugerând că semnalizarea corticală NGF poate stimula reorganizarea funcțională rapidă dependentă de colinergică. Astfel, pe lângă efectele sale trofice pe termen lung asupra celulelor colinergice bazale ale creierului anterior, NGF poate participa și la remodelarea circuitului pe termen scurt. Această ipoteză de „acțiune duală” este susținută de existența mecanismelor de eliberare constitutive și dependente de activitate ale NGF (Blochl și Thoenen, 1995; Lessmann și colab., 2003), care ar putea sta la baza efectelor modulatorii trofice pe termen lung și, respectiv, pe termen scurt ale NGF. Mai mult, atât căile de semnalizare retrograde (pe termen lung), cât și cele locale (pe termen scurt) au fost observate pentru NGF (Huang și Reichardt, 2003).
celulele care exprimă NGF au fost detectate în cortex, cerebel, hipocamp, talamus, striatum, creierul anterior bazal și trunchiul cerebral (Gall și Isackson, 1989; Maisonpierre și colab., 1990; Isackson și colab., 1991; Conner și Varon, 1992; Hayashi și colab., 1993; Mufson și colab., 1994; Zhang și colab., 2007). Deși ARNm NGF a fost observat în astrocite și alte glii, marea majoritate a NGF corticală este produsă de neuroni (Sofroniew și colab., 2001). Cu toate acestea, tipurile specifice de neuroni care produc NGF în cortex nu sunt cunoscute, iar proiecțiile corticopetale colinergice s-au dovedit a inerva atât neuronii excitatori, cât și inhibitorii din cortex (Zaborszky și colab., 1999). În regiunile extracorticale, cum ar fi hipocampul, striatul și creierul anterior bazal, producția de NGF este predominant localizată la neuronii inhibitori Gabaergici (Lauterborn și colab., 1993, 1995; Pascual și colab., 1998; Bizon și colab., 1999). Identificarea celulelor producătoare de NGF în cortex este importantă pentru identificarea mecanismelor potențiale care stau la baza modulării intrărilor corticale colinergice și a mecanismelor de plasticitate corticală. În studiul actual, identificăm un subset de celule Gabaergice corticale ca sursă primară de producție de NGF în cortexul adult, cu o producție relativ rară de neuroni glutamatergici.
materiale și metode
toți subiecții au fost tratați în conformitate cu orientările instituționale pentru îngrijirea animalelor. Datorită nivelurilor endogene scăzute de Expresie NGF corticală care interziceau identificarea surselor specifice de NGF de tip celular în studiile anterioare, am efectuat perfuzii locale de colchicină pentru a inhiba polimerizarea microtubulilor, blocând astfel transportul NGF departe de corpul celular și rezultând acumularea antigenului NGF detectabil în soma celulelor producătoare (Schubert și colab., 1972; Hokfelt și colab., 1975; Hanson și Edstr, 1978; Conner și Varon, 1992). Rapoartele anterioare au arătat că tratamentul cu colchicină crește detectarea NGF folosind tehnici imunohistochimice (Conner și Varon, 1992). Mai mult, nivelurile de colchicină similare cu cele utilizate în studiul actual nu induc anomalii brute în distribuția neuronală a membrului familiei NEUROTROFINELOR BDNF (Conner și colab., 1997).
preparat tisular
opt șobolani adulți Fischer 344 (4 masculi, 4 femele; Harlan Sprague Dawley) au fost anesteziați cu 2 ml/kg dintr-un cocktail de ketamină de 25 mg/ml, 1,3 mg/ml xilazină și 0,25 mg/ml acepromazină și injectați cu 5.Colchicină de 0 ilft (10 ilft/ilft în aCSF) în locațiile corticale enumerate mai jos la o rată de 0,5 ilft/min folosind o seringă Hamilton de 10 ilft. După perfuzie, acul a rămas în poziție timp de patru minute pentru a permite o difuzie adecvată în țesutul înconjurător. Patru animale au primit injecții bilaterale în cortexul motor primar (M1) la +1,2 mm anterior (A/P) și la 2,5 mm lateral (M/L) la bregma. Jumătate din soluție a fost injectată la 1,6 mm sub suprafața creierului (D/V), iar restul la 1,0 mm. restul de patru animale au primit toate injecții unilaterale în cortexul prefrontal (A/P: +3.0, M/L: +0,5, D/V: -2,3 și -1,8), cortexul temporal (A/P: -6,5, M/L: +5,0, D/V: -7,5 și -7,0) și cortexul parietal (A/P: -3,0, M/L: +5,0, D/V: -1,8 și -1,3). După 48 de ore, animalele au fost profund anesteziate și perfuzate transcardial cu 250 ml soluție salină tamponată cu fosfat rece (pH 7,4), urmată de 250 ml de paraformaldehidă rece 2% + 0,2% parabenzochinonă în tampon fosfat de 0,1 m. Creierele au fost extrase, postfixate timp de 2 ore în același fixativ și crioprotectate în tampon fosfat de 0,1 m conținând zaharoză 30% Timp de cel puțin 72 ore la 4 C. Secțiunile coronare (40 xqm) au fost tăiate pe un Microtom glisant înghețat și depozitate în crioprotector (TCS) la 4 XQC până la prelucrarea ulterioară pentru imunohistochimie.
imunohistochimie cu fluorescență dublă etichetă
imunohistochimia secvențială cu etichetă dublă a fost utilizată pentru a vizualiza neuronii care exprimă NGF și markeri celulari Gabaergici sau glutamatergici. Secțiunile plutitoare libere au fost spălate în soluție salină tamponată Tris (TBS), permeabilizată cu 0,25% Triton X-100, iar etichetarea nespecifică a fost apoi blocată cu 5% ser de măgar. Secțiunile au fost incubate timp de 72 de ore la 4 centi C în anticorpi anti-NGF de iepure (Conner și Varon, 1992) diluați 1:1000 în TBS, 0,25% Triton X-100 și 5% ser de măgar. După incubarea primară a anticorpilor, secțiunile au fost incubate în IgG conjugat cu biotină anti-iepure măgar (1:200; Vector Laboratories, Burlingame, ca, SUA). Amplificarea semnalului Tyramide (TSA; PerkinElmer, Waltham, MA, SUA) a fost aplicată pentru amplificarea semnalului NGF, după care secțiunile au fost spălate în TBS și incubate în Alexa Fluor 488 sau 594-streptavidin conjugat (Invitrogen, Carlsbad, CA, SUA) diluat 1:200 timp de 3 ore la 4 C. După o scurtă spălare, secțiunile au fost incubate atât în decarboxilaza anti-glutamat de șoarece (GAD) 65 (GAD-6, AntibodyRegistry:AB_528264,1:2000; studii de dezvoltare Hybridoma Bank, Iowa City, IA, SUA), cât și în anti-GAD67 de șoarece (ANITBODYREGISTRY: AB_2278725, 1:1500; Millipore, Temecula, CA, SUA) sau în anti-parvalbumin de șoarece (antibodyregistry: ab_2174013, 1:30000; Millipore, Temecula, CA, SUA), mouse anti-CALBINDIN-D-28K (antibodyregistry: Ab_476894, 1:1500; Sigma-Aldrich, St. Louis, MO, SUA) sau mouse anti-Ca2+/calmodulin-dependent protein kinaza IIA (camkiia, antibodyregistry: ab_2067919, 1:1500; Millipore) timp de 72 h la 4 C. În final, secțiunile au fost spălate, incubate în Alexa Fluor 594 sau 488-magar conjugat anti-șoarece (Invitrogen) timp de 3 h la temperatura camerei, spălate din nou, montate pe lamele de sticlă și acoperite în Fluoromount-G (Southern Biotech, Birminghan, AL, SUA). Pentru a maximiza identificarea celulelor Gabaergice, anticorpii GAD65 și GAD67 au fost co-incubați. Un subset de secțiuni a fost acoperit în ProLong Gold cu Dapi (Invitrogen) pentru vizualizarea nucleelor celulare.
caracterizarea anticorpilor
anticorpul NGF utilizat în acest studiu este un policlonal purificat prin afinitate crescut la iepure împotriva NGF de șoarece purificat (Conner și Varon, 1992). Anticorpul recunoaște șoarecele purificat și NGF uman recombinant, dar nu reacționează încrucișat cu BDNF recombinant sau NT-3 (Conner și Varon, 1996). Mai mult, modelul imunoreactiv al expresiei NGF în creierul șobolanului se potrivește îndeaproape cu cel obținut din analiza in situ în creierul șobolanului (Conner și Varon, 1997).
anticorpul monoclonal GAD-65 (studii de dezvoltare Hybridoma Bank, Gad-6) a fost produs prin imunizarea șoarecilor cu imunoafinitate proteică Gad-purificată din creierul șobolanului. Analiza Western blot a omogenatelor creierului de șobolan a arătat că anticorpul recunoaște selectiv GAD-65, dar nu GAD-67 (Chang și Gottlieb, 1988). Studii suplimentare au arătat că anticorpul GAD-6 recunoaște un epitop situat între aminoacizii 475-571 ai terminusului C al GAD-65 (Butler și colab., 1993).
șoarecele Gad-67 monoclonal (Millipore, MAB 5406, lot: 25010139) a fost ridicat împotriva reziduurilor de aminoacizi 4-101 de GAD-67 uman, și recunoaște o singură bandă de 67-kDa pe analiza Western blot a creierului de șobolan (informații tehnice producătorului). Preincubarea anticorpului cu o proteină de fuziune GST-GAD-67 nu a dus la niciun semnal imunopozitiv în creier (Ito și colab., 2007).
anti-CaMKIIa monoclonală de șoarece (Millipore, MAB 8699, lot: LV1366080) recunoaște în mod specific subunitatea alfa a protein kinazei ii dependente de calciu/calmodulină. Analiza Western blot demonstrează că anticorpul identifică o singură bandă de 50 kDa și recunoaște atât formele fosforilate, cât și cele nefosforilate (Erondu și Kennedy, 1985).
monoclonal anti-calbindin-D-28k (Sigma–Aldrich, C9848, lot: 088k4799) este derivat din șoareci BALB/c imunizați cu rinichi bovin purificat calbindin-D-28k. imunoblotting a arătat că anticorpul recunoaște o bandă de 28-kDa și nu reacționează cu molecule similare, cum ar fi calbindin-D-9K, calretinin, lanț ușor de miozină și parvalbumin (informații tehnice ale producătorului). S-a demonstrat că preabsorbția cu o proteină calbindin-D-27 kDa purificată din creierul de pui și șobolan elimină imunosupresia calbindinei în creier (Pasteels și colab., 1987).
Anti-parvalbumin (Millipore, MAB 1572, lot: LV1378387) a fost colectat de la șoareci imunizați împotriva parvalbuminei purificate din mușchiul broaștei. Anticorpul monoclonal este îndreptat împotriva unui epitop la primul situs de legare Ca2+, iar analiza imunoblotului demonstrează că recunoaște o proteină cerebrală de 12 kDa (informații tehnice ale producătorului).
analiza confocală
imaginile au fost capturate folosind un Olympus AX70 cu Software Magnafire (versiunea 2.0; Karl Storz Imaging, Goleta, ca, SUA). Deoarece etichetarea NGF a fost redusă substanțial cu aproximativ 2 mm anterior/posterior față de locurile de injectare a colchicinei, probabil din cauza lipsei difuziei colchicinei și a absenței rezultate a acumulării somatice de NGF, au fost analizate doar secțiuni la 1,5 mm de fiecare loc de injectare a colchicinei. Fiecare secțiune a 10-a (400 de metri cubi) a fost examinată într-o regiune corticală. Celulele au fost numărate manual și au fost analizate cel puțin trei secțiuni în fiecare regiune corticală și combinație de anticorpi pe subiect. Doar trei animale au fost evaluate în regiunea temporală datorită etichetării NGF nedetectabile în a patra. Celulele simple și duble au fost cuantificate folosind atât imagini cu un singur canal, cât și cu două canale. Au fost utilizate mai multe criterii pentru a identifica celulele etichetate, inclusiv dimensiunea, morfologia, semnalul vs.fundal și etichetarea dapi coincidentă la evaluarea țesutului colorat cu DAPI. Într-un subset de secțiuni, s-au colectat 5 stive Z-Z de la un nivel de un mie de metri cubi folosind un Olympus Fluoview FV1000 pentru a asigura localizarea neuronală a obiectului etichetat. Datorită interesului nostru față de proporția, și nu numărul absolut, de celule cu etichetă dublă, nu au fost utilizate metode stereologice.
procentul de celule dublu marcate pe grup de celule imunoreactive (IR) a fost determinat pentru fiecare câmp de imagine. Pentru fiecare regiune corticală examinată, s-a calculat eroarea standard medie a numărului de centimetrii. Analiza unidirecțională a varianței (ANOVA) a fost utilizată pentru a evalua diferențele dintre regiunile corticale. HSD-ul lui Fisher a fost folosit pentru analiza post-hoc. Toate analizele statistice au fost efectuate cu SPSS 15.0 Pentru Windows.
grupul de control pentru anticorpi
grupul de control a inclus omiterea anticorpilor primari, omiterea anticorpilor secundari și înlocuirea anticorpului primar cu anticorpi nespecifici (IgG de iepure). Toate manipulările au avut efectele așteptate și au susținut afirmația că celulele etichetate reprezintă etichetarea adevărată a antigenului prin anticorpii lor corespunzători.
rezultate
marcarea imunologică NGF
etichetarea distinctă a NGF a fost vizibilă pe o rază de 1.5 mm de la locurile de injectare corticală a colchicinei. În aceste zone, etichetarea NGF a fost limitată predominant la somata celulară (Figura 1). Rareori, unul sau mai multe procese celulare ar putea fi, de asemenea, distinse. În afara acestei raze de 1,5 mm, etichetarea NGF a fost practic nedetectabilă în cortex. Deoarece expresia corticală a receptorilor NGF TrkA și p75 se limitează la fibrele corticopetale colinergice, etichetarea observată a NGF este puțin probabil să reflecte NGF endocitozat, dar în schimb este indicativă a celulelor producătoare de NGF (Holtzman și colab., 1995; Rossi și colab., 2002; Stephens și colab., 2005). După cum sa raportat anterior (Ribak și colab., 1978), tratamentul cu colchicină a intensificat etichetarea GAD în corpurile celulare, precum și în procesele neuronale. Colchicina nu a avut niciun efect detectabil asupra etichetării pentru parvalbumin, calbindin sau CaMKIIa.
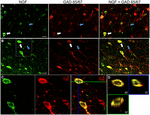
FIGURA 1. Factorul de creștere a nervilor colocalizează extensiv cu markeri celulari inhibitori. Celulele imunoreactive din (a) cortexul motor primar și (B) cortexul prefrontal. Imaginile arată că celulele marcate cu NGF (verde) se colocalizează extensiv cu celule marcate cu GAD 65/67 (roșu). Săgețile albe prezintă un exemplu imunoreactiv celular atât pentru NGF, cât și pentru GAD 65/67 în fiecare regiune corticală. Săgețile albastre arată celulele imunoreactive numai pentru GAD 65/67. (C) imaginea mărită a zonei din interiorul casetei albe de la litera (B). (D) reconstrucția X–Y–Z a celulei cu etichetă dublă indicată la litera (C). Liniile verzi și albastre indică nivelurile de disecție în planurile XZ și respectiv YZ. Bare de scară = 25 oqqm.
NGF și Co-localizarea GABAergică
factorul de creștere nervoasă co-localizat extensiv cu markerii celulelor Gabaergice GAD65 și GAD67, indiferent de zona corticală examinată (Figura 1; Tabelul 1). În general, 91 0,9% din celulele corticale marcate cu NGF au fost etichetate și pentru GAD65/67. Procentul de celule marcate cu NGF coexprimând GAD65 / 67 a arătat o diferență mică între cortexurile prefrontale (90,0 1,5%), motorii (91,7 1,5%), parietale (89,6 3,5%) și temporale (93,4 8,1%) (ANOVA unidirecțională; p = 0,78). Pe de altă parte, NGF co-localizate cu doar 55 2.3% din toate celulele marcate cu GAD65/67. Pentru a determina dacă producția de NGF a fost limitată la un subtip specific de neuron GABAergic, am co-marcat țesutul pentru NGF și fie parvalbumin, fie calbindin (Figura 2). S-a observat că celulele marcate cu NGF se colocalizează cu ambii markeri. Cu toate acestea, colocalizarea NGF cu parvalbumin (67,8% 3,6%) a fost cu peste 2% mai mare decât cu calbindin (29,1% 3,9%). În plus, celulele NGF-IR au constituit mai puțin de jumătate din toate celulele imunoreactive parvalbumin (47,7% 4,6%) și calbindin (25,7% 4,9%).

FIGURA 2. NGF colabelat cu markeri de subclasă de neuroni inhibitori. Felii de cortex motor au fost etichetate pentru NGF și fie parvalbumin, fie calbindin. (A) Celulele au prezentat o suprapunere extinsă a etichetării NGF și parvalbumin (săgeți albe). (B) dimpotrivă, etichetarea NGF și calbindin a fost mai puțin frecventă. Bare de scară = 25 oqqm.

TABELUL 1. NGF – și GAD65/67 – celule imunoreactive pe regiunea corticală.
neuronii care exprimă factorul de creștere nervoasă au fost observați în toate straturile corticale. Studiile anterioare au raportat o distribuție inegală a neuronilor marcați cu NGF în laminele corticale (Pitts și Miller, 2000; Patz și Wahle, 2006). Cu toate acestea, analiza cantitativă pe straturi nu a fost efectuată în studiul actual, deoarece intensitatea etichetării NGF a scăzut odată cu creșterea distanței față de locul injectării colchicinei.
NGF și Co-localizarea Glutamatergică
etichetarea pentru CaMKIIa a fost observată în principal în procesele somata celulare și proximale (Figura 3). Spre deosebire de co-localizarea extinsă observată cu markerii NGF și GABAergic, celulele marcate cu NGF rareori co-localizate cu celule marcate cu CaMKIIa (Figura 3; Tabelul 2). În total, 4,9 1,1% din celulele imunoreactive NGF au fost co-marcate cu anticorpi CaMKIIa. Co-localizarea a diferit semnificativ în funcție de regiunea corticală (ANOVA unidirecțională; p = 0,03); Post-hoc al lui Fisher a arătat că cortexul prefrontal a avut o proporție mai mare de celule NGF cu două etichete (7,6 2,1%) în comparație cu cortexul motor primar (2,4 1,0%; p = 0,02) și cortexul parietal (2,9% 1,5; p = 0,01).

FIGURA 3. Factorul de creștere a nervilor colocalizează minim cu markerul celular excitator CaMKIIa. Celulele imunoreactive din cortexul prefrontal. Celulele au fost rareori etichetate pentru NGF (verde) și CaMKIIa (roșu), indiferent de regiunea corticală examinată. Săgețile de aur arată un exemplu de imunoreactivă celulară numai pentru NGF. Bare de scară = 25 oqqm.

TABELUL 2. NGF – și CaMKIIa – celule imunoreactive prin regiunea corticală.
celulele imunoreactive pentru CaMKIIa au depășit cu mult numărul celor etichetate de anticorpii NGF. Proporția totală a celulelor marcate cu CaMKIIa care exprimă simultan semnalul NGF a fost de 2 0,6%. Acest procent a diferit semnificativ în funcție de regiune (ANOVA unidirecțională p = 0,003), cortexul prefrontal prezentând o proporție mai mare de celule NGF/CaMKIIa dublu marcate (3,7 1,1%) decât cortexul motor primar (0,8% 0,3; p = 0,001), cortexul parietal (1,4% 0,6; p = 0,01) și cortexul temporal (1,5 0,6%; p = 0,01).
discuție
studiul actual demonstrează că marea majoritate (> 90%) a neuronilor producătoare de NGF din cortex sunt Gabaergici, în timp ce jumătate din toți neuronii Gabaergici se colocalizează cu NGF. În schimb, markerii neuronilor excitatori prezintă doar co-localizare rară cu NGF. Aceste rezultate au fost consecvente în mai multe regiuni corticale analizate în acest studiu, indicând faptul că NGF este produs în principal de interneuronii inhibitori din neocortexul șobolanului.
deși imunoreactivitatea NGF a coincis rar cu markerii celulelor excitatorii (CAMKIIa), un procent mic (~5%) a fost pozitiv pentru CaMKIIa în toate regiunile corticale examinate. Analiza confocală a confirmat că această dublă etichetare provine din același plan focal și nu se datorează semnalului discret care rezultă din celulele suprapuse. Semnificația funcțională a expresiei NGF într-o fracțiune atât de mică de celule excitatorii nu este cunoscută, dar este posibil ca acești neuroni producători de NGF să reprezinte o subclasă neidentificată anterior de neuroni excitatori din neocortex.
rezultatele noastre sunt în concordanță cu rezultatele studiilor anterioare din alte regiuni ale creierului care demonstrează că NGF co-localizează aproape exclusiv cu celulele Gabaergice din striatum, creierul anterior bazal și hipocampul (Lauterborn și colab., 1993, 1995; Pascual și colab., 1998; Bizon și colab., 1999). Astfel, producția de NGF de către celulele Gabaergice poate fi o proprietate generală a tuturor țintelor care primesc inervație colinergică bazală a creierului anterior (inclusiv creierul anterior bazal în sine). Aceste populații neuronale colinergice necesită NGF pentru menținerea fenotipului și proiecțiilor lor (Rylett și colab., 1993; Chen și colab., 1997; Hu și colab., 1997; Debeir și colab., 1999). De-a lungul studiilor, interneuronii inhibitori apar acum ca sursă primară de trofism NGF pentru neuronii colinergici bazali ai creierului anterior.
deși neuronii colinergici bazali ai creierului anterior inervează atât rețelele corticale excitatorii, cât și inhibitorii (Zaborszky și colab., 1999), sursa sprijinului trofic este copleșitor din partea populației inhibitoare, despre care se știe că joacă un rol critic în medierea plasticității în circuitele corticale (Hensch și Stryker, 2004; Yazaki-Sugiyama și colab., 2009; Donato și colab., 2013). Semnalizarea colinergică pare să contribuie la activarea diferențială a diferitelor subpopulații inhibitoare, modulând astfel echilibrul excitator-inhibitor (Xiang și colab., 1998; Froemke și colab., 2007). NGF poate servi astfel ca un semnal de feedback între rețelele inhibitoare foarte plastice și intrările colinergice care le activează. Într-adevăr, NGF mărește plasticitatea și învățarea comportamentală prin mecanisme dependente de colinergică (Prakash și colab., 1996, 2004; Gutierrez și colab., 1997; Conner și colab., 2009). Eliberarea dependentă de activitate a NGF (Blochl și Thoenen, 1995; Lessmann și colab., 2003), asociat cu capacitatea NGF de a crește activitatea colinergică (Rylett și colab., 1993; Hu și colab., 1997; Auld și colab., 2001), sugerează că NGF poate promova reorganizarea circuitelor active prin funcția colinergică îmbunătățită.
studiile viitoare vor încerca să identifice care subclase de neuroni inhibitori exprimă NGF și modul în care această expresie influențează cu precizie circuitele corticale. În acest scop, am luat măsuri preliminare pentru a determina dacă NGF co-localizat cu doi markeri comuni ai neuronilor inhibitori, parvalbumin (asociat în principal cu celulele coșului și candelabrului) și calbindin (asociat cu numeroase tipuri de celule inhibitoare; McBain și Fisahn, 2001; Markram și colab., 2004). Rezultatele noastre demonstrează că NGF a fost detectat în principal în celulele imunoreactive parvalbumin, deși multe celule etichetate de parvalbumin nu au co-exprimat NGF. Important, celulele NGF-IR, de asemenea, colocalizate cu celule marcate cu calbindină, sugerând că mai mult de o subclasă de neuron inhibitor produce NGF.
în rezumat, în cadrul neocortexului de șobolan, NGF este exprimat în primul rând de neuroni inhibitori, o proprietate care pare a fi conservată din zonele creierului filogenetic mai vechi și care se poate generaliza la creier în ansamblu. Rezultatele noastre sugerează că interneuronii inhibitori corticali joacă un rol vital în menținerea neuronilor de proiecție colinergică a creierului anterior bazal. Astfel, interneuronii gabaergici pot promova reorganizarea corticală prin intermediul semnalizării NGF reglementate.
Declarație privind conflictul de interese
autorii declară că cercetarea a fost realizată în absența oricăror relații comerciale sau financiare care ar putea fi interpretate ca un potențial conflict de interese.
mulțumiri
finanțat de NIH (AG10435), Administrația Veteranilor, Asociația Alzheimer și Dr.Miriam și Sheldon G. Adelson Medical Research Foundation.
material suplimentar
materialul suplimentar pentru acest articol poate fi găsit online la: http://www.frontiersin.org/journal/10.3389/fncel.2014.00220/abstract
Auld, D. S., Mennicken, F. și Quirion, R. (2001). Factorul de creștere nervoasă induce rapid eliberarea prelungită de acetilcolină din neuronii bazali ai creierului anterior: diferențierea dintre influențele neuromodulatoare și neurotrofice. J. Neurosci. 21, 3375–3382.
Pubmed rezumat / Pubmed text complet
Bakin, J. S. și Weinberger, N. M. (1996). Inducerea unei memorii fiziologice în cortexul cerebral prin stimularea nucleului bazal. Proc. Natl. Acad. Sci. SUA 93, 11219-11224. doi: 10.1073 / pnas.93.20.11219
CrossRef text complet
Bizon, J. L., Lauterborn, J. C. și Gall, C. M. (1999). Subpopulațiile interneuronilor striatali se pot distinge pe baza expresiei factorului neurotrofic. J. Comp. Neurol. 408, 283–298. doi: 10.1002 / (SICI)1096-9861(19990531)408:2<283::ajutor-CNE9>3.0.CO;2-2
Pubmed rezumat / Pubmed text complet / CrossRef text complet
Blochl, A. și Thoenen, H. (1995). Caracterizarea eliberării factorului de creștere nervoasă (NGF) din neuronii hipocampali: dovezi pentru o cale reglementată constitutivă și neconvențională dependentă de sodiu. Eur. J. Neurosci. 7, 1220–1228. doi: 10.1111 / j. 1460-9568.1995.tb01112.X
Pubmed rezumat / Pubmed text complet / CrossRef text complet
Butler, M. H., Solimena, M., Dirkx, R. Jr., Hayday, A. și de Camilli, P. (1993). Identificarea unui epitop dominant al decarboxilazei acidului glutamic (GAD-65) recunoscut de autoanticorpi în sindromul stiff-man. J. Exp. Med. 178, 2097–2106. doi: 10.1084 / jem.178.6.2097
Pubmed rezumat / Pubmed text complet / CrossRef text complet
Chang, Y. C. și Gottlieb, D. I. (1988). Caracterizarea proteinelor purificate cu anticorpi monoclonali la decarboxilaza acidului glutamic. J. Neurosci. 8, 2123–2130.
Chen, K. S., Nishimura, M. C., Armanini, M. P., Crowley, C., Spencer, S. D. și Phillips, H. S. (1997). Perturbarea unei singure alele a genei factorului de creștere nervoasă are ca rezultat atrofia neuronilor colinergici bazali din creierul anterior și deficitele de memorie. J. Neurosci. 17, 7288–7296.
Pubmed rezumat / Pubmed text complet
Conner, J. M., Chiba, AA și Tuszynski ,M. H. (2005). Sistemul colinergic bazal al creierului anterior este esențial pentru plasticitatea corticală și recuperarea funcțională după leziuni cerebrale. Neuron 46, 173-179. doi: 10.1016 / j. neuron.2005.03.003
Pubmed Rezumat / Pubmed Text Complet / CrossRef Text Complet
Conner, J. M., Culberson, A., Packowski, C., Chiba, A. A. și Tuszynski ,M. H. (2003). Leziunile sistemului colinergic bazal al creierului anterior afectează achiziția sarcinii și elimină plasticitatea corticală asociată cu învățarea abilităților motorii. Neuronul 38, 819-829. doi: 10.1016 / S0896-6273(03)00288-5
Pubmed rezumat / Pubmed text complet / CrossRef text complet
Conner, J. M., Franks, K. M., Titterness, A. K., Russell, K., Merrill, D. A., Christie,B. R. și colab. (2009). NGF este esențial pentru plasticitatea și învățarea hipocampului. J. Neurosci. 29, 10883–10889. doi: 10.1523/JNEUROSCI.2594-09.2009
Pubmed rezumat / Pubmed text complet / CrossRef text complet
Conner, J. M., Lauterborn, J. C., Yan, Q., Gall, C. M. și Varon, S. (1997). Distribuția proteinei factorului neurotrofic derivat din creier (BDNF) și ARNm la șobolanul adult normal SNC: dovezi pentru transportul axonal anterograd. J. Neurosci. 17, 2295–2313.
Pubmed rezumat / Pubmed text complet
Conner, J. M. și Varon, S. (1992). Distribuția neuronilor imunoreactivi asemănători factorului de creștere nervoasă în creierul șobolanului adult după tratamentul cu colchicină. J. Comp. Neurol. 326, 347–362. doi: 10.1002 / cne.903260304
Pubmed rezumat / Pubmed text complet / CrossRef text complet
Conner, J. M. și Varon, S. (1996). Caracterizarea anticorpilor la factorul de creștere a nervilor: variabilitatea dependentă de test în reactivitatea încrucișată cu alte neurotrofine. J. Neurosci. Metode 65, 93-99. doi: 10.1016/0165-0270(95)00151-4
Pubmed rezumat / Pubmed text complet / CrossRef text complet
Conner, J. M. și Varon, S. (1997). Profilul de dezvoltare al IMUNOREACTIVITĂȚII NGF în creierul șobolanului: un posibil rol al NGF în stabilirea câmpurilor terminale colinergice în hipocamp și cortex. Brain Res.Dev. Brain Res. 101, 67-79. doi: 10.1016 / S0165-3806(97)00051-5
Pubmed rezumat / Pubmed text complet / CrossRef text complet
Debeir, T., Saragovi, H. U. și Cuello, A. C. (1999). Un antagonist TrkA mimetic al factorului de creștere nervoasă determină retragerea butonilor colinergici corticali la șobolanul adult. Proc. Natl. Acad. Sci. SUA 96, 4067-4072. doi: 10.1073 / pnas.96.7.4067
Pubmed rezumat / Pubmed text complet / CrossRef text complet
Donato, F., Rompani, S. B. și Caroni, P. (2013). Plasticitatea rețelei de coșuri-celule care exprimă parvalbumină indusă de experiență reglementează învățarea adulților. Natură 504, 272-276. doi: 10.1038 / nature12866
Pubmed rezumat / Pubmed text complet / CrossRef text complet
Erondu, N. E. și Kennedy, M. B. (1985). Distribuția regională a protein kinazei dependente de Ca2+/calmodulină de tip II în creierul șobolanului. J. Neurosci. 5, 3270–3277.
Froemke, R. C., Merzenich, M. M. și Schreiner, C. E. (2007). O urmă de memorie sinaptică pentru plasticitatea câmpului cortical receptiv. Natura 450, 425-429. doi: 10.1038 / nature06289
Pubmed rezumat / Pubmed text complet / CrossRef text complet
Gall, C. M. și Isackson, P. J. (1989). Convulsiile limbice cresc producția neuronală de ARN mesager pentru factorul de creștere a nervilor. Știință 245, 758-761. doi: 10.1126 / știință.2549634
CrossRef text complet
Gutierrez, H., Miranda, M. I. și Bermudez-Rattoni, F. (1997). Tulburări de învățare și deaferentare colinergică după privarea factorului de creștere a nervului cortical. J. Neurosci. 17, 3796–3803.
Pubmed rezumat / Pubmed text complet
Hanson, M., și Edstr, A. (1978). Inhibitori de mitoză și transport axonal. Int. Rev. Cytol. Suppl. 373–402.
Hayashi, M., Yamashita, A., Shimizu, K., Sogawa, K. și Fujii, Y. (1993). Expresia genei pentru factorul de creștere a nervilor (NGF) în sistemul nervos central al Maimuței. Brain Res. 618, 142-148. doi: 10.1016/0006-8993(93)90437-R
CrossRef Text Complet
Hefti, F. (1986). Factorul de creștere nervoasă promovează supraviețuirea neuronilor colinergici septali după transecțiile fimbriale. J. Neurosci. 6, 2155–2162.
Hensch, T. K. și Stryker, mp (2004). Arhitectura columnară sculptată de circuitele GABA în dezvoltarea cortexului vizual al pisicii. Știință 303, 1678-1681. doi: 10.1126 / știință.1091031
Pubmed rezumat / Pubmed text complet / CrossRef text complet
Hokfelt, T., Kellerth, J. O., Nilsson, G. și Pernow, B. (1975). Studii imunohistochimice experimentale privind localizarea și distribuția substanței P în neuronii senzoriali primari ai pisicii. Brain Res. 100, 235-252. doi: 10.1016/0006-8993(75)90481-3
Pubmed rezumat / Pubmed text complet / CrossRef text complet
Holtzman, D. M., Kilbridge, J., Li, Y., Cunningham, E. T. Jr., Lenn, N. J., Clary,D. O. și colab. (1995). Expresia TrkA în SNC:dovezi pentru existența mai multor neuroni SNC receptivi la NGF. J. Neurosci. 15, 1567–1576.
Pubmed Rezumat / Pubmed Text Complet
Hu, L., Cote, S. L. și Cuello, A. C. (1997). Modularea diferențială a fenotipului colinergic al neuronilor nucleus basalis magnocellularis prin aplicarea NGF la corpul celular sau câmpurile terminale corticale. Exp. Neurol. 143, 162–171. doi: 10.1006 / exnr.1996.6357
Pubmed rezumat / Pubmed text complet / CrossRef text complet
Huang, E. J. și Reichardt, L. F. (2003). Receptorii Trk: roluri în transducția semnalului neuronal. Anu. Părinte Biochem. 72, 609–642. doi: 10.1146/annurev.biochem.72.121801.161629
CrossRef text complet
Isackson, P. J., Huntsman, M. M., Murray, K. D. și Gall, C. M. (1991). Expresia ARNm BDNF este crescută la creierul anterior al șobolanului adult după convulsii limbice: modele temporale de inducție distincte de NGF. Neuronul 6, 937-948. doi: 10.1016 / 0896-6273 (91)90234-Q
Pubmed rezumat / Pubmed text complet / CrossRef text complet
Ito, T., Hioki, H., Nakamura, K., Tanaka, Y., Nakade, H., Kaneko,T. și colab. (2007). Neuronii preganglionici simpatici care conțin acid Gamma-aminobutiric din măduva spinării toracice de șobolan își trimit axonii către ganglionul cervical superior. J. Comp. Neurol. 502, 113–125. doi: 10.1002 / cne.21309
Pubmed rezumat / Pubmed text complet / CrossRef text complet
Kilgard, M. P. și Merzenich, M. M. (1998). Reorganizarea hărții corticale activată de activitatea nucleus basalis. Știință 279, 1714-1718. doi: 10.1126 / știință.279.5357.1714
Pubmed Rezumat / Pubmed Text Complet / CrossRef Text Complet
Kordower, J. H., Bartus, R. T., Bothwell, M., Schatteman, G. și Gash, D. M. (1988). Activitatea imunore a receptorului factorului de creștere nervoasă la primatul Neuman (Cebus apella): distribuție, morfologie și colocalizare cu enzime colinergice. J. Comp. Neurol. 277, 465–486. doi: 10.1002 / cne.902770402
Pubmed rezumat / Pubmed text complet / CrossRef text complet
kordower, J. H., Winn, S. R., Liu, Y. T., Mufson, E. J., Sladek, J. R. Jr., Hammang,J. P. și colab. (1994). Maimuța în vârstă creierul anterior bazal: salvarea și Germinarea neuronilor bazali axotomizați ai creierului anterior după grefe de celule încapsulate care secretă factorul de creștere a nervilor umani. Proc. Natl. Acad. Sci. SUA 91, 10898-10902. doi: 10.1073 / pnas.91.23.10898
Pubmed rezumat / Pubmed text complet / CrossRef text complet
Korsching, S., Auburger, G., Heumann, R., Scott, J. și Thoenen, H. (1985). Nivelurile factorului de creștere nervoasă și ARNm-ul său în sistemul nervos central al șobolanului se corelează cu inervația colinergică. EMBO J. 4, 1389-1393.
Pubmed rezumat / Pubmed text complet
Lad, S. P., Neet, K. E. și Mufson, E. J. (2003). Factorul de creștere a nervilor: structura, funcția și implicațiile terapeutice pentru boala Alzheimer. Curr. Droguri obiective CNS Neurol. Dezordine. 2, 315–334. doi: 10.2174/1568007033482724
Pubmed rezumat / Pubmed text complet / CrossRef text complet
mare, T. H., Bodary, S. C., Clegg, D. O., Weskamp, G., Otten, U. și Reichardt, L. F. (1986). Expresia genelor factorului de creștere nervoasă în creierul de șobolan în curs de dezvoltare. Știință 234, 352-355. doi: 10.1126 / știință.3764415
CrossRef text complet
Lauterborn, J. C., Bizon, J. L., Tran, T. M. și Gall, C. M. (1995). ARNm NGF este exprimat de neuronii Gabaergici, dar nu colinergici, în creierul anterior bazal de șobolan. J. Comp. Neurol. 360, 454–462. doi: 10.1002 / cne.903600307
Pubmed rezumat / Pubmed text complet / CrossRef text complet
Lauterborn, J. C., Tran, T. M., Isackson, P. J. și Gall, C. M. (1993). Factorul de creștere a nervilor ARNm este exprimat de neuronii Gabaergici din hipocampul șobolanului. Neuroreport 5, 273-276. doi: 10.1097/00001756-199312000-00023
CrossRef text complet
Lessmann, V., Gottmann, K. și Malcangio, M. (2003). Secreția de neurotrofină: fapte actuale și perspective viitoare. Prog. Neurobiol. 69, 341–374. doi: 10.1016 / S0301-0082(03)00019-4
Pubmed rezumat / Pubmed text complet / CrossRef text complet
Li, Y., Holtzman, D. M., Kromer, L. F., Kaplan, D. R., Chua-Couzens, J., Clary,D. O. și colab. (1995). Reglementarea expresiei TrkA și ChAT în dezvoltarea creierului anterior bazal de șobolan: dovezi că NGF exogen și endogen reglează diferențierea neuronilor colinergici. J. Neurosci. 15, 2888–2905.
Pubmed rezumat / Pubmed text complet
Maisonpierre, P. C., Belluscio, L., Friedman, B., Alderson, R. F., Wiegand, S. J., Furth,M. E. și colab. (1990). NT-3, BDNF și NGF în sistemul nervos de șobolan în curs de dezvoltare: modele de exprimare paralele, precum și reciproce. Neuronul 5, 501-509. doi: 10.1016 / 0896-6273 (90)90089-X
Pubmed rezumat / Pubmed text complet / CrossRef text complet
Markram, H., Toledo-Rodriguez, M., Wang, Y., Gupta, A., Silberberg, G. și Wu, C. (2004). Interneuronii sistemului inhibitor neocortical. Nat. Rev. Neurologi. 5, 793–807. doi: 10.1038 / nrn1519
Pubmed rezumat / Pubmed text complet / CrossRef text complet
McBain, C. J. și Fisahn, A. (2001). Interneuronii sunt nelegați. Nat. Rev. Neurologi. 2, 11–23. doi: 10.1038/35049047
Pubmed rezumat / Pubmed text complet / CrossRef text complet
Mufson, E. J., Conner, J. M., Varon, S. și Kordower, J. H. (1994). Profilurile imunoreactive asemănătoare factorului de creștere nervoasă în creierul primat bazal și formarea hipocampului. J. Comp. Neurol. 341, 507–519. doi: 10.1002 / cne.903410407
Pubmed rezumat / Pubmed text complet / CrossRef text complet
Pascual, M., Rocamora, N., Acsady, L., Freund, T. F. și Soriano, E. (1998). Expresia factorului de creștere nervoasă și a ARNm neurotrofin-3 în interneuronii hipocampali: caracterizarea morfologică, nivelurile de exprimare și colocalizarea factorului de creștere nervoasă și a neurotrofinei-3. J. Comp. Neurol. 395, 73–90. doi: 10.1002/(SICI)1096-9861(19980525)395:1<73::ajutor-CNE6>3.0.CO; 2-E
Pubmed rezumat / Pubmed text complet / CrossRef text complet
Pasteels, B., Miki, N., Hatakenaka, S. și Pochet, R. (1987). Reactivitate încrucișată imunohistochimică și comigrare electroforetică între calbindin D-27 kDa și visinin. Brain Res. 412, 107-113. doi: 10.1016/0006-8993(87)91444-2
Pubmed rezumat / Pubmed text complet / CrossRef text complet
Patz, S. și Wahle, P. (2006). Modificări de dezvoltare ale expresiei ARNm neurotrofină în straturile cortexului vizual de șobolan. Eur. J. Neurosci. 24, 2453–2460. doi: 10.1111 / j. 1460-9568.2006. 05126.X
Pubmed rezumat / Pubmed text complet / CrossRef text complet
Pitts, A. F. și Miller, M. W. (2000). Expresia factorului de creștere nervoasă, a factorului neurotrofic derivat din creier și a neurotrofinei-3 în cortexul somatosenzorial al șobolanului Matur: coexpresie cu receptori de neurotrofină cu afinitate ridicată. J. Comp. Neurol. 418, 241–254. doi: 10.1002 / (SICI)1096-9861(20000313)418:3<241::ajutor-CNE1>3.0.CO;2-M
Pubmed rezumat / Pubmed text complet / CrossRef text complet
Prakash, N., Cohen-Cory, S. și Frostig, R. D. (1996). Efecte rapide și opuse ale BDNF și NGF asupra organizării funcționale a cortexului adult in vivo. Natură 381, 702-706. doi: 10.1038 / 381702a0
Pubmed rezumat / Pubmed text complet / CrossRef text complet
Prakash, N., Cohen-Cory, S., Penschuck, S. și Frostig, R. D. (2004). Sistemul colinergic bazal al creierului anterior este implicat în plasticitatea indusă de factorul de creștere rapidă a nervilor (NGF) în cortexul baril al șobolanilor adulți. J. Neurofiziol. 91, 424–437. doi: 10.1152 / jn.00489.2003
Pubmed rezumat / Pubmed text complet / CrossRef text complet
Ribak, C. E., Vaughn, J. E. și Saito, K. (1978). Localizarea imunocitochimică a decarboxilazei acidului glutamic în somata neuronală după inhibarea colchicinei transportului axonal. Brain Res. 140, 315-332. doi: 10.1016/0006-8993(78)90463-8
Pubmed rezumat / Pubmed text complet / CrossRef text complet
Rossi, F. M., Sala, R. și Maffei, L. (2002). Exprimarea receptorilor factorului de creștere nervoasă TrkA și p75NTR în cortexul vizual al șobolanului: dezvoltarea și reglarea prin intrarea colinergică. J. Neurosci. 22, 912–919.
Pubmed rezumat / Pubmed text complet
Rylett, R. J., Goddard, S., Schmidt, B. M. și Williams, L. R. (1993). Sinteza și eliberarea acetilcolinei după administrarea intracerebrală continuă a NGF la șobolani Fischer-344 adulți și vârstnici. J. Neurosci. 13, 3956–3963.
Pubmed rezumat / Pubmed text complet
Schubert, P., Kreutzberg, G. W. și Lux, H. D. (1972). Transportul neuroplasmatic în dendrite: efectul colchicinei asupra morfologiei și fiziologiei motoneuronelor la pisică. Brain Res. 47, 331-343. doi: 10.1016/0006-8993(72)90643-9
Pubmed rezumat / Pubmed text complet / CrossRef text complet
Shelton, D. L., și Reichardt, L. F. (1986). Studiile privind expresia factorului de creștere a nervului beta (NGF) în sistemul nervos central: nivelul și distribuția regională a ARNm NGF sugerează că NGF funcționează ca un factor trofic pentru mai multe populații distincte de neuroni. Proc. Natl. Acad. Sci. SUA 83, 2714-2718. doi: 10.1073 / pnas.83.8.2714
Pubmed rezumat / Pubmed text complet / CrossRef text complet
Sofroniew, M. V., Howe, C. L. și Mobley, W. C. (2001). Semnalizarea factorului de creștere nervoasă, neuroprotecția și repararea neuronală. Anu. Rev. Neurologi. 24, 1217–1281. doi: 10.1146/annurev.neuro.24.1.1217
CrossRef text complet
Stephens, E. S., Belliveau, A. C., Gupta, J. S., Mirkovic, S. și Kablar, B. (2005). Rolul neurotrofinelor în menținerea neuronilor motori ai măduvei spinării și a ganglionilor rădăcinii dorsale neuronii senzoriali proprioceptivi. Int. J. Dev. Neuroști. 23, 613–620. doi: 10.1016/j.ijdevneu.2005.07.002
Pubmed rezumat / Pubmed text complet / CrossRef text complet
Tuszynski, M. H., Armstrong, D. M. și Gage, F. H. (1990). Pierderea celulelor bazale din creierul anterior după transecția fimbriei / fornixului. Brain Res. 508, 241–248. doi: 10.1016 / 0006-8993(90)90402-W
CrossRef text complet
Xiang, Z., Huguenard, J. R. și Prince, D. A. (1998). Comutarea colinergică în rețelele inhibitoare neocorticale. Știință 281, 985-988. doi: 10.1126 / știință.281.5379.985
Pubmed rezumat / Pubmed text complet / CrossRef text complet
Yazaki-Sugiyama, Y., Kang, S., Cateau, H., Fukai, T. și Hensch, T. K. (2009). Plasticitate bidirecțională în circuitele GABA cu vârf rapid prin experiență vizuală. Natură 462, 218-221. doi: 10.1038 / nature08485
Pubmed rezumat / Pubmed text complet / CrossRef text complet
Zaborszky, L., Pang, K., Somogyi, J., Nadasdy, Z. și Kallo, I. (1999). Sistemul corticopetal bazal al creierului anterior a fost revizuit. Ann. Acad. Sci. 877, 339–367. doi: 10.1111 / j. 1749-6632.1999.tb09276.X
Pubmed rezumat / Pubmed text complet / CrossRef text complet
Zhang, H. T., Li, L. Y., Zou, X. L., Song, X. B., Hu, Y. L., Feng,Z. T. și colab. (2007). Distribuția imunohistochimică a NGF, BDNF, nt-3 și NT-4 în creierul maimuței rhesus adulte. J. Histochem. Cytochem. 55, 1–19. doi: 10.1369/jhc.6A6952.2006
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text