- Introduzione
- Materiali e metodi
- Preparazione del tessuto
- Immunoistochimica a fluorescenza a doppia etichetta
- Caratterizzazione anticorpale
- Analisi confocale
- Controlli anticorpali
- Risultati
- Immunolabeling NGF
- Co-localizzazione NGF e gabaergica
- La co-localizzazione NGF e glutammatergica
- Discussione
- Dichiarazione sul conflitto di interessi
- Riconoscimenti
- Materiale supplementare
Introduzione
La neurotrofina fattore di crescita nervosa (NGF) è coinvolto in diversi processi critici in via di sviluppo e maturi sistema nervoso dei mammiferi, tra cui innervazione di destinazione, la differenziazione cellulare e la sopravvivenza neuronale (Grossi et al., 1986; Li et al., 1995; Sofroniew et al., 2001; Lad et al., 2003). Nel cervello adulto, l’NGF svolge un ruolo chiave nel mantenimento e nella funzione del sistema colinergico basale del proencefalo (Lad et al., 2003). I livelli di NGF sono più alti nelle aree che ricevono il maggior numero di proiezioni colinergiche basali del proencefalo, vale a dire l’ippocampo e la corteccia (Korsching et al., 1985; Shelton e Reichardt, 1986) e i recettori per l’NGF nella corteccia sono in gran parte confinati alle proiezioni corticopetali basali del proencefalo (Kordower et al., 1988; Sofroniew et al., 2001; Rossi et al., 2002). La segnalazione del fattore di crescita del nervo mantiene le proiezioni corticopetali colinergiche durante l’età adulta (Chen et al., 1997; Debeir et al., 1999) e può prevenire la degenerazione di questi neuroni dopo la transezione dei loro assoni (Hefti, 1986; Tuszynski et al., 1990; Kordower et al., 1994). Inoltre, NGF migliora il rilascio di acetilcolina dalle colture basali del proencefalo (Auld et al., 2001) e può modulare la funzione colinergica attraverso il controllo fenotipico del locus del gene colinergico (Rylett et al., 1993; Hu et al., 1997).
Il sistema colinergico del proencefalo basale influenza l’apprendimento e la plasticità dipendente dall’esperienza nella corteccia (Bakin e Weinberger, 1996; Kilgard e Merzenich, 1998; Conner et al., 2003, 2005), e la segnalazione NGF è stata ipotizzata per supportare, e possibilmente migliorare, l’apprendimento e la plasticità mediate dal proencefalo basale. Ad esempio, il blocco della segnalazione di NGF tramite iniezioni ripetute di anticorpi NGF nella corteccia insulare riduce l’innervazione colinergica locale e interrompe l’acquisizione di due processi che dipendono dall’integrità degli input colinergici, dall’avversione al gusto condizionata e dall’apprendimento dell’evitamento inibitorio (Gutierrez et al., 1997). Un recente studio di Conner et al. (2009) ha dimostrato che sia l’apprendimento spaziale che il potenziamento a lungo termine dell’ippocampo (LTP) sono migliorati in seguito alle infusioni di NGF nel nucleo del setto, la fonte primaria di innervazione colinergica all’ippocampo.
L’applicazione focale di NGF può anche indurre una rapida espansione della rappresentazione locale del baffo nella corteccia del barile dei ratti. Questo processo dipende dalle proiezioni colinergiche dal proencefalo basale (Prakash et al., 1996, 2004), suggerendo che la segnalazione corticale di NGF può stimolare la riorganizzazione funzionale colinergica-dipendente rapida. Pertanto, oltre ai suoi effetti trofici a lungo termine sulle cellule colinergiche basali del proencefalo, l’NGF può anche partecipare al rimodellamento del circuito a breve termine. Questa ipotesi di “doppia azione” è supportata dall’esistenza di meccanismi di rilascio costitutivi e dipendenti dall’attività di NGF (Blochl e Thoenen, 1995; Lessmann et al., 2003), potenzialmente alla base degli effetti trofici a lungo termine e modulatori a breve termine di NGF, rispettivamente. Inoltre, sia le vie di segnalazione retrograde (a lungo termine) che locali (a breve termine) sono state osservate per NGF (Huang e Reichardt, 2003).
Le cellule che esprimono NGF sono state rilevate nella corteccia, nel cervelletto, nell’ippocampo, nel talamo, nello striato, nel proencefalo basale e nel tronco cerebrale (Gall e Isackson, 1989; Maisonpierre et al., 1990; Isackson et al., 1991; Conner e Varon, 1992; Hayashi et al., 1993; Mufson et al., 1994; Zhang et al., 2007). Sebbene l’mRNA di NGF sia stato osservato negli astrociti e in altri glia, la stragrande maggioranza dell’NGF corticale è prodotta dai neuroni (Sofroniew et al., 2001). I tipi specifici di neuroni che producono NGF nella corteccia non sono noti, tuttavia, e le proiezioni corticopetali colinergiche hanno dimostrato di innervare entrambi i neuroni eccitatori e inibitori nella corteccia (Zaborszky et al., 1999). Nelle regioni extracorticali come l’ippocampo, lo striato e il proencefalo basale, la produzione di NGF è prevalentemente localizzata nei neuroni inibitori gabaergici (Lauterborn et al., 1993, 1995; Pascual et al., 1998; Bizon et al., 1999). L’identificazione delle cellule produttrici di NGF nella corteccia è importante per identificare i potenziali meccanismi alla base della modulazione degli input corticali colinergici e dei meccanismi della plasticità corticale. Nell’attuale studio, identifichiamo un sottoinsieme di cellule gabaergiche corticali come fonte primaria di produzione di NGF nella corteccia adulta, con produzione relativamente rara da parte dei neuroni glutammatergici.
Materiali e metodi
Tutti i soggetti sono stati trattati in conformità alle linee guida istituzionali per la cura degli animali. A causa di bassi livelli endogeni di espressione corticale di NGF che vietavano l’identificazione di specifiche fonti di tipo cellulare di NGF in studi precedenti, abbiamo eseguito infusioni di colchicina locale per inibire la polimerizzazione dei microtubuli, bloccando così il trasporto di NGF dal corpo cellulare e con conseguente accumulo di antigene NGF rilevabile nel soma delle cellule produttrici (Schubert et al., 1972; Hokfelt et al., 1975; Hanson e Edström, 1978; Conner e Varon, 1992). Rapporti precedenti hanno dimostrato che il trattamento con colchicina aumenta la rilevazione di NGF utilizzando tecniche immunoistochimiche (Conner e Varon, 1992). Inoltre, i livelli di colchicina simili a quelli utilizzati nello studio attuale non inducono anomalie grossolane nella distribuzione neuronale del membro della famiglia delle neurotrofine BDNF (Conner et al., 1997).
Preparazione del tessuto
Otto ratti adulti Fischer 344 (4 maschi, 4 femmine; Harlan Sprague Dawley) sono stati anestetizzati con 2 ml/kg di ketamina da 25 mg/ml, xilazina da 1,3 mg/ml e cocktail di acepromazina da 0,25 mg/ml e iniettati con 5.0 µl di colchicina (10 µg/µl in aCSF) nelle posizioni corticali elencate di seguito ad una velocità di 0,5 µl/min utilizzando una siringa Hamilton da 10 µl. Dopo l’infusione, l’ago è rimasto in posizione per quattro minuti per consentire un’adeguata diffusione al tessuto circostante. Quattro animali hanno ricevuto iniezioni bilaterali nella corteccia motoria primaria (M1) a +1,2 mm anteriore (A/P) e ±2,5 mm laterale (M/L) a bregma. Metà della soluzione è stata iniettata a 1,6 mm sotto la superficie del cervello (D/V) e il resto a 1,0 mm. I restanti quattro animali hanno ricevuto iniezioni unilaterali nella corteccia prefrontale (A/P: +3.0, M/L: +0,5, D/V: -2,3 e -1,8), corteccia temporale (A/P: -6,5, M/L: +5,0, D/V: -7,5 e -7,0) e corteccia parietale (A/P: -3,0, M/L: +5,0, D/V: -1,8 e -1,3). Dopo 48 h, gli animali sono stati profondamente anestetizzati e perfusi transcardicamente con 250 ml di soluzione salina tamponata con fosfato freddo (pH 7,4), seguita da 250 ml di paraformaldeide fredda 2% + 0,2% parabenzochinone in tampone fosfato 0,1 M. I cervelli sono stati estratti, postfissati per 2 ore nello stesso fissativo e crioprotetti in tampone fosfato da 0,1 M contenente saccarosio al 30% per almeno 72 ore a 4°C. Le sezioni coronali (40 µm) sono state tagliate su un microtomo scorrevole congelato e conservate in crioprotettore (TCS) a 4°C fino a quando non sono state ulteriormente elaborate per l’immunoistochimica.
Immunoistochimica a fluorescenza a doppia etichetta
L’immunoistochimica sequenziale a doppia etichetta è stata utilizzata per visualizzare i neuroni che esprimono NGF e marcatori cellulari gabaergici o glutamatergici. Le sezioni flottanti sono state lavate in soluzione salina tamponata Tris (TBS), permeabilizzate con Triton X-100 allo 0,25% e l’etichettatura non specifica è stata quindi bloccata con siero d’asino al 5%. Sezioni sono state incubate per 72 ore a 4°C in anticorpo anti-NGF di coniglio (Conner e Varon, 1992) diluito 1:1000 in TBS, 0,25% Triton X-100 e 5% siero d’asino. Dopo l’incubazione primaria dell’anticorpo, le sezioni sono state incubate in IgG coniugate con biotina anti-coniglio (1: 200; Vector Laboratories, Burlingame, CA, USA). L’amplificazione del segnale tiramide (TSA; PerkinElmer, Waltham, MA, USA) è stata applicata per amplificare il segnale NGF, dopo di che le sezioni sono state lavate in TBS e incubate in Alexa Fluor 488 o 594-streptavidina coniugata (Invitrogen, Carlsbad, CA, USA) diluita 1:200 per 3 h a 4°C. Dopo un lavaggio breve, le sezioni sono state incubate in mouse anti-glutammato decarbossilasi (GAD) 65 (GAD-6, AntibodyRegistry:AB_528264,1:2000; Studi di Sviluppo di Ibridoma Banca, Iowa City, IA, USA) e il mouse anti-GAD67 (AnitbodyRegistry: AB_2278725, 1:1500; Millipore, Temecula, CA, USA), o in mouse anti-parvalbumin (AntibodyRegistry: AB_2174013, 1:30000; Millipore, Temecula, CA, USA), mouse anti-calbindin-D-28K (AntibodyRegistry: AB_476894, 1:1500; Sigma-Aldrich, St. Louis, MO, USA), o il mouse anti-Ca2+/calmodulina-dipendente della proteina chinasi IIa (CaMKIIa, AntibodyRegistry: AB_2067919, 1:1500; Millipore) per 72 h a 4°C. Infine, le sezioni sono state lavate, incubate in Alexa Fluor 594 o 488-coniugato asino anti-mouse (Invitrogen) per 3 h a temperatura ambiente, lavato di nuovo, montato su vetrini, e coverslipped in Fluoromount-G (Southern Biotech, Birminghan, AL, USA). Al fine di massimizzare l’identificazione delle cellule gabaergiche, gli anticorpi GAD65 e GAD67 sono stati co-incubati. Un sottoinsieme di sezioni è stato ricoperto in ProLong Gold con DAPI (Invitrogen) per la visualizzazione dei nuclei cellulari.
Caratterizzazione anticorpale
L’anticorpo NGF utilizzato in questo studio è un policlonale purificato per affinità sollevato nel coniglio contro l’NGF purificato del topo (Conner e Varon, 1992). L’anticorpo riconosce il topo purificato e l’NGF umano ricombinante ma non reagisce in modo incrociato con BDNF ricombinante o NT-3 (Conner e Varon, 1996). Inoltre, il modello immunoreattivo dell’espressione di NGF nel cervello di ratto corrisponde strettamente a quello ottenuto dall’analisi in situ nel cervello di ratto (Conner e Varon, 1997).
L’anticorpo monoclonale GAD-65 (Developmental Studies Hybridoma Bank, Gad-6) è stato prodotto immunizzando topi con immunoaffinità della proteina GAD-purificata dal cervello di ratto. L’analisi Western blot degli omogenati cerebrali di ratto ha rivelato che l’anticorpo riconosce selettivamente GAD-65 ma non GAD-67 (Chang e Gottlieb, 1988). Ulteriori studi hanno dimostrato che l’anticorpo GAD – 6 riconosce un epitopo situato tra gli amminoacidi 475-571 del C-terminale di GAD-65 (Butler et al., 1993).
Il topo monoclonale GAD-67 (Millipore, MAB 5406, lotto: 25010139) è stato sollevato contro residui di aminoacidi 4-101 di GAD-67 umana, e riconosce una singola banda 67-kDa sull’analisi Western blot del cervello di ratto (informazioni tecniche del produttore). La preincubazione dell’anticorpo con una proteina di fusione GST-GAD-67 non ha prodotto alcun segnale immunopositivo nel cervello (It et al., 2007).
Il topo monoclonale anti-CaMKIIa (Millipore, MAB 8699, lotto: LV1366080) riconosce specificamente la subunità alfa di calcio/calmodulina-dipendente protein chinasi II. L’analisi Western blot dimostra che l’anticorpo identifica una singola banda di 50 kDa e riconosce sia forme fosforilate che non fosforilate (Erondu e Kennedy, 1985).
Monoclonale anti-calbindin-D-28k (Sigma–Aldrich, C9848, sacco: 088k4799) è derivato da topi BALB/c immunizzati con purificato rene bovino calbindin-D-28k. Immunoblotting ha mostrato l’anticorpo riconosce di 28 kDa band, e non a reagire con altre molecole, come calbindin-D-9K, calretinina, catena leggera della miosina, e parvalbumin (produttore informazioni tecniche). È stato dimostrato che il preassorbimento con una proteina kDa calbindina-D-27 purificata dai cervelli di pulcino e ratto elimina l’immunocontenente calbindina nel cervello (Pasteels et al., 1987).
Anti-parvalbumina (Millipore, MAB 1572, lotto: LV1378387) è stato raccolto da topi immunizzati contro parvalbumina purificata dal muscolo della rana. L’anticorpo monoclonale è diretto contro un epitopo al primo sito di legame Ca2+e l’analisi immunoblot dimostra che riconosce una proteina cerebrale di 12 kDa (informazioni tecniche del produttore).
Analisi confocale
Le immagini sono state catturate utilizzando un Olympus AX70 con software Magnafire (versione 2.0; Karl Storz Imaging, Goleta, CA, USA). Poiché l’etichettatura NGF è stata ridotta sostanzialmente di circa 2 mm anteriore / posteriore ai siti di iniezione della colchicina, presumibilmente a causa della mancanza di diffusione della colchicina e della conseguente assenza di accumulo somatico di NGF, sono state analizzate solo sezioni entro 1,5 mm da ciascun sito di iniezione della colchicina. Ogni 10a sezione (400 µm) è stata esaminata all’interno di una regione corticale. Le cellule sono state contate manualmente e almeno tre sezioni sono state analizzate in ciascuna regione corticale e combinazione di anticorpi per soggetto. Solo tre animali sono stati valutati nella regione temporale a causa dell’etichettatura NGF non rilevabile nel quarto. Le celle singole e doppie sono state quantificate utilizzando immagini a singolo e doppio canale. Diversi criteri sono stati utilizzati per identificare le cellule etichettate, tra cui la dimensione, la morfologia, il segnale rispetto allo sfondo e l’etichettatura DAPI coincidente durante la valutazione del tessuto macchiato da DAPI. In un sottoinsieme di sezioni, 5 µm z-stack sono stati raccolti utilizzando un Olympus Fluoview FV1000 per garantire la localizzazione neuronale dell’oggetto etichettato. A causa del nostro interesse per la proporzione, e non il numero assoluto, delle cellule con doppia etichetta, non sono stati utilizzati metodi stereologici.
La percentuale di cellule a doppia etichetta per gruppo di cellule immunoreattive (IR) è stata determinata per ciascun campo dell’immagine. L’errore medio ± standard è stato calcolato per ciascuna regione corticale esaminata. L’analisi unidirezionale della varianza (ANOVA) è stata utilizzata per valutare le differenze tra le regioni corticali. L’HSD di Fisher è stato utilizzato per l’analisi post-hoc. Tutte le analisi statistiche sono state effettuate con SPSS 15.0 per Windows.
Controlli anticorpali
I controlli comprendevano omissione di anticorpi primari, omissione di anticorpi secondari e sostituzione di anticorpi primari con anticorpi non specifici (IgG di coniglio). Tutte le manipolazioni hanno avuto gli effetti attesi e hanno sostenuto l’affermazione che le cellule etichettate rappresentano la vera etichettatura dell’antigene con i loro anticorpi corrispondenti.
Risultati
Immunolabeling NGF
L’etichettatura NGF distinta era visibile entro un raggio di 1.5 mm dal sito di iniezione corticale della colchicina. All’interno di queste aree, l’etichettatura NGF era prevalentemente limitata alla cellula somata (Figura 1). Raramente, uno o più processi cellulari potrebbero anche essere distinti. Al di fuori di questo raggio di 1,5 mm, l’etichettatura NGF era praticamente non rilevabile nella corteccia. Poiché l’espressione corticale dei recettori NGF TrkA e p75 sono limitati alle fibre corticopetali colinergiche, è improbabile che l’etichettatura osservata di NGF rifletta l’NGF endocytosed, ma è invece indicativa delle cellule produttrici di NGF (Holtzman et al., 1995; Rossi et al., 2002; Stephens et al., 2005). Come riportato in precedenza (Ribak et al., 1978), il trattamento con colchicina ha intensificato l’etichettatura GAD nei corpi cellulari e nei processi neuronali. La colchicina non ha avuto effetti rilevabili sull’etichettatura di parvalbumina, calbindina o CaMKIIa.
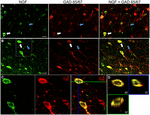
FIGURA 1. Il fattore di crescita del nervo colocalizza estesamente con i marcatori cellulari inibitori. Cellule immunoreattive nella corteccia motoria primaria (A) e nella corteccia prefrontale (B). Le immagini mostrano che le cellule etichettate con NGF (verde) colocalizzano ampiamente con le cellule etichettate con GAD 65/67 (rosso). Le frecce bianche mostrano un esempio di immunoreattività cellulare sia per NGF che per GAD 65/67 in ciascuna regione corticale. Le frecce blu mostrano le cellule immunoreattive solo per GAD 65/67. (C) Immagine ingrandita dell’area all’interno della casella bianca in (B). D) Ricostruzione X-Y-Z della cella a doppia etichetta indicata alla lettera C). Le linee verdi e blu indicano i livelli di dissezione nei piani XZ e YZ, rispettivamente. Barre di scala = 25 µm.
Co-localizzazione NGF e gabaergica
Fattore di crescita del nervo co-localizzato estesamente con i marcatori cellulari gabaergici GAD65 e GAD67, indipendentemente dall’area corticale esaminata (Figura 1; Tabella 1). Nel complesso, 91 ± 0,9% delle cellule corticali marcate con NGF etichettate anche per GAD65 / 67. La percentuale di cellule marcate con NGF che co-esprimono GAD65 / 67 ha mostrato poca differenza tra le cortecce prefrontali (90,0 ± 1,5%), motorie (91,7 ± 1,5%), parietali (89,6 ± 3,5%) e temporali (93,4 ± 8,1%) (ANOVA unidirezionale; p = 0,78). Al contrario, NGF co-localizzato con solo 55 ± 2.3% di tutte le cellule marcate con GAD65/67. Per determinare se la produzione di NGF fosse limitata a un sottotipo specifico di neurone gabaergico, abbiamo co-etichettato il tessuto per NGF e parvalbumina o calbindina (Figura 2). Le cellule marcate con NGF sono state osservate per colocalizzare con entrambi i marcatori. Tuttavia, la colocalizzazione di NGF con parvalbumina (67,8 ± 3,6%) era superiore a 2× maggiore rispetto a calbindina (29,1 ± 3,9%). Inoltre, le cellule NGF-IR costituivano meno della metà di tutte le cellule immunoreattive di parvalbumina (47,7 ± 4,6%) e calbindina (25,7 ± 4,9%).

FIGURA 2. NGF colabeled con marcatori di sottoclasse neurone inibitorio. Fette della corteccia motoria sono state etichettate per NGF e parvalbumina o calbindina. (A) Le cellule hanno mostrato ampia sovrapposizione di NGF e parvalbumin etichettatura (frecce bianche). (B) Al contrario, la colabeling di NGF e calbindin era meno comune. Barre di scala = 25 µm.

TABELLA 1. NGF-e GAD65/67-cellule immunoreattive per regione corticale.
I neuroni che esprimono il fattore di crescita del nervo sono stati osservati in tutti gli strati corticali. Studi precedenti hanno riportato una distribuzione non uniforme dei neuroni marcati con NGF nelle lamine corticali (Pitts e Miller, 2000; Patz e Wahle, 2006). L’analisi quantitativa per strato non è stata eseguita nello studio attuale, tuttavia, poiché l’intensità di etichettatura NGF diminuiva con l’aumentare della distanza dal sito di iniezione della colchicina.
La co-localizzazione NGF e glutammatergica
L’etichettatura per CaMKIIa è stata osservata principalmente all’interno dei processi somati cellulari e prossimali (Figura 3). A differenza dell’ampia co-localizzazione osservata con i marcatori NGF e gabaergici, le cellule etichettate con NGF raramente sono co-localizzate con le cellule etichettate con CaMKIIa (Figura 3; Tabella 2). In totale, 4,9 ± 1,1% delle cellule immunoreattive NGF sono state co-marcate con anticorpi CaMKIIa. La co-localizzazione differiva significativamente dalla regione corticale (ANOVA unidirezionale; p = 0,03); Il post hoc di Fisher ha rivelato che la corteccia prefrontale aveva una percentuale maggiore di cellule NGF a doppia etichetta (7,6 ± 2,1%) rispetto alla corteccia motoria primaria (2,4 ± 1,0%; p = 0,02) e alla corteccia parietale (2,9% ± 1,5; p = 0,01).

FIGURA 3. Il fattore di crescita del nervo colocalizza minimamente con il marcatore cellulare eccitatorio CaMKIIa. Cellule immunoreattive nella corteccia prefrontale. Le cellule sono state raramente colabeled per NGF (verde) e CaMKIIa (rosso), indipendentemente dalla regione corticale esaminata. Le frecce d’oro mostrano un esempio di una cellula immunoreattiva solo per NGF. Barre di scala = 25 µm.

TABELLA 2. NGF-e CaMKIIa-cellule immunoreattive per regione corticale.
Le cellule immunoreattive per CaMKIIa superavano notevolmente quelle etichettate dagli anticorpi NGF. La percentuale complessiva di cellule marcate con CaMKIIa che esprimevano simultaneamente il segnale NGF era del 2 ± 0,6%. Questa percentuale differiva significativamente per regione (ANOVA unidirezionale p = 0,003), con la corteccia prefrontale che mostra una percentuale maggiore di cellule NGF/CaMKIIa a doppia etichetta (3,7 ± 1,1%) rispetto alla corteccia motoria primaria (0,8% ± 0,3; p = 0,001), alla corteccia parietale (1,4% ± 0,6; p = 0,01) e alla corteccia temporale (1,5 ± 0,6%; p = 0,01).
Discussione
L’attuale studio dimostra che la stragrande maggioranza (> 90%) dei neuroni che producono NGF della corteccia sono gabaergici, mentre la metà di tutti i neuroni gabaergici colocalizzano con NGF. Al contrario, i marcatori dei neuroni eccitatori mostrano solo una rara co-localizzazione con NGF. Questi risultati sono stati coerenti in più regioni corticali analizzate in questo studio, indicando che l’NGF è prodotto principalmente da interneuroni inibitori nella neocorteccia del ratto.
Sebbene l’immunoreattività NGF raramente coincidesse con i marcatori cellulari eccitatori (CAMKIIa), una piccola percentuale (~5%) era positiva per CaMKIIa in tutte le regioni corticali esaminate. L’analisi confocale ha confermato che questa doppia etichettatura proveniva dallo stesso piano focale e non era dovuta al segnale discreto derivante da celle sovrapposte. Il significato funzionale dell’espressione di NGF in una piccola frazione di cellule eccitatorie non è noto, ma è possibile che questi neuroni produttori di NGF rappresentino una sottoclasse precedentemente non identificata di neuroni eccitatori nella neocorteccia.
I nostri risultati sono coerenti con i risultati di studi precedenti in altre regioni del cervello che dimostrano che NGF co-localizza quasi esclusivamente con cellule gabaergiche nello striato, nel proencefalo basale e nell’ippocampo (Lauterborn et al., 1993, 1995; Pascual et al., 1998; Bizon et al., 1999). Pertanto, la produzione di NGF da parte delle cellule gabaergiche può essere una proprietà generale di tutti gli obiettivi che ricevono innervazione colinergica del proencefalo basale (incluso il proencefalo basale stesso). Queste popolazioni neuronali colinergiche richiedono NGF per il mantenimento del loro fenotipo e proiezioni (Rylett et al., 1993; Chen et al., 1997; Hu et al., 1997; Debeir et al., 1999). Attraverso gli studi, gli interneuroni inibitori emergono ora come fonte primaria di trofismo NGF per i neuroni colinergici basali del proencefalo.
Sebbene i neuroni colinergici basali del proencefalo innervino sia le reti corticali eccitatorie che inibitorie (Zaborszky et al., 1999), la fonte del supporto trofico è prevalentemente dalla popolazione inibitoria, che è nota per svolgere un ruolo critico nella mediazione della plasticità nei circuiti corticali (Hensch e Stryker, 2004; Yazaki-Sugiyama et al., 2009; Donato et al., 2013). La segnalazione colinergica sembra contribuire all’attivazione differenziale di varie sottopopolazioni inibitorie, modulando così l’equilibrio eccitatorio-inibitorio (Xiang et al., 1998; Froemke et al., 2007). NGF può quindi servire come segnale di feedback tra le reti inibitorie altamente plastiche e gli ingressi colinergici che li attivano. Infatti, NGF aumenta la plasticità e l’apprendimento comportamentale attraverso meccanismi dipendenti dal colinergico (Prakash et al., 1996, 2004; Gutierrez et al., 1997; Conner et al., 2009). Rilascio dipendente dall’attività di NGF (Blochl e Thoenen, 1995; Lessmann et al., 2003), accoppiato con la capacità di NGF di aumentare l’attività colinergica (Rylett et al., 1993; Hu et al., 1997; Auld et al., 2001), suggerisce che NGF può promuovere la riorganizzazione dei circuiti attivi attraverso una maggiore funzione colinergica.
Studi futuri tenteranno di identificare quali sottoclassi di neuroni inibitori esprimono NGF e come questa espressione influenza precisamente i circuiti corticali. A tal fine, abbiamo preso misure preliminari per determinare se NGF co-localizzato con due marcatori comuni di neuroni inibitori, parvalbumina (associata principalmente alle cellule del cesto e del lampadario) e calbindina (associata a numerosi tipi di cellule inibitorie; McBain e Fisahn, 2001; Markram et al., 2004). I nostri risultati dimostrano che l’NGF è stato rilevato principalmente nelle cellule immunoreattive di parvalbumina, sebbene molte cellule etichettate con parvalbumina non abbiano co-espresso NGF. È importante sottolineare che le cellule NGF-IR anche colocalizzate con cellule marcate con calbindina, suggerendo che più di una sottoclasse di neurone inibitorio produce NGF.
In sintesi, all’interno della neocorteccia del ratto l’NGF è espresso principalmente dai neuroni inibitori, una proprietà che sembra essere conservata da aree cerebrali filogeneticamente più vecchie e che può generalizzare al cervello nel suo complesso. I nostri risultati suggeriscono che gli interneuroni inibitori corticali svolgono un ruolo vitale nel mantenimento dei neuroni di proiezione colinergica del proencefalo basale. Gli interneuroni gabaergici possono quindi promuovere la riorganizzazione corticale tramite segnalazione NGF regolata.
Dichiarazione sul conflitto di interessi
Gli autori dichiarano che la ricerca è stata condotta in assenza di relazioni commerciali o finanziarie che potrebbero essere interpretate come un potenziale conflitto di interessi.
Riconoscimenti
Finanziato dal NIH (AG10435), l’Amministrazione dei veterani, l’Associazione Alzheimer e la Dr. Miriam e Sheldon G. Adelson Medical Research Foundation.
Materiale supplementare
Il materiale supplementare per questo articolo può essere trovato online all’indirizzo: http://www.frontiersin.org/journal/10.3389/fncel.2014.00220/abstract
Auld, DS, Mennicken, F. e Quirion, R. (2001). Il fattore di crescita del nervo induce rapidamente il rilascio prolungato di acetilcolina dai neuroni basali del proencefalo in coltura: differenziazione tra influenze neuromodulatorie e neurotrofiche. J. Neurosci. 21, 3375–3382.
Pubmed Abstract / Pubmed Testo completo
Bakin, J. S., e Weinberger, N. M. (1996). Induzione di una memoria fisiologica nella corteccia cerebrale mediante stimolazione del nucleo basalis. Proc. Natl. Acad. Sic. USA 93, 11219-11224. doi: 10.1073 / pnas.93.20.11219
Testo integrale CrossRef
Bizon, J. L., Lauterborn, J. C., e Gall, C. M. (1999). Le sottopopolazioni di interneuroni striatali possono essere distinte sulla base dell’espressione del fattore neurotrofico. J. Comp. Neurolo. 408, 283–298. doi: 10.1002/(SICI)1096-9861(19990531)408:2<283::AIUTO-CNE9>3.0.CO;2-2
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Blochl, A., e Thoenen, H. (1995). Caratterizzazione del rilascio del fattore di crescita nervoso (NGF) dai neuroni ippocampali: evidenza di una via regolata costitutiva e non convenzionale dipendente dal sodio. EUR. J. Neurosci. 7, 1220–1228. doi: 10.1111 / j. 1460-9568. 1995.tb01112.x
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Nel 1993 è stato nominato direttore generale del Dipartimento di Scienze politiche. Identificazione di un epitopo dominante di decarbossilasi dell’acido glutammico (GAD-65) riconosciuto dagli autoanticorpi nella sindrome di stiff-man. J. Scad. Med. 178, 2097–2106. doi: 10.1084 / jem.178.6.2097
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Chang, Y. C., e Gottlieb, D. I. (1988). Caratterizzazione delle proteine purificate con anticorpi monoclonali alla decarbossilasi dell’acido glutammico. J. Neurosci. 8, 2123–2130.
Nel 1997, dopo la morte del padre, si trasferì a New York, dove rimase fino al 1997. La rottura di un singolo allele del gene del fattore di crescita del nervo provoca atrofia dei neuroni colinergici basali del proencefalo e deficit di memoria. J. Neurosci. 17, 7288–7296.
Pubmed Abstract / Pubmed Testo completo
Conner, J. M., Chiba, A. A., e Tuszynski, M. H. (2005). Il sistema colinergico basale del proencefalo è essenziale per la plasticità corticale e il recupero funzionale dopo la lesione cerebrale. Neurone 46, 173-179. doi: 10.1016 / j.neurone.2005.03.003
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Conner, J. M., Culberson, A., Packowski, C., Chiba, A. A., e Tuszynski, M. H. (2003). Le lesioni del sistema colinergico del proencefalo basale compromettono l’acquisizione del compito e aboliscono la plasticità corticale associata all’apprendimento delle abilità motorie. Neurone 38, 819-829. doi: 10.1016/S0896-6273(03)00288-5
Pubmed Astratto | Pubmed Testo Completo | CrossRef Testo Completo
Conner, J. M., Franchi, K. M., Titterness, A. K., Russell, K., Merrill, D. A., Christie, B. R.,et al. (2009). NGF è essenziale per la plasticità e l’apprendimento dell’ippocampo. J. Neurosci. 29, 10883–10889. doi: 10.1523 / JNEUROSCI.2594-09.2009
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Conner, J. M., Lauterborn, J. C., Yan, Q., Gall, C. M., e Varon, S. (1997). Distribuzione della proteina del fattore neurotrofico derivato dal cervello (BDNF) e dell’mRNA nel normale SNC del ratto adulto: evidenza di trasporto assonale anterograde. J. Neurosci. 17, 2295–2313.
Pubmed Abstract / Pubmed Testo completo
Conner, JM, e Varon, S. (1992). Distribuzione dei neuroni immunoreattivi del tipo di fattore di crescita del nervo nel cervello adulto del ratto dopo il trattamento della colchicina. J. Comp. Neurolo. 326, 347–362. doi: 10.1002 / cne.903260304
Pubmed Abstract / Pubmed Testo completo / CrossRef Testo completo
Conner, JM, e Varon, S. (1996). Caratterizzazione degli anticorpi contro il fattore di crescita del nervo: variabilità assay-dipendente nella cross-reattività con altre neurotrofine. J. Neurosci. Metodi 65, 93-99. doi: 10.1016/0165-0270(95)00151-4
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Conner, JM, e Varon, S. (1997). Profilo evolutivo dell’immunoreattività NGF nel cervello del ratto: un possibile ruolo di NGF nella creazione di campi terminali colinergici nell’ippocampo e nella corteccia. Cervello Res. Dev. Cervello Res. 101, 67-79. doi: 10.1016 / S0165-3806(97)00051-5
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Nel 1999 è stato nominato presidente del Consiglio dei Ministri. Un antagonista mimetico del TRKA del fattore di crescita del nervo provoca il ritiro degli attacchi colinergici corticali nel ratto adulto. Proc. Natl. Acad. Sic. USA 96, 4067-4072. doi: 10.1073 / pnas.96.7.4067
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Donato, F., Rompani, S. B., e Caroni, P. (2013). Parvalbumin-esprimendo la plasticità della rete a cestello-cella indotta dall’esperienza regola l’apprendimento degli adulti. Natura 504, 272-276. doi: 10.1038 / nature12866
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Erondu, N. E., e Kennedy, MB (1985). Distribuzione regionale della proteina chinasi Ca2+/calmodulina-dipendente di tipo II nel cervello di ratto. J. Neurosci. 5, 3270–3277.
Froemke, R. C., Merzenich, M. M., e Schreiner, C. E. (2007). Una traccia di memoria sinaptica per la plasticità del campo ricettivo corticale. Natura 450, 425-429. doi: 10.1038 / nature06289
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Gall, C. M., e Isackson, P. J. (1989). Le convulsioni limbiche aumentano la produzione neuronale di RNA messaggero per il fattore di crescita del nervo. Scienza 245, 758-761. doi: 10.1126 / scienza.2549634
Testo integrale CrossRef
Gutierrez, H., Miranda, M. I., e Bermudez-Rattoni, F. (1997). Disturbi dell’apprendimento e deafferentazione colinergica dopo deprivazione del fattore di crescita del nervo corticale. J. Neurosci. 17, 3796–3803.
Pubmed Abstract / Pubmed Testo completo
Hanson, M., e Edström, A. (1978). Inibitori della mitosi e trasporto assonale. Int. Rev. Cytol. Suppl. 373–402.
Nel 1993 è stato pubblicato il primo album in studio della band. Espressione del gene per il fattore di crescita del nervo (NGF) nel sistema nervoso centrale della scimmia. Cervello Res. 618, 142-148. doi: 10.1016/0006-8993(93)90437-R
CrossRef Testo integrale
Hefti, F. (1986). Il fattore di crescita del nervo promuove la sopravvivenza dei neuroni colinergici settali dopo transezioni fimbriali. J. Neurosci. 6, 2155–2162.
Nel 2004 si trasferisce a New York. Architettura colonnare scolpita dai circuiti GABA nello sviluppo della corteccia visiva del gatto. Scienza 303, 1678-1681. doi: 10.1126 / scienza.1091031
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Hokfelt, T., Kellerth, J. O., Nilsson, G., e Pernow, B. (1975). Studi immunoistochimici sperimentali sulla localizzazione e distribuzione della sostanza P nei neuroni sensoriali primari del gatto. Cervello Res. 100, 235-252. doi: 10.1016/0006-8993(75)90481-3
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Il suo nome deriva dal latino “Holtzman”, “D. M.”, “Kilbridge”, “J.”, “Li”, “Y”, “Cunningham”, ” E. T. Jr.”, “Lenn”, “N. J.”, “Clary”, “D. O.”, et al. (1995). Espressione di TrkA nel SNC: prove per l’esistenza di diversi nuovi neuroni del SNC sensibili al NGF. J. Neurosci. 15, 1567–1576.
Pubmed Abstract / Pubmed Testo completo
Hu, L., Cote, SL, e Cuello, A. C. (1997). Modulazione differenziale del fenotipo colinergico dei neuroni nucleo basalis magnocellularis applicando NGF al corpo cellulare o campi terminali corticali. Scad. Neurolo. 143, 162–171. doi: 10.1006 / exnr.1996.6357
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Huang, E. J., e Reichardt, L. F. (2003). Recettori Trk: ruoli nella trasduzione del segnale neuronale. Annu. Rev. Biochem. 72, 609–642. doi: 10.1146 / annurev.biochimica.72.121801.161629
Testo integrale CrossRef
Nel 1991 è stato pubblicato il primo album in studio della band. L’espressione di mRNA BDNF è aumentata in proencefalo adulto del ratto dopo le crisi limbiche: modelli temporali di induzione distinti da NGF. Neurone 6, 937-948. doi: 10.1016/0896-6273(91)90234-Q
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
It, T., Hioki, H., Nakamura, K., Tanaka, Y., Nakade, H., Kaneko,T., et al. (2007). I neuroni preganglionici simpatici contenenti acido gamma-aminobutirrico nel midollo spinale toracico del ratto inviano i loro assoni al ganglio cervicale superiore. J. Comp. Neurolo. 502, 113–125. doi: 10.1002 / cne.21309
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Nel 1998 è stato nominato membro del Consiglio di amministrazione. Riorganizzazione della mappa corticale abilitata dall’attività del nucleo basalis. Scienza 279, 1714-1718. doi: 10.1126 / scienza.279.5357.1714
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Kordower, J. H., Bartus, R. T., Bothwell, M., Schatteman, G., e Gash, D. M. (1988). Attività immunore del recettore del fattore di crescita nervoso nel primate non umano (Cebus apella): distribuzione, morfologia e colocalizzazione con enzimi colinergici. J. Comp. Neurolo. 277, 465–486. doi: 10.1002 / cne.902770402
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Il sito utilizza cookie tecnici e cookie di profilazione di terze parti. (1994). Il proencefalo basale della scimmia invecchiata: salvataggio e germogliamento dei neuroni basali del proencefalo axotomized dopo gli innesti delle cellule incapsulate che secernono il fattore di crescita del nervo umano. Proc. Natl. Acad. Sic. USA 91, 10898-10902. doi: 10.1073 / pnas.91.23.10898
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Korsching, S., Auburger, G., Heumann, R., Scott, J., e Thoenen, H. (1985). I livelli del fattore di crescita del nervo e del suo mRNA nel sistema nervoso centrale del ratto sono correlati all’innervazione colinergica. EMBO J. 4, 1389-1393.
Pubmed Abstract / Pubmed Testo completo
Il suo nome deriva dal latino”” (“”),”” (“”),”” (“”),”” (“”),”” (“”),”” (“”),”” (“”),”” (“”),””). Fattore di crescita del nervo: struttura, funzione e implicazioni terapeutiche per la malattia di Alzheimer. Curr. La droga prende di mira il neurolo del SNC. Disordine. 2, 315–334. doi: 10.2174/1568007033482724
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Grande, T. H., Bodary, SC, Clegg, D. O., Weskamp, G., Otten, U., e Reichardt, L. F. (1986). Espressione genica del fattore di crescita del nervo nel cervello di ratto in via di sviluppo. Scienza 234, 352-355. doi: 10.1126 / scienza.3764415
Testo integrale CrossRef
Lauterborn, J. C., Bizon, J. L., Tran, T. M., e Gall, C. M. (1995). L’mRNA NGF è espresso dai neuroni gabaergici ma non colinergici nel proencefalo basale del ratto. J. Comp. Neurolo. 360, 454–462. doi: 10.1002 / cne.903600307
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Lauterborn, J. C., Tran, T. M., Isackson, P. J., e Gall, C. M. (1993). Il fattore di crescita del nervo mRNA è espresso dai neuroni gabaergici nell’ippocampo di ratto. Neuroreport 5, 273-276. doi: 10.1097/00001756-199312000-00023
Testo integrale CrossRef
Lessmann, V., Gottmann, K., e Malcangio, M. (2003). Secrezione di neurotrofine: fatti attuali e prospettive future. Prog. Neurobiolo. 69, 341–374. doi: 10.1016/S0301-0082(03)00019-4
Pubmed Astratto | Pubmed Testo Completo | CrossRef Testo Completo
Li, Y., Holtzman, D. M., Kromer, L. F., Kaplan, D. R., Chua-Couzens, J., Clary, D. O.,et al. (1995). Regolazione dell’espressione di TrkA e ChAT nello sviluppo del proencefalo basale del ratto: prova che sia l’NGF esogeno che quello endogeno regolano la differenziazione dei neuroni colinergici. J. Neurosci. 15, 2888–2905.
Pubmed Abstract / Pubmed Testo completo
Maisonpierre, P. C., Belluscio, L., Friedman, B., Alderson, R. F., Wiegand, S. J., Furth,M. E., et al. (1990). NT-3, BDNF e NGF nel sistema nervoso del ratto in via di sviluppo: modelli di espressione paralleli e reciproci. Neurone 5, 501-509. doi: 10.1016 / 0896-6273(90)90089-X
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Markram, H., Toledo-Rodriguez, M., Wang, Y., Gupta, A., Silberberg, G., e Wu, C. (2004). Interneuroni del sistema inibitorio neocorticale. NAT. Rev. Neurosci. 5, 793–807. doi: 10.1038 | nrn1519
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Nel 2001 si trasferisce in Germania. Interneuroni non legati. NAT. Rev. Neurosci. 2, 11–23. doi: 10.1038/35049047
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Nel 1994 è stato pubblicato il primo album in studio della band. Profili immunoreattivi simili a fattori di crescita nervosa nel proencefalo basale del primate e nella formazione dell’ippocampo. J. Comp. Neurolo. 341, 507–519. doi: 10.1002 / cne.903410407
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Nel 1998 è stato pubblicato il primo album in studio del gruppo musicale statunitense. Espressione del fattore di crescita nervoso e degli MRNA di neurotrofina-3 negli interneuroni ippocampali: caratterizzazione morfologica, livelli di espressione e colocalizzazione del fattore di crescita nervoso e della neurotrofina-3. J. Comp. Neurolo. 395, 73–90. doi: 10.1002/(SICI)1096-9861(19980525)395:1<73::AIUTO-CNE6>3.0.CO; 2-E
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Pasteels, B., Miki, N., Hatakenaka, S., e Pochet, R. (1987). Immunoistochimica cross-reattività e comigration elettroforetica tra calbindin D-27 kDa e visinin. Cervello Res. 412, 107-113. doi: 10.1016/0006-8993(87)91444-2
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Patz, S., e Wahle, P. (2006). Cambiamenti dello sviluppo dell’espressione di mRNA neurotropina negli strati della corteccia visiva del ratto. EUR. J. Neurosci. 24, 2453–2460. doi: 10.1111 / j. 1460-9568. 2006.05126.x
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Pitts, A. F., e Miller, M. W. (2000). Espressione del fattore di crescita del nervo, del fattore neurotrofico derivato dal cervello e della neurotrofina-3 nella corteccia somatosensoriale del ratto maturo: coespressione con recettori neurotrofici ad alta affinità. J. Comp. Neurolo. 418, 241–254. doi: 10.1002/(SICI)1096-9861(20000313)418:3<241::AIUTO-CNE1>3.0.CO;2-M
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Prakash, N., Cohen-Cory, S., e Frostig, RD (1996). Effetti RAPIDI e opposti di BDNF e NGF sull’organizzazione funzionale della corteccia adulta in vivo. Natura 381, 702-706. doi: 10.1038 | 381702a0
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Prakash, N., Cohen-Cory, S., Penschuck, S., e Frostig, RD (2004). Il sistema colinergico basale del proencefalo è coinvolto nella plasticità indotta dal fattore di crescita nervoso rapido (NGF) nella corteccia del barilotto dei ratti adulti. J. Neurofisiolo. 91, 424–437. doi: 10.1152 / gv.00489.2003
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Ribak, E. V., Vaughn, J. E., e Saito, K. (1978). Localizzazione immunocitochimica della decarbossilasi dell’acido glutammico in somata neuronale a seguito dell’inibizione della colchicina del trasporto assonale. Cervello Res. 140, 315-332. doi: 10.1016/0006-8993(78)90463-8
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Rossi, F. M., Sala, R., e Maffei, L. (2002). Espressione dei recettori del fattore di crescita nervoso TrkA e p75NTR nella corteccia visiva del ratto: sviluppo e regolazione da parte dell’input colinergico. J. Neurosci. 22, 912–919.
Pubmed Abstract / Pubmed Testo completo
Nel 1993 è stato pubblicato il primo album in studio del gruppo musicale statunitense Rylett. Sintesi e rilascio di acetilcolina a seguito di somministrazione intracerebrale continua di NGF in ratti Fischer-344 adulti e invecchiati. J. Neurosci. 13, 3956–3963.
Pubmed Abstract / Pubmed Testo completo
Schubert, P., Kreutzberg, GW, e Lux, HD (1972). Trasporto neuroplasmico nei dendriti: effetto della colchicina sulla morfologia e fisiologia dei motoneuroni nel gatto. Cervello Res. 47, 331-343. doi: 10.1016/0006-8993(72)90643-9
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Il suo nome deriva da quello di Reichardt, il Reichardt, il Reichardt, il Reichardt, il Reichardt. (1986). Studi sull’espressione del gene del fattore di crescita del nervo beta (NGF) nel sistema nervoso centrale: il livello e la distribuzione regionale dell’mRNA NGF suggeriscono che l’NGF funziona come fattore trofico per diverse popolazioni distinte di neuroni. Proc. Natl. Acad. Sic. Usa 83, 2714-2718. doi: 10.1073 / pnas.83.8.2714
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Nel 2001 è stato pubblicato il primo album in studio del gruppo. Segnalazione del fattore di crescita del nervo, neuroprotezione e riparazione neurale. Annu. Rev. Neurosci. 24, 1217–1281. doi: 10.1146 / annurev.neuro.24.1.1217
Testo integrale CrossRef
Nel 2005 è stato nominato presidente del Consiglio dei Ministri. Il ruolo delle neurotrofine nel mantenimento dei motoneuroni del midollo spinale e dei gangli della radice dorsale neuroni sensoriali propriocettivi. Int. J. Dev. Neurosci. 23, 613–620. doi: 10.1016 / j. ijdevneu.2005.07.002
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Tuszynski, M. H., Armstrong, D. M., e Gage, F. H. (1990). Perdita delle cellule basali del proencefalo dopo la transezione di fimbria / fornice. Cervello Res. 508, 241–248. doi: 10.1016 / 0006-8993 (90)90402-W
CrossRef Testo completo
Xiang, Z., Huguenard, J. R., e Prince, D. A. (1998). Commutazione colinergica all’interno di reti inibitorie neocorticali. Scienza 281, 985-988. doi: 10.1126 / scienza.281.5379.985
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Nel 2009 è stato pubblicato il primo album in studio del gruppo musicale statunitense Yazaki-Sugiyama, Y., Kang, S., Cateau, H., Fukai, T., e Hensch, T. K. (2009). Plasticità bidirezionale nei circuiti GABA a chiodatura rapida per esperienza visiva. Natura 462, 218-221. doi: 10.1038 / nature08485
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Zaborszky, L., Pang, K., Somogyi, J., Nadasdy, Z., e Kallo, I. (1999). Il sistema corticopetale del proencefalo basale rivisitato. Ann. N. Y. Acad. Sic. 877, 339–367. doi: 10.1111 / j. 1749-6632. 1999.tb09276.x
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Zhang, H. T., Li, L. Y., Zou, X. L., Canzone, X. B., Hu, Y. L., Feng,Z. T., et al. (2007). Distribuzione immunoistochimica di NGF, BDNF, NT-3 e NT-4 nei cervelli adulti di scimmie rhesus. J. Histochem. Cytochem. 55, 1–19. doi: 10.1369/jhc.6A6952.2006
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text