- Introduction
- Matériaux et méthodes
- Préparation tissulaire
- Immunohistochimie par fluorescence à double étiquette
- Caractérisation des anticorps
- Analyse confocale
- Contrôles d’anticorps
- Résultats
- Immunomarquage du NGF
- Co-localisation NGF et GABAergique
- Co-localisation du NGF et de la glutamatergie
- Discussion
- Déclaration de conflit d’intérêts
- Remerciements
- Matériel supplémentaire
Introduction
Le facteur de croissance nerveuse neurotrophine (NGF) est impliqué dans plusieurs processus critiques du système nerveux des mammifères en développement et matures, y compris l’innervation cible, la différenciation cellulaire et la survie neuronale (Large et al., 1986; Li et coll., 1995; Sofroniew et coll., 2001; Lad et coll., 2003). Dans le cerveau adulte, le NGF joue un rôle clé dans le maintien et la fonction du système cholinergique du cerveau antérieur basal (Lad et al., 2003). Les niveaux de NGF sont les plus élevés dans les zones recevant le plus grand nombre de projections cholinergiques du cerveau antérieur basal, à savoir l’hippocampe et le cortex (Korsching et al., 1985; Shelton et Reichardt, 1986), et les récepteurs du NGF dans le cortex sont en grande partie confinés aux projections corticopétales du cerveau antérieur basal (Kordower et al., 1988; Sofroniew et coll., 2001; Rossi et coll., 2002). La signalisation du facteur de croissance nerveuse maintient les projections corticopétales cholinergiques à l’âge adulte (Chen et al., 1997; Debeir et coll., 1999) et peuvent prévenir la dégénérescence de ces neurones suite à la transection de leurs axones (Hefti, 1986; Tuszynski et al., 1990; Kordower et coll., 1994). De plus, le NGF améliore la libération d’acétylcholine à partir des cultures du cerveau antérieur basal (Auld et al., 2001) et peuvent moduler la fonction cholinergique grâce au contrôle phénotypique du locus du gène cholinergique (Rylett et al., 1993; Hu et coll., 1997).
Le système cholinergique du cerveau antérieur basal influence l’apprentissage et la plasticité dépendante de l’expérience dans le cortex (Bakin et Weinberger, 1996; Kilgard et Merzenich, 1998; Conner et al., 2003, 2005), et la signalisation du NGF a été émise pour soutenir, et peut-être améliorer, l’apprentissage et la plasticité médiés par le cerveau antérieur basal. Par exemple, le blocage de la signalisation du NGF via des injections répétées d’anticorps NGF dans le cortex insulaire réduit l’innervation cholinergique locale et perturbe l’acquisition de deux processus qui dépendent de l’intégrité des intrants cholinergiques, l’aversion gustative conditionnée et l’apprentissage d’évitement inhibiteur (Gutierrez et al., 1997). Une étude récente de Conner et al. (2009) ont démontré que l’apprentissage spatial et la potentialisation à long terme de l’hippocampe (LTP) sont améliorés à la suite d’infusions de NGF dans le noyau septal, la principale source d’innervation cholinergique de l’hippocampe.
L’application focale de NGF peut également induire une expansion rapide de la représentation locale des moustaches dans le cortex du canon des rats. Ce processus dépend des projections cholinergiques du cerveau antérieur basal (Prakash et al., 1996, 2004), suggérant que la signalisation corticale du NGF peut stimuler une réorganisation fonctionnelle cholinergique-dépendante rapide. Ainsi, en plus de ses effets trophiques à long terme sur les cellules cholinergiques du cerveau antérieur basal, le NGF peut également participer au remodelage du circuit à court terme. Cette hypothèse de » double action » est étayée par l’existence de mécanismes de libération constitutifs et dépendants de l’activité du NGF (Blochl et Thoenen, 1995; Lessmann et al., 2003), potentiellement sous-jacents aux effets modulateurs trophiques à long terme et à court terme du FGN, respectivement. De plus, des voies de signalisation rétrogrades (à long terme) et locales (à court terme) ont été observées pour le NGF (Huang et Reichardt, 2003).
Des cellules exprimant le NGF ont été détectées dans le cortex, le cervelet, l’hippocampe, le thalamus, le striatum, le cerveau antérieur basal et le tronc cérébral (Gall et Isackson, 1989; Maisonpierre et al., 1990; Isackson et coll., 1991; Conner et Varon, 1992; Hayashi et coll., 1993; Mufson et coll., 1994; Zhang et coll., 2007). Bien que l’ARNm du NGF ait été observé dans les astrocytes et autres glies, la grande majorité du NGF cortical est produite par les neurones (Sofroniew et al., 2001). Les types spécifiques de neurones qui produisent du NGF dans le cortex ne sont cependant pas connus, et il a été démontré que les projections corticopétales cholinergiques innervent à la fois les neurones excitateurs et inhibiteurs du cortex (Zaborszky et al., 1999). Dans les régions extracorticales telles que l’hippocampe, le striatum et le cerveau antérieur basal, la production de NGF est principalement localisée dans les neurones inhibiteurs GABAergiques (Lauterborn et al., 1993, 1995; Pascual et coll., 1998; Bizon et coll., 1999). L’identification des cellules productrices de NGF dans le cortex est importante pour identifier les mécanismes potentiels sous-jacents à la modulation des entrées corticales cholinergiques et aux mécanismes de plasticité corticale. Dans la présente étude, nous identifions un sous-ensemble de cellules GABAergiques corticales comme la principale source de production de NGF dans le cortex adulte, avec une production relativement rare par les neurones glutamatergiques.
Matériaux et méthodes
Tous les sujets ont été traités conformément aux directives institutionnelles pour les soins aux animaux. En raison des faibles niveaux endogènes d’expression corticale du NGF qui interdisaient l’identification de sources spécifiques de type cellulaire de NGF dans des études précédentes, nous avons effectué des perfusions locales de colchicine pour inhiber la polymérisation des microtubules, bloquant ainsi le transport du NGF loin du corps cellulaire et entraînant une accumulation d’antigène NGF détectable dans le soma des cellules productrices (Schubert et al., 1972; Hokfelt et coll., 1975; Hanson et Edström, 1978; Conner et Varon, 1992). Des rapports antérieurs ont montré que le traitement à la colchicine augmente la détection du FGN à l’aide de techniques immunohistochimiques (Conner et Varon, 1992). De plus, des taux de colchicine similaires à ceux utilisés dans la présente étude n’induisent pas d’anomalies grossières de la distribution neuronale du membre de la famille des neurotrophines BDNF (Conner et al., 1997).
Préparation tissulaire
Huit rats Fischer 344 adultes (4 mâles, 4 femelles; Harlan Sprague Dawley) ont été anesthésiés avec 2 ml / kg d’un cocktail de kétamine à 25 mg / ml, de xylazine à 1,3 mg / ml et d’acépromazine à 0,25 mg / ml, et injectés avec 5.0 µl de colchicine (10 µg/µl dans l’aCSF) aux emplacements corticaux énumérés ci-dessous à raison de 0,5 µl/ min à l’aide d’une seringue Hamilton de 10 µl. Après la perfusion, l’aiguille est restée en place pendant quatre minutes pour permettre une diffusion adéquate vers les tissus environnants. Quatre animaux ont reçu des injections bilatérales dans le cortex moteur primaire (M1) à +1,2 mm antérieur (A / P) et ±2,5 mm latéral (M /L) à bregma. La moitié de la solution a été injectée à 1,6 mm sous la surface du cerveau (D / V) et le reste à 1,0 mm. Les quatre animaux restants ont tous reçu des injections unilatérales dans le cortex préfrontal (A / P: +3.0, M / L: + 0,5, D / V: -2,3 et -1,8), cortex temporal (A / P: -6,5, M /L: +5,0, D / V: -7,5 et -7,0) et cortex pariétal (A / P: -3,0, M /L: +5,0, D/V: -1,8 et -1,3). Après 48 h, les animaux ont été anesthésiés en profondeur et perfusés par voie transcardiale avec 250 ml de solution saline tamponnée au phosphate à froid (pH 7,4), suivie de 250 ml de paraformaldéhyde à froid à 2% + parabenzoquinone à 0,2% dans un tampon phosphate à 0,1 M. Des cerveaux ont été extraits, postfixés pendant 2 h dans le même fixateur et cryoprotégés dans du tampon phosphate 0,1 M contenant 30% de saccharose pendant au moins 72 h à 4°C. Des coupes coronaires (40 µm) ont été découpées sur un microtome glissant par congélation et stockées dans un cryoprotecteur (TCS) à 4 ° C jusqu’à un traitement ultérieur pour l’immunohistochimie.
Immunohistochimie par fluorescence à double étiquette
L’immunohistochimie séquentielle à double étiquette a été utilisée pour visualiser les neurones exprimant le NGF et les marqueurs cellulaires GABAergiques ou glutamatergiques. Les sections flottantes ont été lavées dans une solution saline tamponnée Tris (TBS), perméabilisées avec 0,25% de Triton X-100, puis le marquage non spécifique a été bloqué avec du sérum d’âne à 5%. Des coupes ont été incubées pendant 72 h à 4°C dans un anticorps anti-NGF de lapin (Conner et Varon, 1992) dilué au 1:1000 dans du SCT, 0,25% de Triton X-100 et 5% de sérum d’âne. Après l’incubation des anticorps primaires, des sections ont été incubées dans des IgG conjuguées à la biotine anti-lapin d’âne (1:200; Vector Laboratories, Burlingame, CA, USA). Une amplification du signal tyramide (TSA; PerkinElmer, Waltham, MA, USA) a été appliquée pour amplifier le signal NGF, après quoi des coupes ont été lavées dans du SCT et incubées dans de la streptavidine conjuguée Alexa Fluor 488 ou 594 (Invitrogen, Carlsbad, CA, USA) diluée 1: 200 pendant 3 h à 4 °C. Après un bref lavage, des coupes ont été incubées à la fois dans l’anti-glutamate décarboxylase de souris (GAD) 65 (GAD-6, AntibodyRegistry: AB_528264, 1:2000; Developmental Studies Hybridoma Bank, Iowa City, IA, USA) et dans l’anti-GAD67 de souris (AnitbodyRegistry: AB_2278725, 1:1500; Millipore, Temecula, CA, USA), ou dans l’anti-GAD67 de souris (AnitbodyRegistry: AB_2278725, 1:1500; Millipore, Temecula, CA, USA). parvalbumine (AntibodyRegistry: AB_2174013, 1:30000; Millipore, Temecula, CA, USA), anti-calbindine-D-28K de souris (AntibodyRegistry: AB_476894, 1:1500; Sigma-Aldrich, St. Louis, MO, USA) ou protéine kinase IIa dépendante de Ca2+/calmoduline de souris (CaMKIIa, AntibodyRegistre: AB_2067919,1:1500; Millipore) pendant 72 h à 4°C. Enfin, les coupes ont été lavées, incubées dans Alexa Fluor 594 ou 488 – conjugué anti-souris d’âne (Invitrogen) pendant 3 h à température ambiante, lavées à nouveau, montées sur des lames de verre, et recouvertes de Fluoromount-G (Southern Biotech, Birminghan, AL, USA). Afin de maximiser l’identification des cellules GABAergiques, les anticorps GAD65 et GAD67 ont été co-incubés. Un sous-ensemble de sections a été recouvert d’or prolongé avec du DAPI (Invitrogen) pour la visualisation des noyaux cellulaires.
Caractérisation des anticorps
L’anticorps NGF utilisé dans cette étude est un polyclonal purifié par affinité élevé chez le lapin contre du NGF purifié chez la souris (Conner et Varon, 1992). L’anticorps reconnaît la souris purifiée et le NGF humain recombinant, mais ne réagit pas avec le BDNF recombinant ou le NT-3 (Conner et Varon, 1996). De plus, le profil immunoréactif de l’expression du NGF dans le cerveau du rat correspond étroitement à celui obtenu à partir de l’analyse in situ dans le cerveau du rat (Conner et Varon, 1997).
L’anticorps monoclonal GAD-65 (Banque d’hybridomes des études de développement, Gad-6) a été produit en immunisant des souris avec une immunoaffinité de la protéine GAD purifiée du cerveau de rat. L’analyse par Western blot des homogénats du cerveau de rat a révélé que l’anticorps reconnaît sélectivement GAD-65 mais pas GAD-67 (Chang et Gottlieb, 1988). Des études supplémentaires ont montré que l’anticorps GAD-6 reconnaît un épitope situé entre les acides aminés 475-571 de l’extrémité C de GAD-65 (Butler et al., 1993).
La souris GAD-67 monoclonale (Millipore, MAB 5406, lot: 25010139) a été élevé contre les résidus d’acides aminés 4-101 du GAD-67 humain, et reconnaît une seule bande de 67 kDa sur l’analyse de Western blot du cerveau de rat (informations techniques du fabricant). La préincubation de l’anticorps avec une protéine de fusion GST-GAD-67 n’a entraîné aucun signal immunopositif dans le cerveau (Ito et al., 2007).
L’anti-CaMKIIa monoclonal de souris (Millipore, MAB 8699, lot: LV1366080) reconnaît spécifiquement la sous-unité alpha de la protéine kinase II dépendante du calcium / calmoduline. L’analyse par Western blot démontre que l’anticorps identifie une seule bande de 50 kDa et reconnaît les formes phosphorylées et non phosphorylées (Erondu et Kennedy, 1985).
L’anti-calbindine-D-28k monoclonal (Sigma–Aldrich, C9848, lot: 088k4799) est dérivé de souris BALB / c immunisées avec de la calbindine-D-28k de rein bovin purifié. L’immunoblotting a montré que l’anticorps reconnaît une bande de 28 kDa et ne réagit pas avec des molécules similaires, telles que la calbindine-D-9K, la calrétinine, la chaîne légère de myosine, et parvalbumine (informations techniques du fabricant). Il a été démontré que la préabsorption avec une protéine calbindine-D-27 kDa purifiée à partir de cerveaux de poussin et de rat éliminait l’immunocoloration de la calbindine dans le cerveau (Pasteels et al., 1987).
L’anti-parvalbumine (Millipore, MAB 1572, lot: LV1378387) a été collectée sur des souris immunisées contre la parvalbumine purifiée à partir de muscle de grenouille. L’anticorps monoclonal est dirigé contre un épitope au premier site de liaison au Ca2+ et l’analyse immunoblot démontre qu’il reconnaît une protéine cérébrale de 12 kDa (informations techniques du fabricant).
Analyse confocale
Les images ont été capturées à l’aide d’un Olympus AX70 avec le logiciel Magnafire (version 2.0; Karl Storz Imaging, Goleta, CA, USA). Étant donné que le marquage du NGF a été réduit sensiblement d’environ 2 mm avant / arrière aux sites d’injection de colchicine, probablement en raison d’un manque de diffusion de la colchicine et de l’absence d’accumulation somatique de NGF qui en résulte, seules les sections situées à moins de 1,5 mm de chaque site d’injection de colchicine ont été analysées. Chaque 10ème section (400 µm) a été examinée dans une région corticale. Les cellules ont été comptées manuellement et au moins trois sections ont été analysées dans chaque région corticale et combinaison d’anticorps par sujet. Seuls trois animaux ont été évalués dans la région temporelle en raison de l’étiquetage indétectable du NGF dans le quatrième. Les cellules à marquage simple et double ont été quantifiées à l’aide d’images à canal simple et double. Plusieurs critères ont été utilisés pour identifier les cellules marquées, notamment la taille, la morphologie, le signal par rapport à l’arrière-plan et le marquage DAPI coïncidant lors de l’évaluation du tissu coloré en DAPI. Dans un sous-ensemble de sections, des piles z de 5 µm ont été collectées à l’aide d’un Olympus Fluoview FV1000 pour assurer la localisation neuronale de l’objet marqué. En raison de notre intérêt pour la proportion, et non le nombre absolu, de cellules à double marquage, les méthodes stéréologiques n’ont pas été utilisées.
Le pourcentage de cellules à double marquage par groupe de cellules immunoréactives (IR) a été déterminé pour chaque champ d’image. L’erreur-type moyenne ± a été calculée pour chaque région corticale examinée. L’analyse unidirectionnelle de la variance (ANOVA) a été utilisée pour évaluer les différences entre les régions corticales. Le HSD de Fisher a été utilisé pour l’analyse post-hoc. Toutes les analyses statistiques ont été effectuées avec SPSS 15.0 pour Windows.
Contrôles d’anticorps
Les contrôles comprenaient l’omission d’anticorps primaires, l’omission d’anticorps secondaires et le remplacement de l’anticorps primaire par un anticorps non spécifique (IgG de lapin). Toutes les manipulations ont eu les effets escomptés et ont soutenu l’affirmation selon laquelle les cellules marquées représentent un véritable marquage antigénique par leurs anticorps correspondants.
Résultats
Immunomarquage du NGF
Un marquage distinct du NGF était visible dans un rayon de 1.5 mm des sites d’injection corticale de colchicine. Dans ces zones, l’étiquetage du NGF était principalement limité aux somata cellulaires (figure 1). Rarement, un ou plusieurs processus cellulaires pourraient également être distingués. En dehors de ce rayon de 1,5 mm, le marquage du NGF était pratiquement indétectable dans le cortex. Comme l’expression corticale des récepteurs du NGF TrkA et p75 est confinée aux fibres corticopétales cholinergiques, le marquage observé du NGF est peu susceptible de refléter le NGF endocyté, mais indique plutôt des cellules productrices de NGF (Holtzman et al., 1995; Rossi et coll., 2002; Stephens et coll., 2005). Comme indiqué précédemment (Ribak et al., 1978), le traitement à la colchicine a intensifié le marquage du GAD dans les corps cellulaires ainsi que dans les processus neuronaux. La colchicine n’a eu aucun effet détectable sur l’étiquetage de la parvalbumine, de la calbindine ou de la CaMKIIa.
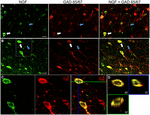
FIGURE 1. Le facteur de croissance nerveuse se colocalise largement avec des marqueurs cellulaires inhibiteurs. Cellules immunoréactives dans le cortex moteur primaire (A) et le cortex préfrontal (B). Les images montrent que les cellules marquées au NGF (en vert) se colocalisent largement avec les cellules marquées au GAD 65/67 (en rouge). Les flèches blanches montrent un exemple d’immunoréactivité cellulaire pour le NGF et le GAD 65/67 dans chaque région corticale. Les flèches bleues montrent les cellules immunoréactives pour GAD 65/67 uniquement. (C) Image agrandie de la zone à l’intérieur de la boîte blanche en (B). (D) Reconstruction X–Y–Z de la cellule à double marquage indiquée en (C). Les lignes vertes et bleues indiquent les niveaux de dissection dans les plans XZ et YZ, respectivement. Barres d’échelle = 25 µm.
Co-localisation NGF et GABAergique
Le facteur de croissance nerveuse est co-localisé de manière extensive avec les marqueurs cellulaires GABAergiques GAD65 et GAD67, quelle que soit la zone corticale examinée (Figure 1 ; tableau 1). Dans l’ensemble, 91 ± 0,9% des cellules corticales marquées au NGF ont également été marquées pour GAD65/67. Le pourcentage de cellules marquées au NGF exprimant co-GAD65/67 a montré peu de différence entre les cortex préfrontal (90,0 ± 1,5%), moteur (91,7 ± 1,5%), pariétal (89,6 ± 3,5%) et temporal (93,4 ± 8,1%) (ANOVA unidirectionnelle; p = 0,78). Inversement, le NGF co-localisé avec seulement 55 ± 2.3% de toutes les cellules marquées GAD65/67. Pour déterminer si la production de NGF était limitée à un sous-type spécifique de neurone GABAergique, nous avons co-marqué le tissu pour le NGF et la parvalbumine ou la calbindine (Figure 2). On a observé que les cellules marquées au NGF se colocalisent avec les deux marqueurs. Cependant, la colocalisation du NGF avec la parvalbumine (67,8 ± 3,6 %) était supérieure de plus de 2 × à celle avec la calbindine (29,1 ± 3,9 %). De plus, les cellules NGF-IR constituaient moins de la moitié de toutes les cellules immunoréactives de parvalbumine (47,7 ± 4,6%) et de calbindine (25,7 ± 4,9 %).

FIGURE 2. Le NGF est étiqueté avec des marqueurs de sous-classe de neurones inhibiteurs. Des tranches du cortex moteur ont été marquées pour le NGF et la parvalbumine ou la calbindine. (A) Les cellules ont montré un chevauchement important du marquage du NGF et de la parvalbumine (flèches blanches). B) À l’inverse, l’étiquetage du NGF et de la calbindine était moins fréquent. Barres d’échelle = 25 µm.

TABLEAU 1. Cellules immunoréactives NGF et GAD65/67 par région corticale.
Des neurones exprimant le facteur de croissance nerveuse ont été observés dans toutes les couches corticales. Des études antérieures ont signalé une distribution inégale des neurones marqués au NGF dans les lamelles corticales (Pitts et Miller, 2000; Patz et Wahle, 2006). L’analyse quantitative par couche n’a cependant pas été réalisée dans la présente étude, car l’intensité du marquage du NGF diminuait avec l’augmentation de la distance du site d’injection de colchicine.
Co-localisation du NGF et de la glutamatergie
Le marquage de la CaMKIIa a été principalement observé dans les somates cellulaires et les processus proximaux (Figure 3). Contrairement à la co-localisation étendue observée avec les marqueurs NGF et GABAergiques, les cellules marquées au NGF sont rarement co-localisées avec les cellules marquées au CaMKIIa (Figure 3; Tableau 2). Au total, 4,9 ± 1,1% des cellules immunoréactives du NGF ont été co-marquées avec des anticorps CaMKIIa. La co-localisation différait significativement selon la région corticale (ANOVA unidirectionnelle; p = 0,03); Le post hoc de Fisher a révélé que le cortex préfrontal avait une plus grande proportion de cellules NGF double-marquées (7,6 ± 2,1%) par rapport au cortex moteur primaire (2,4 ± 1,0%; p = 0,02) et au cortex pariétal (2,9% ± 1,5; p = 0,01).

FIGURE 3. Le facteur de croissance nerveuse se colocalise de manière minimale avec le marqueur cellulaire excitateur CaMKIIa. Cellules immunoréactives dans le cortex préfrontal. Les cellules ont rarement été étiquetées pour le NGF (vert) et le CaMKIIa (rouge), quelle que soit la région corticale examinée. Les flèches d’or montrent un exemple d’immunoréactif cellulaire pour le NGF uniquement. Barres d’échelle = 25 µm.

TABLEAU 2. Cellules immunoréactives NGF et CaMKIIa par région corticale.
Les cellules immunoréactives pour la CaMKIIa sont beaucoup plus nombreuses que celles marquées par les anticorps NGF. La proportion globale de cellules marquées par CaMKIIa exprimant simultanément le signal NGF était de 2 ± 0,6%. Ce pourcentage différait significativement selon la région (ANOVA unidirectionnelle p = 0,003), le cortex préfrontal présentant une plus grande proportion de cellules NGF/ CaMKIIa à double marquage (3,7 ± 1,1%) que le cortex moteur primaire (0,8 % ± 0,3; p = 0,001), le cortex pariétal (1,4% ± 0,6; p = 0,01) et le cortex temporal (1,5 ± 0,6%; p = 0,01).
Discussion
La présente étude démontre que la grande majorité (> 90%) des neurones du cortex produisant du NGF sont GABAergiques, tandis que la moitié de tous les neurones GABAergiques colocalisent avec le NGF. En revanche, les marqueurs des neurones excitateurs ne présentent qu’une co-localisation rare avec le NGF. Ces résultats étaient cohérents dans plusieurs régions corticales analysées dans cette étude, indiquant que le NGF est principalement produit par des interneurones inhibiteurs dans le néocortex du rat.
Bien que l’immunoréactivité au NGF coïncide rarement avec des marqueurs cellulaires excitateurs (CAMKIIa), un faible pourcentage (~ 5 %) était positif pour la CaMKIIa dans toutes les régions corticales examinées. L’analyse confocale a confirmé que ce double marquage provenait du même plan focal et n’était pas dû à un signal discret provenant de cellules qui se chevauchent. La signification fonctionnelle de l’expression du NGF dans une si petite fraction de cellules excitatrices n’est pas connue, mais il est possible que ces neurones producteurs de NGF représentent une sous-classe de neurones excitateurs précédemment non identifiée dans le néocortex.
Nos résultats sont cohérents avec les résultats d’études antérieures dans d’autres régions du cerveau démontrant que le NGF se co-localise presque exclusivement avec les cellules GABAergiques du striatum, du cerveau antérieur basal et de l’hippocampe (Lauterborn et al., 1993, 1995; Pascual et coll., 1998; Bizon et coll., 1999). Ainsi, la production de NGF par les cellules GABAergiques peut être une propriété générale de toutes les cibles recevant l’innervation cholinergique du cerveau antérieur basal (y compris le cerveau antérieur basal lui-même). Ces populations neuronales cholinergiques ont besoin de NGF pour maintenir leur phénotype et leurs projections (Rylett et al., 1993; Chen et coll., 1997; Hu et coll., 1997; Debeir et coll., 1999). À travers les études, les interneurones inhibiteurs apparaissent maintenant comme la principale source de trophisme du NGF pour les neurones cholinergiques du cerveau antérieur basal.
Bien que les neurones cholinergiques du cerveau antérieur basal innervent à la fois des réseaux corticaux excitateurs et inhibiteurs (Zaborszky et al., 1999), la source du soutien trophique provient en grande majorité de la population inhibitrice, qui est connue pour jouer un rôle critique dans la médiation de la plasticité dans les circuits corticaux (Hensch et Stryker, 2004; Yazaki-Sugiyama et al., 2009; Donato et coll., 2013). La signalisation cholinergique semble contribuer à l’activation différentielle de diverses sous-populations inhibitrices, modulant ainsi l’équilibre excitateur-inhibiteur (Xiang et al., 1998; Froemke et coll., 2007). Le NGF peut ainsi servir de signal de rétroaction entre les réseaux inhibiteurs hautement plastiques et les entrées cholinergiques qui les activent. En effet, le NGF augmente la plasticité et l’apprentissage comportemental grâce à des mécanismes cholinergiques dépendants (Prakash et al., 1996, 2004; Gutierrez et coll., 1997; Conner et coll., 2009). Libération dépendante de l’activité du NGF (Blochl et Thoenen, 1995; Lessmann et al., 2003), associée à la capacité du NGF à augmenter l’activité cholinergique (Rylett et al., 1993; Hu et coll., 1997; Auld et coll., 2001), suggère que le NGF pourrait favoriser la réorganisation des circuits actifs via une fonction cholinergique améliorée.
De futures études tenteront d’identifier quelles sous-classes de neurones inhibiteurs expriment le NGF et comment cette expression influence précisément les circuits corticaux. À cette fin, nous avons pris des mesures préliminaires pour déterminer si le NGF était co-localisé avec deux marqueurs communs de neurones inhibiteurs, la parvalbumine (principalement associée aux cellules du panier et du lustre) et la calbindine (associée à de nombreux types de cellules inhibitrices; McBain et Fisahn, 2001; Markram et al., 2004). Nos résultats démontrent que le NGF a été principalement détecté dans les cellules immunoréactives à la parvalbumine, bien que de nombreuses cellules marquées par la parvalbumine n’aient pas co-exprimé le NGF. Il est important de noter que les cellules NGF-IR sont également colocalisées avec des cellules marquées à la calbindine, ce qui suggère que plus d’une sous-classe de neurone inhibiteur produit du NGF.
En résumé, dans le néocortex du rat, le NGF est principalement exprimé par les neurones inhibiteurs, une propriété qui semble être conservée à partir de zones cérébrales phylogénétiquement plus anciennes et qui peut se généraliser au cerveau dans son ensemble. Nos résultats suggèrent que les interneurones inhibiteurs corticaux jouent un rôle essentiel dans le maintien des neurones de projection cholinergiques du cerveau antérieur basal. Les interneurones gabaergiques peuvent ainsi favoriser la réorganisation corticale via une signalisation NGF régulée.
Déclaration de conflit d’intérêts
Les auteurs déclarent que la recherche a été menée en l’absence de relations commerciales ou financières pouvant être interprétées comme un conflit d’intérêts potentiel.
Remerciements
Financé par le NIH (AG10435), l’Administration des anciens combattants, l’Association Alzheimer et la Fondation de recherche médicale Dr. Miriam et Sheldon G. Adelson.
Matériel supplémentaire
Le matériel supplémentaire pour cet article peut être trouvé en ligne à l’adresse suivante:: http://www.frontiersin.org/journal/10.3389/fncel.2014.00220/abstract
Auld, D. S., Mennicken, F., et Quirion, R. (2001). Le facteur de croissance nerveuse induit rapidement une libération prolongée d’acétylcholine par les neurones basaux du cerveau antérieur en culture: différenciation entre les influences neuromodulatrices et neurotrophiques. J. Neurosci. 21, 3375–3382.
Résumé Pubmed / Texte intégral Pubmed
Bakin, J. S., et Weinberger, N. M. (1996). Induction d’une mémoire physiologique dans le cortex cérébral par stimulation du noyau basal. Proc. Natl. Acad. Sci. États-Unis 93, 11219-11224. doi: 10.1073/pnas.93.20.11219
CrossRef Texte intégral
Bizon, J. L., Lauterborn, J. C. et Gall, C. M. (1999). Les sous-populations d’interneurones striataux peuvent être distinguées sur la base de l’expression du facteur neurotrophique. J. Comp. Neurol. 408, 283–298. doi: 10.1002 / (SICI)1096-9861(19990531)408:2<283:: AID-CNE9 >3.0.CO;2-2
Résumé Pubmed / Texte Intégral Pubmed | Texte Intégral CrossRef
Blochl, A., et Thoenen, H. (1995). Caractérisation de la libération de facteurs de croissance nerveuse (NGF) par les neurones de l’hippocampe: preuve d’une voie régulée constitutive et non conventionnelle dépendante du sodium. EUR. J. Neurosci. 7, 1220–1228. doi: 10.1111/j.1460-9568.1995.tb01112.x
Résumé Pubmed / Texte Intégral Pubmed | Texte Intégral CrossRef
Butler, M. H., Solimena, M., Dirkx, R. Jr., Hayday, A. et De Camilli, P. (1993). Identification d’un épitope dominant de l’acide glutamique décarboxylase (GAD-65) reconnu par les autoanticorps dans le syndrome de l’homme raide. J. Exp. Med. 178, 2097–2106. doi: 10.1084/jem.178.6.2097
Résumé Pubmed / Texte Intégral Pubmed | Texte Intégral CrossRef
Chang, Y. C., et Gottlieb, D.I. (1988). Caractérisation des protéines purifiées par des anticorps monoclonaux à l’acide glutamique décarboxylase. J. Neurosci. 8, 2123–2130.
Chen, K. S., Nishimura, M. C., Armanini, M. P., Crowley, C., Spencer, S. D. et Phillips, H. S. (1997). La perturbation d’un seul allèle du gène du facteur de croissance nerveuse entraîne une atrophie des neurones cholinergiques du cerveau antérieur basal et des déficits de mémoire. J. Neurosci. 17, 7288–7296.
Résumé Pubmed / Texte intégral Pubmed
Conner, J. M., Chiba, A.A., et Tuszynski, M. H. (2005). Le système cholinergique basal du cerveau antérieur est essentiel à la plasticité corticale et à la récupération fonctionnelle après une lésion cérébrale. Neurone 46, 173-179. doi: 10.1016/j. neurone.2005.03.003
Résumé Pubmed / Texte Intégral Pubmed | Texte Intégral CrossRef
Conner, J. M., Culberson, A., Packowski, C., Chiba, A.A., et Tuszynski, M. H. (2003). Les lésions du système cholinergique du cerveau antérieur basal nuisent à l’acquisition des tâches et abolissent la plasticité corticale associée à l’apprentissage de la motricité. Neurone 38, 819-829. doi: 10.1016/S0896-6273(03)00288-5
Résumé Pubmed / Texte Intégral Pubmed | Texte Intégral CrossRef
Conner, J. M., Franks, K. M., Titterness, A. K., Russell, K., Merrill, D. A., Christie, B. R., et al. (2009). Le NGF est essentiel à la plasticité et à l’apprentissage de l’hippocampe. J. Neurosci. 29, 10883–10889. doi: 10.1523/JNEUROSCI.2594-09.2009
Résumé Pubmed / Texte Intégral Pubmed | Texte Intégral CrossRef
Conner, J. M., Lauterborn, J. C., Yan, Q., Gall, C. M. et Varon, S. (1997). Distribution of brain-derived neurotrophic factor (BDNF) protein and mRNA in the normal adult rat CNS: evidence for anterograde axonal transport. J. Neurosci. 17, 2295–2313.
Résumé Pubmed / Texte intégral Pubmed
Conner, J. M., et Varon, S. (1992). Distribution des neurones immunoréactifs de type facteur de croissance nerveuse dans le cerveau de rat adulte après un traitement à la colchicine. J. Comp. Neurol. 326, 347–362. doi: 10.1002/cne.903260304
Résumé Pubmed / Texte Intégral Pubmed | Texte Intégral CrossRef
Conner, J. M., et Varon, S. (1996). Caractérisation des anticorps dirigés contre le facteur de croissance nerveuse: variabilité dépendante du dosage de la réactivité croisée avec d’autres neurotrophines. J. Neurosci. Méthodes 65, 93-99. doi: 10.1016/0165-0270(95)00151-4
Résumé Pubmed / Texte Intégral Pubmed | Texte Intégral CrossRef
Conner, J. M., et Varon, S. (1997). Profil de développement de l’immunoréactivité au FGN dans le cerveau du rat: un rôle possible du NGF dans l’établissement de champs terminaux cholinergiques dans l’hippocampe et le cortex. Cerveau Res. Dev. Brain Res. 101, 67-79. doi: 10.1016/S0165-3806(97)00051-5
Résumé Pubmed / Texte Intégral Pubmed | Texte Intégral CrossRef
Debeir, T., Saragovi, H.U. et Cuello, A. C. (1999). Un antagoniste du TrkA mimétique du facteur de croissance nerveuse provoque le retrait des boutons cholinergiques corticaux chez le rat adulte. Proc. Natl. Acad. Sci. États-Unis 96, 4067-4072. doi: 10.1073/pnas.96.7.4067
Résumé Pubmed / Texte Intégral Pubmed | Texte Intégral CrossRef
Donato, F., Rompani, S. B. et Caroni, P. (2013). La plasticité du réseau de cellules de panier exprimant la parvalbumine induite par l’expérience régule l’apprentissage des adultes. Nature 504, 272-276. doi: 10.1038 / nature12866
Résumé Pubmed / Texte Intégral Pubmed | Texte Intégral CrossRef
Il s’agit de la première édition de la série. Distribution régionale de la protéine kinase Ca2+/calmoduline dépendante de type II dans le cerveau de rat. J. Neurosci. 5, 3270–3277.
Jean-Pierre, R. C., Merzenich, M. M., et Schreiner, C.E. (2007). Une trace de mémoire synaptique pour la plasticité du champ réceptif cortical. Nature 450, 425-429. doi: 10.1038 /nature06289
Résumé Pubmed / Texte Intégral Pubmed | Texte Intégral CrossRef
Gall, C. M., et Isackson, P. J. (1989). Les crises limbiques augmentent la production neuronale d’ARN messager pour le facteur de croissance nerveuse. Science 245, 758-761. doi: 10.1126 / science.2549634
CrossRef Texte intégral
Gutierrez, H., Miranda, M. I. et Bermudez-Rattoni, F. (1997). Troubles de l’apprentissage et désafférentation cholinergique après privation du facteur de croissance du nerf cortical. J. Neurosci. 17, 3796–3803.
Résumé Pubmed / Texte intégral Pubmed
Hanson, M., et Edström, A. (1978). Inhibiteurs de la mitose et transport axonal. Int. Rév. Cytol. Suppl. 373–402.
Il s’agit d’une espèce de plantes de la famille des » Poaceae « , sous-famille des » pooideae « , sous-famille des » Pooideae « , sous-famille des » Pooideae « , sous-famille des » Pooideae « , sous-famille des » Pooideae « , originaire d’Asie du Sud-Est. Expression du gène du facteur de croissance nerveuse (NGF) dans le système nerveux central du singe. Cerveau Rés. 618, 142-148. doi: 10.1016/0006-8993 (93) 90437-R
CrossRef Texte intégral
Hefti, F. (1986). Le facteur de croissance nerveuse favorise la survie des neurones cholinergiques septaux après les transections fimbriales. J. Neurosci. 6, 2155–2162.
Il s’agit de la première édition de la série. Architecture colonnaire sculptée par des circuits GABA dans le développement du cortex visuel du chat. Science 303, 1678-1681. doi: 10.1126 / science.1091031
Résumé Pubmed / Texte Intégral Pubmed | Texte Intégral CrossRef
Il s’agit d’une espèce de plantes de la famille des » Poaceae « , sous-famille des » pooideae « , sous-famille des » pooideae « , originaire d’Asie du Sud-Est. Études immunohistochimiques expérimentales sur la localisation et la distribution de la substance P dans les neurones sensoriels primaires du chat. Brain Res. 100, 235-252. doi: 10.1016/0006-8993(75)90481-3
Résumé Pubmed / Texte Intégral Pubmed | Texte Intégral CrossRef
Holtzman, D. M., Kilbridge, J., Li, Y., Cunningham, E. T. Jr., Lenn, N. J., Clary, D. O., et al. (1995). Expression de TrkA dans le SNC: preuve de l’existence de plusieurs nouveaux neurones du SNC sensibles au NGF. J. Neurosci. 15, 1567–1576.
Résumé Pubmed / Texte intégral Pubmed
Hu, L., Cote, S.L., et Cuello, A.C. (1997). Modulation différentielle du phénotype cholinergique des neurones du noyau basalis magnocellulaire par application de NGF au niveau du corps cellulaire ou des champs terminaux corticaux. Exp. Neurol. 143, 162–171. doi: 10.1006/exnr.1996.6357
Résumé Pubmed / Texte Intégral Pubmed | Texte Intégral CrossRef
Il s’agit de la première édition de la série. Récepteurs Trk: rôles dans la transduction du signal neuronal. Annu. Rév. Biochem. 72, 609–642. doi: 10.1146/annurev.biochem.72.121801.161629
CrossRef Texte intégral
Il s’agit de l’un des principaux facteurs de risque de la maladie. L’expression de l’ARNm du BDNF est augmentée dans le cerveau antérieur du rat adulte après des crises limbiques: modèles temporels d’induction distincts du NGF. Neurone 6, 937-948. doi: 10.1016/0896-6273 (91) 90234-Q
Résumé Pubmed / Texte Intégral Pubmed | Texte intégral CrossRef
Ito, T., Hioki, H., Nakamura, K., Tanaka, Y., Nakade, H., Kaneko, T., et al. (2007). Les neurones préganglionnaires sympathiques contenant de l’acide gamma-aminobutyrique dans la moelle épinière thoracique du rat envoient leurs axones au ganglion cervical supérieur. J. Comp. Neurol. 502, 113–125. doi: 10.1002/cne.21309
Résumé Pubmed / Texte Intégral Pubmed | Texte Intégral CrossRef
Il s’agit de la première édition de la série. Réorganisation de la carte corticale permise par l’activité du noyau basal. Science 279, 1714-1718. doi: 10.1126 / science.279.5357.1714
Résumé Pubmed / Texte Intégral Pubmed | Texte Intégral CrossRef
Kordower, J. H., Bartus, R. T., Bothwell, M., Schatteman, G. et Gash, D. M. (1988). Activité immunore du récepteur du facteur de croissance nerveuse chez le primate non humain (Cebus apella): distribution, morphologie et colocalisation avec des enzymes cholinergiques. J. Comp. Neurol. 277, 465–486. doi: 10.1002/cne.902770402
Résumé Pubmed / Texte Intégral Pubmed | Texte Intégral CrossRef
Kordower, J. H., Winn, S. R., Liu, Y. T., Mufson, E. J., Sladek, J. R. Jr., Hammang, J. P., et al. (1994). Le cerveau antérieur basal du singe âgé: sauvetage et germination des neurones basaux axotomisés du cerveau antérieur après greffes de cellules encapsulées sécrétant un facteur de croissance nerveux humain. Proc. Natl. Acad. Sci. États-Unis 91, 10898-10902. doi: 10.1073/pnas.91.23.10898
Résumé Pubmed / Texte Intégral Pubmed | Texte Intégral CrossRef
Korsching, S., Auberger, G., Heumann, R., Scott, J. et Thoenen, H. (1985). Les niveaux de facteur de croissance nerveuse et de son ARNm dans le système nerveux central du rat sont en corrélation avec l’innervation cholinergique. EMBO J. 4, 1389-1393.
Résumé Pubmed / Texte intégral Pubmed
Lad, S. P., Neet, K. E. et Mufson, E. J. (2003). Facteur de croissance nerveuse: structure, fonction et implications thérapeutiques pour la maladie d’Alzheimer. Curr. Le médicament cible le Neurol du SNC. Désarroi. 2, 315–334. doi: 10.2174/1568007033482724
Résumé Pubmed / Texte Intégral Pubmed | Texte Intégral CrossRef
Il s’agit de l’un des principaux ouvrages de référence de l’auteur. Expression du gène du facteur de croissance nerveuse dans le cerveau de rat en développement. Science 234, 352-355. doi: 10.1126/ science.3764415
CrossRef Texte intégral
Lauterborn, J. C., Bizon, J. L., Tran, T. M. et Gall, C. M. (1995). L’ARNm du NGF est exprimé par les neurones GABAergiques mais pas cholinergiques du cerveau antérieur basal du rat. J. Comp. Neurol. 360, 454–462. doi: 10.1002/cne.903600307
Résumé Pubmed / Texte Intégral Pubmed | Texte Intégral CrossRef
Lauterborn, J. C., Tran, T. M., Isackson, P. J. et Gall, C. M. (1993). L’ARNm du facteur de croissance nerveuse est exprimé par les neurones GABAergiques dans l’hippocampe du rat. Neuroreport 5, 273-276. doi: 10.1097/00001756-199312000-00023
CrossRef Texte Intégral
Lessmann, V., Gottmann, K. et Malcangio, M. (2003). Sécrétion de neurotrophine: faits actuels et perspectives d’avenir. Prog. Neurobiol. 69, 341–374. doi: 10.1016/S0301-0082(03)00019-4
Résumé Pubmed / Texte Intégral Pubmed | Texte Intégral CrossRef
Li, Y., Holtzman, D. M., Kromer, L. F., Kaplan, D. R., Chua-Couzens, J., Clary, D. O., et al. (1995). Régulation de l’expression du TrkA et du ChAT dans le développement du cerveau antérieur basal du rat: preuve que le NGF exogène et endogène régule la différenciation des neurones cholinergiques. J. Neurosci. 15, 2888–2905.
Résumé Pubmed / Texte intégral Pubmed
Maisonpierre, P. C., Belluscio, L., Friedman, B., Alderson, R. F., Wiegand, S. J., Furth, M. E., et al. (1990). NT-3, BDNF et NGF dans le système nerveux du rat en développement: modèles d’expression parallèles et réciproques. Neurone 5, 501-509. doi: 10.1016/0896-6273 (90) 90089-X
Résumé Pubmed / Texte Intégral Pubmed | Texte Intégral CrossRef
Markram, H., Toledo-Rodriguez, M., Wang, Y., Gupta, A., Silberberg, G. et Wu, C. (2004). Interneurones du système inhibiteur néocortical. NAT. Rév. Neurosci. 5, 793–807. doi: 10.1038 / nrn1519
Résumé Pubmed / Texte Intégral Pubmed | Texte Intégral CrossRef
McBain, C. J., et Fisahn, A. (2001). Interneurones non liés. NAT. Rév. Neurosci. 2, 11–23. doi: 10.1038/35049047
Résumé Pubmed / Texte Intégral Pubmed | Texte Intégral CrossRef
Il s’agit de l’un des principaux ouvrages de référence de l’auteur. Profils immunoréactifs de type facteur de croissance nerveuse dans la formation du cerveau antérieur basal et de l’hippocampe du primate. J. Comp. Neurol. 341, 507–519. doi: 10.1002/cne.903410407
Résumé Pubmed / Texte Intégral Pubmed | Texte Intégral CrossRef
Pascual, M., Rocamora, N., Acsady, L., Freund, T. F., et Soriano, E. (1998). Expression du facteur de croissance nerveuse et des ARNM de la neurotrophine-3 dans les interneurones de l’hippocampe: caractérisation morphologique, niveaux d’expression et colocalisation du facteur de croissance nerveuse et de la neurotrophine-3. J. Comp. Neurol. 395, 73–90. doi: 10.1002 / (SICI)1096-9861(19980525)395:1<73:: AID-CNE6 >3.0.CO ;2-E
Résumé Pubmed / Texte Intégral Pubmed | Texte Intégral CrossRef
Pasteels, B., Miki, N., Hatakenaka, S. et Pochet, R. (1987). Réactivité croisée immunohistochimique et comigration électrophorétique entre la calbindine D-27 kDa et la visinine. Cerveau Res. 412, 107-113. doi: 10.1016/0006-8993(87)91444-2
Résumé Pubmed / Texte Intégral Pubmed | Texte Intégral CrossRef
Patz, S., et Wahle, P. (2006). Developmental changes of neurotrophin mRNA expression in the layers of rat visual cortex. EUR. J. Neurosci. 24, 2453–2460. doi: 10.1111/j.1460-9568.2006.05126.x
Résumé Pubmed / Texte Intégral Pubmed | Texte Intégral CrossRef
Il s’agit de la première édition de la série. Expression du facteur de croissance nerveuse, du facteur neurotrophique dérivé du cerveau et de la neurotrophine-3 dans le cortex somatosensoriel du rat mature: coexpression avec des récepteurs de neurotrophine de haute affinité. J. Comp. Neurol. 418, 241–254. doi: 10.1002 / (SICI)1096-9861(20000313)418:3<241:: AID-CNE1 >3.0.CO;2-M
Résumé Pubmed / Texte Intégral Pubmed | Texte Intégral CrossRef
Prakash, N., Cohen-Cory, S. et Frostig, R. D. (1996). Effets rapides et opposés du BDNF et du NGF sur l’organisation fonctionnelle du cortex adulte in vivo. Nature 381, 702-706. doi: 10.1038|381702a0
Résumé Pubmed / Texte Intégral Pubmed | Texte Intégral CrossRef
Prakash, N., Cohen-Cory, S., Penschuck, S. et Frostig, R. D. (2004). Le système cholinergique du cerveau antérieur basal est impliqué dans la plasticité induite par le facteur de croissance nerveuse rapide (NGF) dans le cortex du canon des rats adultes. J. Neurophysiol. 91, 424–437. doi: 10.1152/jn.00489.2003
Résumé Pubmed / Texte Intégral Pubmed | Texte Intégral CrossRef
Ribak, C. E., Vaughn, J. E. et Saito, K. (1978). Localisation immunocytochimique de l’acide glutamique décarboxylase dans les somates neuronales après inhibition du transport axonal par la colchicine. Brain Res. 140, 315-332. doi: 10.1016/0006-8993(78)90463-8
Résumé Pubmed / Texte Intégral Pubmed | Texte Intégral CrossRef
Il s’agit de la première édition de la série. Expression des récepteurs du facteur de croissance nerveuse TrkA et p75NTR dans le cortex visuel du rat: développement et régulation par l’entrée cholinergique. J. Neurosci. 22, 912–919.
Résumé Pubmed / Texte intégral Pubmed
Rylett, R. J., Goddard, S., Schmidt, B. M. et Williams, L. R. (1993). Synthèse et libération d’acétylcholine après administration intracérébrale continue de NGF chez des rats Fischer-344 adultes et âgés. J. Neurosci. 13, 3956–3963.
Résumé Pubmed / Texte intégral Pubmed
Schubert, P., Kreutzberg, G. W. et Lux, H. D. (1972). Transport neuroplasmique dans les dendrites: effet de la colchicine sur la morphologie et la physiologie des motoneurones chez le chat. Brain Res. 47, 331-343. doi: 10.1016/0006-8993(72)90643-9
Résumé Pubmed / Texte Intégral Pubmed | Texte Intégral CrossRef
Les deux parties sont les suivantes : (1986). Des études sur l’expression du gène du facteur de croissance du nerf bêta (NGF) dans le système nerveux central: le niveau et la distribution régionale de l’ARNm du NGF suggèrent que le NGF fonctionne comme un facteur trophique pour plusieurs populations distinctes de neurones. Proc. Natl. Acad. Sci. États-Unis 83, 2714-2718. doi: 10.1073/pnas.83.8.2714
Résumé Pubmed / Texte Intégral Pubmed | Texte Intégral CrossRef
Sofroniew, M. V., Howe, C.L. et Mobley, W. C. (2001). Signalisation du facteur de croissance nerveuse, neuroprotection et réparation neurale. Annu. Rév. Neurosci. 24, 1217–1281. doi: 10.1146/annurev.neuro.24.1.1217
CrossRef Texte intégral
Stephens, H. E., Belliveau, A. C., Gupta, J. S., Mirkovic, S. et Kablar, B. (2005). Le rôle des neurotrophines dans le maintien des motoneurones de la moelle épinière et des neurones sensoriels proprioceptifs des ganglions de la racine dorsale. Int. J. Dev. Neurosci. 23, 613–620. doi: 10.1016/ j. ijdevneu.2005.07.002
Résumé Pubmed / Texte Intégral Pubmed | Texte Intégral CrossRef
Tuszynski, M. H., Armstrong, D. M. et Gage, F. H. (1990). Perte de cellules du cerveau antérieur basal suite à la transection de fimbria/fornix. Cerveau Res. 508, 241–248. doi: 10.1016/0006-8993 (90) 90402-W
CrossRef Texte intégral
Xiang, Z., Huguenard, J. R., et Prince, D.A. (1998). Commutation cholinergique dans les réseaux inhibiteurs néocorticaux. Science 281, 985-988. doi: 10.1126 / science.281.5379.985
Résumé Pubmed / Texte Intégral Pubmed | Texte Intégral CrossRef
Yazaki-Sugiyama, Y., Kang, S., Cateau, H., Fukai, T. et Hensch, T. K. (2009). Plasticité bidirectionnelle dans les circuits GABA à pointes rapides par expérience visuelle. Nature 462, 218-221. doi: 10.1038 / nature08485
Résumé Pubmed / Texte Intégral Pubmed | Texte Intégral CrossRef
Zaborszky, L., Pang, K., Somogyi, J., Nadasdy, Z. et Kallo, I. (1999). Le système corticopétal basal du cerveau antérieur revisité. Ann. N. Y. Acad. Sci. 877, 339–367. doi: 10.1111/j.1749-6632.1999.tb09276.x
Résumé Pubmed / Texte Intégral Pubmed | Texte Intégral CrossRef
Zhang, H. T., Li, L. Y., Zou, X. L., Song, X. B., Hu, Y. L., Feng, Z. T., et al. (2007). Distribution immunohistochimique du NGF, du BDNF, du NT-3 et du NT-4 dans des cerveaux de singe rhésus adultes. J. Histochem. Cytochem. 55, 1–19. doi: 10.1369/jhc.6A6952.2006
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text