はじめに
ニューロトロフィン神経成長因子(NGF)は、標的神経支配、細胞分化および神経生存を含む、発達および成熟した哺乳類の神経系におけるいくつかの重要なプロセスに関与している(Large et al. 1986年;Li et al. ら、1 9 9 5;Sofroniew e t a l. ら、2 0 0 1;Lad e t a l., 2003). 成体の脳において、NGFは、基底前脳コリン作動系の維持および機能において重要な役割を果たす(Lad e t a l., 2003). NGFのレベルは、最も多くの基底前脳コリン作動性突起、すなわち海馬および皮質を受けている領域で最も高い(Korsching e t a l. ら、1 9 8 5;Shelton and Reichardt,1 9 8 6)、および皮質におけるNGFに対する受容体は、大部分が基底前脳皮質皮質突起に限定される(Kordower e t a l.,1 9 8 8;shelton and Reichardt,1 9 8 9)。 ら、1 9 8 8;Sofroniew e t a l. ら,2 0 0 1;Rossi e t a l., 2002). 神経成長因子シグナル伝達は、成人期にコリン作動性皮質頂突起を維持する(Chen e t a l. ら、1 9 9 7;Debeir e t a l. ら、1 9 9 9)、およびそれらの軸索の切断後のこれらのニューロンの変性を防止することができる(Hefti、1 9 8 6;Tuszynski e t a l. ら、1 9 9 0;Kordower e t a l., 1994). さらに、NGFは、基底前脳培養物からのアセチルコリンの放出を増強する(Auld e t a l. ら、2 0 0 1)およびコリン作動性遺伝子座の表現型制御を介してコリン作動性機能を調節することができる(Rylett e t a l.,2 0 0 1)。 ら、1 9 9 3;H Uら、1 9 9 4;H E t a l., 1997).
基底前脳コリン作動系は、皮質における学習および経験依存性可塑性に影響を及ぼす(Bakin and Weinberger,1996;Kilgard and Merzenich,1998;Conner et al.、2003、2005)、およびNGFシグナル伝達は、基礎前脳を介した学習および可塑性を支持し、おそらく強化すると仮定されている。 例えば、島皮質におけるNGF抗体の反復注射を介したNGFシグナル伝達の遮断は、局所コリン作動性神経支配を減少させ、コリン作動性入力の完全性、調節された味覚嫌悪および抑制的回避学習に依存する2つのプロセスの獲得を妨害する(Gutierrez e t a l., 1997). Conner et alによる最近の研究。 (2009)は、空間学習と海馬長期増強(LTP)の両方が、海馬へのコリン作動性神経支配の主要な源である中隔核へのNGFの注入後に強化されることを実証した。
Ngfの焦点適用はまた、ラットのバレル皮質における局所ウィスカー表現の急速な拡大を誘導することができる。 この過程は、基底前脳からのコリン作動性突起に依存する(Prakash e t a l.、1996、2004)、皮質NGFシグナル伝達は、急速なコリン作動性依存性機能再編成を刺激することができることを示唆している。 したがって、基礎前脳コリン作動性細胞に対するその長期的な栄養効果に加えて、NGFはまた、短期的な回路リモデリングに参加することができます。 この「二重作用」仮説は、NGFの構成的および活性依存的放出機構の存在によって支持される(Blochl and Thoenen,1 9 9 5;Lessmann e t a l.,2003),潜在的にNGFの長期栄養および短期調節効果の根底にある,それぞれ. さらに、逆行性(長期)および局所(短期)シグナル伝達経路の両方がNGFについて観察されている(Huang and Reichardt、2003)。
ngfを発現する細胞は、皮質、小脳、海馬、視床、線条体、基底前脳および脳幹において検出されている(Gall and Isackson,1989;Maisonpierre et al. ら,1 9 9 0;Isackson e t a l. ら、1 9 9 1;Conner and Varon,1 9 9 2;Hayashi e t a l. ら、1 9 9 3;Mufson e t a l. ら、1 9 9 4;Zhang e t a l., 2007). Ngf mRNAは、星状細胞および他のグリアで観察されていると報告されているが、大部分の皮質NGFは、神経細胞によって産生される(Sofroniew e t a l., 2001). しかし、皮質でNGFを産生する特定のタイプのニューロンは知られておらず、コリン作動性皮質頂部突起は、皮質の興奮性および抑制性ニューロンの両方を神経支配することが示されている(Zaborszky et al., 1999). 海馬、線条体および基底前脳のような皮質外領域では、NGF産生は、主にGaba作動性抑制性ニューロンに局在する(Lauterborn e t a l. ら,1 9 9 3,1 9 9 5;Pascualら,1 9 9 4,1 9 9 5;Pascualら, ら、1 9 9 8;Bizon e t a l., 1999). 皮質におけるNGF産生細胞の同定は、コリン作動性皮質入力の変調の基礎となる潜在的なメカニズム、および皮質可塑性のメカニズムを同定するため 現在の研究では、我々はグルタミン酸作動性ニューロンによる比較的まれな生産で、大人の皮質におけるNGF産生の主なソースとして皮質Gaba作動性細胞のサブセ
材料および方法
すべての被験者は、動物ケアのための制度的ガイドラインに従って治療された。 これまでの研究では、特定の細胞型ngf源の同定を禁止した皮質NGF発現の内因性レベルが低いため、我々は、微小管重合を阻害するために局所コルヒチン注入を行い、それによって細胞体からのNGF輸送を遮断し、産生細胞の相馬における検出可能なNGF抗原の蓄積をもたらす(Schubert et al. ら、1 9 7 2;Hokfelt e t a l. ることができると考えられている。 以前の報告は、コルヒチン治療が免疫組織化学的技術を用いたNGFの検出を増加させることを示している(Conner and Varon、1992)。 さらに、現在の研究で使用されたものと同様のコルヒチンレベルは、ニューロトロフィンファミリーのメンバー BDNFの神経分布における総異常を誘発しない(Conner et al., 1997).
組織調製
成人フィッシャー344ラット(男性4人、女性4人、Harlan Sprague Dawley)を2ml/kgの25mg/mlケタミン、1.3mg/mlキシラジン、0.25mg/mlアセプロマジンカクテルで麻酔し、510μ lのHamilton注射器を用いて、0.5μ l/分の速度で下記の皮質部位で0μ lのコルヒチン(aCSF中の10μ g/μ l)を投与した。 注入後、針は周囲の組織への適切な拡散を可能にするために四分間所定の位置にとどまった。 四つの動物は、ブレグマに+1.2ミリメートル前方(A/P)と±2.5ミリメートル横(M/L)で一次運動皮質(M1)の両側注射を受けました。 溶液の半分を脳の表面より1.6mm下(D/V)に注射し、残りを1.0mmで注射した。5.0、D/V:-7.5および-7.0)、および頭頂皮質(A/P:-3.0、M/L:+5.0、D/V:-1.8および-1.3)。 48時間後、動物を深く麻酔し、250mlの冷たいリン酸緩衝生理食塩水(pH7.4)で経心的に灌流し、続いて250mlの冷たい2%パラホルムアルデヒド+0.2%パラベンゾキノンを0.1Mリン酸緩衝液で灌流した。 脳を抽出し、同じ固定剤中で2時間後に固定し、0.1Mリン酸緩衝液中で30%ショ糖を少なくとも72時間4℃で凍結保護した。 コロナ切片(40μ m)は、凍結スライディングミクロトーム上で切断し、さらに免疫組織化学のために処理されるまで、4℃で凍結保護剤(TCS)に保存されました。
二重標識蛍光免疫組織化学
順次二重標識免疫組織化学は、NGFとGaba作動性またはグルタミン酸作動性細胞マーカーのいずれかを発現するニューロンを 遊離浮遊切片を、Tris緩衝生理食塩水(TBS)中で洗浄し、0.2 5%Triton X−1 0 0で透過処理し、次いで、非特異的標識を5%ロバ血清で遮断した。 切片を、ウサギ抗NGF抗体(Conner and Varon,1 9 9 2)中で4℃で7 2時間インキュベートし、TBS中で1:1 0 0 0に希釈し、0.2 5%Triton X−1 0 0、および5%ロバ血清を添加した。 一次抗体インキュベーションの後、切片をロバ抗ウサギビオチン結合Igg(1:2 0 0;Vector Laboratories,Burlingame,C A,USA)中でインキュベートした。 チラミドシグナル増幅(TSA;Perkinelmer,Waltham,M A,USA)を適用してNGFシグナルを増幅し、その後切片をTBS中で洗浄し、Alexa Fluor4 8 8または5 9 4−共役ストレプトアビジン(Invitrogen,Carlsbad,C A,USA)中で1:2 0 0 簡単な洗浄の後、切片を、マウス抗−グルタミン酸デカルボキシラーゼ(GAD)6 5(GAD−6,Antibodyregistry:A B_5 2 8 2 6 4,1:2 0 0 0;Developmental Studies H Ybridoma Bank,Iowa City,I A,USA)およびマウス抗−GAD6 7(Anitbodyregistry:A B_2 2 7 8 7 2 5,1:1 5 0 0;Millipore,Temecula,C A,USA)、またはマウス抗−parvalbumin(a B−6,Antibodyregistry:A B_2 2 7 8 7 2 5,1:1 5 0 0;Millipore,Temecula,C A,USA)Louis,MO,USA)、またはマウス抗CA2+/カルモジュリン依存性プロテインキナーゼIia(Camkiia,ANTIBODYREGISTRY:a B_2 1 7 4 0 1 3,1:3 0 0 0 0;MILLIPORE,TEMECULA,C A,Usa)、マウス抗CALBINDIN−D−2 8K(AntibodyRegistry:A B_4 7 6 8 9 4,1:1 5 0 0;SIGMA−Aldrich,St.、1:1500; 最後に、切片を洗浄し、Alexa Fluor5 9 4または4 8 8結合ロバ抗マウス(Invitrogen)中で室温で3時間インキュベートし、再び洗浄し、ガラススライド上に装着し、fluoromount−G(Southern Biotech,Birminghan,A L,USA)中 Gaba作動性細胞の同定を最大化するために、GAD6 5およびGAD6 7抗体を共インキュベートした。 切片のサブセットを、細胞核の可視化のためにDapi(Invitrogen)を用いてProlong Goldで被覆した。
抗体特性評価
本研究で使用されるNGF抗体は、精製されたマウスNGFに対するウサギで飼育された親和性精製ポリクローナルである(Conner and Varon,1992)。 抗体は、精製されたマウスおよび組換えヒトNGFを認識するが、組換えBDNFまたはNT−3と交差反応しない(Conner and Varon,1996)。 さらに、ラット脳におけるNGF発現の免疫反応性パターンは、ラット脳におけるin−situ分析から得られたものと密接に一致する(Conner and Varon,1 9 9 7)。
モノクローナル抗体GAD-65(Developmental Studies Hybridoma Bank,Gad-6)は、ラット脳から精製されたGADタンパク質免疫親和性でマウスを免疫することによって産生された。 ラット脳ホモジネートのウェスタンブロット分析により、抗体はGAD−6 5を選択的に認識するが、GAD−6 7は認識しないことが明らかになった(Chang and Gottlieb,1 9 8 8)。 さらなる研究により、GAD−6抗体は、gad−6 5のC末端のアミノ酸4 7 5〜5 7 1の間に位置するエピトープを認識することが示されている(Butler e t a l., 1993).
GAD-67マウスモノクローナル(Millipore,MAB5406,lot: 25010139)は、ヒトGAD-67のアミノ酸残基4-101に対して上昇し、ラット脳のウェスタンブロット分析上の単一の67-kDaバンドを認識した(製造業者の技術情報)。 抗体をGST−GAD−6 7融合タンパク質で前インキュベーションすると、脳内に免疫陽性シグナルは生じなかった(Ito e t a l., 2007).
マウスモノクローナル抗CaMKIIa(Millipore,MAB8699,lot:LV1366080)は、カルシウム/カルモジュリン依存性プロテインキナーゼIIのαサブユニットを特異的に認識する。 ウェスタンブロット分析は、抗体が50kDaの単一バンドを同定し、リン酸化形態と非リン酸化形態の両方を認識することを示す(Erondu and Kennedy、1985)。<3 8 8 5><6 4 7 2>モノクローナル抗calbindin−d−2 8k(Sigma−Aldrich,c9 8 4 8,lot:0 8 8k4 7 9 9)は、精製ウシ腎臓calbindin−d−2 8kで免疫したBALB/cマウス由来である。パルバルブミン(製造業者の技術情報)。 ニワトリおよびラットの脳から精製されたカルビンジン−D−2 7kDaタンパク質による前吸収は、脳内のカルビンジン免疫染色を排除することが示された(Pasteels e t a l., 1987).<3885><6472>抗パルバルブミン(Millipore,MAB1572,lot:LV1378387)をカエル筋肉から精製したパルバルブミンに対して免疫したマウスから採取した。 モノクローナル抗体は最初のCa2+結合部位のエピトープに対して指示され、immunoblotの分析は12kDaの頭脳蛋白質を確認することを示す(製造業者の技術情報)。<3 8 8 5><9 2 0 6>共焦点分析<3 1 5 3><6 4 7 2>画像は、Magnafireソフトウェアを用いたOlympus A X7 0(バージョン2.0;Kaarl Storz Imaging,Goleta,C A,USA)を用いて撮影した。 NGFラベリングは、おそらくコルヒチン拡散の欠如と体細胞NGF蓄積の結果の不在のために、コルヒチン注射部位に実質的に約2ミリメートル前後に減少 すべての10番目のセクション(400μ m)は、皮質領域内で調べた。 細胞を手動で計数し、少なくとも3つの切片を、各皮質領域および被験体当たりの抗体の組み合わせにおいて分析した。 第四の検出不可能なNGF標識のために、側頭領域で評価されたのは三つの動物のみであった。 単一および二重標識細胞を、単一チャネル画像および二重チャネル画像の両方を用いて定量した。 標識された細胞を同定するために、dapi染色組織を評価する際に、サイズ、形態、シグナル対背景、および一致するDAPI標識を含むいくつかの基準を使用した。 セクションのサブセットでは、5μ mのzスタックは、標識されたオブジェクトの神経局在を確実にするためにOlympus Fluoview FV1000を使用して収集されました。 二重標識された細胞の絶対数ではなく割合に関心があるため、立体法は使用されなかった。<3885><6472>免疫反応性(IR)細胞群あたりの二重標識細胞の割合を各画像フィールドについて決定した。 調べた各皮質領域について平均±標準誤差を計算した。 一方向分散分析(ANOVA)を使用して、皮質領域間の差を評価しました。 FisherのHSDを事後分析に使用した。 すべての統計分析は、SPSS15.0for Windowsを使用して実行しました。
抗体コントロール
コントロールには、一次抗体の省略、二次抗体の省略、および一次抗体の非特異的抗体(ウサギIgG)への置換が含まれていました。 すべての操作は期待される効果を有し、標識された細胞がそれらの対応する抗体によって真の抗原標識を表すという主張を支持した。
結果
NGF免疫標識
半径1以内に異なるNGF標識が見られた。コルヒチンの皮層の注入の場所からの5つのmm。 これらの領域では、NGF標識は主に細胞体に限定されていた(図1)。 まれに、一つ以上の細胞プロセスも区別することができます。 この1.5mmの半径の外で、NGFの分類は皮質で事実上検出不可能だった。 NGF受容体Trkaおよびp7 5の皮質発現はコリン作動性皮質繊維に限定されているので、観察されるngfの標識は、エンドサイトーシスされたNGFを反映することは ら、1 9 9 5;Rossi e t a l. ら,2 0 0 2;Shephensら,2 0 0 3., 2005). 以前に報告されたように(Ribak e t a l.,1978),コルヒチン治療は、細胞体だけでなく、神経プロセスにおけるGAD標識を強化しました. コルヒチンはパルバルブミン,カルビンジン,カムキイアの標識に対して検出可能な効果を示さなかった。
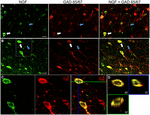
図1. 神経の成長因子は抑制的な細胞のマーカーと広く共局在します。 (A)一次運動野および(B)前頭前野における免疫反応性細胞。 画像は、NGF標識された細胞(緑色)がGAD6 5/6 7標識された細胞(赤色)と広範囲に共局在することを示す。 白い矢印は、各皮質領域におけるNGFおよびGAD6 5/6 7の両方についての免疫反応性の例の細胞を示す。 青い矢印は、GAD65/67のみの免疫反応性細胞を示しています。 (C)(B)のホワイトボックス内の領域を拡大した画像。 (D)(C)に示す二重標識細胞のX−Y−Z再構成。 緑と青の線は、それぞれXZとYZ平面の解剖レベルを示しています。 スケールバー=25μ m。
ngfとGaba作動性の共局在
神経成長因子は、調べた皮質領域にかかわらず、Gaba作動性細胞マーカー GAD65およびGAD67と広範囲に共局在した(図1;表1)。 全体として、NGF標識皮質細胞の91±0.9%もGAD65/67について標識した。 GAD65/67を同時発現するNGF標識細胞の割合は、前頭前野(90.0±1.5%)、モーター(91.7±1.5%)、頭頂(89.6±3.5%)および側頭(93.4±8.1%)皮質(一方向ANOVA;p=0.78)の間でほとんど差を示 逆に、NGFは55±2のみで共局在している。全てのGAD6 5/6 7標識細胞の3%。 NGF産生がGaba作動性ニューロンの特定のサブタイプに制限されていたかどうかを決定するために、我々はNGFとパルバルブミンまたはカルビジンのいずれかの組織を共標識した(図2)。 NGF標識された細胞は、両方のマーカーと共局在することが観察された。 しかし、パルバルブミン(67.8±3.6%)とNGF共局在化は、カルビンジン(29.1±3.9%)よりも2倍以上であった。 さらに、NGF-IR細胞は、すべてのパルバルブミン(47.7±4.6%)とカルビンジン(25.7±4.9%)免疫反応性細胞の半分未満を構成した。

図2. Ngfは阻害性ニューロサブクラスマーカーでコラベルした。 運動皮質のスライスは、NGFとパルバルブミンまたはカルビンジンのいずれかについて標識された。 (A)細胞は、NGFおよびパルバルブミン標識(白い矢印)の広範な重複を示した。 (B)逆に、NGFとカルビンジンのコラベリングはあまり一般的ではなかった。 スケールバー=25μ m。

表1. 皮質領域によるNGF-およびGAD65/67-免疫反応性細胞。
神経成長因子発現ニューロンは、すべての皮質層にわたって観察された。 これまでの研究では、皮質層におけるNGF標識ニューロンの不均一な分布が報告されている(Pitts and Miller、2000;Patz and Wahle、2006)。 しかし,ngf標識強度はコルヒチン注射部位からの距離の増加とともに減少するため,層による定量分析は現在の研究では行われなかった。
Ngfとグルタミン酸作動性の共局在
CaMKIIaのラベリングは、主に細胞体および近位プロセス内で観察された(図3)。 NGFおよびGaba作動性マーカーで見られる広範な共局在化とは異なり、NGF標識細胞はめったにCaMKIIa標識細胞と共局在化しない(図3;表2)。 合計で、NGF免疫反応性細胞の4.9±1.1%をCaMKIIa抗体と共標識した。 共局在は皮質領域によって有意に異なっていた(一方向ANOVA;p=0.03);フィッシャーのポストホックは、前頭前野が一次運動皮質(2.4±1.0%;p=0.02)と頭頂皮質(2.9%±1.5;p=0.01)と比較して二重標識NGF細胞(7.6±2.1%)の割合が高かったことを明らかにした。

図3. 神経成長因子は、興奮性細胞マーカー CaMKIIaと最小限に共局在する。 前頭前野の免疫反応性細胞。 細胞は、調べた皮質領域に関係なく、NGF(緑)とCaMKIIa(赤)のためにめったにcolabeledませんでした。 金の矢印は、NGFのみに対する免疫反応性の細胞の例を示す。 スケールバー=25μ m。

表2. Ngf-およびCaMKIIa-皮質領域による免疫反応性細胞。
CaMKIIaに対する免疫反応性細胞は、NGF抗体によって標識された細胞を大きく上回った。 同時にNGFシグナルを発現するCaMKIIa標識細胞の全体的な割合は2±0.6%であった。 この割合は、一次運動皮質(0.8%±0.3;p=0.001)、頭頂皮質(1.4%±0.6;p=0.01)、および側頭皮質(1.5±0.6%;p=0.01)よりも二重標識NGF/CaMKIIa細胞(3.7±1.1%)の大きな割合を示
考察
今回の研究では、皮質のNGF産生ニューロンの大部分(>90%)がGABAergicであり、全GABAergicニューロンの半分がngfと共局在することが示されている。 対照的に、興奮性ニューロンのマーカーは、NGFとの唯一のまれな共局在を示す。 これらの結果は、本研究で分析された複数の皮質領域全体で一貫しており、NGFは主にラット新皮質の抑制性介在ニューロンによって産生されることを示
NGF免疫反応性は興奮性細胞マーカー(CAMKIIa)とほとんど一致しなかったが、わずかな割合(-5%)は、すべての調べた皮質領域を通じてCaMKIIaの陽性であった。 共焦点解析により,この二重標識は同じ焦点面に由来し,重複する細胞から生じる離散的な信号によるものではないことが確認された。 知られていないが、それはこれらのNGF産生ニューロンは、新皮質における興奮性ニューロンの以前に未確認のサブクラスを表すことが可能である興奮性細胞のような小さな画分におけるNGF発現の機能的意義。
我々の結果は、NGFが線条体、基底前脳、海馬のGABAergic細胞とほぼ独占的に共局在することを示す他の脳領域における以前の研究の知見と一致している(Lauterborn et al. ら,1 9 9 3,1 9 9 5;Pascualら,1 9 9 4,1 9 9 5;Pascualら, ら、1 9 9 8;Bizon e t a l., 1999). したがって、Gaba作動性細胞によるNGF産生は、基底前脳コリン作動性神経支配(基底前脳自体を含む)を受けるすべての標的の一般的な特性であり得る。 これらのコリン作動性神経集団は、それらの表現型および予測の維持のためにNGFを必要とする(Rylett e t a l., 1993; Chen et al. ら、1 9 9 7;H Uら、1 9 9 8;H E t a l. ら、1 9 9 7;Debeir e t a l., 1999). 研究全体では、抑制性介在ニューロンは今基底前脳コリン作動性ニューロンのためのNGF栄養の主要なソースとして出てくる。
基底前脳コリン作動性ニューロンは興奮性および抑制性皮質ネットワークの両方を神経支配するが(Zaborszky et al. ることが知られている(Hensch and Stryker,2 0 0 4;Yazaki−Sugyama e t a l.,1 9 9 9)。 ら,2 0 0 9;Donatoら,2 0 0 9;Donatoら,, 2013). コリン作動性シグナル伝達は、様々な阻害性亜集団の差動活性化に寄与し、それによって興奮性-阻害性バランスを調節するように思われる(Xiang et al. ら、1 9 9 8;Froemke e t a l., 2007). NGFは、それによって、高度に塑性阻害ネットワークとそれらを活性化するコリン作動性入力との間のフィードバック信号として役立つ可能性がある。 実際、NGFは、コリン作動性依存機構を介して可塑性および行動学習を増強する(Prakash e t a l. 1996年2004年Gutierrez et al. ら、1 9 9 7;Konnerら、1 9 9 8;Konnerら、, 2009). NGFの活性依存性放出(Blochl and Thoenen,1 9 9 5;Lessmann e t a l. ら、2 0 0 3)、コリン作動性活性を増加させるNGFの能力と対になっている(Rylett e t a l. ら、1 9 9 3;H Uら、1 9 9 4;H E t a l. ら、1 9 9 7;Auldら、1 9 9 8;Auldら、1 9 9 9.,2001),NGFは、強化されたコリン作動性機能を介して活性回路の再編成を促進する可能性があることを示唆している。
今後の研究では、抑制性ニューロンのどのサブクラスがNGFを発現し、この発現が皮質回路にどのように正確に影響するかを同定しようとする。 この目的のために、我々は、ngfが阻害性ニューロンの二つの一般的なマーカー、パルバルブミン(主にバスケットとシャンデリア細胞に関連付けられている)、およ, 2004). 我々の結果は、パルバルブミンによって標識された多くの細胞がNGFを共発現しなかったが、NGFは、主にパルバルブミン免疫反応性細胞で検出されたこと 重要なことに、NGF-IR細胞はまた、阻害性ニューロンの複数のサブクラスがNGFを産生することを示唆し、カルビンジン標識細胞と共局在化しました。
要約すると、ラット新皮質内のNGFは主に抑制性ニューロンによって発現され、系統発生的に古い脳領域から保存され、脳全体に一般化する可能性があ これらの結果から,皮質抑制性介在ニューロンが基底前脳のコリン作動性投射ニューロンの維持に重要な役割を果たすことが示唆された。 Gaba作動性介在ニューロンは,調節されたNGFシグナル伝達を介して皮質再編成を促進する可能性がある。
利益相反声明
著者らは、この研究は利益相反の可能性があると解釈される可能性のある商業的または財政的関係がない場合に行われたと宣言
謝辞
NIH(AG10435)、退役軍人局、アルツハイマー協会、Dr.Miriam and Sheldon G.Adelson Medical Research Foundationによって資金提供されています。
補足資料
この記事の補足資料はオンラインで見つけることができます: http://www.frontiersin.org/journal/10.3389/fncel.2014.00220/abstract
とができることを明らかにした。 神経成長因子は、培養された基底前脳ニューロンからのアセチルコリン放出を迅速に誘導する:神経調節および神経栄養の影響との間の分化。 J.Neurosci. 21, 3375–3382.
Pubmed要約|Pubmed全文
およびWeinberger,Nm(1 9 9 6)。 基底核の刺激による大脳皮質における生理学的記憶の誘導。 プロク… ナトル アカド サイ… 93,11219-11224. ドイ:10.1073/pnas.93.20.11219
クロスリファレンス全文
ることができると考えられている。 線条体介在ニューロンの亜集団は、神経栄養因子発現に基づいて区別することができる。 J.Comp. ニューロール 408, 283–298. 土井:10.1002/(SICI)1096-9861(19990531)408:2<283::AID-CNE9>3.0.CO;2-2
Pubmed要約/Pubmed全文|CrossRef全文
ら(1 9 9 5)。 海馬ニューロンからの神経成長因子(NGF)放出の特徴:構成的および型破りなナトリウム依存性調節経路の証拠。 ユーロ J.Neurosci. 7, 1220–1228. doi:10.1111/j.1460-9568.1995.01112.x
Pubmed要約/Pubmed全文|CrossRef全文
Butler,M.H.,Solimena,M.,Dirkx,R.Jr.,Hayday,A.,And De Camilli,P.(1993). スティッフマン症候群における自己抗体によって認識されるグルタミン酸デカルボキシラーゼ(GAD-65)の支配的なエピトープの同定。 J.Exp. メッド 178, 2097–2106. ドイ:10.1084/jem.178.6.2097
Pubmed要約/Pubmed全文|CrossRef全文
ることができる。 グルタミン酸デカルボキシラーゼに対するモノクローナル抗体で精製したタンパク質のキャラクタリゼーション。 J.Neurosci. 8, 2123–2130.
Chen,K.S.,Nishimura,M.C.,Armanini,M.P.,Crowley,C.,Spencer,S.D.,And Phillips,H.S.(1997). 神経成長因子遺伝子の単一の対立遺伝子の破壊は、基底前脳コリン作動性ニューロンおよび記憶障害の萎縮をもたらす。 J.Neurosci. 17, 7288–7296.
Pubmed要約|Pubmed全文
ることができると考えられている。 基礎前脳コリン作動性システムは、脳損傷後の皮質可塑性および機能回復に不可欠である。 46件中173-179件を表示しています。 土井:10.1016/j.neuron.2005.03.003
Pubmed要約/Pubmed全文|CrossRef全文
コナー,J.M. ることができると考えられている。 基底前脳コリン作動性システムの病変は、タスクの獲得を損ない、運動技能学習に関連する皮質可塑性を廃止する。 38,819-829 ドイ:10.1016/S0896-6273(03)00288-5
Pubmed Abstract|Pubmed Full Text|CrossRef Full Text
Conner,J.M.,Franks,K.M.,Titterness,A.K.,Russell,K.,Merrill,D.A.,Christie,B.R.,et al. (2009). NGFは海馬の可塑性と学習に不可欠です。 J.Neurosci. 29, 10883–10889. 土井:10.1523/JNEUROSCI.2594-09.2009
Pubmed要約/Pubmed全文|CrossRef全文
ることができると考えられている(1 9 9 7年)。 正常成体ラットCNSにおける脳由来神経栄養因子(BDNF)タンパク質とmRNAの分布:順行性軸索輸送の証拠。 J.Neurosci. 17, 2295–2313.
Pubmed要約|Pubmed全文
およびVaron,S.(1 9 9 2)。 コルヒチン治療後の成体ラット脳における神経成長因子様免疫反応性ニューロンの分布。 J.Comp. ニューロール 326, 347–362. doi:10.1002/cne.903260304
Pubmed要約/Pubmed全文|CrossRef全文
およびVaron,S.(1 9 9 6)。 神経成長因子に対する抗体の特性評価:他のニューロトロフィンとの交差反応性のアッセイ依存性の変動。 J.Neurosci. 方法65、93-99。 土井: 10.1016/0165-0270(95)00151-4
Pubmed Abstract|Pubmed Full Text|CrossRef Full Text
およびVaron,S.(1 9 9 7)。 ラット脳におけるNGF免疫反応性の発達プロファイル: 海馬および皮質におけるコリン作動性末端野の確立におけるNGFの可能な役割。 ブレイン-レゾリューション 脳Res.101,67-79. doi:10.1016/S0165-3806(97)00051-5
Pubmed Abstract|Pubmed Full Text|CrossRef Full Text
ることができると考えられている。 神経成長因子模倣Trkaきっ抗薬は成体ラットにおける皮質コリン作動性ブートンの離脱を引き起こす。 プロク… ナトル アカド サイ… 米国96、4067-4072。 ドイ:10.1073/pnas.96.7.4067
Pubmed要約/Pubmed全文|CrossRef全文
ドナート、F.、ロンパニ、S.B.、およびCaroni、P.(2013)。 経験によって誘導されるパルバルブミン発現バスケット細胞ネットワーク可塑性は、成人の学習を調節する。 自然504、272-276。 doi:10.1038/nature12866
Pubmed要約/Pubmed全文|CrossRef全文
ることができる。 ラット脳におけるII型Ca2+/カルモジュリン依存性プロテインキナーゼの局所分布。 J.Neurosci. 5, 3270–3277.
フロムケ(R.C. ら、merzenich,M. 皮質受容野可塑性のためのシナプス記憶トレース。 自然450,425-429. doi:10.1038/nature06289
Pubmed要約/Pubmed全文|CrossRef全文
ることができる。 辺縁系発作は、神経成長因子のメッセンジャー RNAの神経産生を増加させる。 科学245、758-761。 土井:10.1126/科学。2549634
クロスリファレンス全文
とができるようになることを期待しています。 皮質神経成長因子欠乏症後の学習障害およびコリン作動性欠乏症。 J.Neurosci. 17, 3796–3803.
Pubmed要約|Pubmed全文
Hanson,M.,And Edström,A.(1978). 有糸分裂阻害剤および軸索輸送。 Int. レヴュー-シトールズィー(著) サップル 373–402.
1993年、林雅彦、山下和彦、清水公彦、曽川公彦、藤井洋一(1993年)。 サルの中枢神経系における神経成長因子(NGF)の遺伝子の発現。 脳Res.618,142-148. 土井:10.1016/0006-8993(93)90437-R
CrossRef全文
Hefti,F.(1986). 神経の成長因子はfimbrial切片の後で隔壁のコリン作動性ニューロンの存続を促進します。 J.Neurosci. 6, 2155–2162.
とができるようになった。 猫の視覚野を開発するGABA回路によって彫刻された柱状建築。 科学303、1678-1681。 土井:10.1126/科学。1091031
Pubmed要約/Pubmed全文|CrossRef全文
ることができると考えられています。 猫の一次感覚ニューロンにおけるサブスタンスPの局在と分布に関する実験的免疫組織化学的研究。 脳Res.100,235-252. 土井: 10.1016/0006-8993(75)90481-3
Pubmed Abstract|Pubmed Full Text|CrossRef Full Text
Holtzman,D.M.,Kilbridge,J.,Li,Y.,Cunningham,E.T.Jr.,Lenn,N.J.,Clary,D.O.,et al. (1995). CNSにおけるTRKA発現:いくつかの新規NGF応答性CNSニューロンの存在の証拠。 J.Neurosci. 15, 1567–1576.
Pubmed要約|Pubmed全文
Hu,L. ら、cote,S. 細胞体または皮質末端フィールドにNGFを適用することにより、核basalis magnocellularisニューロンのコリン作動性表現型の差動変調。 経験値 ニューロール 143, 162–171. ドイ:10.1006/exnr.1996.6357
Pubmed要約/Pubmed全文|CrossRef全文
ることを示した。 Trk受容体:神経シグナル伝達における役割。 アンヌ バイオケム博士 72, 609–642. ドイ:10.1146/annurev.バイオケム72.121801.161629
クロスリファレンス全文
とができるようになることを期待しています。 BDNF mRNA発現は、辺縁発作後の成体ラット前脳において増加する:ngfとは異なる誘導の一時的なパターン。 6,937-948 doi:10.1016/0896-6273(91)90234-Q
Pubmed要約/Pubmed全文|CrossRef全文
伊藤T.,日置H.,中村K.,田中Y.,中出H.,金子T.,et al. (2007). ラット胸部脊髄におけるγ-アミノ酪酸含有交感神経節前ニューロンは,軸索を上頚部神経節に送る。 J.Comp. ニューロール 502, 113–125. doi:10.1002/cne.21309
Pubmed要約/Pubmed全文|CrossRef全文
とができることを示しています。 基底核活性により皮質マップ再編成が可能になった。 科学279、1714-1718。 土井:10.1126/科学。279.5357.1714
Pubmed要約/Pubmed全文|CrossRef全文
Kordower,J.H.,Bartus,R.T. ら、bothwell,M.,Schatteman,G.,およびGash,D. 非ヒト霊長類(Cebus apella)における神経成長因子受容体免疫活性:コリン作動性酵素との分布、形態、および共局在。 J.Comp. ニューロール 277, 465–486. doi:10.1002/cne.902770402
Pubmed要約/Pubmed全文|CrossRef全文
Kordower,J.H.,Winn,S.R.,Liu,Y.T.,Mufson,E.J.,Sladek,J.R.Jr.,Hammang,J.P.,et al. (1994). 高齢猿の基底前脳: レスキューとヒト神経成長因子を分泌するカプセル化された細胞の移植後axotomized基底前脳ニューロンの発芽。 プロク… ナトル アカド サイ… 米国91、10898-10902。 ドイ:10.1073/pnas.91.23.10898
Pubmed要約|Pubmed全文|CrossRef全文
ることができると考えられています。 ラットの中枢神経系における神経成長因子およびそのmrnaのレベルはコリン作動性神経支配と相関した。 エンボJ.4,1389-1393.
Pubmed要約|Pubmed全文
ら、Mufson,E.J.(2 0 0 3)。 神経の成長因子:アルツハイマー病のための構造、機能および治療上の含意。 カー 薬物はCNS Neurolを標的とする。 ディソード 2, 315–334. 土井: 10.2174/1568007033482724
Pubmed Abstract|Pubmed Full Text|CrossRef Full Text
Large,T.H.,Bodary,S.C.,Clegg,D.O.,Weskamp,G.,Otten,U.,And Reichardt,L.F.(1986). 発達中のラット脳における神経成長因子遺伝子発現。 科学234,352-355. 土井:10.1126/3764415
クロスリファレンス全文
ることができると考えられています。 NGFMRNAはラット基底前脳におけるgaba作動性ではなくコリン作動性ニューロンによって発現される。 J.Comp. ニューロール 360, 454–462. doi:10.1002/cne.903600307
Pubmed要約/Pubmed全文|CrossRef全文
ることができると考えられている。 神経成長因子mrnaはラット海馬におけるGaba作動性ニューロンによって発現される。 ニューロポート5,273-276. 土井:10.1097/00001756-199312000-00023
CrossRef全文
ることができます。 Neurotrophinの分泌:現在の事実および未来の見通し。 プログ ニューロビオール 69, 341–374. ドイ:10.1016/S0301-0082(03)00019-4
Pubmed Abstract|Pubmed Full Text|CrossRef Full Text
Li,Y.,Holtzman,D.M.,Kromer,L.F.,Kaplan,D.R.,Chua-Couzens,J.,Clary,D.O.,et al. (1995). ラット基底前脳の発達におけるTrkAとChAT発現の調節: 外因性および内因性NGFの両方がコリン作動性ニューロンの分化を調節するという証拠。 J.Neurosci. 15, 2888–2905.
Pubmed要約|Pubmed全文
Maisonpierre,P.C.,Belluscio,L.,Friedman,B.,Alderson,R.F.,Wiegand,S.J.,Furth,M.E.,et al. (1990). 発達中のラット神経系におけるNT-3、BDNF、およびNGF:発現の平行パターンおよび相互パターン。 5,501-509 doi:10.1016/0896-6273(90)90089-X
Pubmed要約/Pubmed全文|CrossRef全文
マークラムH. ることができると考えられている。 新皮質抑制系の介在ニューロン。 ナット ニューロシー牧師。 5, 793–807. doi:10.1038/nrn1519
Pubmed要約/Pubmed全文|CrossRef全文
ら、Mcbain,C. 介在ニューロンは結合されていない。 ナット ニューロシー牧師。 2, 11–23. 土井: 10.1038/35049047
Pubmed Abstract|Pubmed Full Text|CrossRef Full Text
ら、Mufson,E.J.,Conner,J. 霊長類基底前脳および海馬形成における神経成長因子様免疫反応性プロファイル。 J.Comp. ニューロール 341, 507–519. doi:10.1002/cne.903410407
Pubmed要約/Pubmed全文|CrossRef全文
およびSoriano,E.(1 9 9 8)。 海馬介在ニューロンにおける神経成長因子およびニューロトロフィン-3mrnaの発現:形態学的特徴、発現レベル、および神経成長因子およびニューロトロフィン-3の共局在化。 J.Comp. ニューロール 395, 73–90. 土井:10.1002/)1096-9861(19980525)395:1<73::AID-CNE6>3.0.CO;2-E
Pubmed要約/Pubmed全文|CrossRef全文
Pasteels,B.,Miki,N.,Hatakenaka,S.,およびPochet,R.(1987). カルビンジンD-27kDaとvisininの間の免疫組織化学的交差反応性および電気泳動のcomigration。 脳Res.412,107-113. 土井: 10.1016/0006-8993(87)91444-2
Pubmed Abstract|Pubmed Full Text|CrossRef Full Text
ることを示した。 ラット視覚野の層におけるニューロトロフィンmRNA発現の発達変化。 ユーロ J.Neurosci. 24, 2453–2460. ドイ:10.1111/j.1460-9568.2006.05126.x
Pubmed要約/Pubmed全文|CrossRef全文
とができるようになりました。 成熟ラットの体性感覚皮質における神経成長因子、脳由来神経栄養因子、およびニューロトロフィン-3の発現:高親和性ニューロトロフィン受容体との共発現。 J.Comp. ニューロール 418, 241–254. 土井:10.1002/(SICI)1096-9861(20000313)418:3<241::AID-CNE1>3.0.CO;2-M
Pubmed要約/Pubmed全文|CrossRef全文
ることができると考えられている。 IN vivoでの成体皮質の機能的組織に対するBDNFおよびNGFの迅速かつ逆の効果。 381,702-706 doi:10.1038/381702a0
Pubmed要約/Pubmed全文|CrossRef全文
Prakash,N.,Cohen-Cory,S.,Penschuck,S.,And Frostig,R.D.(2004). 基底前脳コリン作動性システムは、成体ラットのバレル皮質における急速な神経成長因子(NGF)誘導可塑性に関与している。 J.Neurophysiol。 91, 424–437. 土井:10.1152/jn.00489.2003
Pubmed要約/Pubmed全文|CrossRef全文
ることを示した。 軸索輸送のコルヒチン阻害後の神経細胞体におけるグルタミン酸デカルボキシラーゼの免疫細胞化学的局在。 脳Res.140,315-332. 土井:10.1016/0006-8993(78)90463-8
Pubmed Abstract|Pubmed Full Text|CrossRef Full Text
Rossi,F.M.,Sala,R.,およびMaffei,L.(2002). ラットの視覚野における神経成長因子受容体TrkAおよびp75ntrの発現:コリン作動性入力による発達および調節。 J.Neurosci. 22, 912–919.
Pubmed要約|Pubmed全文
Rylett,R.J.,Goddard,S.,Schmidt,B.M.,And Williams,L.R.(1993). アセチルコリンの合成と成人および高齢者フィッシャー344ラットにおけるNGFの連続脳内投与後のリリース。 J.Neurosci. 13, 3956–3963.
Pubmed要約|Pubmed全文
とができるようになった。 樹状突起における神経プラズマ輸送:猫の運動ニューロンの形態および生理学に対するコルヒチンの影響。 脳Res.47,331-343. 土井: 10.1016/0006-8993(72)90643-9
Pubmed Abstract|Pubmed Full Text|CrossRef Full Text
ることができます。 (1986). 中枢神経系におけるβ神経成長因子(NGF)遺伝子の発現に関する研究:NGF mRNAのレベルと地域分布は、NGFがニューロンのいくつかの異なる集団のための栄養因子 プロク… ナトル アカド サイ… 米国83、2714-2718。 ドイ:10.1073/pnas.83.8.2714
Pubmed要約/Pubmed全文|CrossRef全文
とができるようになりました。 神経成長因子シグナル伝達、神経保護、および神経修復。 アンヌ ニューロシー牧師。 24, 1217–1281. ドイ:10.1146/annurev.ニューロ24.1.1217
クロスリファレンス全文
とができるようになりました。 脊髄運動ニューロンおよび後根神経節固有受容感覚ニューロンの維持におけるニューロトロフィンの役割。 Int. J.Dev. ニューロシ… 23, 613–620. 土井:10.1016/j.ijdevneu.2005.07.002
Pubmed要約/Pubmed全文|CrossRef全文
Tuszynski,M.H.,Armstrong,D.M.,And Gage,F.H.(1990). Fimbria/fornixのtransectionの後の基底のforebrainの細胞の損失。 ブレイン-レセ… 508, 241–248. doi:10.1016/0006-8993(90)90402-W
CrossRef全文
ることができます。 新皮質抑制ネットワーク内のコリン作動性スイッチング。 科学281,985-988. 土井:10.1126/科学。281.5379.985
Pubmed要約/Pubmed全文|CrossRef全文
2009年、Yazaki-Sugiyama,Y.,Kang,S.,Cateau,H.,Fukai,T.,And Hensch,T.K.(2009). 視覚経験による高速スパイクGABA回路における双方向可塑性。 自然462、218-221。 土井:10.1038/nature08485
Pubmed要約/Pubmed全文|CrossRef全文
ることができると考えられている。 基底前脳皮質弁系が再訪された。 アン N.Y.Acad. サイ… 877, 339–367. ドイ:10.1111/j.1749-6632.1999.09276x
Pubmed要約/Pubmed全文|CrossRef全文
Zhang,H.T.,Li,L.Y.,Zou,X.L.,Song,X.B.,Hu,Y.L.,Feng,Z.T.,et al. (2007). 成体アカゲザル脳におけるNGF、BDNF、NT-3、およびNT-4の免疫組織化学的分布。 J. Histochem. Cytochem. 55, 1–19. doi: 10.1369/jhc.6A6952.2006
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text