- Inleiding
- materialen en methoden
- Weefselpreparaat
- Dubbellabel fluorescentie immunohistochemie
- Antilichaamkarakterisatie
- confocale analyse
- controles op antilichamen
- resultaten
- NGF Immunolabeling
- NGF en Gabaerge Co-lokalisatie
- NGF en glutamaterge Co-lokalisatie
- discussie
- belangenverstrengeling verklaring
- Dankbetuigingen
- aanvullend materiaal
Inleiding
de neurotrophin nerve growth factor (NGF) is betrokken bij verschillende kritische processen in het zich ontwikkelende en volwassen zoogdier zenuwstelsel, waaronder target innervatie, celdifferentiatie en neuronale overleving (Large et al., 1986; Li et al., 1995; Sofroniew et al., 2001; Lad et al., 2003). In de volwassen hersenen speelt NGF een sleutelrol in het onderhoud en de functie van het cholinerge basale forebrainesysteem (Lad et al., 2003). De niveaus van NGF zijn het hoogst in gebieden die het grootste aantal basale cholinerge projecties van forebrain, namelijk hippocampus en cortex (Korsching et al ontvangen., 1985; Shelton and Reichardt, 1986), en receptoren voor NGF in de cortex zijn grotendeels beperkt tot basale corticopetale projecties van de voorhersenen (Kordower et al., 1988; Sofroniew et al., 2001; Rossi et al., 2002). Het signaleren van de zenuwgroeifactor handhaaft cholinerge corticopetale projecties tijdens volwassenheid (Chen et al., 1997; Debeir et al., 1999) en kan degeneratie van deze neuronen voorkomen na doorsnede van hun axonen (Hefti, 1986; Tuszynski et al., 1990; Kordower et al., 1994). Bovendien verbetert NGF de afgifte van acetylcholine uit basale forebrainculturen (Auld et al., 2001) en kan cholinerge functie moduleren door fenotypische controle van de cholinerge gen locus (Rylett et al., 1993; Hu et al., 1997).
het cholinerge systeem van de basale voorhersenen beïnvloedt de leer-en ervaringsafhankelijke plasticiteit in de cortex (Bakin en Weinberger, 1996; Kilgard en Merzenich, 1998; Conner et al., 2003, 2005), en NGF het signaleren is verondersteld om, basaal forebrain-bemiddelde het leren en plasticiteit te steunen en mogelijk te verbeteren. Bijvoorbeeld, de blokkade van NGF die via herhaalde injecties van NGF antilichamen in de insulaire cortex signaleren vermindert lokale cholinerge innervatie en verstoort aanwinst van twee processen die van de integriteit van cholinerge input, geconditioneerde smaakaversie en inhibitory vermijding het leren afhangen (Gutierrez et al., 1997). Een recente studie door Conner et al. (2009) toonde aan dat zowel ruimtelijk leren als hippocampale potentiëring op lange termijn (LTP) na infusies van NGF in de septale kern, de primaire bron van cholinerge innervatie aan de hippocampus worden verbeterd.
focale toepassing van NGF kan ook een snelle expansie van de lokale whisker representatie in de barrelschors van ratten veroorzaken. Dit proces is afhankelijk van cholinerge projecties van de basale voorhersenen (Prakash et al., 1996, 2004), die suggereren dat corticale NGF het signaleren snelle cholinerge-afhankelijke functionele reorganisatie kan bevorderen. Aldus, naast zijn trofische gevolgen op lange termijn op basale voorbrein cholinerge cellen, kan NGF ook deelnemen aan kortdurende kring remodellering. Deze” dual-action ” hypothese wordt ondersteund door het bestaan van constitutieve en activiteitsafhankelijke release mechanismen van NGF (Blochl and Thoenen, 1995; Lessmann et al., 2003), die mogelijk ten grondslag liggen aan de trofische effecten op lange termijn en de modulerende effecten op korte termijn van NGF, respectievelijk. Bovendien zijn zowel retrograde (lange termijn) als lokale (korte termijn) signaalwegen waargenomen voor NGF (Huang and Reichardt, 2003).
cellen die NGF tot expressie brengen zijn gedetecteerd in de cortex, cerebellum, hippocampus, thalamus, striatum, basale voorhersenen en hersenstam (Gall and Isackson, 1989; Maisonpierre et al., 1990; Isackson et al., 1991; Conner and Varon, 1992; Hayashi et al., 1993; Mufson et al., 1994; Zhang et al., 2007). Hoewel NGF mRNA naar verluidt is waargenomen in astrocyten en andere glia, wordt de overgrote meerderheid van corticale NGF geproduceerd door neuronen (Sofroniew et al., 2001). De specifieke soorten neuronen die NGF in de cortex produceren zijn echter niet bekend, en cholinerge corticopetale projecties zijn aangetoond dat zowel prikkelende als remmende neuronen in de cortex innerveren (Zaborszky et al., 1999). In extracorticale gebieden zoals de hippocampus, striatum en basale voorhersenen, wordt NGF productie voornamelijk gelokaliseerd aan Gabaerge remmende neuronen (Lauterborn et al., 1993, 1995; Pascual et al., 1998; Bizon et al., 1999). Identificatie van NGF-producerende cellen in de cortex is belangrijk voor het identificeren van potentiële mechanismen onderliggende modulatie van cholinerge corticale inputs, en mechanismen van corticale plasticiteit. In de huidige studie identificeren we een subset van corticale Gabaerge cellen als de primaire bron van NGF productie in de volwassen cortex, met relatief zeldzame productie door glutamaterge neuronen.
materialen en methoden
alle proefpersonen werden behandeld in overeenstemming met de institutionele richtlijnen voor de verzorging van dieren. Vanwege lage endogene niveaus van corticale NGF-expressie die identificatie van specifieke cel–type bronnen van NGF in eerdere studies verboden, voerden we lokale colchicine-infusies uit om microtubule polymerisatie te remmen, waardoor NGF-transport uit de buurt van het cellichaam wordt geblokkeerd en resulterend in accumulatie van detecteerbaar NGF-antigeen in het soma van producerende cellen (Schubert et al., 1972; Hokfelt et al., 1975; Hanson en Edström, 1978; Conner en Varon, 1992). Eerdere rapporten hebben aangetoond dat behandeling met colchicine de detectie van NGF met behulp van immunohistochemische technieken verhoogt (Conner en Varon, 1992). Bovendien veroorzaken colchicinespiegels die vergelijkbaar zijn met die welke in de huidige studie worden gebruikt geen grove afwijkingen in de neuronale verdeling van het neurotrophine-familielid BDNF (Conner et al., 1997).
Weefselpreparaat
acht volwassen Fischer 344-ratten (4 mannetjes, 4 vrouwtjes; Harlan Sprague Dawley) werden verdoofd met 2 ml/kg ketamine 25 mg/ml, 1,3 mg/ml xylazine en 0,25 mg/ml acepromazinecocktail en geïnjecteerd met 5.Colchicine 0 µl (10 µg / µl in aCSF) op de onderstaande corticale locaties met een snelheid van 0,5 µl/min met een Hamilton-spuit van 10 µl. Na de infusie bleef de naald vier minuten op zijn plaats om voldoende diffusie naar het omliggende weefsel mogelijk te maken. Vier dieren kregen bilaterale injecties in de primaire motorische cortex (M1) bij +1,2 mm anterior (A/P) en ±2,5 mm lateraal (M/L) aan bregma. De helft van de oplossing werd geïnjecteerd op 1,6 mm Onder het oppervlak van de hersenen (D/V), en de rest op 1,0 mm. de overige vier dieren kregen allemaal unilaterale injecties in de prefrontale cortex (A/P: +3.0, M / L: + 0,5, D / V: -2,3 en -1,8), temporale cortex (A/P: -6,5, M/L: +5,0, D/V: -7,5 en -7,0), en pariëtale cortex (A/P: -3,0, M/L: +5,0, D/V: -1,8 en -1,3). Na 48 uur werden de dieren diep verdoofd en transcardiaal geperforeerd met 250 ml koudfosfaat gebufferde zoutoplossing (pH 7,4), gevolgd door 250 ml koud 2% paraformaldehyde + 0,2% parabenzoquinon in 0,1 M fosfaatbuffer. Hersenen werden geëxtraheerd, nafixeerd gedurende 2 uur in hetzelfde fixeermiddel, en cryoprotected in 0,1 M fosfaatbuffer met 30% sucrose gedurende ten minste 72 uur bij 4°C. Coronale secties (40 µm) werden gesneden op een invriezende glijdende microtoom en opgeslagen in cryoprotectant (TCS) bij 4°C tot verder verwerkt voor immunohistochemie.
Dubbellabel fluorescentie immunohistochemie
sequentiële dubbellabel immunohistochemie werd gebruikt om neuronen die NGF uitdrukken en Gabaerge of glutamaterge celmarkers te visualiseren. Vrij zwevende secties werden gewassen in Tris Buffered Saline (TBS), permeabilized met 0,25% Triton X-100, en niet-specifieke etikettering werd vervolgens Geblokkeerd met 5% donkey serum. De secties werden gedurende 72 uur bij 4°C geïncubeerd in anti-NGF-antilichaam van konijnen (Conner en Varon, 1992) verdund 1:1000 in TBS, 0,25% Triton X-100 en 5% donkey serum. Na primaire antilichaam incubatie werden secties geïncubeerd in Donkey anti-rabbit biotine geconjugeerd IgG (1: 200; Vector Laboratories, Burlingame, CA, USA). Tyramide signaalversterking (TSA; PerkinElmer, Waltham, MA, USA) werd toegepast om het NGF-signaal te versterken, waarna secties werden gewassen in TBS en geïncubeerd in Alexa Fluor 488 of 594-geconjugeerde streptavidin (Invitrogen, Carlsbad, CA, USA) verdund 1:200 gedurende 3 uur bij 4°C. Na een korte wasbeurt, secties werden geïncubeerd in zowel muis anti-glutamaat decarboxylase (GAD) 65 (GAD-6, AntibodyRegistry:AB_528264,1:2000; Developmental Studies Hybridoma Bank, Iowa City, IA, USA) en de muis anti-GAD67 (AnitbodyRegistry: AB_2278725, 1:1500; Millipore, Temecula, CA, verenigde staten), of in de muis anti-parvalbumin (AntibodyRegistry: AB_2174013, 1:30000; Millipore, Temecula, CA, USA), muis anti-calbindin-D-28K (AntibodyRegistry: AB_476894, 1:1500; Sigma-Aldrich, St. Louis, MO, USA), of met de muis anti-Ca2+/calmodulin-dependent protein kinase IIa (CaMKIIa, AntibodyRegistry: AB_2067919, 1:1500; Millipore) gedurende 72 uur bij 4°C. tenslotte werden secties gewassen, gedurende 3 uur bij kamertemperatuur geïncubeerd in Alexa Fluor 594 of 488-geconjugeerde donkey anti-mouse (Invitrogen), opnieuw gewassen, gemonteerd op glazen objectglaasjes en bedekt met Fluoromount-G (Southern Biotech, Birminghan, al, USA). Om de identificatie van Gabaerge cellen te maximaliseren, werden GAD65 en GAD67 antilichamen co-geïncubeerd. Een subset van secties werd coverslipped in verlengen goud met DAPI (Invitrogen) voor visualisatie van celkernen.
Antilichaamkarakterisatie
het NGF-antilichaam dat in deze studie wordt gebruikt, is een affiniteit-gezuiverd polyclonaal verhoogd bij konijnen tegen gezuiverd NGF bij muizen (Conner en Varon, 1992). Het antilichaam herkent gezuiverde muizen en recombinant humaan NGF, maar reageert niet met recombinant BDNF of NT-3 (Conner en Varon, 1996). Bovendien komt het immunoreactieve patroon van NGF-expressie in de hersenen van ratten nauw overeen met dat verkregen uit in-situ analyse in de hersenen van ratten (Conner en Varon, 1997).
het monoklonale antilichaam GAD-65 (Ontwikkelingsstudies Hybridoma Bank, Gad-6) werd geproduceerd door het immuniseren van muizen met GAD-eiwit immunoaffiniteit-gezuiverd uit rattenhersenen. Western blot analyse van rat hersenen homogenaten bleek het antilichaam selectief herkent Gad-65 maar niet GAD-67 (Chang en Gottlieb, 1988). Aanvullende studies hebben aangetoond dat het Gad-6 antilichaam een epitoop tussen aminozuren 475-571 van het c-Eindpunt van GAD-65 (Butler et al., 1993).
de monoklonale muis van Gad-67 (Millipore, MAB 5406, lot: 25010139) werd verhoogd tegen aminozuurresiduen 4-101 van menselijke Gad-67, en erkent een enkele 67-kDa band op Westelijke vlekanalyse van rattenhersenen (technische informatie van de fabrikant). Pre-incubatie van het antilichaam met een fusie-eiwit GST-Gad-67 resulteerde in geen immunopositief signaal in de hersenen (Ito et al., 2007).
de monoklonale anti-CaMKIIa van de muis (Millipore, MAB 8699, lot: LV1366080) herkent specifiek de Alfa-subeenheid van calcium/calmoduline-afhankelijk proteïne kinase II. De analyse van de westelijke vlek toont aan dat het antilichaam één enkele band van 50 kDa identificeert en zowel phosphorylated als unphosphorylated vormen erkent (Erondu en Kennedy, 1985).
Monoklonaal anti-calbindin-D-28k (Sigma–Aldrich, C9848, lot: 088k4799) is afgeleid van BALB/c muizen geïmmuniseerd met gezuiverd runderen nieren calbindin-D-28k. Immunoblotting toonde het antilichaam herkent een 28-kDa band, en niet om te reageren met soortgelijke moleculen, zoals calbindin-D-9K, calretinin, myosin lichte keten, en parvalbumin (fabrikant de technische informatie). Preabsorptie met een calbindin-d-27 kDa eiwit gezuiverd uit kip en rat hersenen werd aangetoond dat calbindin immunostaining in de hersenen te elimineren (Pasteels et al., 1987).
Anti-parvalbumine (Millipore, MAB 1572, lot: LV1378387) werd verzameld bij muizen die geïmmuniseerd waren tegen parvalbumine gezuiverd uit kikkerspier. Het monoclonal antilichaam wordt gericht tegen een epitope bij de eerste Ca2 + – bindende plaats en immunoblotanalyse toont het een hersenenproteã ne van 12 kDa (de technische informatie van de fabrikant) erkent.
confocale analyse
beelden werden vastgelegd met behulp van een Olympus AX70 met Magnafire-software (Versie 2.0; Karl Storz Imaging, Goleta, CA, USA). Omdat NGF-etikettering aanzienlijk verminderd was ongeveer 2 mm anterior/posterior aan colchicine injectieplaatsen, vermoedelijk als gevolg van een gebrek aan colchicine diffusie en de resulterende afwezigheid van somatische NGF accumulatie, werden alleen secties binnen 1,5 mm van elke colchicine injectieplaats geanalyseerd. Elke 10e sectie (400 µm) werd onderzocht binnen een corticaal gebied. Cellen werden handmatig geteld en ten minste drie secties werden geanalyseerd in elke corticale regio en antilichaamcombinatie per proefpersoon. Slechts drie dieren werden geëvalueerd in de temporale regio als gevolg van niet-detecteerbare NGF etikettering in de vierde. De enige en dubbel-geëtiketteerde cellen werden gekwantificeerd gebruikend zowel enig als dubbel-kanaalbeelden. Verscheidene criteria werden gebruikt om geëtiketteerde cellen, met inbegrip van grootte, morfologie, signaal Versus achtergrond, en samenvallende DAPI etikettering te identificeren wanneer het beoordelen van DAPI-bevlekt Weefsel. In een subset van secties, werden 5 µm z-stapels verzameld gebruikend een Olympus Fluoview FV1000 om neuronale lokalisatie van het geëtiketteerde object te verzekeren. Vanwege onze interesse in de verhouding, en niet het absolute aantal, van dubbel gelabelde cellen, werden stereologische methoden niet gebruikt.
het percentage dubbel gelabelde cellen per immunoreactieve (IR) celgroep werd bepaald voor elk beeldveld. De gemiddelde ± standaardfout werd berekend voor elk onderzocht corticaal gebied. Eenrichtingsanalyse van variantie (ANOVA) werd gebruikt om verschillen tussen corticale regio ‘ s te evalueren. Fisher ‘ s HSD werd gebruikt voor post-hoc analyse. Alle statistische analyses werden uitgevoerd met SPSS 15.0 Voor Windows.
controles op antilichamen
controles omvatten weglating van primaire antilichamen, weglating van secundaire antilichamen en vervanging van primaire antilichamen door niet-specifiek antilichaam (konijn-IgG). Alle manipulaties hadden de verwachte gevolgen en steunden de bewering dat geëtiketteerde cellen ware antigeen etikettering door hun overeenkomstige antilichamen vertegenwoordigen.
resultaten
NGF Immunolabeling
verschillende NGF-labeling was zichtbaar binnen een straal van 1.5 mm van colchicine corticale injectieplaatsen. Binnen deze gebieden, NGF etikettering was voornamelijk beperkt tot cel somata (figuur 1). Zelden kunnen ook één of meer cellulaire processen worden onderscheiden. Buiten deze straal van 1,5 mm, NGF etikettering was vrijwel niet op te sporen in de cortex. Aangezien corticale expressie van de NGF-receptoren TrkA en p75 beperkt zijn tot cholinerge corticopetale vezels, is het onwaarschijnlijk dat de waargenomen etikettering van NGF endocytose NGF reflecteert, maar in plaats daarvan wijst op NGF-producerende cellen (Holtzman et al., 1995; Rossi et al., 2002; Stephens et al., 2005). Zoals eerder gemeld (Ribak et al., 1978), verhoogde de colchicinebehandeling Gad-etikettering in cellichamen evenals neuronale processen. Colchicine had geen detecteerbaar effect op de etikettering voor parvalbumine, calbindin of CaMKIIa.
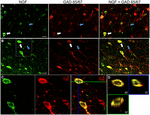
FIGUUR 1. Zenuwgroeifactor colocalizes uitgebreid met remmende celmarkers. Immunoreactieve cellen in de (A) primaire motorische cortex en (B) prefrontale cortex. De beelden tonen aan dat NGF-geëtiketteerde cellen (groen) uitgebreid met GAD 65/67-geëtiketteerde cellen (rood) colocalize. De witte pijlen tonen een voorbeeld cel immunoreactive voor zowel NGF als Gad 65/67 in elk corticaal gebied. Blauwe pijlen tonen cellen immunoreactive voor GAD 65/67 alleen. (C) vergroot beeld van het gebied binnen witte doos in (B). (D) X–Y–Z reconstructie van de dubbelgelabelde cel aangegeven in (C). Groene en blauwe lijnen geven dissectieniveaus aan in respectievelijk XZ-en YZ-vlakken. Schaalbalken = 25 µm.
NGF en Gabaerge Co-lokalisatie
zenuwgroeifactor Co-gelokaliseerd uitgebreid met de Gabaerge celmarkers GAD65 en GAD67, ongeacht het onderzochte corticale gebied (figuur 1; Tabel 1). Globaal, 91 ± 0.9% van NGF-geëtiketteerde corticale cellen ook geëtiketteerd voor GAD65/67. Het percentage NGF-geëtiketteerde cellen die GAD65/67 mede tot expressie brengen vertoonde weinig verschil tussen de prefrontale (90,0 ± 1,5%), motorische (91,7 ± 1,5%), pariëtale (89,6 ± 3,5%) en temporale (93,4 ± 8,1%) cortices (eenrichtingsanova; p = 0,78). Omgekeerd, NGF co-gelokaliseerd met slechts 55 ± 2.3% van alle GAD65 / 67-gelabelde cellen. Om te bepalen of NGF productie was beperkt tot een specifiek subtype van Gabaerge neuron, we co-label weefsel voor NGF en ofwel parvalbumine of calbindin (Figuur 2). NGF-geëtiketteerde cellen werden waargenomen om met beide tellers te colocalize. NGF colokalisatie met parvalbumine (67,8 ± 3,6%) was echter meer dan 2× groter dan met calbindin (29,1 ± 3,9%). Bovendien vormden NGF-IR-cellen minder dan de helft van alle parvalbumine (47,7 ± 4,6%) en calbindin (25,7 ± 4,9%) immunoreactieve cellen.

FIGUUR 2. NGF gelabeld met remmende neuron subklasse markers. Plakjes van de motor cortex werden geëtiketteerd voor NGF en ofwel parvalbumine of calbindin. (A) cellen toonden uitgebreide overlapping van NGF en parvalbumine etikettering (witte pijlen). (B) omgekeerd kwam colabeling van NGF en calbindin minder vaak voor. Schaalbalken = 25 µm.

TABEL 1. NGF – en GAD65/67-immunoreactieve cellen per corticale regio.
Zenuwgroeifactorexpressie neuronen werden waargenomen in alle corticale lagen. Eerdere studies hebben een ongelijke verdeling van NGF-gelabelde neuronen in de corticale laminae gemeld (Pitts and Miller, 2000; Patz and Wahle, 2006). Kwantitatieve analyse per laag werd in de huidige studie echter niet uitgevoerd, aangezien de NGF-etiketteringsintensiteit afnam met toenemende afstand tot de injectieplaats van colchicine.
NGF en glutamaterge Co-lokalisatie
etikettering voor CaMKIIa werd voornamelijk waargenomen binnen cel somata en proximale processen (Figuur 3). In tegenstelling tot de uitgebreide co-lokalisatie gezien met NGF en GABAergic markers, NGF-geëtiketteerde cellen zelden co-gelokaliseerd met CaMKIIa-geëtiketteerde cellen (Figuur 3; Tabel 2). In totaal werden 4,9 ± 1,1% van NGF-immunoreactieve cellen Geco-gelabeld met CaMKIIa-antilichamen. De co-lokalisatie verschilde beduidend door corticale gebied (one-way ANOVA; p = 0,03); post hoc van Fisher onthulde dat de prefrontale cortex een groter aandeel van dubbel-geëtiketteerde NGF cellen (7,6 ± 2,1%) in vergelijking met de primaire motorcors (2,4 ± 1,0%; p = 0,02) en pariëtale cortex (2,9% ± 1,5; p = 0,01) had.

FIGUUR 3. De zenuwgroeifactor colokaliseert minimaal met de prikkelende celmarker CaMKIIa. Immunoreactieve cellen in de prefrontale cortex. De cellen werden zelden colabeled voor NGF (groen) en CaMKIIa (rood), ongeacht onderzocht corticale gebied. Gouden pijlen tonen een voorbeeld van een cel immunoreactive voor NGF slechts. Schaalbalken = 25 µm.

TABEL 2. NGF – en CaMKIIa-immunoreactive cellen door corticale regio.
cellen die immunoreactief zijn voor CaMKIIa overtreffen sterk de cellen die gelabeld zijn met NGF-antilichamen. Het totale aandeel van met CaMKIIa gelabelde cellen die gelijktijdig NGF-signaal uitdrukken, was 2 ± 0,6%. Dit percentage verschilde significant per gebied (one-way ANOVA p = 0,003), waarbij de prefrontale cortex een groter deel van dubbel gelabelde NGF/CaMKIIa cellen (3,7 ± 1,1%) vertoont dan de primaire motorische cortex (0,8% ± 0,3; p = 0,001), de pariëtale cortex (1,4% ± 0,6; p = 0,01), en de temporale cortex (1,5 ± 0,6%; p = 0,01).
discussie
de huidige studie toont aan dat de overgrote meerderheid (>90%) van NGF-producerende neuronen van de cortex Gabaerge zijn, terwijl de helft van alle Gabaerge neuronen colokaliseren met NGF. In tegenstelling, vertonen de tellers van prikkelende neuronen slechts zeldzame co-lokalisatie met NGF. Deze resultaten waren consistent in meerdere corticale regio ‘ s die in deze studie werden geanalyseerd, wat erop wijst dat NGF voornamelijk wordt geproduceerd door remmende interneuronen in de neocortex van de rat.
hoewel NGF-immunoreactiviteit zelden samenviel met prikkelende celmarkers (CAMKIIa), was een klein percentage (~5%) positief voor CaMKIIa in alle onderzochte corticale regio ‘ s. Confocal analyse bevestigde dat deze dubbele etikettering uit hetzelfde brandpuntsvlak voortkwam, en niet toe te schrijven was aan discreet signaal dat uit overlappende cellen voortkomt. De functionele betekenis van NGF-expressie in zo ‘ n kleine fractie van prikkelende cellen in niet bekend, maar het is mogelijk dat deze NGF-producerende neuronen een eerder ongeïdentificeerde subklasse van prikkelende neuronen in de neocortex vertegenwoordigen.
onze resultaten zijn consistent met bevindingen van eerdere studies in andere hersengebieden die aantonen dat NGF bijna uitsluitend co-lokaliseert met Gabaerge cellen in het striatum, basale forebrain en hippocampus (Lauterborn et al., 1993, 1995; Pascual et al., 1998; Bizon et al., 1999). Aldus, kan de productie van NGF door GABAergic cellen een algemene eigenschap van alle doelstellingen zijn die basale forebrain cholinerge innervatie (met inbegrip van de basale forebrain zelf) ontvangen. Deze cholinerge neuronale populaties hebben NGF nodig voor het behoud van hun fenotype en projecties (Rylett et al., 1993; Chen et al., 1997; Hu et al., 1997; Debeir et al., 1999). Over studies heen, treden remmende interneuronen nu op als de primaire bron van NGF trofisme voor basale forebrain cholinerge neuronen.
hoewel cholinerge neuronen van basale forebrainen zowel prikkelende als remmende corticale netwerken innerveren (Zaborszky et al., 1999), is de bron van trofische ondersteuning grotendeels afkomstig van de remmende populatie, waarvan bekend is dat ze een cruciale rol speelt bij het bemiddelen van plasticiteit in corticale circuits (Hensch and Stryker, 2004; Yazaki-Sugiyama et al., 2009; Donato et al., 2013). Cholinerge signalering lijkt bij te dragen aan de differentiële activering van verschillende remmende subpopulaties, waardoor de prikkelend-remmende balans wordt gemoduleerd (Xiang et al., 1998; Froemke et al., 2007). NGF kan daarbij dienen als een feedback signaal tussen hoogst plastic remmende netwerken en de cholinerge inputs die hen activeren. Inderdaad, NGF verhoogt plasticiteit en gedragsleren door cholinerge-afhankelijke mechanismen (Prakash et al., 1996, 2004; Gutierrez et al., 1997; Conner et al., 2009). Activity-dependent release of NGF (Blochl and Thoenen, 1995; Lessmann et al., 2003), gecombineerd met het vermogen van NGF om cholinerge activiteit te verhogen (Rylett et al., 1993; Hu et al., 1997; Auld et al., 2001), stelt voor dat NGF reorganisatie van actieve circuits via verbeterde cholinerge functie kan bevorderen.
toekomstige studies zullen proberen te achterhalen welke subklassen van remmende neuronen NGF tot expressie brengen en hoe deze expressie precies de corticale Circuits beïnvloedt. Hiertoe namen we voorlopige stappen om te bepalen of NGF co-gelokaliseerd met twee gemeenschappelijke markers van remmende neuronen, parvalbumine (voornamelijk geassocieerd met mand en kroonluchtercellen), en calbindin (geassocieerd met talrijke remmende celtypen; McBain en Fisahn, 2001; Markram et al., 2004). Onze resultaten tonen aan dat NGF voornamelijk werd gedetecteerd in parvalbumine-immunoreactieve cellen, hoewel veel cellen die door parvalbumine worden geëtiketteerd NGF niet co-express. Belangrijk, NGF-de cellen van IRL colokaliseerden ook met calbindin-geëtiketteerde cellen, die voorstellen dat meer dan één subklasse van remmend neuron NGF produceert.
samengevat wordt het NGF van neocortex in de rat voornamelijk tot expressie gebracht door remmende neuronen, een eigenschap die bewaard lijkt te blijven in fylogenetisch oudere hersengebieden en die zich kan veralgemenen naar de hersenen als geheel. Onze resultaten suggereren corticale remmende interneuronen spelen een vitale rol in het behoud van cholinerge projectie neuronen van de basale voorhersenen. GABAergic interneurons zo kunnen corticale reorganisatie via geregeld NGF signaleren bevorderen.
belangenverstrengeling verklaring
de auteurs verklaren dat het onderzoek werd uitgevoerd zonder enige commerciële of financiële relatie die als een potentieel belangenconflict kon worden opgevat.
Dankbetuigingen
gefinancierd door de NIH (AG10435), de Veterans Administration, de Alzheimer ‘ s Association en de Dr.Miriam en Sheldon G. Adelson Medical Research Foundation.
aanvullend materiaal
het aanvullende materiaal voor dit artikel is online te vinden op: http://www.frontiersin.org/journal/10.3389/fncel.2014.00220/abstract
Auld, D. S., Mennicken, F., and Quirion, R. (2001). Zenuwgroeifactor induceert snel verlengde acetylcholineafgifte uit gecultiveerde basale forebrain neuronen: differentiatie tussen neuromodulerende en neurotrofe invloeden. J. Neurosci. 21, 3375–3382.
Pubmed Abstract / Pubmed Full Text
Bakin, J. S., and Weinberger, N. M. (1996). Inductie van een fysiologisch geheugen in de hersenschors door stimulatie van de nucleus basalis. Proc. Natl. Acad. Sci. U. S. A. 93, 11219-11224. doi: 10.1073 / pnas.93.20.11219
CrossRef volledige tekst
Bizon, J. L., Lauterborn, J. C., and Gall, C. M. (1999). Subpopulaties van striatale interneuronen kunnen worden onderscheiden op basis van neurotrofische factorexpressie. J. Comp. Neurol. 408, 283–298. doi: 10.1002/(SICI)1096-9861(19990531)408:2<283::steun-CNE9>3.0.CO;2-2
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Blochl, A., and Thoenen, H. (1995). Karakterisering van de afgifte van de zenuwgroeifactor (NGF) van hippocampale neuronen: bewijs voor een constitutieve en een onconventionele natriumafhankelijke gereguleerde weg. Euro. J. Neurosci. 7, 1220–1228. doi: 10.1111 / j. 1460-9568.1995.tb01112.X
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Butler, M. H., Solimena, M., Dirkx, R. Jr., Hayday, A., en de Camilli, P. (1993). Identificatie van een dominante epitoop van glutaminezuur decarboxylase (GAD-65) die door autoantilichamen in het syndroom van stiff-man wordt erkend. J. Exp. Med. 178, 2097–2106. doi: 10.1084 / jem.178.6.2097
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Chang, Y. C., en Gottlieb, D. I. (1988). Karakterisatie van de eiwitten gezuiverd met monoklonale antilichamen tegen glutaminezuur decarboxylase. J. Neurosci. 8, 2123–2130.
Chen, K. S., Nishimura, M. C., Armanini, M. P., Crowley, C., Spencer, S. D., and Phillips, H. S. (1997). Verstoring van een enkel allel van het gen van de zenuwgroeifactor resulteert in atrofie van cholinerge neuronen van de basale forebrain en geheugentekorten. J. Neurosci. 17, 7288–7296.
Pubmed Abstract / Pubmed Full Text
Conner, J. M., Chiba, A. A., and Tuszynski, M. H. (2005). Het cholinerge systeem van de basale voorhersenen is essentieel voor corticale plasticiteit en functioneel herstel na hersenletsel. Neuron 46, 173-179. doi: 10.1016 / j.neuron.2005.03.003
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Conner, J. M., Culberson, A., Packowski, C., Chiba, A. A., and Tuszynski, M. H. (2003). Laesies van het cholinerge systeem van de basale voorhersenen belemmeren taakverwerving en heffen corticale plasticiteit op geassocieerd met motorisch leren. Neuron 38, 819-829. doi: 10.1016/S0896-6273(03)00288-5
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Conner, J. M., Franks, K. M., Titterness, A. K., Russell, K., Merrill, D. A., Christie, B. R., et al. (2009). NGF is essentieel voor hippocampale plasticiteit en leren. J. Neurosci. 29, 10883–10889. doi: 10.1523 / JNEUROSCI.2594-09.2009
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Conner, J. M., Lauterborn, J. C., Yan, Q., Gall, C. M., and Varon, S. (1997). Distributie van neurotrophic factor (BDNF) eiwit en mRNA in de normale volwassen Rat CNS: bewijs voor anterograde axonaal transport. J. Neurosci. 17, 2295–2313.
Pubmed Abstract / Pubmed Full Text
Conner, J. M., and Varon, S. (1992). Verdeling van zenuwgroeifactorachtige immunoreactieve neuronen in de hersenen van volwassen ratten na behandeling met colchicine. J. Comp. Neurol. 326, 347–362. doi: 10.1002 / cne.903260304
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Conner, J. M., and Varon, S. (1996). Karakterisering van antilichamen tegen zenuwgroeifactor: assay-afhankelijke variabiliteit in de kruisreactiviteit met andere neurotrofinen. J. Neurosci. Methoden 65, 93-99. doi: 10.1016/0165-0270(95)00151-4
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Conner, J. M., and Varon, S. (1997). Ontwikkelingsprofiel van NGF immunoreactiviteit in de hersenen van de rat: een mogelijke rol van NGF in de oprichting van cholinerge eindvelden in de hippocampus en cortex. Brain Res. Dev. Brain Res. 101, 67-79. doi: 10.1016 / S0165-3806(97)00051-5
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Debeir, T., Saragovi, H. U., And Cuello, A. C. (1999). Een mimetische TrkA-antagonist van de zenuwgroeifactor veroorzaakt terugtrekking van corticale cholinerge boutons bij de volwassen rat. Proc. Natl. Acad. Sci. U. S. A. 96, 4067-4072. doi: 10.1073 / pnas.96.7.4067
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Donato, F., Rompani, S. B., and Caroni, P. (2013). Parvalbumine-expressie mand-cel netwerk plasticiteit geïnduceerd door ervaring reguleert volwasseneneducatie. Nature 504, 272-276. doi: 10.1038 / nature12866
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Erondu, N. E., and Kennedy, M. B. (1985). Regionale verdeling van type II Ca2+ / calmoduline-afhankelijk eiwitkinase in de hersenen van ratten. J. Neurosci. 5, 3270–3277.
Froemke, R. C., Merzenich, M. M., and Schreiner, C. E. (2007). Een synaptische geheugenspoor voor corticale ontvankelijk veld plasticiteit. Nature 450, 425-429. doi: 10.1038 / nature06289
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Gall, C. M., and Isackson, P. J. (1989). Limbische beslagleggingen verhogen neuronale productie van boodschapper RNA voor de factor van de zenuwgroei. Wetenschap 245, 758-761. doi: 10.1126 / wetenschap.2549634
CrossRef volledige tekst
Gutierrez, H., Miranda, M. I., and Bermudez-Rattoni, F. (1997). Leerstoornis en cholinerge deafferentatie na corticale zenuwgroeifactordeprivatie. J. Neurosci. 17, 3796–3803.
Pubmed Abstract / Pubmed Full Text
Hanson, M., and Edström, A. (1978). Mitoseremmers en axonaal transport. Int. Rev. Cytol. Suppl. 373–402.
Hayashi, M., Yamashita, A., Shimizu, K., Sogawa, K., and Fujii, Y. (1993). Expressie van het gen voor de zenuwgroeifactor (NGF) in het centrale zenuwstelsel van de aap. Brain Res. 618, 142-148. doi: 10.1016/0006-8993 (93)90437-R
CrossRef Volledige Tekst
Hefti, F. (1986). De zenuwgroeifactor bevordert de overleving van septale cholinerge neuronen na fimbriale transecties. J. Neurosci. 6, 2155–2162.
Hensch, T. K., and Stryker, M. P. (2004). Zuilvormige architectuur gebeeldhouwd door GABA circuits in het ontwikkelen van kat visuele cortex. Wetenschap 303, 1678-1681. doi: 10.1126 / wetenschap.1091031
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Hokfelt, T., Kellerth, J. O., Nilsson, G., and Pernow, B. (1975). Experimentele immunohistochemische studies naar de lokalisatie en distributie van substantie P in primaire sensorische neuronen van katten. Brain Res. 100, 235-252. doi: 10.1016/0006-8993(75)90481-3
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Holtzman, D. M., Kilbridge, J., Li, Y., Cunningham, E. T. Jr., Lenn, N. J., Clary, D. O., et al. (1995). TrkA-expressie in het CZS: bewijs voor het bestaan van verschillende nieuwe NGF-responsieve CZS-neuronen. J. Neurosci. 15, 1567–1576.
Pubmed Abstract / Pubmed Full Text
Hu, L., Cote, S. L., and Cuello, A. C. (1997). Differentiële modulatie van het cholinerge fenotype van de nucleus basalis magnocellularis neuronen door toepassing van NGF op het cellichaam of corticale terminale velden. Exp. Neurol. 143, 162–171. doi: 10.1006/exnr.1996,6357
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Huang, E. J., and Reichardt, L. F. (2003). Trk-receptoren: rollen in neuronale signaaltransductie. Annu. Rev. Biochem. 72, 609–642. doi: 10.1146 / annurev.biochem.72.121801.161629
CrossRef volledige tekst
Isackson, P. J., Huntsman, M. M., Murray, K. D., and Gall, C. M. (1991). BDNF mRNA expressie is verhoogd in volwassen ratten forebrainen na limbische aanvallen: temporale patronen van inductie verschillend van NGF. Neuron 6, 937-948. doi: 10.1016 / 0896-6273 (91)90234-Q
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Ito, T., Hioki, H., Nakamura, K., Tanaka, Y., Nakade, H., Kaneko, T., et al. (2007). Gamma-aminoboterzuur bevattende sympathische preganglionische neuronen in rat thoracale ruggenmerg sturen hun axonen naar de superieure cervicale ganglion. J. Comp. Neurol. 502, 113–125. doi: 10.1002 / cne.21309
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Kilgard, M. P., and Merzenich, M. M. (1998). Corticale kaart reorganisatie mogelijk gemaakt door nucleus basalis activiteit. Wetenschap 279, 1714-1718. doi: 10.1126 / wetenschap.279.5357.1714
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Kordower, J. H., Bartus, R. T., Bothwell, M., Schatteman, G., and Gash, D. M. (1988). Zenuwgroeifactor receptor immunore activiteit in de niet-menselijke primaat (Cebus apella): distributie, morfologie en colokalisatie met cholinerge enzymen. J. Comp. Neurol. 277, 465–486. doi: 10.1002 / cne.902770402
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Kordower, J. H., Winn, S. R., Liu, Y. T., Mufson, E. J., Sladek, J. R. Jr., Hammang, J. P., et al. (1994). De oude aap basale voorhersenen: redding en ontkieming van axotomized basal forebrain neuronen na enten van ingekapselde cellen afscheiden menselijke zenuwgroeifactor. Proc. Natl. Acad. Sci. U. S. A. 91, 10898-10902. doi: 10.1073 / pnas.91.23.10898
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Korsching, S., Auburger, G., Heumann, R., Scott, J., en Thoenen, H. (1985). De niveaus van de zenuwgroeifactor en zijn mRNA in het centrale zenuwstelsel van de rat correleren met cholinerge innervatie. EMBO J. 4, 1389-1393.
Pubmed Abstract / Pubmed Full Text
Lad, S. P., Neet, K. E., and Mufson, E. J. (2003). Zenuwgroeifactor: structuur, functie en therapeutische implicaties voor de ziekte van Alzheimer. Curr. Drug richt zich op CNS Neurol. Disord. 2, 315–334. doi: 10.2174/1568007033482724
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Large, T. H., Bodary, S. C., Clegg, D. O., Weskamp, G., Otten, U., And Reichardt, L. F. (1986). De genuitdrukking van de zenuwgroeifactor in de zich ontwikkelende rattenhersenen. Wetenschap 234, 352-355. doi: 10.1126 / wetenschap.3764415
CrossRef volledige tekst
Lauterborn, J. C., Bizon, J. L., Tran, T. M., and Gall, C. M. (1995). NGF mRNA wordt uitgedrukt door Gabaerge maar niet cholinerge neuronen in basaalvoorbrein van de rat. J. Comp. Neurol. 360, 454–462. doi: 10.1002 / cne.903600307
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Lauterborn, J. C., Tran, T. M., Isackson, P. J., and Gall, C. M. (1993). De factor mRNA van de zenuwgroei wordt uitgedrukt door GABAergic neuronen in rattenhipocampus. Neurorapport 5, 273-276. doi: 10.1097/00001756-199312000-00023
volledige tekst CrossRef
Lessmann, V., Gottmann, K., and Malcangio, M. (2003). Neurotrophin secretie: huidige feiten en toekomstperspectieven. Prog. Neurobiol. 69, 341–374. doi: 10.1016 / S0301-0082(03)00019-4
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Li, Y., Holtzman, D. M., Kromer, L. F., Kaplan, D. R., Chua-Couzens, J., Clary,D. O., et al. (1995). Regulatie van TrkA en Chatexpressie bij het ontwikkelen van basale voorhersenen bij ratten: bewijs dat zowel exogene als endogene NGF differentiatie van cholinerge neuronen regelen. J. Neurosci. 15, 2888–2905.
Pubmed Abstract / Pubmed Full Text
Maisonpierre, P. C., Belluscio, L., Friedman, B., Alderson, R. F., Wiegand, S. J., Furth, M. E., et al. (1990). NT-3, BDNF, en NGF in het zich ontwikkelende zenuwstelsel van de rat: parallel evenals wederkerige patronen van uitdrukking. Neuron 5, 501-509. doi: 10.1016 / 0896-6273 (90)90089-X
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Markram, H., Toledo-Rodriguez, M., Wang, Y., Gupta, A., Silberberg, G., and Wu, C. (2004). Interneuronen van het neocorticale remmende systeem. Nat. Rev. Neurosci. 5, 793–807. doi: 10.1038 / nrn1519
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
McBain, C. J., and Fisahn, A. (2001). Interneuros niet geconsolideerd. Nat. Rev. Neurosci. 2, 11–23. doi: 10.1038/35049047
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Mufson, E. J., Conner, J. M., Varon, S., and Kordower, J. H. (1994). Zenuwgroeifactor-achtige immunoreactieve profielen in de primaat basale voorhersenen en hippocampusvorming. J. Comp. Neurol. 341, 507–519. doi: 10.1002 / cne.903410407
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Pascual, M., Rocamora, N., Acsady, L., Freund, T. F., and Soriano, E. (1998). Expressie van zenuwgroeifactor en neurotrophin-3 mRNAs in hippocampale interneurons: morfologische karakterisering, niveaus van expressie, en colokalisatie van zenuwgroeifactor en neurotrophin-3. J. Comp. Neurol. 395, 73–90. doi: 10.1002 / (SICI)1096-9861(19980525)395:1<73::steun-CNE6>3.0.CO; 2-E
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Pasteels, B., Miki, N., Hatakenaka, S., and Pochet, R. (1987). Immunohistochemische kruisreactiviteit en elektroforetische comigratie tussen calbindin D-27 kDa en visinine. Brain Res. 412, 107-113. doi: 10.1016/0006-8993(87)91444-2
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Patz, S., en Wahle, P. (2006). Ontwikkelingsveranderingen van neurotrophin mRNA-expressie in de lagen van de visuele cortex van de rat. Euro. J. Neurosci. 24, 2453–2460. doi: 10.1111 / j. 1460-9568.2006.05126.X
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Pitts, A. F., and Miller, M. W. (2000). Expressie van zenuwgroeifactor, neurotrofische factor uit de hersenen en neurotrofine-3 in de somatosensorische cortex van de volwassen rat: coexpressie met neurotrofin-receptoren met hoge affiniteit. J. Comp. Neurol. 418, 241–254. doi: 10.1002/(SICI)1096-9861(20000313)418:3<241::steun-CNE1>3.0.CO;2-M
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Prakash, N., Cohen-Cory, S., and Frostig, R. D. (1996). Snelle en tegengestelde effecten van BDNF en NGF op de functionele organisatie van de volwassen cortex in vivo. Nature 381, 702-706. doi: 10.1038 / 381702a0
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Prakash, N., Cohen-Cory, S., Penschuck, S., and Frostig, R. D. (2004). Het cholinerge systeem van het basale forebrain is betrokken bij de snelle zenuwgroeifactor (NGF)-geïnduceerde plasticiteit in de vatschors van volwassen ratten. J. Neurophysiol. 91, 424–437. doi: 10.1152 / jn.00489.2003
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Ribak, C. E., Vaughn, J. E., and Saito, K. (1978). Immunocytochemische lokalisatie van glutaminezuur decarboxylase in neuronale somata na colchicine remming van axonaal transport. Brain Res. 140, 315-332. doi: 10.1016/0006-8993(78)90463-8
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Rossi, F. M., Sala, R., and Maffei, L. (2002). Expressie van de zenuwgroeifactorreceptoren TrkA en p75NTR in de visuele cortex van de rat: ontwikkeling en regulatie door de cholinerge input. J. Neurosci. 22, 912–919.
Pubmed Abstract / Pubmed Full Text
Rylett, R. J., Goddard, S., Schmidt, B. M., and Williams, L. R. (1993). Acetylcholine synthese en afgifte na continue intracerebrale toediening van NGF bij volwassen en oude Fischer-344 ratten. J. Neurosci. 13, 3956–3963.
Pubmed Abstract / Pubmed Full Text
Schubert, P., Kreutzberg, G. W., en Lux, H. D. (1972). Neuroplasmisch transport in dendrieten: effect van colchicine op morfologie en fysiologie van motoneuronen in de kat. Brain Res. 47, 331-343. doi: 10.1016/0006-8993(72)90643-9
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Shelton, D. L., and Reichardt, L. F. (1986). De Studies over de uitdrukking van het gen van de de groeifactor (NGF) van de bèta zenuw in het centrale zenuwstelsel: niveau en regionale distributie van NGF mRNA suggereren dat NGF als trofische factor voor verscheidene verschillende populaties van neuronen functioneert. Proc. Natl. Acad. Sci. U. S. A. 83, 2714-2718. doi: 10.1073 / pnas.83.8.2714
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Sofroniew, M. V., Howe, C. L., and Mobley, W. C. (2001). Zenuwgroeifactor signalering, neuroprotectie en neuraal herstel. Annu. Rev. Neurosci. 24, 1217–1281. doi: 10.1146 / annurev.neuro.24.1.1217
CrossRef volledige tekst
Stephens, H. E., Belliveau, A. C., Gupta, J. S., Mirkovic, S., and Kablar, B. (2005). De rol van neurotrophins in het onderhoud van de ruggenmergmotorneuronen en de dorsale wortelganglia proprioceptieve sensorische neuronen. Int. J. Dev. Neurowetenschappen. 23, 613–620. doi: 10.1016 / j. ijdevneu.2005.07.002
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Tuszynski, M. H., Armstrong, D. M., and Gage, F. H. (1990). Basaal forebrain celverlies na fimbria / fornix doorsnede. Brain Res. 508, 241–248. doi: 10.1016 / 0006-8993 (90)90402-W
CrossRef volledige tekst
Xiang, Z., Huguenard, J. R., and Prince, D. A. (1998). Cholinerge switching binnen neocorticale remmende netwerken. Wetenschap 281, 985-988. doi: 10.1126 / wetenschap.281.5379.985
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Yazaki-Sugiyama, Y., Kang, S., Cateau, H., Fukai, T., en Hensch, T. K. (2009). Bidirectionele plasticiteit in snelle GABA-circuits door visuele ervaring. Natuur 462, 218-221. doi: 10.1038 / nature08485
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Zaborszky, L., Pang, K., Somogyi, J., Nadasdy, Z., and Kallo, I. (1999). Het corticopetale systeem van de basale voorhersenen is opnieuw bekeken. Anne. N. Y. Acad. Sci. 877, 339–367. doi: 10.1111 / j. 1749-6632.1999.tb09276.X
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Zhang, H. T., Li, L. Y., Zou, X. L., Song, X. B., Hu, Y. L., Feng, Z. T., et al. (2007). Immunohistochemische distributie van NGF, BDNF, NT-3 en NT-4 in volwassen resusapen hersenen. J. Histochem. Cytochem. 55, 1–19. doi: 10.1369/jhc.6A6952.2006
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text