Úvod
glyoxylát cyklu obchází dekarboxylace kroky Krebsova cyklu a způsobuje asimilaci tekutý uhlík z acetyl-CoA. Izocitrát lyáza (EC 4.1.3.1) a malátsyntáza (EC 2.3.3.9) jsou jedinými enzymy pro tuto metabolickou dráhu. Na glyoxylát cyklu dochází při klíčení semen (Eastmond & Graham, 2001), v některých bezobratlých, jako je C. elegans (Edwards, Poradí, Brito, Canfield, & Bradshaw, 2013) a na mikroorganismy, jako jsou E. coli (Nelson & Cox, 2009) a S. cerevisiae (Rezaei, Aslankoohi, Verstrepen, & Courtin, 2015). Cesta byla popsána v roce 1957 během studií na mikroorganismech, které rostly na acetátu a ethanolu jako zdroj uhlíku (Kornberg & Krebs, 1957).
Acetyl-CoA v glyoxylát cyklu váže na oxalacetát, respektive produkci citrátu a isocitrate. Ten produkuje glyoxylát a sukcinát v reakci katalyzované isocitrátovou lyázou. Dále, glyoxylát kondenzuje s druhým acetyl-CoA molekuly v reakci katalyzované malát syntázy, po malát vyrábí je oxidován na oxalacetát a tak regeneraci intermediate (kroky B-1 až B-5, Obr. 1). Dva acetyl-CoA molekul jsou zavedeny v každém opakování glyoxylát cyklu a kapalina syntézu jedna molekula sukcinátu dochází (Beeckmans, 2009; Berg, Stryer, & Tymoczko, 2015; Torres & Marzzoco, 2007).
Dále, sacharidy vyrobené z rezervních lipidů v olejnatá semena jsou distribuovány do závodu a využívány jako zdroj uhlíku, dokud chloroplasty začnou rozlišovat v folioles a začít fotosyntézu. Tuky a oleje jsou důležitými chemickými strukturami při ukládání uhlíku mnoha semen, i když ve snížené formě, zahrnující důležité agronomické druhy, jako je sója, arašídy, Bavlna a slunečnice (Junqueira, 2012). Kyseliny laurové (12: 0), myristové (14:0), palmitové (16:0) a stearové (18:0) jsou nejdůležitějšími nasycenými mastnými kyselinami v zelenině; vzhledem k tomu, nenasycených kyselin jsou kyselina olejová (18:1(Δ9)), kyselina linolová (18:2(Δ9, 12)) a linolenové kyseliny (18:3(Δ9, 12, 15)) (Taiz & Zeiger, 2002).

Obrázek 1.
Mastných kyselin nebo acetát katabolismu k výrobě energie prostřednictvím glyoxylát cyklu, prokazující integraci betweenß-oxidace(kroky A-1 až A-4), glyoxylát cyklu (kroky B-1 až B-5), Krebsův cyklus (kroky C-1through C-8), glukoneogeneze (kroky D-1 až D-3) a glykolýzy (krok E-1).
mastné kyseliny s párovým počtem uhlíků nevedou k syntéze uhlohydrátů u zvířat (Nelson & Cox, 2009). K této skutečnosti dochází, protože neexistuje žádná čistá produkce oxaloacetátu na podporu glukoneogeneze, protože v tomto případě jsou mastné kyseliny katabolizovány na acetyl-CoA. Prostřední je oxidován v Krebsově cyklu, a pro každé dva uhlíky, které vstupují jako acetyl-CoA o dva uhlíky jsou ztraceny jako CO2 (Eastmond & Graham, 2001; Nelson & Cox, 2009).
absence glyoxylátového cyklu u savců může být cílem selektivní toxicity při vývoji antimikrobiálních látek. Inhibiční aktivita 3-nitropropionamidů na isocitrát lyázu u m. tuberculosis (Sriram et al ., 2011), bromofenoly (Oh a kol., 2010) a alkaloidy z hub na isocitrát lyase v C. albicans (Lee et al., 2008; Oh a kol., 2010) byly analyzovány.
v literatuře nejsou žádné údaje o energetických aspektech zahrnujících lipidový katabolismus prostřednictvím glyoxylátového cyklu. V tomto kontextu současného výzkumu zkoumali vztah mezi množstvím vyrobené energie v glyoxylát cyklu, s mastných kyselin-velikost řetězu, a ve srovnání energetické účinnosti v buňkách, které používají tento přístup, u živočišných buněk chybí glyoxylát cyklu.
Materiála metody
energetická bilance kroků s výrobou a spotřebou energie byl proveden s cílem získat rovnici, která se vztahuje přímo na řetěz velikosti mastné kyseliny s počtem uhlíků násobek 4, s energií, produkoval jeho degradaci. Ve generované rovnici nebyly započítány náklady na energii spojené s aktivací mastné kyseliny pro acyl-CoA. Je to krok před β-oxidací a zahrnuje rozbití dvou vysokoenergetických fosfátových vazeb.
navrhované rovnice byla ověřena porovnáním ATP částka získaná jeho uplatňování, s ATP sazby získané přidáním ATP množství vyrobené oxidativní fosforylace a úroveň substrátu fosforylace v každý krok metabolické dráhy, které se účastní degradace mastných kyselin zahrnující glyoxylát cyklu. Mastné kyseliny degradace zahrnuje β-oxidace v glyoxysomes, glyoxylát cyklus, Krebsův cyklus, část glukoneogeneze a glykolýza, dekarboxylace pyruvátu a znovu Krebsova cyklu (Obrázek 1).
energetická účinnost degradace mastných kyselin zahrnující glyoxylátový cyklus byla porovnána s katabolismem mastných kyselin v živočišných buňkách. Rovnice dříve ověřeny byly použity v tomto srovnání a množství energie vyrobené v β-oxidaci, jak se vyskytuje u zvířat byla vypočtena (Gonçalves, Valduga, & Pereira, 2012), spolu rovnic vyvinula v současný výzkum. Energetické účinnosti faktor v glyoxylát cyklu (E%) byla definována poměrem ATP vyrábí ve mastných kyselin katabolismus s přihlédnutím na glyoxylát cyklu a zvíře katabolismu. Parametr byl vynesen proti počtu atomů uhlíku mastné kyseliny. Kromě toho byla rychlost ATP produkovaná jednotou CH2 reprezentována jako funkce počtu uhlíků řetězce mastných kyselin. GrapPad Prism 6.0 vygeneroval matematické modely, které představovaly vztah mezi proměnnými.
výsledkya diskuse
mitochondriální matrice je hlavním místem, kde dochází k oxidaci mastných kyselin v živočišných buňkách. Nicméně, katabolismus těchto biomolekul se vyskytuje hlavně v peroxizómech z listových tkání a v glyoxysomes průběhu rostlin, klíčení semen (Buchanan, Gruissem, Vickers, & Jones, 2015). Degradace mastných kyselin v glyoxysomech zahrnuje metabolické dráhy uvedené v tabulce 1.
Paralelně k výrobě energie, přeměny mastných kyselin na sacharidy má další funkce, jako je výroba strukturální polysacharidy a nukleotidy prostřednictvím pentózového cyklu (Nelson & Cox, 2009). Pokud jde energetický zisk, kratší a více energeticky úsporný způsob, pravděpodobně vybrán evoluce, obsahuje glukoneogeneze, dokud fosfoenolpyruvátu (krok D-3 na Obrázku 1), degradován na glycolytic pathway.
Množství energie (ATP) vyprodukovaných během glyoxysomal degradace mastných kyselin
množství ATP (x) výsledný fromglyoxysomal degradace mastných kyselin s počtem uhlíků násobek 4, následovány glukoneogeneze, dokud fosfoenolpyruvátu a jeho katabolismu, k výrobě energie,lze vypočítat součtem ATP sazby vyrobené a spotřebované v β-oxidaci (ATP, β-OX), glyoxylát cyklu (ATP C GLYOX),Krebsův cyklus (ATP C KREBS), glukoneogeneze (ATP OXAL-PEP) a glykolýzy /Krebsův cyklus znovu (ATP PEP-CO2), podle Rovnice (1):

Každou přestávku uhlík-uhlík bondduring β-oxidace v glyoxysomes a peroxizómech vyprodukuje jedno NADH + h+, které, inoxidative fosforylace, produkuje 2.5 Atp (stupeň A-3 na Obrázku 1). V peroxizómech,elektron, energie, odstraněny během prvního kroku β-oxidace se rozptýlí jako teplo (stepA-1 na Obrázku 1).

proto neexistuje žádná čistá energie z oxidace FADH2 (Buchanan et al ., 2015). Protože α uhlík je esterifikován koenzymem a, dochází k β-oxidaci 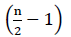 krát, kde n je číslo uhlíku v řetězci mastných kyselin. Na Atp, množství produkované β-oxidaci na glyoxylát cycleis dána Rovnicí (2):
krát, kde n je číslo uhlíku v řetězci mastných kyselin. Na Atp, množství produkované β-oxidaci na glyoxylát cycleis dána Rovnicí (2):

Pro každé dva acetyl-CoA moleculesdirected na glyoxylát cyklu, tam je čistá výroba jednoho succinatemolecule, což odpovídá polovině acetyl-CoA množství, tak, že n/4succinate molekuly jsou produkovány. V Krebsově cyklu, sukcinát je oxidizedto oxalacetátu, výrobu 1 FADH2 a 1 NADH + h+, který produkuje 4 ATP v oxidativephosphorylation (kroky C-6 a C-8, Obrázek 1). Tato hodnota vynásobí n/4succinate molekul je vyjádřena Rovnicí (3), což představuje ATPamount vyrábí jako první v Krebsově cyklu:

regenerace oxalacetate inglyoxylate cyklus zahrnuje oxidace malátu, který produkuje 1 NADH, že yields2.5 Atp v oxidativní fosforylace (krok B-5 na Obrázku 1). V důsledku toho, množství energie (ATP) vyprodukovaných v glyoxylát cyklu, může být vyjádřena Rovnicí(4):

Přebytek oxalacetátu vyrábí v Krebscycle může být zaměřena na glukoneogenezi. Za účelem výroby energieglukoneogeneze se vyskytuje ve formaci fosfoenolpyruvátu s 1 GTP spotřebovaným (stepD3 na obrázku 1), vyjádřeným v rovnici (5). Pokračování glukoneogenezepro tvorbu metabolitů odvozených z hexózy je důležitým procesemklíčení semen (Buchanan et al ., 2015; Eastmond & Graham, 2001; Quettier& Eastmond, 2009) :

Fosfoenolpyruvátu catabolisminvolves substrát-úroveň fosforylace, která produkuje pyruvát (krok E-1,Obrázek 1), oxidační dekarboxylace pyruvátu (krok F-1) s 1 NADHproduction, a acetyl-CoA-oxidací na CO2. V acetyl-CoA oxidační, deformací 3 NADH, 1 FADH2 a 1 GTP odpovídá 10 vysoké energetické phosphatebonds. Tato hodnota přidaná k úrovni substrátu fosforylace a oxidační fosforylace spojené s NADH generovanou dekarboxylací pyruvátu, celkem 13,5 ATP (rovnice 6).

nahrazení rovnic (2), (3), (4),(5) a (6) v rovnici (1) se získá rovnice (7). Při zjednodušení rovnice (8) stanoví přímý poměr mezi množstvím vyrobené energie (x) a velikostí řetězce mastných kyselin (n).

Validationof Rovnice (8) pro výpočet energie (ATP) produkován mastných acidsdegradation přes glyoxylát cyklu
Tak, že Rovnici (8) může být ověřena,ATP množství, získané z jeho použití, byl ve srovnání s ATP amountcalculated individuálně z součet z acetyl-CoA, NAHD a FADH2 moleculesnumber, a úroveň substrátu fosforylace, generované v oxidaci offatty kyselin s konkrétní čísla atomů uhlíku v glyoxysomes (Tabulka 2). V obou podmínkách jsou získané množství ATP ekvivalentní. Užívání těchto equivalentresults v úvahu, rovnice vyvinut v aktuální studie determinedthe množství energie vyrobené v katabolismu lipidů, vzhledem k tomu, integraci ofmetabolic cesty, které zahrnuje více než dvacet kroků.

Navíc, energetická bilance forgenerating rovnic, následuje jejich ověření, může být důležitým nástrojem analýzy různých metabolických drah. V biochemii lze přistupovat k aspektům, jako jsou stechiometrické vztahy v metabolických drahách, pomocí výsledků současného výzkumu.

Comparisonbetween účinnost mastných kyselin‘ degradace glyoxylát cyklu a animalcatabolism
Podle předchozí studie, množství energie v živočišné buňky produkované v ATP mastné kyseliny degradationwith uhlíky pár číslo může být algebraicky týkající se řetěz velikost fattyacid. Tento vztah je vyjádřen rovnicí (9) (Gonçalves et al., 2012), které lze porovnat s rovnicí (8) vyvinutou v současné studii. Na twoequations mohou být použity k porovnání energetické účinnosti mezi ß-oxidaci v animalcells a organismů, buněk, kde glyoxylát cyklu dochází.

dělením Rovnice (8) do Rovnice(9) a vynásobí 100, procento účinnosti (E%) mastných kyselin degradationto výrobě energie se získává, v případě dobrých katabolismu, jako expressedby Rovnice (10).

vynesením e% na délku řetězce mastných kyselin (Obrázek 2) se ověřuje, že účinnost klesá s nárůstem uhlovodíkového řetězce. Kromě toho energie získaná oxidací mastných kyselin v buňkách glyoxylátovým cyklem dosahuje méně než 90% energetické úrovně, která by byla generována podobnou cestou v živočišné buňce.
ATP míru vyrobeného na oxidovaný atom uhlíku (ATP/n) je také závislá na mastné kyseliny o délce řetězce, v maximální výši téměř šest ATP/n (viz Obrázek 3-a), vzhledem k tomu, že tato sazba je vyšší u živočišných buněk (Obr 3-b).

Obrázek 2.
srovnání energetické účinnosti degradace mastných kyselin při β-oxidaci zvířat a β-oxidaci v organismech pomocí enzymů glyoxylátového cyklu v důsledku řetězce délky mastných kyselin.
na rozdíl od zvířat, zeleninya některé mikroorganismy jsou schopny přeměnit acetyl-CoA z oxidace mastných kyselin na cukry. Organismy kombinují glyoxylátový cyklus a glukoneogenesisreakce, které jsou rozděleny mezi glyoxysomy / peroxisomy, mitochondrie a cytosol. Tato funkce poskytuje vyšší metabolické všestrannost,což umožňuje bakterie využít acetát jako zdroj energie a rostliny storelipids v semena jako zdroj energie, aby být použity během klíčení.

obrázek 3.
rychlost ATP produkovaná atomem uhlíku (ATP / n) v důsledku atomů uhlíku (n) v kyselém tuku v glyoxylátovém cyklu (a) a katabolismu zvířat (b). Rychlost ATP / n se významně zvyšuje, dokud neasi n = 20, od té doby se rychlost zvyšuje méně významným způsobem.
Závěr
degradace mastných kyselin, které glyoxylát cyklu pro výrobu energie zahrnuje β-oxidace, s jeho zvláštní vlastnosti v glyoxysomes, glyoxylát cyklus, Krebsův cyklus, glukoneogeneze a glykolýzy. I přes tyto kroky a metabolické dráhy lze z algebraického hlediska stanovit stechiometrický vztah mezi délkou řetězce mastných kyselin a množstvím energie produkovaným při jeho degradaci.
srovnání mezi stechiometrie energický zapojených do těchto metabolických drah a stechiometrie aktivní β-oxidace se vyskytuje v živočišných buňkách, ukazuje, snížení energetické účinnosti, když ve srovnání se metabolismu zvířat. Zatímco obchvat dekarboxylace reakce Krebsova cyklu poskytuje evoluční adaptace na organismy, pokud je přítomen, určuje také menší množství generované energie na atom uhlíku oproti mastných kyselin zhoršování u zvířat.