introduktion
glyoksylat cyklus omgår dekarboksyleringstrin Krebs cyklus og forårsager assimilering af flydende carbon fra acetyl-CoA. Isocitrat lyase (EC 4.1.3.1) og malatsyntase (EC 2.3.3.9) er de eneste tegn på denne metaboliske vej. Glyoksylat cyklus forekommer i frøspiring (Eastmond & Graham, 2001), i nogle hvirvelløse dyr, såsom C. elegans (Edvard, Copes, Brito, Canfield, & Bradshav, 2013) og i mikroorganismer, såsom E. coli (Nelson & Costin, 2009) og S. cerevisiae (Resaei, Aslankoohi, Verstrepen, & Courtin, 2015). Vejen blev beskrevet i 1957 under undersøgelser af mikroorganismer, der voksede på acetat og ethanol som kulstofkilde (Kornberg & Krebs, 1957).
Acetyl-CoA i glyoksylat-cyklussen bindes med henholdsvis citrat og isocitrat. I de fleste tilfælde kan det være nødvendigt at anvende en række forskellige metoder til behandling af denne sygdom. Endvidere kondenseres glyoksylat med et andet acetyl-CoA-molekyle i en reaktion katalyseret af malatsyntase, efter at det producerede malat er iltet til oksaloacetat og således regenererer mellemproduktet (trin B-1 til B-5, Figur 1). To acetyl-CoA-molekyler introduceres ved hver gentagelse af glyoksylat-cyklussen, og væskesyntesen af et succinatmolekyle forekommer (Beeckmans, 2009; Berg, Stryer, & Tymocko, 2015; Torres & Marc, 2007).
endvidere fordeles kulhydrater produceret af reservelipider i oliefrø til planten og anvendes som kulstofkilde, indtil kloroplasterne begynder at differentiere i foliolerne og starte fotosyntese. Fedtstoffer og olier er vigtige kemiske strukturer i kulstoflagring af mange frø, omend i reduceret form, der omfatter vigtige agronomiske arter som sojabønne, jordnødde, bomuld og solsikke (Junkeira, 2012). Laurinsyre (12:0), myristiske (14:0), palmitinsyre (16:0) og stearinsyre (18: 0) er de vigtigste mættede fedtsyrer i grøntsager; der henviser til, at umættede syrer er oliesyre (18:1(lit 9)), linolsyre (18:2(lit 9, 12)) og linolensyre (18:3(lit 9, 12, 15)) (lit & lit, 2002).

Figur 1.
fedtsyrer eller acetatkatabolisme til at producere energi gennem glyoksylat-cyklussen, hvilket viser integrationen mellem glyoksylat-cyklus(trin A-1 til a-4), Glyoksylat cyklus (trin B-1 til B-5), Krebs cyklus (trin C-1 gennem C-8), glukoneogenese (trin D-1 til D-3) og glykolyse (trin E-1).
fedtsyrer med et par antal carbonatomer resulterer ikke i kulhydratsyntese hos dyr (Nelson & KKS, 2009). Denne kendsgerning opstår, fordi der ikke er nogen nettoproduktion af oksaloacetat til støtte for glukoneogenese, da fedtsyrer i dette tilfælde kataboliseres til acetyl-CoA. Mellemproduktet iltes i Krebs-cyklus, og for hver to carbonatomer, der kommer ind som acetyl-CoA, går to carbonatomer tabt som CO2 (Eastmond & Graham, 2001; Nelson & KKS, 2009).
fraværet af glyoksylat-cyklussen hos pattedyr kan være et mål for selektiv toksicitet i udviklingen af antimikrobielle midler. Den inhiberende aktivitet af 3-nitropropionamider på isocitrat lyase i M. tuberculosis (Sriram et al., 2011), bromphenoler (Oh et al., 2010) og alkaloider fra svampe på isocitrat lyase i C. albicans (Lee et al., 2008; Oh et al., 2010) er blevet analyseret.
der er ingen data i litteraturen om de energiske aspekter, der involverer lipidkatabolisme via glyoksylat-cyklussen. I denne sammenhæng undersøgte den nuværende forskning forholdet mellem mængden af energi produceret i glyoksylat-cyklussen med fedtsyrekædestørrelse og sammenlignede energieffektivitet i celler, der bruger denne tilgang, med de dyreceller, der mangler glyoksylat-cyklussen.
materialeog metoder
en energibalance af trin med produktion og forbrug af energi blev udført for at opnå en ligning, der direkte relaterer kædestørrelsen af en fedtsyre med et carbonantal multiplum af 4, med den energi, der produceres ved dets nedbrydning. I den genererede ligning blev energiomkostningerne involveret i aktiveringen af fedtsyren for acyl-CoA ikke medregnet. Det er et skridt forud for kalsiltning og indebærer brud på to højenergifosfatbindinger.
den foreslåede ligning blev valideret ved at sammenligne ATP-mængde opnået ved dens anvendelse med ATP-hastigheder opnået ved tilsætning af ATP-mængde produceret ved oksidativ phosphorylering og substratniveauphosphorylering i hvert trin i de metaboliske veje, der deltager i fedtsyredbrydning, der involverer glyoksylat-cyklussen. Det er en af de mest almindelige årsager til, at der er tale om en nedbrydning af fedtsyre, der er forbundet med glyoksysomer, Krebs-cyklus, en del af glukoneogenese og glykolyse, pyruvat-dekarboksylation og igen Krebs-cyklus (Figur 1).
energieffektiviteten af nedbrydning af fedtsyrer, der involverer glyoksylat-cyklussen, blev sammenlignet med katabolisme af fedtsyrer i dyreceller. Ligninger, der tidligere blev valideret, blev anvendt i denne sammenligning, og den energimængde, der blev produceret i dyr, som forekommer hos dyr, blev beregnet (Gonoralves, Valduga, & Pereira, 2012), koblet til ligninger udviklet i nuværende forskning. Energieffektivitetsfaktoren i glyoksylat-cyklussen (e%) blev defineret ved forholdet mellem ATP produceret i fedtsyrekatabolisme under hensyntagen til glyoksylat-cyklussen og dyrekatabolisme. Parameteren blev afbildet mod antallet af carbonatomer af fedtsyre. Endvidere blev ATP-hastighed produceret af CH2-enhed repræsenteret som en funktion af antallet af carbonatomer i fedtsyrekæden. GrapPad Prism 6.0 genererede de matematiske modeller, der repræsenterede forholdet mellem variablerne.
Resultaterog diskussion
mitokondriematricen er det vigtigste sted, hvor iltningen af fedtsyrer forekommer i dyreceller. Imidlertid forekommer katabolismen af disse biomolekyler hovedsageligt i bladvævets peroksisomer og i glyoksysomer under planternes frøspiring (Buchanan, Gruissem, Vickers, & Jones, 2015). Nedbrydningen af fedtsyrer i glyoksysomer omfatter de metaboliske veje vist i tabel 1.
parallelt med energiproduktion har omdannelsen af fedtsyrer til kulhydrater andre funktioner, såsom produktion af strukturelle polysaccharider og nukleotider gennem pentosefosfatvejen (Nelson & KKS, 2009). Med hensyn til energiforøgelse inkluderer den kortere og mere energisk økonomiske måde, sandsynligvis valgt ved evolution, glukoneogenese indtil phosphoenolpyruvat (trin D-3 i Figur 1), nedbrudt af den glykolytiske vej.
energimængde (ATP) produceret under glyoksysomal nedbrydning af fedtsyrer
ATP-mængde (H) som følge af glyoksysomal nedbrydning af fedtsyrer med carbonantal multiplum af 4, efterfulgt af glukoneogenese indtil phosphoenolpyruvat og dets katabolisme, til at producere energi,kan beregnes ved summen af ATP-hastigheder produceret og forbrugt i C glyoks), Krebs cyklus (ATP C Krebs),glukoneogenese (ATP oksal-Pep) og glykolyse /Krebs cyklus igen (ATP pep-CO2), ifølge ligning (1):

hvert brud på carbon-carbon-bindingen i glyoksysomer og peroksisomer producerer en NADH, som inoksidativ phosphorylering producerer 2,5 ATP ‘ er (trin a-3 i Figur 1). I peroksisomer spredes elektronenergien,der blev fjernet under det første trin af koloksidering, som varme (stepA-1 i Figur 1).

derfor er der ingen nettoenergi fra FADH2-iltningen (Buchanan et al., 2015). Da karbon er esterificeret med coensym A, forekommer karbon-iltning 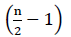 gange, hvor n er carbon-tallet i fedtsyrekæden. Den ATPs-mængde, der produceres ved hjælp af glyoksylat-cyklus, er givet ved ligning (2):
gange, hvor n er carbon-tallet i fedtsyrekæden. Den ATPs-mængde, der produceres ved hjælp af glyoksylat-cyklus, er givet ved ligning (2):

for hver to acetyl-CoA-molekylerrettet mod glyoksylatcyklussen er der en nettoproduktion af et succinatmolekyle, hvilket svarer til halvdelen af acetyl-CoA-mængden, således at n/4succinatmolekyler produceres. I Krebs-cyklussen iltes succinatet til oksaloacetat, der producerer 1 FADH2 og 1 NADH, der producerer 4 ATP i oksidativphosphorylering (trin C-6 og C-8, figur 1). Denne værdi multipliceret med n / 4succinatmolekyler udtrykkes ved ligning (3), som repræsenterer ATPamount produceret først i Krebs-cyklussen:

det er en af de mest almindelige metoder, der anvendes til behandling af denne type phosphorylering, og som anvendes til behandling af denne type phosphorylering (trin b-5 i Figur 1). Derfor kan mængden af energi (ATP) produceret i glyoksylat cyklus udtrykkes ved ligning(4):

overskydende oksaloacetat produceret i Krebscycle kan være rettet mod glukoneogenese. For at producere energi, dengluconeogenese forekommer i phosphoenolpyruvatdannelsen, med 1 GTP brugt (stepD3 i Figur 1), udtrykt i ligning (5). Glukoneogenesens fortsættelsefor dannelsen af metabolitter afledt af geksose er en vigtig proces, der spiser frø (Buchanan et al., 2015; Eastmond & Graham, 2001; Cettier& Eastmond, 2009):

Phosphoenolpyruvatkatabolismeinvolverer en phosphorylering på substratniveau, der producerer pyruvat (trin E-1,Figur 1), iltning af pyruvat (trin F-1) med 1 Nadproduktion og acetyl-CoA-iltning til CO2. Ved acetyl-CoA-iltning svarer produktionen af 3 NADH, 1 FADH2 og 1 GTP til 10 fosfatbindinger med høj energi. Denne værdi tilføres substratniveauet phosphorylering og iltning phosphorylering forbundet med NADH genereret dekarboksylation af pyruvat, i alt 13,5 ATP(ligning 6).

substituerende ligninger (2), (3), (4),(5) og (6) i ligning (1) opnås ligning (7). Når det forenkles algebraisk, etablerer ligning (8) et direkte forhold mellem mængden af produceret energi og størrelsen af fedtsyrekæden (n).

validering af ligning (8) for at beregne energien (ATP) produceret ved fedtsyrerdegradering gennem glyoksylat-cyklussen
således at ligning (8) kan valideres,blev ATP-mængden opnået ved dens anvendelse sammenlignet med ATP-mængdenberegnet individuelt ud fra summen af acetyl-CoA -, NAHD-og FADH2-molekylernummer og substratniveau phosphorylering, genereret i iltningen af fedtsyre med et specifikt antal carbonatomer i glyoksysomer (tabel 2). Begge betingelser er de opnåede ATP-mængder ækvivalente. Under hensyntagen til disse ækvivalenteresultater bestemte ligningen udviklet i den nuværende undersøgelse den energimængde, der produceres i lipidkatabolisme, i betragtning af integrationen afmetaboliske veje, der involverer mere end tyve trin.

desuden kan den energiske balance forgenererende ligninger efterfulgt af deres Validering være et vigtigt værktøjtil analyse af forskellige metaboliske veje. I biokemi, aspekter som støkiometriske forhold i metaboliske veje kan kontaktes ved hjælp af resultaterne i den nuværende forskning.

Sammenligningmellem effektiviteten af fedtsyrernes nedbrydning ved glyoksylatcyklus og dyrekatabolisme
ifølge tidligere undersøgelser kan mængden af energi i dyreceller produceret i ATP ved nedbrydning af fedtsyrer med carbonparret være algebraisk relateret til fedtsyrens kædestørrelse. Dette forhold udtrykkes ved ligning (9) (Gonrimalves et al.,2012), som kan sammenlignes med ligning (8) udviklet i den nuværende undersøgelse. De to forhold kan anvendes til at sammenligne energieffektiviteten mellem iltning i celler fra dyr og organismer, hvor glyoksylatcyklussen forekommer.

ved at dividere ligning (8) med ligning(9) og multiplicere med 100 opnås den procentvise effektivitet (E%) af fedtsyredbrydningat producere energi i forhold til dyrekatabolisme som udtrykt ved ligning (10).

planlægning af E% mod fedtsyrekædelængde (figur 2) verificerer, at effektiviteten falder med stigning i carbonhydridkæden. Desuden når den energi, der opnås fra fedtsyreoksidering i celler med glyoksylat-cyklus, mindre end 90% af det energiniveau, der ville blive genereret på samme måde i en dyrecelle.
ATP-hastighed produceret pr.iltet carbonatom (ATP/n) er også afhængig af fedtsyrens længdekæde med en maksimal hastighed tæt på seks ATP/n (figur 3-a), hvorimod denne hastighed er højere i dyreceller (figur 3-B).

figur 2.
sammenligning mellem energieffektiviteten af nedbrydning af fedtsyre i dyreforgiftning og iltning i organismer med glyoksylatcyklus på grund af fedtsyrens længdekæde.
i modsætning til dyr, grøntsagerog nogle mikroorganismer er i stand til at omdanne acetyl-CoA fra fedtsyrernes iltning til sukkerarter. Disse organismer kombinerer glyoksylat cyklus og glukoneogenesisreaktioner, som er opdelt mellem glyoksysomer / peroksisomer,mitokondrier og cytosol. Denne funktion giver højere metabolisk alsidighed, så bakterier kan bruge acetat som energikilde og planter til at opbevare lipider i frøene som energikilde, der skal bruges under spiring.

figur 3.
ATP-hastighed produceret af carbonatom (ATP/n)på grund af syrefedtets carbonatomer (n) i glyoksylat-cyklus (A) og inanimal katabolisme (b). ATP / n-satsen stiger betydeligt indtilcirka n = 20, fremover stiger hastigheden på en mindre signifikant måde.
konklusion
nedbrydning af fedtsyrer ved hjælp af glyoksylat-cyklussen til produktion af energi involverer glyoksysidering med dets særlige egenskaber i glyoksysomer, Glyoksylat-cyklus, Krebs-cyklus, glukoneogenese og glykolyse. På trods af disse trin og metaboliske veje kan der etableres et støkiometrisk forhold mellem fedtsyrernes kædelængde og energimængde produceret i dets nedbrydning i algebraiske termer.
sammenligningen mellem den støkiometriske energi, der er involveret i disse metaboliske veje, og den støkiometriske energi, der forekommer i dyreceller, viser en reduktion i energieffektivitet sammenlignet med dyremetabolisme. Mens bypass af Dekarboksyleringsreaktioner af Krebs-cyklus giver evolutionære tilpasninger til organismerne, når de er til stede, bestemmer den også en mindre energimængde genereret pr.carbonatom sammenlignet med fedtsyrernes nedbrydning hos dyr.