Innledning
glyoksylatsyklusen omgår dekarboksyleringstrinnene I Krebs-syklusen og forårsaker assimilering av flytende karbon fra acetyl-CoA. Isocitratlyase (EC 4.1.3.1) og malatsyntase (EC 2.3.3.9) er de eneste enzymene for denne metabolismeveien. Glyoksylatsyklusen forekommer i frøspredning (Eastmond & Graham, 2001), hos Noen hvirvelløse dyr, Som C. elegans (Edwards, Copes, Brito, Canfield, & Bradshaw, 2013) Og i mikroorganismer, som E. Coli (Nelson & Cox, 2009) og s. cerevisiae (Rezaei, Aslankoohi, Verstrepen, & Courtin, 2015). Banen ble beskrevet i 1957 under studier på mikroorganismer som vokste på acetat Og etanol som karbonkilde (Kornberg & Krebs, 1957).
Acetyl-CoA i glyoksylatsyklusen bindes med oksaloacetat, henholdsvis som produserer citrat og isocitrat. Sistnevnte produserer glyoksylat og succinat i reaksjonen katalysert av isocitratlyase. Videre kondenserer glyoksylat med et andre acetyl-CoA-molekyl i en reaksjon katalysert av malatsyntase, etter at det produserte malatet oksyderes til oksaloacetat og dermed regenererer mellomproduktet(trinn B-1 Til B-5, Figur 1). To acetyl-CoA-molekyler blir introdusert ved hver gjentagelse av glyoksylatsyklusen, og væskesyntesen av ett succinatmolekyl forekommer (Beeckmans, 2009; Berg, Stryer, & Tymoczko, 2015; Torres & Marzzoco, 2007).
videre distribueres karbohydrater produsert fra reserve lipider i oljefrø til anlegget og benyttes som karbonkilde til kloroplastene begynner å skille seg i foliolene og starte fotosyntese. Fett og oljer er viktige kjemiske strukturer i karbonlagring av mange frø, om enn i redusert form, som omfatter viktige agronomiske arter som soyabønner, peanøtter, bomull og solsikke (Junqueira, 2012). Laurinsyre (12:0), myristiske (14:0), palmitinsyre (16:0) og stearinsyre (18:0) er de viktigste mettede fettsyrene i grønnsaker; mens umettede syrer er oljesyre (18:1(Δ9)), linolsyre (18:2(Δ9, 12)) og linolensyre (18:3(Δ9, 12, 15)) (Taiz & Zeiger, 2002).

Figur 1.
Fettsyrer eller acetatkatabolisme tilprodusere energi gjennom glyoksylatsyklusen, som viser integrasjonen mellomß-oksidasjon (trinn A-1 Til a-4), glyoksylatsyklus (trinn B-1 Til B-5), Krebs syklus (trinn C-1 gjennom C-8), glukoneogenese (trinn D-1 Til d-3) og glykolyse (trinn E-1).
Fettsyrer med et par antall karboner resulterer ikke i karbohydratsyntese hos dyr (Nelson & Cox, 2009). Dette faktum oppstår fordi det ikke er netto produksjon av oksaloacetat for å støtte glukoneogenese, siden i dette tilfellet kataboliseres fettsyrer til acetyl-CoA. Mellomproduktet oksideres i Krebs syklus, og for hver to karboner som kommer inn som acetyl-CoA, går to karboner tapt SOM CO2 (Eastmond & Graham, 2001; Nelson & Cox, 2009).
fraværet av glyoksylatsyklusen hos pattedyr kan være et mål for selektiv toksisitet ved utvikling av antimikrobielle midler. Den hemmende aktiviteten av 3-nitropropionamider på isocitratlyase I m. tuberculosis (Sriram et al., 2011), kristin (Et al., 2010) og alkaloider fra svamper på isocitrat lyase I C. albicans (Lee et al., 2008; Et al. 2010) har blitt analysert.
det finnes ingen data i litteraturen om de energiske aspektene som involverer lipidkatabolisme via glyoksylatsyklusen. I denne sammenheng undersøkte den nåværende forskningen forholdet mellom mengden energi som produseres i glyoksylatsyklusen, med fettsyrekjedestørrelse, og sammenlignet energieffektivitet i celler som bruker denne tilnærmingen, med dyrecellene som mangler glyoksylatsyklusen.
Materialand methods
en energibalanse av trinn med produksjon og forbruk av energi ble utført for å oppnå en ligning som direkte relaterer kjedestørrelsen til en fettsyre med et karbon nummer multiplum av 4, med energien produsert av dens nedbrytning. I den genererte ligningen ble energikostnaden involvert i aktiveringen av fettsyren for acyl-CoA ikke regnskapsført. Det er et skritt før β-oksidasjon og innebærer brudd på to høy-energi fosfatbindinger.
den foreslåtte ligningen ble validert ved å sammenligne ATP-mengde oppnådd ved dens anvendelse, MED ATP-hastigheter oppnådd ved tilsetning AV ATP-mengde produsert ved oksidativ fosforylering og substratnivå fosforylering i hvert trinn i metabolske veier som deltar i fettsyre-nedbrytningen som involverer glyoksylatsyklusen. Degraderingen av fettsyren innebærer β-oksidasjon i glyoksysomer, glyoksylatsyklus, Krebs-syklus, del av glukoneogenese og glykolyse, pyruvatdekarboksylering og Igjen Krebs-syklus (Figur 1).
energieffektiviteten av fettsyrenes nedbrytning som involverer glyoksylatsyklusen ble sammenlignet med fettsyrenes katabolisme i dyreceller. Tidligere validerte ligninger ble brukt i denne sammenligningen, og energimengden som ble produsert i β-oksidasjonen som forekommer hos dyr ble beregnet (Gon@alves, Valduga, & Pereira, 2012), koblet til ligninger utviklet i dagens forskning. Energieffektivitetsfaktoren i glyoksylatsyklusen (e%) ble definert av FORHOLDET MELLOM ATP produsert i fettsyrekatabolisme tatt i betraktning glyoksylatsyklusen og dyrekatabolisme. Parameteren ble plottet mot antall karbonatomer av fettsyre. VIDERE BLE ATP-hastighet produsert AV CH2-enhet representert som en funksjon av antall karboner i fettsyrekjeden. GrapPad Prism 6.0 genererte de matematiske modellene som representerte forholdet mellom variablene.
Resultaterog diskusjon
mitokondriellmatrisen er hovedstedet der oksidasjon av fettsyrer forekommer i dyreceller. Katabolismen av disse biomolekylene forekommer imidlertid hovedsakelig i peroksisomene av bladvev og i glyoksysomer under plantens frøspredning (Buchanan, Gruissem, Vickers, & Jones, 2015). Nedbrytningen av fettsyrer i glyoksysomer inkluderer metabolismeveiene vist i Tabell 1.
Parallelt med energiproduksjon har omdannelsen av fettsyrer til karbohydrater andre funksjoner som produksjon av strukturelle polysakkarider og nukleotider gjennom pentosefosfatveien (Nelson & Cox, 2009). Når det gjelder energiøkning, inkluderer den kortere og mer energisk økonomiske måten, sannsynligvis valgt av evolusjon, glukoneogenese til fosfoenolpyruvat (trinn D-3 I Figur 1), degradert av glykolytisk vei.
Mengde energi (ATP) produsert under glyoksysomal degradering av fettsyrer
ATP mengde (x) som følge avglyoksysomal degradering av fettsyrer med karbon tall multiplum av 4, følgtved glukoneogenese til fosfoenolpyruvat og dets katabolisme, for å produsere energi,kan beregnes ved summen AV ATP-priser produsert og konsumert i β-oksidasjon (ATP β-OX), glyoksylatsyklus (ATP C GLYOX),krebs syklus (atp c krebs), Glukoneogenese (ATP oxal-pep) og glykolyse /krebs syklus igjen (atp pep-co2), I HENHOLD TIL LIGNING (1):

Hvert brudd på karbon-karbonbinding under β-oksidasjon i glyoksysomer og peroksisomer produserer EN NADH som, inoksidativ fosforylering, produserer 2,5 ATPs (trinn a-3 I Figur 1). I peroksisomer forsvinner elektronenergien som fjernes i løpet av det første trinnet med β-oksidasjon som varme (stepA-1 I Figur 1).

Derfor er det ingen netto energi FRA FADH2 oksidasjon (Buchanan et al., 2015). Siden α karbon er forestret med koenzym A, oppstår β-oksidasjonen 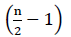 ganger, hvor n er karbonnummeret i fettsyrekjeden. Atps-mengden produsert av β-oksidasjon i glyoksylatsykluser gitt Ved Ligning (2):
ganger, hvor n er karbonnummeret i fettsyrekjeden. Atps-mengden produsert av β-oksidasjon i glyoksylatsykluser gitt Ved Ligning (2):

For hver to acetyl-CoA molekylerrettet til glyoksylatsyklusen, er det en nettoproduksjon av ett succinatmolekyl, som tilsvarer halvparten av acetyl-CoA-mengden, slik at n/4succinatmolekyler produseres. I Krebs syklusen oksyderes succinatet til oksaloacetat, som produserer 1 FADH2 og 1 NADH som produserer 4 ATP i oksidativfosforylering(trinn C-6 Og C-8, Figur 1). Denne verdien multiplisert med n / 4succinatmolekyler uttrykkes Ved Ligning (3), som representerer ATPamount produsert først I Krebs syklusen:

regenerering av oksalacetat inglyoxylat syklus innebærer malatoksidasjon, som produserer 1 NADH som gir2.5 ATPs i oksidativ fosforylering (trinn B-5 I Figur 1). Følgelig kan mengden energi (ATP) produsert i glyoksylatsyklus uttrykkes Ved Ligning(4):

Overskudd av oksaloacetat produsert I Krebscycle kan rettes mot glukoneogenese. For å produsere energi, oppstår gluconeogenese i fosfoenolpyruvatdannelsen, med 1 gtp brukt (trinn 3 I Figur 1), uttrykt I Ligning (5). Glukoneogenesefor dannelsen av metabolitter avledet fra heksose er en viktig prosess ispiring av frø (Buchanan et al., 2015; Eastmond & Graham, 2001; Quettier& Eastmond, 2009):

Fosfoenolpyruvatkatabolismeinnebærer en fosforylering på substratnivå som produserer pyruvat (trinn E-1, Figur 1), oksidativ dekarboksylering av pyruvat (trinn F-1) med 1 Nadhproduksjon og acetyl-CoA-oksidasjon TIL CO2. I acetyl-CoA oksidasjon, theproduction av 3 NADH, 1 FADH2 og 1 gtp tilsvarer 10 høy energi fosfatebonds. Denne verdien legges til substratnivået fosforylering og oksidativ fosforyleringassosiert MED NADH generert dekarboksylering av pyruvat, totalt 13.5 ATP (Ligning 6).

Substituere Ligninger (2), (3), (4),(5) og (6) I Ligning (1) Blir Ligning (7) oppnådd. Når forenkletalgebraisk Etablerer Ligning (8) et direkte forhold mellom mengden avenergi produsert (x) og størrelsen på fettsyrekjeden (n).

Validering Av Ligning (8) for å beregne energien (ATP) produsert av fettsyrerdegradering gjennom glyoksylatsyklusen
slik At Ligning (8) kan valideres,BLE ATP-mengden, oppnådd fra dens anvendelse, sammenlignet med ATP-beløpetberegnet individuelt fra summen av acetyl-CoA, NAHD OG FADH2 molekylertall og substratnivå fosforylering, generert i oksidasjonenfettsyrer med spesifikke antall karbonatomer i glyoksysomer (Tabell 2). Ibegge forholdene er DE OPPNÅDDE ATP-beløpene ekvivalente. Tar disse ekvivalentresultatene i betraktning, ligningen utviklet i dagens studie bestemmetenergimengden produsert i lipidkatabolisme, vurderer integrasjonen avmetabolske veier som involverer mer enn tjue trinn.

Videre er den energiske balansen forgenererende ligninger, etterfulgt av validering, kan være et viktig verktøy for analyse av forskjellige metabolske veier. I Biokjemi, aspekter som støkiometriske relasjoner i metabolske veier kan nærmer seg ved hjelp av resultater i dagens forskning.

Sammenligningmellom effektiviteten av fettsyrenes nedbrytning ved glyoksylatsyklus og dyrekatabolisme
ifølge tidligere studier kan mengden energi i dyreceller produsert I ATP ved nedbryting av fettsyrer med karbonparnummer være algebraisk relatert til kjedestørrelsen til fettsyren. Dette forholdet er uttrykt Ved Ligning (9) (Gon@alves et al., 2012), som kan sammenlignes Med Ligning (8) utviklet i dagens studie. De to ligningene kan brukes til å sammenligne energieffektivitet mellom ß-oksidasjon i dyreceller og organismeceller, der glyoksylatsyklusen oppstår.

ved å dele Ligning (8) Med Ligning (9) og multiplisere med 100, oppnås prosentandelen effektivitet (E%) av fettsyredbrytning for å produsere energi, i forhold til dyrekatabolisme, som uttrykt Ved Ligning (10).

Plotting e% mot fettsyre kjedelengde (Figur 2) bekrefter at effektiviteten avtar med økning i hydrokarbonkjeden. Videre når energien oppnådd fra fettsyreoksydasjon i celler med glyoksylatsyklus mindre enn 90% av energinivået som ville bli generert av den samme ruten i en dyrecelle.
ATP-hastighet produsert per oksidert karbonatom (ATP/n) er også avhengig av fettsyrens lengdekjede, med en maksimal hastighet nær seks ATP/n (Figur 3-a), mens denne hastigheten er høyere i dyreceller (Figur 3-b).

Figur 2.
Sammenligning mellom energetiskeffektivitet av fettsyredegradering i dyr β-oksidasjon og β-oksidasjon i organismer med glyoksylatsyklusenzymer, på grunn av fettsyrens lengdekjede.
Kontrasterende til dyr, grønnsakerog noen mikroorganismer er i stand til å konvertere acetyl-CoA fra fettsyreroksidasjon til sukker. Organismene kombinerer glyoksylatsyklusen og glukoneogenesisreaksjoner, som er oppdelt mellom glyoksysomer / peroksisomer, mitokondrier og cytosol. Denne funksjonen gir høyere metabolsk allsidighet, slik at bakterier kan utnytte acetat som energikilde og planter for å lagre lipider i frøene som energikilde som skal brukes under spiring.

Figur 3.
ATP-hastighet produsert av karbonatom (ATP/n)på grunn av syre fettets karbonatomer (n) i glyoksylatsyklus (a) og livløs katabolisme (b). ATP / n-frekvensen øker betydelig tilomtrent n = 20, fremover øker hastigheten på en mindre signifikant måte.
Konklusjon
nedbrytning av fettsyrer ved glyoksylatsyklusen for produksjon av energi innebærer β-oksidasjon, med sine spesielle egenskaper i glyoksysomer, glyoksylatsyklus, Krebs syklus, glukoneogenese og glykolyse. Til tross for disse trinnene og metabolske veier, kan et støkiometrisk forhold mellom fettsyrenes kjedelengde og energimengde produsert i nedbrytningen bli etablert i algebraiske termer.
sammenligningen mellom støkiometri energisk involvert i disse metabolske veiene og støkiometri energisk av β-oksidasjon som forekommer i dyreceller, viser en reduksjon i energieffektivitet sammenlignet med dyr metabolisme. Mens bypass av dekarboksyleringsreaksjoner Av Krebs syklus gir evolusjonære tilpasninger til organismene når de er tilstede, bestemmer den også en mindre energimengde generert per karbonatom sammenlignet med fettsyrens nedbrytning hos dyr.