Introducción
El ciclo de glioxilato evita los pasos de descarboxilación del ciclo de Krebs y causa la asimilación de carbono líquido del acetil-CoA. La isocitrato liasa (EC 4.1.3.1) y la malato sintasa (EC 2.3.3.9) son las únicas enzimas de esta vía metabólica. El ciclo del glioxilato ocurre en la germinación de semillas (Eastmond & Graham, 2001), en algunos invertebrados, como C. elegans (Edwards, Copes, Brito, Canfield, & Bradshaw, 2013) y en microorganismos, como E. coli (Nelson & Cox, 2009) y S. cerevisiae (Rezaei, Aslankoohi, Verstrepen, & Courtin, 2015). La vía se describió en 1957 durante estudios sobre microorganismos que crecieron en acetato y etanol como fuente de carbono (Kornberg & Krebs, 1957).
El acetil-CoA en el ciclo del glioxilato se une al oxaloacetato, produciendo respectivamente citrato e isocitrato. Este último produce glioxilato y succinato en la reacción catalizada por la isocitrato liasa. Además, el glioxilato se condensa con una segunda molécula de acetil-CoA en una reacción catalizada por la malato sintasa, después de que el malato producido se oxida a oxaloacetato y, por lo tanto, regenera el intermedio (pasos B-1 a B-5, Figura 1). Se introducen dos moléculas de acetil-CoA en cada repetición del ciclo de glioxilato y se produce la síntesis líquida de una molécula de succinato (Beeckmans, 2009; Berg, Stryer, & Tymoczko, 2015; Torres & Marzzoco, 2007).
Además, los carbohidratos producidos a partir de lípidos de reserva en semillas oleaginosas se distribuyen a la planta y se utilizan como fuente de carbono hasta que los cloroplastos comienzan a diferenciarse en los foliolos y comienzan la fotosíntesis. Las grasas y los aceites son estructuras químicas importantes en el almacenamiento de carbono de muchas semillas, aunque en forma reducida, que comprenden especies agronómicas importantes como la soja, el maní, el algodón y el girasol (Junqueira, 2012). Los ácidos láurico (12:0), mirístico (14:0), palmítico (16:0) y esteárico (18:0) son los ácidos grasos saturados más importantes de las verduras; considerando que los ácidos insaturados son el ácido oleico (18:1 (Δ9)), el ácido linoleico(18:2 (Δ9, 12)) y el ácido linolénico(18: 3 (Δ9, 12, 15)) (Taiz & Zeiger, 2002).

Figura 1.
Los ácidos grasos o el catabolismo del acetato producen energía a través del ciclo del glioxilato, evidenciando la integración entre la oxidación-ß(pasos A-1 a A-4), el ciclo del glioxilato (pasos B-1 a B-5), el ciclo de Krebs (pasos C-1 a C-8), la gluconeogénesis (pasos D-1 a D-3) y la glucólisis (paso E-1).
Los ácidos grasos con un par de carbonos no producen síntesis de carbohidratos en animales (Nelson & Cox, 2009). Este hecho ocurre porque no hay producción neta de oxaloacetato para apoyar la gluconeogénesis ya que, en este caso, los ácidos grasos se catabolizan a acetil-CoA. El intermedio se oxida en el ciclo de Krebs, y por cada dos carbonos que entran como acetil-CoA, dos carbonos se pierden como CO2 (Eastmond & Graham, 2001; Nelson & Cox, 2009).
La ausencia del ciclo del glioxilato en los mamíferos puede ser un blanco de toxicidad selectiva en el desarrollo de agentes antimicrobianos. La actividad inhibidora de las 3-nitropropionamidas sobre la isocitrato liasa en M. tuberculosis (Sriram et al., 2011), bromofenoles (Oh et al., 2010) y alcaloides de esponjas sobre isocitrato liasa en C. albicans (Lee et al., 2008; Oh et al., 2010).
No hay datos en la literatura sobre los aspectos energéticos relacionados con el catabolismo lipídico a través del ciclo de glioxilato. En este contexto, la presente investigación investigó la relación entre la cantidad de energía producida en el ciclo de glioxilato, con el tamaño de la cadena de ácidos grasos, y comparó la eficiencia energética en células que utilizan este enfoque, con las células animales que carecen del ciclo de glioxilato.
Materiales y métodos
Se realizó un balance energético de pasos con producción y consumo de energía para obtener una ecuación que relaciona directamente el tamaño de cadena de un ácido graso con un número de carbono múltiplo de 4, con la energía producida por su degradación. En la ecuación generada, no se contabilizó el costo de energía involucrado en la activación del ácido graso para el acil-CoA. Es un paso previo a la β-oxidación e implica la ruptura de dos enlaces de fosfato de alta energía.
La ecuación propuesta se validó comparando la cantidad de ATP obtenida por su aplicación, con las tasas de ATP obtenidas por la adición de la cantidad de ATP producida por fosforilación oxidativa y fosforilación a nivel de sustrato en cada paso de las vías metabólicas que participan en la degradación de ácidos grasos que involucran el ciclo de glioxilato. La degradación de ácidos grasos implica β-oxidación en glioxisomas, ciclo de glioxilato, ciclo de Krebs, parte de la gluconeogénesis y glucólisis, la descarboxilación de piruvato y de nuevo ciclo de Krebs (Figura 1).
Se comparó la eficiencia energética de la degradación de los ácidos grasos en el ciclo del glioxilato con el catabolismo de los ácidos grasos en células animales. En esta comparación se utilizaron ecuaciones previamente validadas y se calculó la cantidad de energía producida en la β-oxidación como ocurre en animales (Gonçalves, Valduga, & Pereira, 2012), acoplada a ecuaciones desarrolladas en la investigación actual. El factor de eficiencia energética en el ciclo del glioxilato (E%) se definió por la proporción de ATP producida en el catabolismo de ácidos grasos, teniendo en cuenta el ciclo del glioxilato y el catabolismo animal. El parámetro se trazó contra el número de átomos de carbono de ácidos grasos. Además, la tasa de ATP producida por la unidad de CH2 se representó en función del número de carbonos de la cadena de ácidos grasos. GrapPad Prism 6.0 generó los modelos matemáticos que representaban la relación entre las variables.
Resultados y discusión
La matriz mitocondrial es el sitio principal donde se produce la oxidación de ácidos grasos en las células animales. Sin embargo, el catabolismo de estas biomoléculas ocurre principalmente en los peroxisomas de los tejidos foliares y en los glioxisomas durante la germinación de las semillas de las plantas (Buchanan, Gruissem, Vickers, & Jones, 2015). La degradación de los ácidos grasos en los glioxisomas incluye las vías metabólicas que se muestran en la Tabla 1.
Paralelamente a la producción de energía, la conversión de ácidos grasos en carbohidratos tiene otras funciones, como la producción de polisacáridos estructurales y nucleótidos a través de la vía de fosfato de pentosa (Nelson & Cox, 2009). En cuanto a la ganancia de energía, la vía más corta y energéticamente más económica, probablemente seleccionada por la evolución, incluye la gluconeogénesis hasta el fosfoenolpiruvato (paso D-3 en la Figura 1), degradado por la vía glucolítica.
La cantidad de energía (ATP) producida durante la degradación glioxisómica de ácidos grasos
La cantidad de ATP (x) resultante de la degradación glioxisómica de ácidos grasos con un número de carbono múltiplo de 4, seguida por la gluconeogénesis hasta que el fosfoenolpiruvato y su catabolismo, para producir energía,puede calcularse mediante la suma de las tasas de ATP producidas y consumidas en el ciclo de β-oxidación (ATP β-OX), glioxilato (ATP C GLIOX),Ciclo de Krebs (ATP C KREBS), gluconeogénesis (ATP OXAL-PEP) y glicólisis /ciclo de Krebs de nuevo (ATP PEP-CO2), según la ecuación (1):

Cada ruptura de la unión carbono-carbono durante la β-oxidación en glioxisomas y peroxisomas produce un NADH que, fosforilación oxidativa, produce 2,5 ATPs (paso A-3 en la Figura 1). En los peroxisomas, la energía de electrones eliminada durante el primer paso de β-oxidación se disipa en forma de calor (paso A-1 en la Figura 1).

Por lo tanto, no hay energía neta de la oxidación FADH2 (Buchanan et al., 2015). Dado que el carbono α se esterifica con coenzima A, la β-oxidación ocurre 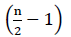 veces, donde n es el número de carbono en la cadena de ácidos grasos. La cantidad de ATPs producida por β-oxidación en el ciclo de glioxilato está dada por Ecuación (2):
veces, donde n es el número de carbono en la cadena de ácidos grasos. La cantidad de ATPs producida por β-oxidación en el ciclo de glioxilato está dada por Ecuación (2):

Por cada dos moléculas de acetil-CoA dirigidas al ciclo de glioxilato, hay una producción neta de una succinatemolécula, que corresponde a la mitad de la cantidad de acetil-CoA, de modo que se producen moléculas de n/4 succinato. En el ciclo de Krebs, el succinato se oxida a oxaloacetato, produciendo 1 FADH2 y 1 NADH que producen 4 ATP en la fosforilación oxidativa (pasos C-6 y C-8, Figura 1). Este valor multiplicado por n / 4 moléculas de succinato se expresa mediante la Ecuación (3), que representa el ATPamount producido primero en el ciclo de Krebs:

La regeneración del ciclo de oxalacetato inglioxilato implica la oxidación de malato, que produce 1 NADH que produce 2,5 ATPs en la fosforilación oxidativa (paso B-5 en la Figura 1). En consecuencia, la cantidad de energía (ATP) producida en el ciclo de glioxilato puede expresarse por Ecuación(4):

El exceso de oxaloacetato producido en Krebscycle puede dirigirse a la gluconeogénesis. Para producir energía, la gluconeogénesis ocurre en la formación de fosfoenolpiruvato, con 1 GTP gastado (paso D3 en la Figura 1), expresado en la Ecuación (5). La continuación de la gluconeogénesis para la formación de metabolitos derivados de la hexosa es un proceso importante de ingestión de semillas (Buchanan et al., 2015; Eastmond & Graham, 2001; Quettier& Eastmond, 2009):

El catabolismo del fosfoenolpiruvato implica una fosforilación a nivel de sustrato que produce piruvato (paso E-1,Figura 1), descarboxilación oxidativa del piruvato (paso F-1) con producción de 1 NADH, y oxidación de acetil-CoA a CO2. En la oxidación de acetil-CoA, la producción de 3 NADH, 1 FADH2 y 1 GTP corresponde a 10 bonos de fosfatos de alta energía. Este valor añadido al nivel de sustrato fosforilación y fosforilación oxidativa asociado con el NADH generó descarboxilación de piruvato, totalizando 13,5 ATP (Ecuación 6).

Sustitución de Ecuaciones (2), (3), (4),(5) y (6) en la ecuación (1), se obtiene la Ecuación (7). Al simplificarse algebraicamente, la ecuación (8) establece una relación directa entre la cantidad de energía producida (x) y el tamaño de la cadena de ácidos grasos (n).

Validación de la ecuación (8) para calcular la energía (ATP) producida por la degradación de ácidos grasos a través del ciclo de glioxilato
Para que la ecuación (8) pueda validarse,la cantidad de ATP, obtenida de su aplicación, se comparó con la cantidad de ATP calculada individualmente a partir de la suma de número de moléculas de acetil-CoA, NAHD y FADH2, y fosforilación a nivel de sustrato, generada en los ácidos grasos de oxidación con números específicos de átomos de carbono en glioxisomas (Tabla 2). En ambas condiciones, las cantidades de ATP obtenidas son equivalentes. Teniendo en cuenta estos resultados equivalentes, la ecuación desarrollada en el estudio actual determinó la cantidad de energía producida en el catabolismo lipídico, considerando la integración de vías metabólicas que involucra más de veinte pasos.

Además, las ecuaciones de generación de equilibrio energético, seguidas de su validación, pueden ser una herramienta importante para el análisis de diferentes vías metabólicas. En bioquímica, aspectos como las relaciones estequiométricas en las vías metabólicas se pueden abordar utilizando losresultados de la investigación actual.

Comparación entre la eficiencia de la degradación de los ácidos grasos por el ciclo de glioxilato y el catabolismo animal
Según estudios anteriores, la cantidad de energía en células animales producida en ATP por la degradación de ácidos grasos con el número de pares de carbonos puede estar algebraicamente relacionada con el tamaño de la cadena del ácido graso. Esta relación se expresa mediante la ecuación (9) (Gonçalves et al., 2012), que puede compararse con la ecuación (8) desarrollada en el presente estudio. Las dos ecuaciones se pueden emplear para comparar la eficiencia energética entre la ß-oxidación en células animales y células de organismos, donde se produce el ciclo de glioxilato.

Dividiendo la Ecuación (8) por la Ecuación(9) y multiplicándola por 100, se obtiene el porcentaje de eficiencia (E%) de degradación de ácidos grasos para producir energía, en relación con el catabolismo animal, expresado por la Ecuación (10).

El trazado de E% contra la longitud de la cadena de ácidos grasos (Figura 2) verifica que la eficiencia disminuye con el aumento de la cadena de hidrocarburos. Además, la energía obtenida de la oxidación de ácidos grasos en células con ciclo de glioxilato alcanza menos del 90% del nivel de energía que se generaría por la ruta similar en una célula animal.
La tasa de ATP producida por átomo de carbono oxidado (ATP/n) también depende de la cadena de longitud del ácido graso, a una tasa máxima cercana a seis ATP/n (Figura 3-a), mientras que esta tasa es mayor en las células animales (Figura 3-b).

Figura 2.
Comparación entre la eficiencia energética de la degradación de ácidos grasos en la β-oxidación animal y la β-oxidación en organismos con enzimas del ciclo de glioxilato, debido a la cadena de longitud de ácidos grasos.
En contraste con los animales, los vegetales y algunos microorganismos son capaces de convertir el acetil-CoA de la oxidación de ácidos grasos en azúcares. Los organismos combinan el ciclo de glioxilato y las reacciones gluconeogenéticas, que están compartimentadas entre glioxisomas / peroxisomas,mitocondrias y citosol. Esta característica proporciona una mayor versatilidad metabólica, lo que permite que las bacterias utilicen acetato como fuente de energía y que las plantas almacenen lípidos en las semillas como fuente de energía que se utilizará durante la germinación.

Figura 3.
Tasa de ATP producida por el átomo de carbono (ATP/n)debido a los átomos de carbono de ácidos grasos (n) en el ciclo de glioxilato (a) y el catabolismo inanimal (b). La tasa de ATP/n aumenta significativamente hasta n = 20, en adelante la tasa aumenta de una manera menos significativa.
Conclusión
La degradación de los ácidos grasos por el ciclo de glioxilato para la producción de energía implica β-oxidación, con sus características particulares en glioxisomas, ciclo de glioxilato, ciclo de Krebs, gluconeogénesis y glucólisis. A pesar de estos pasos y vías metabólicas, se puede establecer una relación estequiométrica entre la longitud de la cadena de ácidos grasos y la cantidad de energía producida en su degradación en términos algebraicos.
La comparación entre la estequiometría energética involucrada en estas vías metabólicas y la estequiometría energética de β-oxidación como ocurre en las células animales, muestra una reducción en la eficiencia energética, en comparación con el metabolismo animal. Mientras que el bypass de las reacciones de descarboxilación del ciclo de Krebs confiere adaptaciones evolutivas a los organismos cuando están presentes, también determina una menor cantidad de energía generada por átomo de carbono en comparación con la degradación de los ácidos grasos en animales.