wprowadzenie
cykl glioksylanowy omija etapy dekarboksylacji cyklu Krebsa i powoduje asymilację ciekłego węgla z acetylo-CoA. Izocyt liaza (EC 4.1.3.1) i syntaza jabłczanowa (EC 2.3.3.9) są jedynymi enzymami tego szlaku metabolicznego. Cykl glioksylanowy występuje w kiełkowaniu nasion (Eastmond & Graham, 2001), u niektórych bezkręgowców, takich jak C. elegans (Edwards, Copes, Brito, Canfield, & Bradshaw, 2013) i mikroorganizmów, takich jak E. coli (Nelson & Cox, 2009) i S. cerevisiae (Rezaei, Aslankoohi, Verstrepen, & Courtin, 2015). Szlak został opisany w 1957 roku podczas badań nad mikroorganizmami, które rosły na octanie i etanolu jako źródle węgla (Kornberg & Krebs, 1957).
acetylo-CoA w cyklu glioksylanowym wiąże się ze szczawiooctanem, odpowiednio wytwarzając cytrynian i izocytrat. Ten ostatni wytwarza glioksylan i bursztynian w reakcji katalizowanej przez liazę izocyjanianową. Co więcej, glioksylan skrapla się z drugą cząsteczką acetylo-CoA w reakcji katalizowanej przez syntazę jabłczanu, po utlenieniu wytworzonego jabłczanu do szczawiooctanu i tym samym regeneracji półproduktu (etapy B-1 do B-5, Fig. 1). Dwie cząsteczki acetylo-CoA są wprowadzane w każdym powtórzeniu cyklu glioksylanowego i następuje płynna synteza jednej cząsteczki bursztynianu (Beeckmans, 2009; Berg, Stryer, & Tymoczko, 2015; Torres & Marzzoco, 2007).
co więcej, węglowodany wytwarzane z rezerwowych lipidów w nasionach oleistych są rozprowadzane do rośliny i wykorzystywane jako źródło węgla, dopóki chloroplasty nie zaczną różnicować się w foliolach i rozpocząć fotosyntezę. Tłuszcze i oleje są ważnymi strukturami chemicznymi w magazynowaniu węgla w wielu nasionach, choć w zredukowanej formie, obejmującej ważne gatunki agronomiczne, takie jak soja, orzeszki ziemne, bawełna i słonecznik (Junqueira, 2012). Kwas laurynowy (12:0), mirystynowy (14:0), palmitynowy (16:0) i stearynowy (18:0) to najważniejsze nasycone kwasy tłuszczowe w warzywach; natomiast kwasami nienasyconymi są kwas oleinowy (18:1(Δ9)), kwas linolowy (18:2(Δ9, 12)) i kwas linolenowy (18: 3 (Δ9, 12, 15)) (Taiz & Zeiger, 2002).

Rysunek 1.
kwasy tłuszczowe lub katabolizm octanu wytwarzają energię w cyklu glioksylanowym, co dowodzi integracji między utlenianiem(etapy a-1 do a-4), cyklem glioksylanowym (etapy B-1 do B-5), cyklem Krebsa (etapy C-1 przez C-8), glukoneogenezą (etapy D-1 do D-3) i glikolizą (etap E-1).
kwasy tłuszczowe o liczbie par węgli nie powodują syntezy węglowodanów u zwierząt (Nelson & Cox, 2009). Fakt ten występuje, ponieważ nie ma produkcji netto szczawiooctanu wspierającego glukoneogenezę, ponieważ w tym przypadku kwasy tłuszczowe są katabolizowane do acetylo-CoA. Związek pośredni utlenia się w cyklu Krebsa, a na każde dwa węgle, które wchodzą jako acetylo-CoA, dwa węgle tracą jako CO2 (Eastmond & Graham, 2001; Nelson & Cox, 2009).
brak cyklu glioksylanowego u ssaków może być celem selektywnej toksyczności w rozwoju środków przeciwdrobnoustrojowych. Aktywność hamująca 3-nitropropionamidów na liazę izocytrynianową w M. tuberculosis (Sriram i wsp ., 2011), bromofenole (Oh et al., 2010) i alkaloidy z gąbek na izocyt liazy w C. albicans (Lee et al., 2008; Oh et al., 2010).
brak danych w literaturze na temat aspektów energetycznych obejmujących katabolizm lipidów za pośrednictwem cyklu glioksylanowego. W tym kontekście w niniejszym badaniu zbadano zależność między ilością energii wytwarzanej w cyklu glioksylanowym, z wielkością łańcucha kwasów tłuszczowych i porównano efektywność energetyczną w komórkach stosujących to podejście, z komórkami zwierzęcymi pozbawionymi cyklu glioksylanowego.
materiał i metody
przeprowadzono bilans energetyczny etapów produkcji i zużycia energii w celu uzyskania równania, które odnosi się bezpośrednio do wielkości łańcucha kwasu tłuszczowego o liczbie węgla wielokrotności 4, z energią wytwarzaną przez jego degradację. W wygenerowanym równaniu nie uwzględniono kosztów energii związanych z aktywacją kwasu tłuszczowego dla acylo-CoA. Jest to etap poprzedzający β-utlenianie i polega na zerwaniu dwóch wysokoenergetycznych wiązań fosforanowych.
proponowane równanie zwalidowano przez porównanie ilości ATP uzyskanej przez jego zastosowanie, z szybkościami ATP uzyskanymi przez dodanie ilości ATP wytwarzanej przez fosforylację oksydacyjną i fosforylację na poziomie substratu na każdym etapie szlaków metabolicznych, które uczestniczą w degradacji kwasów tłuszczowych z udziałem cyklu glioksylanowego. Degradacja kwasów tłuszczowych obejmuje β-utlenianie w glioksysomach, cykl glioksylanowy, cykl Krebsa, część glukoneogenezy i glikolizy, dekarboksylację pirogronianową i ponownie cykl Krebsa (ryc. 1).
efektywność energetyczną degradacji kwasów tłuszczowych z udziałem cyklu glioksylanowego porównano z katabolizmem kwasów tłuszczowych w komórkach zwierzęcych. W tym porównaniu wykorzystano wcześniej zwalidowane równania i obliczono ilość energii wytworzonej w β-utlenianiu występującym u zwierząt (Gonçalves, Valduga, & Pereira, 2012), połączoną z równaniami opracowanymi w bieżących badaniach. Współczynnik efektywności energetycznej w cyklu glioksylanowym (E%) został określony przez stosunek ATP wytwarzanego w katabolizmie kwasów tłuszczowych z uwzględnieniem cyklu glioksylanowego i katabolizmu zwierzęcego. Parametr został wykreślony na podstawie liczby atomów węgla kwasów tłuszczowych. Ponadto szybkość ATP wytwarzana przez jedność CH2 była reprezentowana jako funkcja liczby atomów węgla w łańcuchu kwasów tłuszczowych. GrapPad Prism 6.0 generował modele matematyczne, które reprezentowały relacje między zmiennymi.
Wynikii dyskusja
matryca mitochondrialna jest głównym miejscem, w którym zachodzi utlenianie kwasów tłuszczowych w komórkach zwierzęcych. Jednak katabolizm tych biomolekuł występuje głównie w peroksysomach tkanek liściowych i glioksysomach podczas kiełkowania nasion roślin (Buchanan, Gruissem, Vickers, & Jones, 2015). Degradacja kwasów tłuszczowych w glioksysomach obejmuje szlaki metaboliczne przedstawione w tabeli 1.
równolegle do produkcji energii, konwersja kwasów tłuszczowych w węglowodany ma inne funkcje, takie jak wytwarzanie polisacharydów strukturalnych i nukleotydów poprzez szlak fosforanu pentozy (Nelson & Cox, 2009). Jeśli chodzi o zysk energetyczny, krótszy i bardziej energooszczędny sposób, prawdopodobnie wybrany przez ewolucję, obejmuje glukoneogenezę aż do fosfoenolopirogronianu (etap D-3 na fig.
Ilość energii (ATP) wytworzonej podczas glioksysomalnej degradacji kwasów tłuszczowych
Ilość ATP (x) wynikająca z glioksysomalnej degradacji kwasów tłuszczowych o liczbie węglowej wielokrotności 4, po glukoneogenezie aż do fosfoenolopirogronianu i jego katabolizmu, w celu wytworzenia energii,można obliczyć przez sumę szybkości ATP wytwarzanych i zużywanych w β-utlenianiu (ATP β-OX), cyklu glioksylowym (ATP C glyox),cykl Krebsa (ATP c Krebs), glukoneogeneza (ATP Oxal-Pep) i glikoliza /cykl Krebsa (ATP pep-CO2), zgodnie z równaniem (1):

każde zerwanie wiązania węgiel-węgiel podczas β-utleniania w glioksysomach i peroksysomach wytwarza jeden NADH, który, fosforylacja nietoksydacyjna, wytwarza 2,5 ATP (etap a-3 na fig.1). W peroksysomach energia elektronów usunięta w pierwszym etapie β-utleniania jest rozpraszana w postaci ciepła (Kroka – 1 na fig.

dlatego nie ma energii netto z utleniania FADH2 (Buchanan et al., 2015). Ponieważ węgiel α jest estryfikowany koenzymem a, β-utlenianie zachodzi 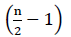 razy, gdzie n jest liczbą węgla w łańcuchu kwasów tłuszczowych. Ilość ATPs wytwarzana przez β-utlenianie w cyklu glioksylanowym jest określona równaniem (2):
razy, gdzie n jest liczbą węgla w łańcuchu kwasów tłuszczowych. Ilość ATPs wytwarzana przez β-utlenianie w cyklu glioksylanowym jest określona równaniem (2):

na każde dwie cząsteczki acetylo-CoA skierowane do cyklu glioksylanowego powstaje netto jedna cząsteczka sukcynatemolekuły, która odpowiada połowie ilości acetylo-CoA, tak że wytwarzane są N / 4 cząsteczki bursztynianu. W cyklu Krebsa bursztynian utlenia się do szczawiooctanu, wytwarzając 1 FADH2 i 1 NADH, co daje 4 ATP w oksydatywnejefosforylacji (etapy C-6 I C-8, Fig. 1). Wartość pomnożona przez N / 4 cząsteczek bursztynianu wyraża się równaniem (3), które przedstawia Ilość ATPamount wytworzoną jako pierwszą w cyklu Krebsa:

regeneracja cyklu inglyoxylate szczawioctanu obejmuje utlenianie jabłczanu, które wytwarza 1 NADH, które daje 2,5 ATP w fosforylacji oksydacyjnej (etap B-5 na fig.1). W konsekwencji ilość energii (ATP) wytworzonej w cyklu glioksylanowym może być wyrażona równaniem(4):

nadmiar szczawiooctanu wytwarzanego w Krebscyklu może być skierowany na glukoneogenezę. W celu wytworzenia energii, glukoneogeneza zachodzi w tworzeniu fosfoenolopirogronianu, z 1 GTP zużytym (krok 3 Na rysunku 1), wyrażonym równaniem (5). Kontynuacja glukoneogenezy do tworzenia metabolitów pochodzących z heksozy jest ważnym procesem w nasieniu nasion (Buchanan et al., 2015; Eastmond & Graham, 2001; Quettier& Eastmond, 2009):

Katabolizminy Fosfoenolopirogronianowe obejmują fosforylację na poziomie substratu,w wyniku której powstaje pirogronian (etap E-1, Fig.1), dekarboksylację oksydacyjną pirogronianu (etap F-1) z 1 Nadhprodukcją i utlenianie acetylo-CoA do CO2. W utlenianiu acetylo-CoA wytwarzanie 3 NADH, 1 FADH2 i 1 GTP odpowiada 10 wysokoenergetycznym fosfatebondom. Wartość ta dodana do fosforylacji na poziomie substratu i fosforylacji oksydacyjnej powiązana z nadh wygenerowaną dekarboksylacją pirogronianu, wynoszącą 13,5 ATP(równanie 6).

zastępowanie równań (2), (3), (4),(5) i (6) w równaniu (1) otrzymuje się równanie (7). W uproszczeniu równanie (8) określa bezpośredni stosunek ilości wytwarzanej energii (x) do wielkości łańcucha kwasów tłuszczowych (n).

Walidacja równania (8) w celu obliczenia energii (ATP) wytworzonej przez rozpad kwasów tłuszczowych w cyklu glioksylanowym
tak,aby równanie (8) mogło zostać zwalidowane, ilość ATP otrzymaną w wyniku jego zastosowania porównano z ilością ATP obliczoną indywidualnie z sumy liczby cząsteczek acetylo-CoA, nahd i FADH2 oraz fosforylacji na poziomie substratu, wytworzonej w kwasach utleniających o określonej liczbie atomów węgla w glioksysomach (Tabela 2). W innych warunkach uzyskane ilości ATP są równoważne. Biorąc pod uwagę te równoważne wyniki, równanie opracowane w bieżącym badaniu określiło ilość energii wytwarzanej w katabolizmie lipidów, biorąc pod uwagę integrację szlaków metabolicznych, które obejmują więcej niż dwadzieścia kroków.

ponadto ważnym narzędziem analizy różnych szlaków metabolicznych może być bilans energetyczny, a następnie ich Walidacja. W biochemii aspekty takie jak stechiometryczne relacje w szlakach metabolicznych można podchodzić za pomocą wyników w bieżących badaniach.

porównanie między efektywnością degradacji kwasów tłuszczowych przez cykl glioksylanowy a katabolizmem zwierząt
zgodnie z wcześniejszymi badaniami, ilość energii w komórkach zwierzęcych wytwarzana w ATP przez degradację kwasów tłuszczowych z liczbą par węgli może być algebraicznie związana z wielkością łańcucha kwasu tłuszczowego. Zależność ta wyraża się równaniem (9) (Gonçalves et al., 2012), które można porównać do równania (8) opracowanego w bieżącym badaniu. Te dwie sekwencje mogą być wykorzystane do porównania efektywności energetycznej między ß-utlenianiem w komórkach zwierząt i organizmów, w których zachodzi cykl glioksylanowy.

dzieląc równanie (8) przez równanie(9) i mnożąc przez 100, uzyskuje się procentową sprawność (E%) degradacji kwasów tłuszczowych do wytworzenia energii w odniesieniu do katabolizmu zwierząt, wyrażoną równaniem (10).

2) sprawdza, czy wydajność zmniejsza się wraz ze wzrostem łańcucha węglowodorowego. Ponadto energia uzyskana z utleniania kwasów tłuszczowych w komórkach z cyklem glioksylanowym osiąga mniej niż 90% poziomu energii, który byłby generowany podobną drogą w komórce zwierzęcej.
szybkość ATP wytwarzanego na utleniony atom węgla (ATP/N) jest również zależna od łańcucha długości kwasu tłuszczowego, przy maksymalnej szybkości bliskiej sześciu ATP/N (Fig.3-a), podczas gdy szybkość ta jest wyższa w komórkach zwierzęcych (Fig. 3-b).

Rysunek 2.
porównanie efektywności energetycznej degradacji kwasów tłuszczowych w zwierzęcym β-utlenianiu i β-utlenianiu w organizmach z enzymami cyklu glyoxylate, ze względu na łańcuch długości kwasu tłuszczowego.
w przeciwieństwie do zwierząt, warzywa i niektóre mikroorganizmy są w stanie przekształcić acetylo-CoA z utleniania kwasów tłuszczowych w cukry. Organizmy łączą cykl glioksylowy i glukoneogenezy, które dzielą się między glioksysomy / peroksysomy, mitochondria i cytosol. Ta funkcja zapewnia większą wszechstronność metaboliczną, umożliwiając bakteriom wykorzystanie octanu jako źródła energii, a roślinom Przechowywanie w nasionach jako źródła energii do wykorzystania podczas kiełkowania.

Rysunek 3.
szybkość ATP wytwarzana przez atom węgla (ATP/N) z powodu atomów węgla kwasów tłuszczowych (n) w cyklu glioksylanowym (a) i katabolizmie nieożywionym (b). Szybkość ATP / n wzrasta znacząco do około n = 20, od tego czasu szybkość wzrasta w sposób mniej znaczący.
wniosek
degradacja kwasów tłuszczowych przez cykl glioksylanowy do produkcji energii obejmuje β-utlenianie, ze szczególnymi cechami w glioksysomach, cyklu glioksylanowym, cyklu Krebsa, glukoneogenezie i glikolizie. Pomimo tych etapów i szlaków metabolicznych, stechiometryczny związek między długością łańcucha kwasów tłuszczowych a ilością energii wytworzonej w jego degradacji może zostać ustalony w kategoriach algebraicznych.
porównanie energii stechiometrii związanej z tymi szlakami metabolicznymi i energii stechiometrii β-utleniania, jaka występuje w komórkach zwierzęcych, pokazuje zmniejszenie efektywności energetycznej w porównaniu z metabolizmem zwierząt. Podczas gdy obejście reakcji dekarboksylacji cyklu Krebsa zapewnia ewolucyjne adaptacje do organizmów, gdy są obecne, określa również mniejszą ilość energii generowanej na atom węgla w porównaniu do degradacji kwasów tłuszczowych u zwierząt.