introduktion
glyoxylatcykeln kringgår dekarboxyleringsstegen i Krebs-cykeln och orsakar assimilering av flytande kol från acetyl-CoA. Isocitratlyas (EC 4.1.3.1) och malatsyntas (EC 2.3.3.9) är de enda enzymerna för denna metaboliska väg. Glyoxylatcykeln förekommer vid frögroning (Eastmond & Graham, 2001), hos vissa ryggradslösa djur, såsom C. elegans (Edwards, Copes, Brito, Canfield, & Bradshaw, 2013) och i mikroorganismer, såsom E. coli (Nelson & Cox, 2009) och S. cerevisiae (Rezaei, Aslankoohi, Verstrepen, & Courtin, 2015). Vägen beskrevs 1957 under studier på mikroorganismer som växte på acetat och etanol som kolkälla (Kornberg & Krebs, 1957).
Acetyl-CoA i glyoxylatcykeln binds med oxaloacetat respektive producerar citrat och isocitrat. Den senare producerar glyoxylat och Succinat i reaktionen katalyserad av isocitratlyas. Vidare kondenserar glyoxylat med en andra acetyl-CoA-molekyl i en reaktion som katalyseras av malatsyntas, efter att det producerade malatet oxideras till oxaloacetat och därmed regenererar mellanprodukten (steg B-1 till B-5, Figur 1). Två acetyl-CoA-molekyler introduceras vid varje upprepning av glyoxylatcykeln och vätskesyntesen av en succinatmolekyl uppträder (Beeckmans, 2009; Berg, Stryer, & Tymoczko, 2015; Torres & Marzzoco, 2007).
vidare distribueras kolhydrater som produceras från reservlipider i oljeväxter till växten och används som kolkälla tills kloroplasterna börjar differentiera i foliolerna och starta fotosyntes. Fetter och oljor är viktiga kemiska strukturer vid kollagring av många frön, om än i reducerad form, innefattande viktiga agronomiska arter som sojabönor, jordnötter, bomull och solros (Junqueira, 2012). Laurinsyra (12:0), myristiska (14:0), palmitinsyra (16:0) och stearinsyra (18:0) syror är de viktigaste mättade fettsyrorna i grönsaker; medan omättade syror är oljesyra (18:1(XXL 9)), linolsyra (18:2(XXL 9, 12)) och linolensyra (18: 3 (XXL 9, 12, 15)) (Taiz & Zeiger, 2002).

Figur 1.
fettsyror eller acetatkatabolism toproduce energi genom glyoxylatcykeln, som bevisar integreringen mellan Avsugning-oxidation (steg a – 1 till a-4), glyoxylatcykel (steg B-1 till B-5), Krebs-cykel (steg C-1 genom C-8), glukoneogenes (steg D-1 till D-3) och glykolys (steg E-1).
fettsyror med ett par antal kol resulterar inte i kolhydratsyntes hos djur (Nelson & Cox, 2009). Detta faktum inträffar eftersom det inte finns någon nettoproduktion av oxaloacetat för att stödja glukoneogenes eftersom fettsyror i detta fall kataboliseras till acetyl-CoA. Mellanprodukten oxideras i Krebs-cykeln, och för varje två kol som kommer in som acetyl-CoA, förloras två kol som CO2 (Eastmond & Graham, 2001; Nelson & Cox, 2009).
frånvaron av glyoxylatcykeln hos däggdjur kan vara ett mål för selektiv toxicitet vid utveckling av antimikrobiella medel. Den hämmande aktiviteten hos 3-nitropropionamider på isocitratlyas i M. tuberculosis (Sriram et al., 2011), bromofenoler (Oh et al., 2010) och alkaloider från svampar på isocitratlyas i C. albicans (Lee et al., 2008; Oh et al., 2010) har analyserats.
det finns inga data i litteraturen om de energiska aspekterna som involverar lipidkatabolism via glyoxylatcykeln. I detta sammanhang undersökte den aktuella forskningen förhållandet mellan mängden energi som produceras i glyoxylatcykeln, med fettsyrakedjestorlek, och jämförde energieffektivitet i celler som använder detta tillvägagångssätt, med djurcellerna som saknar glyoxylatcykeln.
materialoch metoder
en energibalans av steg med produktion och förbrukning av energi utfördes för att erhålla en ekvation som direkt hänför sig till kedjestorleken hos en fettsyra med en kolnummermultipel på 4, med den energi som produceras genom dess nedbrytning. I den genererade ekvationen redovisades inte energikostnaden för aktiveringen av fettsyran för acyl-CoA. Det är ett steg före oxidering och innebär att två fosfatbindningar med hög energi bryts.
den föreslagna ekvationen validerades genom att jämföra ATP-mängd erhållen genom dess applicering, med ATP-hastigheter erhållna genom tillsats av ATP-mängd producerad genom oxidativ fosforylering och substratnivå fosforylering i varje steg i de metaboliska vägarna som deltar i fettsyranedbrytningen som involverar glyoxylatcykeln. Fettsyranedbrytningen innefattar sackarioxidation i glyoxysomer, glyoxylatcykel, Krebs-cykel, del av glukoneogenes och glykolys, pyruvatdekarboxylering och igen Krebs-cykel (Figur 1).
energieffektiviteten hos fettsyrans nedbrytning som involverar glyoxylatcykeln jämfördes med fettsyrans katabolism i djurceller. Ekvationer som tidigare validerats användes i denna jämförelse och den energimängd som produceras i oxidationen av det som sker hos djur beräknades (Gonuclusalves, Valduga, & Pereira, 2012), kopplad till ekvationer som utvecklats i aktuell forskning. Energieffektivitetsfaktorn i glyoxylatcykeln (e%) definierades av förhållandet ATP producerat i fettsyrakatabolism med hänsyn till glyoxylatcykeln och djurkatabolism. Parametern plottades mot antalet kolatomer av fettsyra. Vidare representerades ATP-hastighet producerad av CH2-enhet som en funktion av antalet kol i fettsyrakedjan. GrapPad Prism 6.0 genererade de matematiska modellerna som representerade förhållandet mellan variablerna.
Resultatoch diskussion
mitokondriell matris är den huvudsakliga platsen där oxidationen av fettsyror sker i djurceller. Katabolismen av dessa biomolekyler förekommer emellertid huvudsakligen i peroxisomerna i bladvävnader och i glyoxysomer under växternas frögroning (Buchanan, Gruissem, Vickers, & Jones, 2015). Nedbrytningen av fettsyror i glyoxysomer inkluderar de metaboliska vägarna som visas i Tabell 1.
parallellt med energiproduktionen har omvandlingen av fettsyror till kolhydrater andra funktioner såsom produktion av strukturella polysackarider och nukleotider genom pentosfosfatvägen (Nelson & Cox, 2009). När det gäller energivinst innefattar det kortare och mer energiskt ekonomiska sättet, troligen valt av evolutionen, glukoneogenes tills fosfoenolpyruvat (steg D-3 i Figur 1), nedbrutet av den glykolytiska vägen.
Amountof energi (ATP) som produceras under glyoxysomal nedbrytning av fettsyror
ATP-mängd (x) som härrör frånglyoxysomal nedbrytning av fettsyror med kol nummer multipel av 4, följt av glukoneogenes tills fosfoenolpyruvat och dess katabolism, för att producera energi,kan beräknas med summan av ATP-hastigheter som produceras och konsumeras i glyox), Krebs cykel (ATP C Krebs),glukoneogenes (ATP oxal-Pep) och glykolys /Krebs cykel igen (ATP pep-CO2), enligt ekvation (1):

varje brytning av kol-kolbindningunder oxid i glyoxisomer och peroxisomer producerar en NADH som, inoxidativ fosforylering, producerar 2,5 ATP (steg a-3 i Figur 1). I peroxisomer försvinner elektronenergin som avlägsnats under det första steget av oxidationen i form av värme (stepA-1 i Figur 1).

därför finns det ingen nettoenergi från FADH2-oxidationen (Buchanan et al., 2015). Eftersom kolet förestras med koenzym A, sker oxideringen med 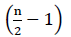 gånger, där n är kolantalet i fettsyrakedjan. ATPs-mängden som produceras genom sackarioxidation i glyoxylatcykler ges genom ekvation (2):
gånger, där n är kolantalet i fettsyrakedjan. ATPs-mängden som produceras genom sackarioxidation i glyoxylatcykler ges genom ekvation (2):

för varje två acetyl-CoA-molekylerriktad till glyoxylatcykeln finns en nettoproduktion av en succinatmolekyl, vilket motsvarar hälften av acetyl-CoA-mängden, så att n/4succinatmolekyler produceras. I Krebs-cykeln oxideras succinatet till oxaloacetat, som producerar 1 FADH2 och 1 NADH som producerar 4 ATP i oxidativfosforylering (steg C-6 och C-8, figur 1). Detta värde multiplicerat med n / 4succinatmolekyler uttrycks med ekvation (3), vilket representerar ATPamount som produceras först i Krebs-cykeln:

regenereringen av oxalacetatinglyoxylatcykeln innefattar malatoxidation, som producerar 1 NADH som ger2.5 ATP i oxidativ fosforylering (steg B-5 i Figur 1). Följaktligen kan mängden energi (ATP) som produceras i glyoxylatcykeln uttryckas genom ekvation(4):

överskott av oxaloacetat producerat i Krebscykeln kan riktas mot glukoneogenes. För att producera energi, glukoneogenes uppträder i fosfoenolpyruvatbildningen, med 1 GTP förbrukad (stepD3 i Figur 1), uttryckt i ekvation (5). De glukoneogenes fortsättningför bildandet av metaboliter härledda från hexos är en viktig process ingerminerande frön (Buchanan et al., 2015; Eastmond & Graham, 2001; Quettier& Eastmond, 2009):

Fosfoenolpyruvatkatabolisminnebär en fosforylering på substratnivå som producerar pyruvat (steg E-1,Figur 1), oxidativ dekarboxylering av pyruvat (steg F-1) med 1 Nadhproduktion och acetyl-CoA-oxidation till CO2. Vid acetyl-CoA-oxidation, produktion av 3 NADH, 1 FADH2 och 1 GTP motsvarar 10 fosfatobligationer med hög energi. Detta värde tillfördes substratnivån fosforylering och oxidativ fosforyleringassocierad med NADH-genererad dekarboxylering av pyruvat, totalt 13,5 ATP(ekvation 6).

ersätta ekvationer (2), (3), (4),(5) och (6) i ekvation (1) erhålls ekvation (7). När det förenklas algebraiskt fastställer ekvation (8) ett direkt förhållande mellan mängden producerad energi (x) och storleken på fettsyrakedjan (n).

Validationof ekvation (8) för att beräkna den energi (ATP) som produceras av fettsyrornedbrytning genom glyoxylatcykeln
så att ekvationen (8) kan valideras jämfördes ATP-mängden,erhållen från dess tillämpning, med ATP-beloppetberäknat individuellt från summan av acetyl-CoA -, NAHD-och FADH2-molekylernummer och substratnivå fosforylering, genererad i oxidationen avfettsyror med specifika antal kolatomer i glyoxysomer (Tabell 2). Ibåde förhållandena är de erhållna ATP-mängderna ekvivalenta. Med hänsyn till dessa ekvivalentresultat, ekvationen som utvecklats i aktuell studie bestämdesenergimängden som produceras i lipidkatabolism, med tanke på integrationen avmetaboliska vägar som involverar mer än tjugo steg.

dessutom kan den energiska balansen förgenererande ekvationer, följt av deras validering, vara ett viktigt verktygför analys av olika metaboliska vägar. I biokemi, aspekter som stökiometriska relationer i metaboliska vägar kan närma sig med hjälp avresultat i aktuell forskning.

Jämförelsemellan effektiviteten av fettsyrornas nedbrytning genom glyoxylatcykel och animalcatabolism
enligt tidigare studier kan mängden energi i djurceller som produceras i ATP genom fettsyror nedbrytning med kolparnummer vara algebraiskt relaterad till fettsyrans kedjestorlek. Detta förhållande uttrycks av ekvation (9) (Gonusaclusalves et al., 2012), som kan jämföras med ekvation (8) utvecklad i aktuell studie. De två ekvationerna kan användas för att jämföra energieffektivitet mellan oxidering i djurceller och organismceller, där glyoxylatcykeln inträffar.

genom att dividera ekvation (8) med ekvation(9) och multiplicera med 100 erhålls den procentuella effektiviteten (e%) av fettsyranedbrytningför att producera energi i förhållande till djurkatabolism, som uttrycktes genom ekvation (10).

plottning E% mot fettsyrakedjelängd (Figur 2) verifierar att effektiviteten minskar med ökning av kolvätekedjan. Dessutom når energin som erhålls från fettsyror oxidation i celler med glyoxylatcykel mindre än 90% av energinivån som skulle genereras av liknande väg i en djurcell.
ATP-hastighet producerad per oxiderad kolatom (ATP/n) är också beroende av fettsyrans längdkedja, med en maximal hastighet nära sex ATP/n (Figur 3-a), Medan denna hastighet är högre i djurceller (Figur 3-b).

Figur 2.
jämförelse mellan energieffektivitet av fettsyranedbrytning i djur-oxidering och-oxidering i organismer med glyoxylatcykelenzymer, på grund av fettsyrans längdkedja.
kontrast till djur, grönsakeroch vissa mikroorganismer kan omvandla acetyl-CoA från fettsyror till sockerarter. Organismerna kombinerar glyoxylatcykeln och glukoneogenesreaktioner, som är uppdelade mellan glyoxysomer / peroxisomer,mitokondrier och cytosol. Denna funktion ger högre metabolisk mångsidighet, vilket gör att bakterier kan använda acetat som energikälla och växter för att lagra lipider i fröna som energikälla som ska användas under spiring.

Figur 3.
ATP-hastighet producerad av kolatom (ATP/n)på grund av syrafettets kolatomer (n) i glyoxylatcykel (a) och livlös katabolism (b). ATP / n-hastigheten ökar betydligt tillsom n = 20, hädanefter ökar hastigheten på ett mindre signifikant sätt.
slutsats
nedbrytningen av fettsyror genom glyoxylatcykeln för produktion av energi innefattar sackaridoxidation, med dess speciella egenskaper i glyoxysomer, glyoxylatcykel, Krebs-cykel, glukoneogenes och glykolys. Trots dessa steg och metaboliska vägar kan ett stökiometriskt förhållande mellan fettsyrornas kedjelängd och energimängd som produceras i dess nedbrytning fastställas i algebraiska termer.
jämförelsen mellan stökiometrin som är energisk involverad i dessa metaboliska vägar och stökiometrin som är energisk för sackaridoxidation som förekommer i djurceller, visar en minskning av energieffektiviteten jämfört med djurmetabolism. Medan bypass av dekarboxyleringsreaktioner av Krebs-cykeln ger evolutionära anpassningar till organismerna när de är närvarande, bestämmer den också en mindre energimängd som genereras per kolatom jämfört med fettsyrornas nedbrytning hos djur.