Introduction
Le cycle du glyoxylate contourne les étapes de décarboxylation du cycle de Krebs et provoque l’assimilation du carbone liquide de l’acétyl-CoA. L’isocitrate lyase (EC 4.1.3.1) et la malate synthase (EC 2.3.3.9) sont les seules enzymes de cette voie métabolique. Le cycle du glyoxylate se produit lors de la germination des graines (Eastmond & Graham, 2001), chez certains invertébrés, tels que C. elegans (Edwards, Copes, Brito, Canfield, & Bradshaw, 2013) et chez des microorganismes, tels que E. coli (Nelson & Cox, 2009) et S. cerevisiae (Rezaei, Aslankoohi, Verstrepen, & Courtin, 2015). La voie a été décrite en 1957 lors d’études sur des microorganismes qui se sont développés sur l’acétate et l’éthanol comme source de carbone (Kornberg & Krebs, 1957).
L’acétyl-CoA dans le cycle du glyoxylate se lie à l’oxaloacétate, produisant respectivement du citrate et de l’isocitrate. Ce dernier produit du glyoxylate et du succinate dans la réaction catalysée par l’isocitrate lyase. De plus, le glyoxylate se condense avec une deuxième molécule d’acétyl-CoA dans une réaction catalysée par la malate synthase, après que le malate produit est oxydé en oxaloacétate et régénère ainsi l’intermédiaire (étapes B-1 à B-5, Figure 1). Deux molécules d’acétyl-CoA sont introduites à chaque répétition du cycle de glyoxylate et la synthèse liquide d’une molécule de succinate se produit (Beeckmans, 2009; Berg, Stryer, & Tymoczko, 2015; Torres & Marzzoco, 2007).
De plus, les hydrates de carbone produits à partir des lipides de réserve dans les graines oléagineuses sont distribués à la plante et utilisés comme source de carbone jusqu’à ce que les chloroplastes commencent à se différencier dans les folioles et commencent la photosynthèse. Les graisses et les huiles sont des structures chimiques importantes dans le stockage du carbone de nombreuses graines, bien que sous une forme réduite, comprenant des espèces agronomiques importantes telles que le soja, l’arachide, le coton et le tournesol (Junqueira, 2012). Les acides lauriques (12:0), myristiques (14:0), palmitiques (16:0) et stéariques (18:0) sont les acides gras saturés les plus importants des légumes; alors que les acides insaturés sont l’acide oléique (18: 1 (Δ9)), l’acide linoléique (18:2 (Δ9, 12)) et l’acide linolénique (18:3 (Δ9, 12, 15)) (Taiz & Zeiger, 2002).

Figure 1.
Catabolisme des acides gras ou de l’acétate pour produire de l’énergie à travers le cycle du glyoxylate, mettant en évidence l’intégration entre laß-oxydation (étapes A-1 à A-4), le cycle du glyoxylate (étapes B-1 à B-5), le cycle de Krebs (étapes C-1 à C-8), la gluconéogenèse (étapes D-1 à D-3) et la glycolyse (étape E-1).
Les acides gras avec un nombre de paires de carbones n’entraînent pas de synthèse de glucides chez les animaux (Nelson & Cox, 2009). Ce fait se produit parce qu’il n’y a pas de production nette d’oxaloacétate pour soutenir la gluconéogenèse puisque, dans ce cas, les acides gras sont catabolisés en acétyl-CoA. L’intermédiaire est oxydé dans le cycle de Krebs, et pour deux carbones qui entrent sous forme d’acétyl-CoA, deux carbones sont perdus sous forme de CO2 (Eastmond & Graham, 2001; Nelson & Cox, 2009).
L’absence du cycle du glyoxylate chez les mammifères peut être une cible de toxicité sélective dans le développement d’agents antimicrobiens. L’activité inhibitrice des 3-nitropropionamides sur l’isocitrate lyase chez M. tuberculosis (Sriram et al., 2011), les bromophénols (Oh et al., 2010) et des alcaloïdes des éponges sur l’isocitrate lyase chez C. albicans (Lee et al., 2008; Oh et coll., 2010) ont été analysés.
Il n’y a pas de données dans la littérature sur les aspects énergétiques impliquant le catabolisme lipidique via le cycle du glyoxylate. Dans ce contexte, la présente recherche a étudié la relation entre la quantité d’énergie produite dans le cycle du glyoxylate, avec la taille de la chaîne des acides gras, et a comparé l’efficacité énergétique dans les cellules qui utilisent cette approche, avec les cellules animales dépourvues du cycle du glyoxylate.
Matériauet méthodes
Un bilan énergétique des étapes de production et de consommation d’énergie a été réalisé pour obtenir une équation qui relie directement la taille de la chaîne d’un acide gras avec un nombre de carbone multiple de 4, à l’énergie produite par sa dégradation. Dans l’équation générée, le coût énergétique impliqué dans l’activation de l’acide gras pour l’acyl-CoA n’a pas été pris en compte. C’est une étape préalable à la β-oxydation et implique la rupture de deux liaisons phosphate à haute énergie.
L’équation proposée a été validée en comparant la quantité d’ATP obtenue par son application, avec les taux d’ATP obtenus par l’addition de la quantité d’ATP produite par phosphorylation oxydative et phosphorylation au niveau du substrat à chaque étape des voies métaboliques qui participent à la dégradation des acides gras impliquant le cycle du glyoxylate. La dégradation des acides gras implique la β-oxydation dans les glyoxysomes, le cycle du glyoxylate, le cycle de Krebs, une partie de la gluconéogenèse et de la glycolyse, la décarboxylation du pyruvate et à nouveau le cycle de Krebs (Figure 1).
L’efficacité énergétique de la dégradation des acides gras impliquant le cycle du glyoxylate a été comparée au catabolisme des acides gras dans les cellules animales. Des équations précédemment validées ont été utilisées dans cette comparaison et la quantité d’énergie produite dans la β-oxydation telle qu’elle se produit chez les animaux a été calculée (Gonçalves, Valduga, & Pereira, 2012), couplée aux équations développées dans les recherches actuelles. Le facteur d’efficacité énergétique dans le cycle du glyoxylate (E%) a été défini par le rapport de l’ATP produit dans le catabolisme des acides gras en tenant compte du cycle du glyoxylate et du catabolisme animal. Le paramètre a été représenté par rapport au nombre d’atomes de carbone d’acide gras. De plus, le taux d’ATP produit par l’unité CH 2 a été représenté en fonction du nombre de carbones de la chaîne des acides gras. Le prisme GrapPad 6.0 a généré les modèles mathématiques qui représentaient la relation entre les variables.
Résultatset discussion
La matrice mitochondriale est le site principal où l’oxydation des acides gras se produit dans les cellules animales. Cependant, le catabolisme de ces biomolécules se produit principalement dans les peroxysomes des tissus foliaires et dans les glyoxysomes lors de la germination des graines des plantes (Buchanan, Gruissem, Vickers, & Jones, 2015). La dégradation des acides gras dans les glyoxysomes comprend les voies métaboliques indiquées dans le tableau 1.
Parallèlement à la production d’énergie, la conversion des acides gras en glucides a d’autres fonctions telles que la production de polysaccharides structurels et de nucléotides par la voie du pentose phosphate (Nelson & Cox, 2009). En ce qui concerne le gain énergétique, la voie la plus courte et la plus économe en énergie, probablement choisie par évolution, inclut la gluconéogenèse jusqu’au phosphoénolpyruvate (étape D-3 de la Figure 1), dégradée par la voie glycolytique.
Quantité d’énergie (ATP) produite lors de la dégradation glyoxysomique des acides gras
La quantité d’ATP (x) résultant de la dégradation glyoxysomique des acides gras avec un nombre de carbone multiple de 4, suivie de la gluconéogenèse jusqu’à ce que le phosphoénolpyruvate et son catabolisme produisent de l’énergie, peut être calculée par la somme des taux d’ATP produits et consommés dans la β-oxydation (ATP β-OX), le cycle du glyoxylate (ATP C GLYOX), cycle de Krebs (ATP C KREBS), gluconéogenèse (ATP OXAL-PEP) et cycle de glycolyse/Krebs à nouveau (ATP PEP-CO2), selon l’équation (1):

Chaque rupture de liaison carbone-carbone lors de la β-oxydation dans les glyoxysomes et les peroxysomes produit un NADH qui, par phosphorylation oxydative, produit 2,5 ATPs (étape A-3 de la figure 1). Dans les peroxysomes, l’énergie électronique éliminée lors de la première étape de β-oxydation est dissipée sous forme de chaleur (stepA-1 sur la figure 1).

Par conséquent, il n’y a pas d’énergie nette provenant de l’oxydation de FADH2 (Buchanan et al., 2015). Puisque le carbone α est estérifié par la coenzyme A, la β-oxydation se produit 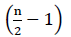 fois, où n est le nombre de carbone dans la chaîne des acides gras. La quantité d’ATPs produite par la β-oxydation dans le cycle de glyoxylate est donnée par l’équation (2):
fois, où n est le nombre de carbone dans la chaîne des acides gras. La quantité d’ATPs produite par la β-oxydation dans le cycle de glyoxylate est donnée par l’équation (2):

Pour deux molécules d’acétyl-CoA dirigées vers le cycle de glyoxylate, il y a une production nette d’une succinatémolécule, ce qui correspond à la moitié de la quantité d’acétyl-CoA, de sorte que n / 4 molécules de succinate sont produites. Dans le cycle de Krebs, le succinate est oxydé en oxaloacétate, produisant 1 FADH2 et 1 NADH qui produit 4 ATP en phosphorylation oxydative (étapes C-6 et C-8, Figure 1). Cette valeur multipliée par n/4 molécules de succinate est exprimée par l’équation (3), qui représente l’ATPamount produit en premier dans le cycle de Krebs:

La régénération du cycle inglyoxylate d’oxalacétate implique l’oxydation du malate, qui produit 1 NADH qui donne 2,5 ATPs en phosphorylation oxydative (étape B-5 de la figure 1). Par conséquent, la quantité d’énergie (ATP) produite dans le cycle du glyoxylate peut être exprimée par l’équation(4):

L’excès d’oxaloacétate produit dans Krebscycle peut être dirigé vers la gluconéogenèse. Pour produire de l’énergie, la gluconéogenèse se produit dans la formation de phosphoénolpyruvate, avec 1 GTP dépensé (étape D3 sur la figure 1), exprimée dans l’équation (5). La continuation de la gluconéogenèse pour la formation de métabolites dérivés de l’hexose est un processus important d’ingermination des graines (Buchanan et al., 2015; Eastmond & Graham, 2001; Quettier & Eastmond, 2009):

La catabolisation du phosphoénolpyruvate implique une phosphorylation au niveau du substrat qui produit du pyruvate (étape E-1, Figure 1), une décarboxylation oxydative du pyruvate (étape F-1) avec une production de 1 NADH et une oxydation de l’acétyl-CoA en CO2. En oxydation acétyl-CoA, la production de 3 NADH, 1 FADH2 et 1 GTP correspond à 10 phosphatebondes de haute énergie. Cette valeur ajoutée à la phosphorylation au niveau du substrat et à la phosphorylation oxydative associée à la décarboxylation du pyruvate générée par le NADH, totalisant 13,5 ATP (Équation 6).

Substituer des Équations (2), (3), (4),(5) et (6) dans l’Équation (1), l’équation (7) est obtenue. Lorsqu’elle est simplifiée algébriquement, l’équation (8) établit un rapport direct entre la quantité d’énergie produite (x) et la taille de la chaîne d’acides gras (n).

Validationde l’équation (8) pour calculer l’énergie (ATP) produite par la dégradation des acides gras à travers le cycle du glyoxylate
Afin que l’équation (8) puisse être validée, la quantité d’ATP, obtenue à partir de son application, a été comparée à la quantité d’ATP calculée individuellement à partir de la somme des molécules d’acétyl-CoA, de NAHD et de FADH2NOMBRE, et de la phosphorylation au niveau du substrat, générées dans l’oxydation des acides gras avec un nombre spécifique d’atomes de carbone dans les glyoxysomes (tableau 2 ). Dans les deux conditions, les quantités d’ATP obtenues sont équivalentes. En tenant compte de ces résultats équivalents, l’équation développée dans la présente étude a déterminé la quantité d’énergie produite dans le catabolisme lipidique, compte tenu de l’intégration des voies métaboliques qui implique plus de vingt étapes.

De plus, l’équilibre énergétique des équations génératrices, suivi de leur validation, peut être un outil important pour l’analyse des différentes voies métaboliques. En biochimie, des aspects tels que les relations stœchiométriques dans les voies métaboliques peuvent être abordés à l’aide des résultats de la recherche actuelle.

Comparaison Entre l’efficacité de la dégradation des acides gras par le cycle du glyoxylate et l’animalcatabolisme
Selon des études antérieures, la quantité d’énergie dans les cellules animales produites dans l’ATP par la dégradation des acides gras avec le nombre de paires de carbones peut être algébriquement liée à la taille de la chaîne de l’acide gras. Cette relation est exprimée par l’équation (9) (Gonçalves et al., 2012), qui peut être comparée à l’équation (8) développée dans la présente étude. Les deux équations peuvent être utilisées pour comparer l’efficacité énergétique entre la ß-oxydation dans les cellules d’animaux et les cellules d’organismes, où se produit le cycle du glyoxylate.

En divisant l’Équation (8) par l’Équation (9) et en multipliant par 100, on obtient le pourcentage d’efficacité (E%) de la dégradation des acides gras pour produire de l’énergie, par rapport au catabolisme animal, exprimé par l’Équation (10).

Le fait de tracer E% par rapport à la longueur de la chaîne d’acides gras (Figure 2) vérifie que l’efficacité diminue avec l’augmentation de la chaîne hydrocarbonée. De plus, l’énergie obtenue à partir de l’oxydation des acides gras dans les cellules à cycle glyoxylate atteint moins de 90% du niveau d’énergie qui serait généré par la voie similaire dans une cellule animale.
Le taux d’ATP produit par atome de carbone oxydé (ATP/n) dépend également de la longueur de la chaîne de l’acide gras, à un taux maximum proche de six ATP/n (Figure 3-a), alors que ce taux est plus élevé dans les cellules animales (Figure 3-b).

Figure 2.
Comparaison entre l’efficacité énergétique de la dégradation des acides gras dans la β-oxydation animale et la β-oxydation dans les organismes avec des enzymes du cycle des glycylates, en raison de la chaîne de longueur des acides gras.
Contrairement aux animaux, aux légumeset à certains microorganismes sont capables de convertir l’acétyl-CoA de l’oxydation des acides gras en sucres. Les organismes combinent le cycle du glyoxylate et les réactions de gluconéogénèse, qui sont compartimentées entre les glyoxysomes / peroxysomes, les mitochondries et le cytosol. Cette caractéristique offre une plus grande polyvalence métabolique, permettant aux bactéries d’utiliser l’acétate comme source d’énergie et aux plantes de stocker les lipides dans les graines comme source d’énergie à utiliser pendant la germination.

Figure 3.
Taux d’ATP produit par l’atome de carbone (ATP /n) en raison des atomes de carbone des acides gras (n) dans le cycle du glyoxylate (a) et du catabolisme inanimé (b). Le taux ATP / n augmente de manière significative jusqu’àenviron n = 20, le taux augmente désormais de manière moins significative.
Conclusion
La dégradation des acides gras par le cycle du glyoxylate pour la production d’énergie implique une β-oxydation, avec ses caractéristiques particulières dans les glyoxysomes, le cycle du glyoxylate, le cycle de Krebs, la gluconéogenèse et la glycolyse. Malgré ces étapes et voies métaboliques, une relation stoechiométrique entre la longueur de la chaîne des acides gras et la quantité d’énergie produite lors de sa dégradation peut être établie en termes algébriques.
La comparaison entre la stoechiométrie énergétique impliquée dans ces voies métaboliques et la stoechiométrie énergétique de la β-oxydation telle qu’elle se produit dans les cellules animales, montre une réduction de l’efficacité énergétique, par rapport au métabolisme animal. Alors que le contournement des réactions de décarboxylation du cycle de Krebs confère des adaptations évolutives aux organismes lorsqu’ils sont présents, il détermine également une quantité d’énergie moindre générée par atome de carbone par rapport à la dégradation des acides gras chez les animaux.