- Introduction
- materiaalit ja menetelmät
- Kudosvalmiste
- Kaksimerkintäistä fluoresenssi-Immunohistokemiaa
- vasta-aineiden Luonnehdinta
- Confocal Analysis
- vasta-Ainekontrollit
- tulokset
- NGF-Immunomerkintä
- NGF ja GABAerginen Koekalalisaatio
- NGF-ja Glutamaterginen Rinnakkaislokalisaatio
- Keskustelu
- Eturistiriitalausunto
- kiitokset
- lisäaineisto
Introduction
the neurotrofin nerve growth factor (NGF)is involved in several critical processes in the developing and length nisäkäs nervation, cell differentation and neuronal survival (Large et al., 1986; Li et al., 1995; Sofroniew ym., 2001; Lad et al., 2003). Aikuisten aivoissa NGF: llä on keskeinen rooli perusaivojen kolinergisen järjestelmän ylläpidossa ja toiminnassa (Lad et al., 2003). NGF: n tasot ovat korkeimmat alueilla, jotka saavat eniten kolinergisia tyvitumakkeita, eli hippokampuksessa ja aivokuoressa(Korsching et al., 1985; Shelton and Reichardt, 1986), ja NGF: n reseptorit aivokuoressa rajoittuvat suurelta osin perusaivojen etuaivojen kortikopetaaliprojektioihin (Kordower et al., 1988; Sofroniew ym., 2001; Rossi ym., 2002). Hermokasvutekijän signalointi ylläpitää kolinergisiä kortikopetaalisia projektioita aikuisiällä (Chen et al., 1997; Debeir ym., 1999) ja voi estää näiden neuronien rappeutumisen niiden aksonien transektion jälkeen (Hefti, 1986; Tuszynski et al., 1990; Kordower ym., 1994). Lisäksi NGF parantaa asetyylikoliinin vapautumista perusaivoviljelmistä (Auld et al., 2001)ja voi moduloida kolinergisen toiminnan kolinergisen geenin lokuksen fenotyyppisen kontrollin avulla (Rylett et al., 1993; Hu ym., 1997).
perusaivojen kolinerginen järjestelmä vaikuttaa oppimiseen ja kokemuksista riippuvaiseen plastisuuteen aivokuoressa (Bakin and Weinberger, 1996; Kilgard and Merzenich, 1998; Conner et al., 2003, 2005), ja NGF-signaloinnin on oletettu tukevan ja mahdollisesti parantavan perusaivojen välittämää oppimista ja plastisuutta. Esimerkiksi NGF-signaloinnin estäminen toistuvilla NGF-vasta-aineiden injektioilla saariaivokuoressa vähentää paikallista kolinergistä innervaatiota ja häiritsee kahden prosessin hankintaa, jotka riippuvat kolinergisten syötteiden eheydestä, ehdollistetusta makuahdistuksesta ja estävästä välttämisen oppimisesta (Gutierrez et al., 1997). Tuore tutkimus Conner et al. (2009) osoitti, että sekä spatiaalinen oppiminen että hippokampuksen pitkäaikainen potentiaatio (LTP) voimistuvat, kun NGF-infuusiot väliseinään, joka on hippokampuksen kolinergisen innervaation ensisijainen lähde, on annettu.
NGF: n fokaalinen käyttö voi myös aiheuttaa rotan piipun aivokuoressa paikallisen viiksiesityksen nopean laajenemisen. Tämä prosessi riippuu kolinergisten ulokkeiden basal etuaivojen (Prakash et al., 1996, 2004), mikä viittaa siihen, että aivokuoren NGF-signalointi voi stimuloida nopeaa kolinergisesti riippuvaista toiminnallista uudelleenjärjestelyä. Sen lisäksi, että NGF: llä on pitkäaikaisia trofisia vaikutuksia perusaivojen kolinergisiin soluihin, se voi osallistua myös lyhytaikaiseen piirin uudelleenmuodostukseen. Tätä ”kaksitoimista” hypoteesia tukee NGF: n konstitutiivisten ja aktiivisuusriippuvaisten vapautumismekanismien olemassaolo (Blochl and Thoenen, 1995; Lessmann et al., 2003), jotka voivat olla NGF: n pitkän aikavälin trofisten vaikutusten taustalla ja lyhyen aikavälin modulatoristen vaikutusten taustalla. Lisäksi NGF: lle on havaittu sekä retrogradisia (pitkäaikaisia) että paikallisia (lyhytaikaisia) signalointireittejä (Huang and Reichardt, 2003).
NGF: ää ilmentäviä soluja on havaittu aivokuoressa, pikkuaivoissa, hippokampuksessa, talamuksessa, striatumissa, tyvitumakkeessa ja aivoaivoissa (Gall and Isackson, 1989; Maisonpierre et al., 1990; Isackson ym., 1991; Conner and Varon, 1992; Hayashi et al., 1993; Mufson ym., 1994; Zhang et al., 2007). Vaikka NGF mRNA: ta on tiettävästi havaittu astrosyyteissä ja muissa glia: ssa, valtaosa aivokuoren NGF: stä tuotetaan neuroneilla (Sofroniew et al., 2001). Tietyntyyppisiä neuroneja, jotka tuottavat NGF: ää aivokuoressa, ei kuitenkaan tunneta, ja kolinergisten kortikopetaalisten projektioiden on osoitettu innervatoivan sekä eksitatorisia että inhibitorisia neuroneja aivokuoressa (Zaborszky et al., 1999). Ulkoisilla alueilla, kuten hippokampuksessa, striatumissa ja perusaivoissa, NGF-tuotanto on pääasiassa lokalisoitu Gabaergisiin inhibitorisiin neuroneihin (Lauterborn et al., 1993, 1995; Pascual ym., 1998; Bizon et al., 1999). NGF: ää tuottavien solujen tunnistaminen aivokuoressa on tärkeää kolinergisten aivokuoren syötteiden modulaation taustalla olevien mahdollisten mekanismien ja aivokuoren plastisuuden mekanismien tunnistamiseksi. Nykyisessä tutkimuksessa, tunnistamme osajoukko kortikaalisten Gabaergisten solujen ensisijainen lähde NGF tuotannon aikuisen aivokuoren, suhteellisen harvinaista tuotantoa glutamatergisten neuronien.
materiaalit ja menetelmät
kaikki potilaat hoidettiin laitoshoidon ohjeiden mukaisesti. Koska kortikaalisen NGF-ilmentymän endogeeninen taso oli alhainen, mikä kielsi erityisten solutyyppisten NGF–lähteiden tunnistamisen aiemmissa tutkimuksissa, suoritimme paikallisia kolkisiini-infuusioita mikrotubuluspolymeroinnin estämiseksi, estäen siten NGF: n kulkeutumisen pois soluruumiista ja johtaen havaittavan NGF-antigeenin kertymiseen tuottavien solujen somaan (Schubert et al., 1972; Hokfelt ym., 1975; Hanson and Edström, 1978; Conner and Varon, 1992). Aiemmat raportit ovat osoittaneet, että kolkisiinihoito lisää NGF: n toteamista immunohistokemiallisilla menetelmillä (Conner ja Varon, 1992). Lisäksi kolkisiinipitoisuudet, jotka ovat samankaltaisia kuin tässä tutkimuksessa käytetyt pitoisuudet, eivät aiheuta vakavia poikkeavuuksia neurotrofiiniperheen jäsenen BDNF: n neuronaalijakaumassa (Conner et al., 1997).
Kudosvalmiste
kahdeksan aikuista Fischer 344-rottaa (4 urosta, 4 naarasta; Harlan Sprague Dawley) nukutettiin 2 ml/kg: lla ketamiinia 25 mg/ml, 1, 3 mg/ml ksylatsiinia ja 0, 25 mg/ml asepromatsiinicocktailia ja pistettiin 5.0 µl kolkisiinia (10 µg/µl aCSF: ssä) alla luetelluissa aivokuoren kohdissa nopeudella 0, 5 µl/min käyttäen 10 µl Hamiltonin ruiskua. Infuusion jälkeen neula pysyi paikoillaan neljä minuuttia, jotta se pääsi leviämään riittävästi ympäröivään kudokseen. Neljälle eläimelle annettiin molemminpuolisia injektioita primaarimotoriseen aivokuoreen (M1), joka oli +1, 2 mm: n etummainen (A/P) ja ±2, 5 mm: n lateraalinen (M/L) bregmaan. Puolet liuoksesta pistettiin 1,6 mm: n syvyyteen aivojen pinnan alapuolelle (D/V) ja loput 1,0 mm: n syvyyteen. loput neljä eläintä saivat kaikki yksipuoliset injektiot etuotsalohkoon (A/P: +3.0, M/L: +0, 5, D/V: -2, 3 ja -1, 8), ohimoaivokuori (A/P: -6, 5, M/L: +5, 0, D/V: -7, 5 ja -7, 0) ja päälaenaivokuori (A/P: -3, 0, M/L: +5, 0, D/V: -1, 8 ja -1, 3). 48 tunnin kuluttua Eläimet nukutettiin syvästi ja perfuusioitiin transsardiaalisesti 250 ml: lla kylmää fosfaattipuskuroitua suolaliuosta (pH 7,4), minkä jälkeen 250 ml kylmää 2% paraformaldehydiä + 0,2% parabentsokinonia 0,1 M fosfaattipuskurissa. Aivot erotettiin, liitettiin 2 tunnin ajan samaan kiinnikkeeseen ja kryotettiin 0, 1 M fosfaattipuskuriin, joka sisälsi 30% sakkaroosia, vähintään 72 tunnin ajan 4°C: ssa. Koronaaliosat (40 µm) leikattiin jäätyvään liukuvaan mikrotomiin ja varastoitiin kryoproteiiniin (TCS) 4°C: ssa, kunnes ne jatkojalostettiin immunohistokemiaa varten.
Kaksimerkintäistä fluoresenssi-Immunohistokemiaa
peräkkäistä kaksimerkintäistä immunohistokemiaa käytettiin visualisoimaan neuroneja, jotka ilmentävät NGF: ää ja joko Gabaergisiä tai glutamatergisia solumarkkereita. Vapaasti kelluvat osat pestiin Tris Puskuroidulla suolaliuoksella (TBS), permeabiloitiin 0,25% Triton X-100: lla, ja epäspesifiset merkinnät estettiin 5% aasinseerumilla. Osia inkuboitiin 72 tunnin ajan 4°C:ssa kanin NGF-vasta-aineella (Conner ja Varon, 1992) laimennettuna 1: 1000 TBS: llä, 0, 25% Triton X-100: lla ja 5% aasinseerumilla. Primaarisen vasta-aineiden inkubaation jälkeen sektioita inkuboitiin aasin Anti-rabbit biotiini-konjugoidussa IgG:ssä (1: 200; Vector Laboratories, Burlingame, CA, USA). Tyramidisignaalin vahvistusta (TSA; PerkinElmer, Waltham, MA, USA) käytettiin NGF-signaalin vahvistamiseen, minkä jälkeen osat pestiin TBS:ssä ja inkuboitiin Alexa Fluor 488: lla tai 594-konjugoidulla streptavidiinilla (Invitrogen, Carlsbad, CA, USA) laimennettuna 1: 200 3 tunnin ajan 4°C: ssa. Lyhyen pesun jälkeen osia inkuboitiin sekä hiiren anti-glutamaattidekarboksylaasilla (Gad) 65 (Gad-6, AntibodyRegistry:AB_528264, 1:2000; Developmental Studies Hybridoma Bank,Iowa City, IA, USA) että hiiren anti-GAD67 (anitbodyregistry: AB_2278725, 1:1500; Millipore, Temecula, CA, USA) tai hiiren anti-parvalbumiinilla (antibodyregistry: ab_2174013, 1:30000; Millipore, Temecula, CA, USA), hiiren anti-KALBINDIINI-d-28K (antibodyregistry: Ab_476894, 1:1500; Sigma-Aldrich, St. Louis, MO, USA), tai hiiren Anti-CA2+/kalmoduliinista riippuvainen proteiinikinaasi IIA (camkiia, antibodyregistry: ab_2067919, 1:1500; Millipore) 72 tunnin ajan 4°C: ssa.lopuksi osat pestiin, inkuboitiin Alexa Fluor 594-tai 488-konjugoidulla aasintorjuntahiirellä (Invitrogen) 3 tunnin ajan huoneenlämmössä, pestiin uudelleen, asennettiin lasilevyille ja päällystettiin Fluoromount-G: llä (Southern Biotech, Birminghan, AL, USA). Gabaergisten solujen tunnistamisen maksimoimiseksi gad65-ja GAD67-vasta-aineita inkuboitiin samanaikaisesti. Osajoukko osioita peitettiin pitkittää kultaa Dapi (Invitrogen) visualisointi solujen tumien.
vasta-aineiden Luonnehdinta
tässä tutkimuksessa käytetty NGF-vasta-aine on kaniineilla kohotettu affiniteetti-puhdistettu polyklonaali puhdistettua hiirtä NGF: ää vastaan (Conner ja Varon, 1992). Vasta-aine tunnistaa puhdistetun hiiren ja rekombinantin ihmisen NGF: n, mutta ei Ristiinnaulitse rekombinantin BDNF: n tai NT-3: n kanssa (Conner ja Varon, 1996). Lisäksi rotan aivojen NGF-ilmentymän immunoreaktiivinen malli vastaa läheisesti rotan aivojen in situ-analyysistä saatua mallia (Conner and Varon, 1997).
monoklonaalinen vasta-aine Gad-65 (Developmental Studies Hybridoma Bank, Gad-6) tuotettiin rokottamalla hiiriä rotan aivoista puhdistetulla Gad-proteiinin immunoaffiniteetilla. Rotan aivojen homogenaattien Western blot-analyysi paljasti vasta-aineen tunnistavan selektiivisesti GAD-65: n, mutta ei GAD-67: ää (Chang and Gottlieb, 1988). Lisätutkimukset ovat osoittaneet, että GAD-6-vasta tunnistaa epitoopin, joka sijaitsee Gad-65: n C-Terminuksen aminohappojen 475-571 välissä (Butler et al., 1993).
Gad-67-hiiren monoklonaali (Millipore, MAB 5406, lot: 25010139) nostettiin aminohappojäämiä 4-101 ihmisen GAD-67, ja tunnistaa yhden 67-kDa bändi Western blot analyysi rotan aivojen (valmistajan tekniset tiedot). Vasta-aineen esiinkubaatio GST-GAD-67-fuusioproteiinin kanssa ei aiheuttanut immunopositiivista signaalia aivoissa (Ito ym., 2007).
hiiren monoklonaalinen Anti-CaMKIIa (Millipore, MAB 8699, lot: LV1366080) tunnistaa erityisesti kalsium/kalmoduliinista riippuvaisen proteiinikinaasi II: n alfa-alayksikön. Western blot-analyysi osoittaa, että vasta-aine tunnistaa yhden 50 kDa: n kaistan ja tunnistaa sekä fosforyloidut että fosforyloimattomat muodot (Erondu and Kennedy, 1985).
monoklonaalinen anti-kalbindin-D-28k (Sigma–Aldrich, C9848, lot: 088k4799) on saatu BALB/C-hiiristä, jotka on immunisoitu puhdistetulla naudan munuaisella kalbindin-D-28k. immunoblottaus osoitti, että vasta-aine tunnistaa 28-kDa: n kaistan eikä reagoi samankaltaisten molekyylien kanssa, kuten kalbindiini-D-9K, kalretiniini, myosiinin kevyt ketju, ja parvalbumin (valmistajan tekniset tiedot). Preabsorptio poikasen ja rotan aivoista puhdistetun calbindin-D-27 kDa-proteiinin kanssa osoitti eliminoivansa calbindin-immunosäilytyksen aivoissa (Pasteels et al., 1987).
Anti-parvalbumiini (Millipore, MAB 1572, lot: LV1378387) kerättiin sammakon lihasta puhdistettua parvalbumiinia vastaan immunisoiduilta hiiriltä. Monoklonaalinen vasta-aine kohdistuu epitooppiin ensimmäisessä Ca2+-sitoutumiskohdassa ja immunoblottianalyysi osoittaa sen tunnistavan 12 kDa: n aivoproteiinin (valmistajan tekniset tiedot).
Confocal Analysis
kuvat otettiin Magnafire-ohjelmistolla varustetulla Olympus AX70: llä (versio 2.0; Karl Storz Imaging, Goleta, CA, USA). Koska NGF-merkintää vähennettiin huomattavasti noin 2 mm kolkisiinin injektiokohtien ETU – /taka-alueella, oletettavasti kolkisiinin diffuusion puutteen vuoksi ja siitä johtuvan somaattisen NGF-kertymisen puuttumisen vuoksi, analysoitiin vain 1,5 mm: n sisällä olevia osia kustakin kolkisiini-injektiokohdasta. Jokainen 10.jakso (400 µm) tutkittiin aivokuoren alueella. Solut laskettiin käsin, ja vähintään kolme osaa analysoitiin jokaiselta aivokuoren alueelta ja vasta-aineyhdistelmä per koehenkilö. Vain kolme eläintä arvioitiin ajallisella alueella, koska neljännessä ei ollut havaittavissa NGF-merkintää. Yksi-ja kaksoismerkityt solut kvantifioitiin sekä yksi-että kaksikanavaisilla kuvilla. Leimattujen solujen tunnistamiseen käytettiin useita kriteerejä, kuten kokoa, morfologiaa, signaalia vs. taustaa ja samanaikaista DAPI-merkintää arvioitaessa DAPI-värjättyä kudosta. Osajoukossa 5 µm Z-pinoja kerättiin Olympus Fluoview FV1000: lla merkityn kohteen neuronaalisen lokalisoinnin varmistamiseksi. Koska olimme kiinnostuneita kaksoismerkittyjen solujen osuudesta eikä absoluuttisesta lukumäärästä, stereologisia menetelmiä ei käytetty.
kaksoismerkittyjen solujen prosenttiosuus immunoreaktiivista (IR) soluryhmää kohti määritettiin kullekin kuvakentälle. Kullekin tutkitulle aivokuoren alueelle laskettiin keskiarvo ± keskivirhe. Yksisuuntaista varianssi-analyysiä (ANOVA) käytettiin aivokuoren alueiden välisten erojen arviointiin. Fisherin HSD: tä käytettiin jälkianalyysissä. Kaikki tilastolliset analyysit tehtiin SPSS 15.0 Windowsille.
vasta-Ainekontrollit
kontrollit sisälsivät primaaristen vasta-aineiden poisjättämisen, sekundaaristen vasta-aineiden poisjättämisen ja primaarisen vasta-aineen korvaamisen epäspesifisellä vasta-aineella (kani IgG). Kaikilla manipulaatioilla oli odotetut vaikutukset, ja ne tukivat väitettä, jonka mukaan merkityt solut edustavat todellista antigeenimerkintää vastaavilla vasta-aineillaan.
tulokset
NGF-Immunomerkintä
erilliset NGF-merkinnät olivat näkyvissä säteellä 1.5 mm: n etäisyydellä kolkisiini-aivokuoren injektiokohdasta. Näillä alueilla NGF-merkintä rajoittui pääasiassa solusomataan (Kuva 1). Harvoin voidaan erottaa myös yksi tai useampi soluprosessi. Tämän 1,5 mm: n säteen ulkopuolella NGF-merkintä oli käytännössä huomaamaton aivokuoressa. Koska NGF-reseptorien aivokuoren ilmentyminen TrkA ja p75 rajoittuvat kolinergisiin kortikopedisiin kuituihin, NGF: n havaittu merkintä ei todennäköisesti heijasta endosytoitunutta NGF: ää, vaan on sen sijaan osoitus NGF: ää tuottavista soluista (Holtzman et al., 1995; Rossi ym., 2002; Stephens et al., 2005). Kuten aiemmin on raportoitu (Ribak et al., 1978), kolkisiinihoito tehosti GAD-merkintää soluissa sekä hermosoluissa. Kolkisiinilla ei ollut havaittavaa vaikutusta parvalbumiinin, kalbindiinin tai Camkiian merkintöihin.
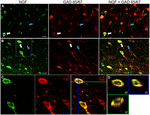
KUVA 1. Hermokasvutekijä kolokalisoituu laajasti inhiboivilla solumarkkereilla. Immunoreaktiiviset solut a) primaarisessa motorisessa aivokuoressa ja B) prefrontaalisessa aivokuoressa. Kuvat osoittavat, että NGF-merkitty solut (vihreä) colocalize laajasti Gad 65/67-merkitty solut (punainen). Valkoiset nuolet näyttävät esimerkkisolun immunoreaktiivisuuden sekä NGF: lle että Gad 65/67: lle kullakin aivokuoren alueella. Siniset nuolet osoittavat solujen immunoreaktiivisuutta vain GAD 65/67: lle. (C) suurennettu kuva alueen sisällä valkoinen laatikko (B). (D) X–Y-Z-rekonstruktio kohdassa (C) tarkoitetusta kaksoismerkitystä solusta. Vihreät ja siniset viivat osoittavat dissektiotasot XZ-ja YZ-tasoissa. Skaalatangot = 25 µm.
NGF ja GABAerginen Koekalalisaatio
hermokasvutekijä lokalisoitui laajalti Gabaergisten solujen markkereiden GAD65 ja GAD67 kanssa riippumatta tutkitusta aivokuoren alueesta (Kuva 1; Taulukko 1). Kaiken kaikkiaan 91 ± 0, 9% NGF-merkityistä aivokuoren soluista merkitsi myös GAD65/67: ää. NGF-merkittyjen solujen prosentuaalisessa osuudessa, joka ilmensi GAD65/67: ää, oli vain vähän eroa etuotsalohkon (90, 0 ± 1, 5%), motorisen (91, 7 ± 1, 5%), päälaen (89, 6 ± 3, 5%) ja ohimolohkon (93, 4 ± 8, 1%) (yksisuuntainen ANOVA; p = 0, 78) välillä. Kääntäen, NGF co-lokalisoitu vain 55 ± 2.3% kaikista GAD65/67-merkityistä soluista. Sen määrittämiseksi, oliko NGF: n tuotanto rajoitettu tiettyyn gabaergisen hermosolun alatyyppiin, merkitsimme NGF: n ja joko parvalbumiinin tai kalbindiinin kudokseen (kuva 2). NGF-merkittyjen solujen havaittiin kolokalisoituvan molempien merkkiaineiden kanssa. NGF-kolokalisaatio parvalbumiinilla (67, 8 ± 3, 6%) oli kuitenkin yli 2× suurempi kuin kalbindiinilla (29, 1 ± 3, 9%). Lisäksi NGF-IR-solut muodostivat alle puolet kaikista parvalbumiinin (47, 7 ± 4, 6%) ja kalbindiinin (25, 7 ± 4, 9%) immunoreaktiivisista soluista.

KUVA 2. NGF on yhdistetty inhiboiviin hermosolun alaluokan markkereihin. Motorisen aivokuoren viipaleet merkittiin NGF: lle ja joko parvalbumiinille tai kalbindiinille. (A) soluissa oli laajoja päällekkäisyyksiä NGF-ja parvalbumiinimerkinnöissä (valkoiset nuolet). (B) kääntäen, colabeling NGF ja calbindin oli harvinaisempaa. Skaalatangot = 25 µm.

TAULUKKO 1. NGF-ja GAD65/67-immunoreaktiiviset solut aivokuoren alueen mukaan.
Hermokasvutekijää ilmentäviä neuroneja havaittiin kaikissa aivokuoren kerroksissa. Aiemmat tutkimukset ovat raportoineet NGF-merkittyjen neuronien epätasaisesta jakautumisesta aivokuoren laminaeissa (Pitts and Miller, 2000; Patz and Wahle, 2006). Kvantitatiivista analyysiä kerroksittain ei kuitenkaan tehty nykyisessä tutkimuksessa, koska NGF: n merkintävoimakkuus väheni, kun etäisyys kolkisiinin injektiokohdasta kasvoi.
NGF-ja Glutamaterginen Rinnakkaislokalisaatio
Camkiia-merkintä havaittiin pääasiassa solujen somatassa ja proksimaalisissa prosesseissa (kuva 3). Toisin kuin NGF: n ja Gabaergisten merkkiaineiden kanssa nähty laaja rinnakkaislokalisaatio, NGF-merkityt solut harvoin lokalisoituvat yhdessä CaMKIIa-merkittyjen solujen kanssa (kuva 3; taulukko 2). Yhteensä 4, 9 ± 1, 1%: ssa NGF-immunoreaktiivisista soluista oli CaMKIIa-vasta-aineita. Co-lokalisointi vaihteli merkittävästi aivokuoren alueella (yksisuuntainen ANOVA; p = 0, 03); Fisherin post hoc osoitti, että etuotsalohkon aivokuorella oli suurempi osuus kaksoismerkittyjä NGF-soluja (7, 6 ± 2, 1%) verrattuna primaariseen motoriseen aivokuoreen (2, 4 ± 1, 0%; p = 0, 02) ja päälaen aivokuoreen (2, 9% ± 1, 5; p = 0, 01).

KUVA 3. Hermokasvutekijä kolokalisoituu minimaalisesti eksitatorisen solumarkkerin Camkiian kanssa. Immunoreaktiivisia soluja etuotsalohkossa. NGF: n (vihreä) ja Camkiian (punainen) solujen kolabeloitiin harvoin riippumatta tutkitusta aivokuoren alueesta. Kultanuolet näyttävät esimerkin solun immunoreaktiivisuudesta vain NGF: lle. Skaalatangot = 25 µm.

TAULUKKO 2. NGF-ja CaMKIIa-immunoreaktiiviset solut aivokuoren alueen mukaan.
Camkiian immunoreaktiivisia soluja oli huomattavasti enemmän kuin NGF-vasta-aineiden leimaamia soluja. CaMKIIa-merkittyjen solujen kokonaisosuus, joka ilmensi samanaikaisesti NGF-signaalia, oli 2 ± 0, 6%. Tämä prosenttiluku vaihteli merkittävästi alueittain (yksisuuntainen ANOVA P = 0, 003) siten, että prefrontaalisessa aivokuoressa oli enemmän kaksoismerkittyjä NGF/CaMKIIa-soluja (3, 7 ± 1, 1%) kuin primaarisessa motorisessa aivokuoressa (0, 8% ± 0, 3; p = 0, 001), parietaalisessa aivokuoressa (1, 4% ± 0, 6; p = 0, 01) ja ohimollisessa aivokuoressa (1, 5 ± 0, 6%; p = 0, 01).
Keskustelu
nykyinen tutkimus osoittaa, että valtaosa (> 90%) aivokuoren NGF: ää tuottavista neuroneista on Gabaergisiä, kun taas puolet kaikista Gabaergisistä neuroneista kolokalisoituu NGF: llä. Sen sijaan eksitatoristen neuronien markkereilla esiintyy vain harvinaista rinnakkaislokalisoitumista NGF: n kanssa. Nämä tulokset olivat yhdenmukaisia useilla tässä tutkimuksessa analysoiduilla aivokuoren alueilla, mikä viittaa siihen, että NGF: ää tuottavat pääasiassa rotan neokorteksissa olevat inhiboivat interneuronit.
vaikka NGF-immunoreaktiivisuus harvoin yhtyi eksitatorisiin solumarkkereihin (CAMKIIa), pieni osuus (~5%) oli positiivinen Camkiialle kaikilla tutkituilla aivokuoren alueilla. Konfokaalinen analyysi vahvisti, että tämä kaksinkertainen merkintä oli peräisin samasta fokaalitasosta, eikä se johtunut päällekkäisistä soluista johtuvasta diskreetistä signaalista. NGF-ekspression funktionaalista merkitystä niin pienessä eksitatoristen solujen murto-osassa ei tunneta, mutta on mahdollista, että nämä NGF-tuottavat neuronit edustavat aiemmin tunnistamatonta eksitatoristen neuronien alaluokkaa neokorteksissa.
tuloksemme ovat yhtäpitäviä muilla aivoalueilla tehtyjen aiempien tutkimusten havaintojen kanssa, jotka osoittavat, että NGF: n samanaikainen sijainti on lähes yksinomaan striatumin, perusaivojen ja hippokampuksen Gabaergisten solujen kanssa (Lauterborn et al., 1993, 1995; Pascual ym., 1998; Bizon et al., 1999). Näin ollen GABAERGISTEN solujen aiheuttama NGF-tuotanto voi olla yleinen ominaisuus kaikille niille kohteille, jotka saavat perusaivojen kolinergistä innervaatiota (mukaan lukien perusaivojen etuaivot). Nämä kolinergiset neuronipopulaatiot tarvitsevat NGF: ää fenotyyppinsä ja projektioidensa ylläpitämiseksi (Rylett et al., 1993; Chen ym., 1997; Hu ym., 1997; Debeir ym., 1999). Eri tutkimuksissa inhiboivat interneuronit ovat nyt NGF-trofismin ensisijainen lähde perusaivojen kolinergisille neuroneille.
vaikka perusaivojen kolinergiset neuronit inervoivat sekä eksitatorisia että inhibitorisia aivokuoren verkostoja (Zaborszky et al., 1999), troofisen tuen lähde on ylivoimaisesti inhibitorisesta väestöstä, jolla tiedetään olevan kriittinen rooli plastisuuden välittäjänä aivokuoren piireissä (Hensch and Stryker, 2004; Yazaki-Sugiyama et al., 2009; Donato et al., 2013). Kolinerginen signalointi näyttää edistävän erilaisten inhibitoristen alipopulaatioiden differentiaalista aktivaatiota, mikä moduloi eksitatorista inhibitorista tasapainoa (Xiang et al., 1998; Froemke et al., 2007). NGF voi siten toimia takaisinkytkentäsignaalina erittäin muovisten inhibitoristen verkkojen ja niitä aktivoivien kolinergisten syötteiden välillä. Itse asiassa NGF lisää plastisuutta ja käyttäytymisen oppimista kolinergisistä riippuvaisten mekanismien kautta (Prakash et al., 1996, 2004; Gutierrez et al., 1997; Conner et al., 2009). NGF: n toimintariippuvainen vapautuminen (Blochl and Thoenen, 1995; Lessmann et al., 2003), yhdistettynä NGF: n kykyyn lisätä kolinergistä aktiivisuutta (Rylett et al., 1993; Hu ym., 1997; Auld ym., 2001), ehdottaa, että NGF voi edistää uudelleenorganisointia aktiivisten piirien kautta parannettu kolinerginen toiminta.
tulevissa tutkimuksissa pyritään selvittämään, mitkä inhibitoristen neuronien alaluokat ilmentävät NGF: ää ja miten tämä ilmaisu tarkalleen vaikuttaa aivokuoren virtapiireihin. Tätä varten otimme alustavia toimenpiteitä selvittää, onko NGF yhteistyössä lokalisoitu kaksi yhteistä markkereita inhibitory neuronien, parvalbumin (liittyy ensisijaisesti kori ja kattokruunu solut), ja calbindin (liittyy lukuisia inhibitory solutyypit; McBain ja Fisahn, 2001; Markram et al., 2004). Tuloksemme osoittavat, että NGF havaittiin ensisijaisesti parvalbumiini-immunoreaktiivisissa soluissa, vaikka monet parvalbumiinin merkitsemät solut eivät yhdessä ilmaisseet NGF: ää. Tärkeää on, että NGF-IR-solut myös kolokalisoituvat calbindin-merkittyjen solujen kanssa, mikä viittaa siihen, että useampi kuin yksi inhibitorinen neuroni tuottaa NGF: ää.
yhteenvetona voidaan todeta, että rotan neokorteksissa NGF ilmaistaan pääasiassa inhibitorisilla neuroneilla, ominaisuus, joka näyttää säilyvän fylogeneettisesti vanhemmilta aivoalueilta ja joka voi yleistyä koko aivoihin. Tuloksemme viittaavat siihen, että aivokuoren inhibitorisilla interneuroneilla on tärkeä rooli perusaivojen kolinergisten projektiosoluneiden ylläpidossa. GABAerginen interneurons siten voi edistää aivokuoren uudelleenjärjestely kautta säännelty NGF signalointi.
Eturistiriitalausunto
kirjoittajat toteavat, että tutkimus tehtiin ilman kaupallisia tai taloudellisia suhteita, joita voitaisiin pitää mahdollisena eturistiriitana.
kiitokset
rahoittajina NIH (AG10435), veteraanien hallinto, Alzheimer ’ s Association sekä Dr. Miriam ja Sheldon G. Adelson Medical Research Foundation.
lisäaineisto
tämän artikkelin lisäaineisto löytyy verkosta osoitteesta: http://www.frontiersin.org/journal/10.3389/fncel.2014.00220/abstract
Auld, D. S., Mennicken, F., and Quirion, R. (2001). Hermokasvutekijä indusoi nopeasti pitkittynyttä asetyylikoliinin vapautumista viljellyistä perusaivojen neuroneista: erilaistuminen neuromodulatoristen ja neurotrofisten vaikutusten välillä. J. Neurotutkija. 21, 3375–3382.
Pubmed Abstrakti / Pubmed kokoteksti
Bakin, J. S., and Weinberger, N. M. (1996). Fysiologisen muistin induktio aivokuoressa stimuloimalla Tuma basalis. Proc. Natl. Acad. Sci. USA 93, 11219-11224. doi: 10.1073 / pnas.93. 20. 11219
CrossRef koko teksti
Bizon, J. L., Lauterborn, J. C., and Gall, C. M. (1999). Striataalisten interneuronien alapopulaatiot voidaan erottaa neurotrofisen tekijän ilmentymisen perusteella. J. Comp. Neurol. 408, 283–298. doi: 10.1002 / (SICI)1096-9861(19990531)408:2<283::tuki-CNE9>3.0.CO;2-2
Pubmed Abstrakti / Pubmed koko teksti | CrossRef koko teksti
Blochl, A., and Thoenen, H. (1995). Characterization of nerve growth factor (NGF) release from hippokampal neurons: evidence for a constitutive and an unconventional sodium-dependent regulated Path. Euro. J. Neurotutkija. 7, 1220–1228. doi: 10.1111 / j.1460-9568. 1995.tb01112.x
Pubmed Abstrakti / Pubmed koko teksti | CrossRef koko teksti
Butler, M. H., Solimena, M., Dirkx, R. Jr., Hayday, A., and De Camilli, P. (1993). Glutamiinihappodekarboksylaasin (GAD-65) dominoivan epitoopin tunnistaminen autovasta-aineista jäykkämiehen oireyhtymässä. Käyt. Viim. Med. 178, 2097–2106. doi: 10.1084 / jem.178. 6. 2097
Pubmed Abstrakti | Pubmed koko teksti | CrossRef koko teksti
Chang, Y. C., and Gottlieb, D. I. (1988). Glutamiinihappodekarboksylaasin monoklonaalisilla vasta-aineilla puhdistettujen proteiinien Luonnehdinta. J. Neurotutkija. 8, 2123–2130.
Chen, K. S., Nishimura, M. C., Armanini, M. P., Crowley, C., Spencer, S. D., and Phillips, H. S. (1997). Hermokasvutekijägeenin yhden alleelin häiriintyminen johtaa tyvitumakkeiden kolinergisten neuronien surkastumiseen ja muistivajeisiin. J. Neurotutkija. 17, 7288–7296.
Pubmed Abstrakti / Pubmed kokoteksti
Conner, J. M., Chiba, A. A., and Tuszynski, M. H. (2005). Perusaivojen kolinerginen järjestelmä on välttämätön aivokuoren plastisuuden ja toiminnallisen palautumisen kannalta aivovamman jälkeen. Neuron 46, 173-179. doi: 10.1016 / J.neuron.2005. 03. 003
Pubmed Abstrakti | Pubmed Koko Teksti | CrossRef Koko Teksti
Conner, J. M., Culberson, A., Packowski, C., Chiba, A. A., and Tuszynski, M. H. (2003). Kolinergisen perusaivojärjestelmän vauriot heikentävät tehtävän saamista ja poistavat motoriseen taitojen oppimiseen liittyvän aivokuoren plastisuuden. Neuron 38, 819-829. doi: 10.1016 / S0896-6273(03)00288-5
PubMed Abstrakti / Pubmed kokoteksti | CrossRef kokoteksti
Conner, J. M., Franks, K. M., Titterness, A. K., Russell, K., Merrill, D. A., Christie,B. R., et al. (2009). NGF on välttämätön hippokampuksen plastisuuden ja oppimisen kannalta. J. Neurotutkija. 29, 10883–10889. doi: 10.1523 / JNEUROSCI.2594-09.2009
Pubmed Abstrakti / Pubmed koko teksti | CrossRef koko teksti
Conner, J. M., Lauterborn, J. C., Yan, Q., Gall, C. M., and Varon, S. (1997). Brain-derived neurotrofic factor (BDNF) protein and mRNA in the normal adult rotta CNS: evidence for anterogradeaksonal transport. J. Neurotutkija. 17, 2295–2313.
Pubmed Abstrakti / Pubmed kokoteksti
Conner, J. M., and Varon, S. (1992). Hermokasvutekijän kaltaisten immunoreaktiivisten hermosolujen jakautuminen aikuisen rotan aivoissa kolkisiinihoidon jälkeen. J. Comp. Neurol. 326, 347–362. doi: 10.1002 / cne.903260304
Pubmed Abstrakti / Pubmed koko teksti | CrossRef koko teksti
Conner, J. M., and Varon, S. (1996). Vasta-aineiden luonnehtiminen hermokasvutekijälle: määrityksestä riippuva vaihtelu ristireaktiivisuudessa muiden neurotrofiinien kanssa. J. Neurotutkija. Menetelmät 65, 93-99. doi: 10.1016/0165-0270(95)00151-4
PubMed Abstrakti / Pubmed kokoteksti | CrossRef kokoteksti
Conner, J. M., and Varon, S. (1997). NGF-immunoreaktiivisuuden kehitysprofiili rotan aivoissa: NGF: n mahdollinen rooli kolinergisten terminaalikenttien muodostamisessa hippokampuksessa ja aivokuoressa. Brain Res. Dev. Brain Res. 101, 67-79. doi: 10.1016 / S0165-3806(97)00051-5
PubMed Abstrakti / Pubmed kokoteksti | CrossRef kokoteksti
Debeir, T., Saragovi, H. U., and cuello, A. C. (1999). Hermokasvutekijän mimeettinen TrkA-antagonisti aiheuttaa Rotalla aivokuoren kolinergisten boutonien vetäytymistä. Proc. Natl. Acad. Sci. USA 96, 4067-4072. doi: 10.1073 / pnas.96.7.4067
Pubmed Abstrakti / Pubmed koko teksti | CrossRef koko teksti
Donato, F., Romppani, S. B., and Caroni, P. (2013). Kokemuksen aiheuttama parvalbumiinia ilmentävä kori-Soluverkon plastisuus säätelee aikuisopiskelua. Nature 504, 272-276. doi: 10.1038 / nature12866
Pubmed Abstrakti / Pubmed kokoteksti | CrossRef kokoteksti
Erondu, N. E., and Kennedy, M. B. (1985). Tyypin II Ca2+/kalmoduliiniriippuvaisen proteiinikinaasin alueellinen jakautuminen rotan aivoissa. J. Neurotutkija. 5, 3270–3277.
Froemke, R. C., Merzenich, M. M., and Schreiner, C. E. (2007). Synaptinen muistijälki aivokuoren vastaanottavan kentän plastisuuteen. Nature 450, 425-429. doi: 10.1038 / nature06289
Pubmed Abstrakti / Pubmed kokoteksti | CrossRef kokoteksti
Gall, C. M., and Isackson, P. J. (1989). Limbiset kohtaukset lisäävät hermokasvutekijän lähetti-RNA: n hermotuotantoa. Science 245, 758-761. doi: 10.1126 / tiede.2549634
Ristikirjoitus koko teksti
Gutierrez, H., Miranda, M. I., and Bermudez-Rattoni, F. (1997). Oppimisvaikeudet ja kolinerginen deafferentaatio aivokuoren hermokasvutekijän puutteen jälkeen. J. Neurotutkija. 17, 3796–3803.
Pubmed Abstrakti / Pubmed kokoteksti
Hanson, M., and Edström, A. (1978). Mitoosin estäjät ja aksonaalinen kuljetus. Int. Pastori Cytol. Suppl. 373–402.
Hayashi, M., Yamashita, A., Shimizu, K., Sogawa, K., and Fujii, Y. (1993). Nerve growth factor (NGF) – geenin ilmentyminen apinoiden keskushermostossa. Brain Res. 618, 142-148. doi: 10.1016/0006-8993 (93)90437-R
CrossRef Koko Teksti
Hefti, F. (1986). Hermokasvutekijä edistää väliseinäisten kolinergisten neuronien selviytymistä fimbriaalisten transaktioiden jälkeen. J. Neurotutkija. 6, 2155–2162.
Hensch, tk, and Stryker, M. P. (2004). Columnar arkkitehtuuri veistetty GABA circuits kehittää cat visual cortex. Science 303, 1678-1681. doi: 10.1126 / tiede.1091031
Pubmed Abstrakti / Pubmed koko teksti | CrossRef koko teksti
Hokfelt, T., Kellerth, J. O., Nilsson, G., and Pernow, B. (1975). Kokeelliset immunohistokemialliset tutkimukset aineen P lokalisoinnista ja jakautumisesta kissan primaarisissa aistineuroneissa. Brain Res. 100, 235-252. doi: 10.1016/0006-8993(75)90481-3
PubMed Abstrakti / Pubmed kokoteksti | CrossRef kokoteksti
Holtzman, D. M., Kilbridge, J., Li, Y., Cunningham, E. T. Jr., Lennn, N. J., Clary,D. O., et al. (1995). TrkA expression in the CNS: evidence for the existence of several novel NGF-responsive CNS neurons. J. Neurotutkija. 15, 1567–1576.
Pubmed Abstrakti / Pubmed Kokoteksti
Hu, L., Cote, S. L., and Cuello, A. C. (1997). Nucleus basalis magnocellularis-neuronien kolinergisen fenotyypin differentiaalimodulaatio soveltamalla NGF: ää solurungossa tai aivokuoren terminaalikentissä. Käyt.viim. Neurol. 143, 162–171. doi: 10.1006 / exnr.1996. 6357
Pubmed Abstrakti / Pubmed koko teksti | CrossRef koko teksti
Huang, E. J., and Reichardt, L. F. (2003). Trk-reseptorit: roolit neuronaalisessa signaalinsignaalin transduktiossa. Annu. Pastori Biochem. 72, 609–642. doi: 10.1146 / annurev.biochem.72.121801.161629
Ristikirjoitus koko teksti
Isackson, P. J., Huntsman, M. M., Murray, K. D., and Gall, C. M. (1991). BDNF mRNA: n ilmentyminen lisääntyy aikuisilla rotilla etuaivoissa limbisten kohtausten jälkeen: induktion ajalliset mallit, jotka eroavat NGF: stä. Neuron 6, 937-948. doi: 10.1016 / 0896-6273 (91) 90234-Q
Pubmed Abstrakti / Pubmed kokoteksti | CrossRef kokoteksti
Ito, T., Hioki, H., Nakamura, K., Tanaka, Y., Nakade, H., Kaneko,T., et al. (2007). Gamma-aminovoihappoa sisältävät sympaattiset preganglioniset hermosolut rottien rintarangan selkäytimessä lähettävät aksoninsa ylempään kaularangan hermosolmuun. J. Comp. Neurol. 502, 113–125. doi: 10.1002 / cne.21309
Pubmed Abstrakti / Pubmed koko teksti | CrossRef koko teksti
Kilgard, M. P., and Merzenich, M. M. (1998). Nucleus basalis-aktiviteetin mahdollistama aivokartan uudelleenjärjestely. Science 279, 1714-1718. doi: 10.1126 / tiede.279. 5357. 1714
Pubmed Abstrakti | Pubmed Koko Teksti | CrossRef Koko Teksti
Kordower, J. H., Bartus, R. T., Bothwell, M., Schatteman, G., and Gash, D. M. (1988). Nerve growth factor receptor immunore activity in the nonhumanum primate (cebus apella): distribution, morphology, and colocalisation with cholinergic enzymes. J. Comp. Neurol. 277, 465–486. doi: 10.1002 / cne.902770402
Pubmed Abstrakti / Pubmed koko teksti | CrossRef koko teksti
Kordower, J. H., Winn, S. R., Liu, Y. T., Mufson, E. J., Sladek, J. R. Jr., Hammang,J. P., et al. (1994). Vanha apina basal etuaivot: aksotomisoitujen aivopuoliskojen pelastaminen ja idättäminen ihmisen hermokasvutekijää erittävien kapseloitujen solujen siirtämisen jälkeen. Proc. Natl. Acad. Sci. USA 91, 10898-10902. doi: 10.1073 / pnas.91. 23. 10898
Pubmed Abstrakti | Pubmed koko teksti | CrossRef koko teksti
Korsching, S., Auburger, G., Heumann, R., Scott, J., and Thoenen, H. (1985). Hermokasvutekijän ja sen mRNA: n tasot rotan keskushermostossa korreloivat kolinergisen innervaation kanssa. EMBO J. 4, 1389-1393.
Pubmed Abstrakti / Pubmed kokoteksti
Lad, S. P., Neet, K. E., and Mufson, E. J. (2003). Nerve growth factor: structure, function and therapeutic implications for Alzheimer ’ s disease. Kurr. Lääke kohdistuu keskushermoston Neuroliin. Epäsopu. 2, 315–334. doi: 10.2174/1568007033482724
PubMed Abstrakti / Pubmed kokoteksti | CrossRef kokoteksti
Large, T. H., Bodary, S. C., Clegg, D. O., Weskamp, G., Otten, U., and Reichardt, L. F. (1986). Hermokasvutekijän geenin ilmentyminen kehittyvissä rotan aivoissa. Science 234, 352-355. doi: 10.1126 / tiede.3764415
Ristikirjoitus koko teksti
Lauterborn, J. C., Bizon, J. L., Tran, T. M., and Gall, C. M. (1995). NGF mRNA: ta ilmentävät Gabaergiset, mutta eivät kolinergiset hermosolut rotan perusaivoissa. J. Comp. Neurol. 360, 454–462. doi: 10.1002 / cne.903600307
Pubmed Abstrakti / Pubmed koko teksti | CrossRef koko teksti
Lauterborn, J. C., Tran, T. M., Isackson, P. J., and Gall, C. M. (1993). Hermokasvutekijä mRNA: ta ilmentävät Gabaergiset hermosolut rotan hippokampuksessa. Neuroraportti 5, 273-276. doi: 10.1097/00001756-199312000-00023
yliviivataan koko teksti
Lessmann, V., Gottmann, K., and Malcangio, M. (2003). Neurotrophinin eritys: nykyiset tosiasiat ja tulevaisuudennäkymät. Prog. Neurobioli. 69, 341–374. doi: 10.1016 / S0301-0082(03)00019-4
PubMed Abstrakti / Pubmed kokoteksti | CrossRef kokoteksti
Li, Y., Holtzman, D. M., Kromer, L. F., Kaplan, D. R., Chua-Couzens, J., Clary,D. O., et al. (1995). Trka: n ja ChAT-ilmaisun säätely rotan perusaivojen kehittämisessä: todisteet siitä, että sekä eksogeeninen että endogeeninen NGF säätelevät kolinergisten neuronien erilaistumista. J. Neurotutkija. 15, 2888–2905.
Pubmed Abstrakti / Pubmed kokoteksti
Maisonpierre, P. C., Belluscio, L., Friedman, B., Alderson, R. F., Wiegand, S. J., Furth,M. E., et al. (1990). NT-3, BDNF ja NGF kehittyvässä rotan hermostossa: yhdensuuntaiset ja vastavuoroiset ilmaisumallit. Neuron 5, 501-509. doi: 10.1016 / 0896-6273 (90)90089-X
Pubmed Abstrakti / Pubmed kokoteksti | CrossRef kokoteksti
Markram, H., Toledo-Rodriguez, M., Wang, Y., Gupta, A., Silberberg, G., and Wu, C. (2004). Neokortikaalisen inhibitorisen järjestelmän sisäiset neuronit. Nat. Pastori Neurotutkija. 5, 793–807. doi: 10.1038 / nrn1519
Pubmed Abstrakti / Pubmed koko teksti | CrossRef koko teksti
McBain, C. J., and Fisahn, A. (2001). Ei sitoumuksia. Nat. Pastori Neurotutkija. 2, 11–23. doi: 10.1038/35049047
PubMed Abstrakti / Pubmed kokoteksti | CrossRef kokoteksti
Mufson, E. J., Conner, J. M., Varon, S., and Kordower, J. H. (1994). Nerve growth factor-like immunoreactive profiles in the primate basal forbrain and hippokampal formation. J. Comp. Neurol. 341, 507–519. doi: 10.1002 / cne.903410407
Pubmed Abstrakti / Pubmed koko teksti | CrossRef koko teksti
Pascual, M., Rocamora, N., Acsady, L., Freund, TF, and Soriano, E. (1998). Hermokasvutekijän ja neurotrophin-3 mRNAs: n ilmentyminen hippokampaalisissa interneuroneissa: hermokasvutekijän ja neurotrophin-3: n morfologinen Luonnehdinta, ilmentymistasot ja kolokalisaatio. J. Comp. Neurol. 395, 73–90. doi: 10.1002 / (SICI)1096-9861(19980525)395:1<73::tuki-CNE6>3.0.CO; 2-E
Pubmed Abstrakti / Pubmed koko teksti | CrossRef koko teksti
Pasteels, B., Miki, N., Hatakenaka, S., and Pochet, R. (1987). Immunohistokemiallinen ristireaktiivisuus ja elektroforeettinen komigraatio kalbindiini D – 27 kDa: n ja visiniinin välillä. Brain Res. 412, 107-113. doi: 10.1016/0006-8993(87)91444-2
PubMed Abstrakti / Pubmed kokoteksti | CrossRef kokoteksti
Patz, S., and Wahle, P. (2006). Neurotrofin mRNA-ilmentymän kehityshäiriöt rotan näköaivokuoren kerroksissa. Euro. J. Neurotutkija. 24, 2453–2460. doi: 10.1111 / j.1460-9568.2006.05126.x
Pubmed Abstrakti / Pubmed koko teksti | CrossRef koko teksti
Pitts, A. F., and Miller, M. W. (2000). Hermokasvutekijän, aivoista johdetun neurotrofisen tekijän ja neurotrofiini-3: n ilmentyminen kypsän rotan somatosensorisessa aivokuoressa: coekspressio korkean affiniteetin neurotrofiinireseptoreilla. J. Comp. Neurol. 418, 241–254. doi: 10.1002 / (SICI)1096-9861(20000313)418:3<241::tuki-CNE1>3.0.CO;2-M
Pubmed Abstrakti / Pubmed koko teksti | CrossRef koko teksti
Prakash, N., Cohen-Cory, S., and Frostig, R. D. (1996). BDNF: n ja NGF: n nopeat ja vastakkaiset vaikutukset aikuisen aivokuoren toimintaan in vivo. Luonto 381, 702-706. doi: 10.1038 / 381702a0
Pubmed Abstrakti / Pubmed koko teksti | CrossRef koko teksti
Prakash, N., Cohen-Cory, S., Penschuck, S., and Frostig, R. D. (2004). Kolinerginen tyvitumake on mukana nopean hermokasvutekijän (NGF) aiheuttamassa plastisuudessa aikuisten rottien piipun aivokuoressa. J. Neurofysioli. 91, 424–437. doi: 10.1152 / jn.00489. 2003
Pubmed Abstrakti / Pubmed kokoteksti | CrossRef kokoteksti
Ribak, C. E., Vaughn, J. E., and Saito, K. (1978). Glutamiinihappodekarboksylaasin immunosytokemiallinen lokalisointi neuronaaliseen somataan sen jälkeen, kun kolkisiini estää aksonaalisen kuljetuksen. Brain Res. 140, 315-332. doi: 10.1016/0006-8993(78)90463-8
PubMed Abstrakti / Pubmed kokoteksti | CrossRef kokoteksti
Rossi, F. M., Sala, R., and Maffei, L. (2002). Hermokasvutekijäreseptorien trka ja p75NTR ilmentyminen rotan näköaivokuoressa: kolinergisen syötön kehittyminen ja säätely. J. Neurotutkija. 22, 912–919.
Pubmed Abstrakti / Pubmed kokoteksti
rylett, R. J., Goddard, S., Schmidt, B. M., and Williams, L. R. (1993). Asetyylikoliinisynteesi ja vapautuminen NGF: n jatkuvan intrakerebraalisen annon jälkeen aikuisilla ja ikääntyneillä Fischer-344-rotilla. J. Neurotutkija. 13, 3956–3963.
Pubmed Abstrakti / Pubmed kokoteksti
Schubert, P., Kreutzberg, G. W., and Lux, H. D. (1972). Neuroplasmic transport in dendrites: effect of colchicine on morphology and physiology of motoneurones in the cat. Brain Res. 47, 331-343. doi: 10.1016/0006-8993(72)90643-9
PubMed Abstrakti / Pubmed kokoteksti | CrossRef kokoteksti
Shelton, D. L. ja Reichardt, L. F. (1986). Tutkimukset beta nerve growth factor (NGF) – geenin ilmentymisestä keskushermostossa: NGF mRNA: n taso ja alueellinen jakautuminen viittaavat siihen, että NGF toimii trofiatekijänä useille eri neuronipopulaatioille. Proc. Natl. Acad. Sci. USA 83, 2714-2718. doi: 10.1073 / pnas.83. 8. 2714
Pubmed Abstrakti / Pubmed koko teksti | CrossRef koko teksti
Sofroniew, M. V., Howe, C. L., and Mobley, W. C. (2001). Hermokasvutekijän signalointi, neuroprotektio ja hermoston korjaus. Annu. Pastori Neurotutkija. 24, 1217–1281. doi: 10.1146 / annurev.neuro.24.1.1217
Ristikirjoitus koko teksti
Stephens, H. E., Belliveau, A. C., Gupta, J. S., Mirkovic, S., and Kablar, B. (2005). Neurotrofiinien rooli selkäytimen motoneuronien ja selkäjuuren proprioseptisten aistineuronien ylläpidossa. Int. J. Dev. Neurotieteilijä. 23, 613–620. doi: 10.1016 / J.ijdevneu.2005. 07. 002
Pubmed Abstrakti | Pubmed koko teksti | CrossRef koko teksti
Tuszynski, M. H., Armstrong, D. M., and Gage, F. H. (1990). Fimbria/fornix-transektion jälkeinen perusaivojen solujen häviäminen. Brain Res. 508, 241–248. doi: 10.1016/0006-8993(90)90402-W
CrossRef koko teksti
Xiang, Z., Hugenard, J. R., and Prince, D. A. (1998). Kolinerginen vaihto neokortikaalisten inhibitoristen verkostojen sisällä. Tiede 281, 985-988. doi: 10.1126 / tiede.281. 5379. 985
Pubmed Abstrakti / Pubmed koko teksti | CrossRef koko teksti
Yazaki-Sugiyama, Y., Kang, S., Cateau, H., Fukai, T., and Hensch, T. K. (2009). Kaksisuuntainen plastisuus nopeasti piikittävissä GABA-piireissä visuaalisella kokemuksella. Nature 462, 218-221. doi: 10.1038 / nature08485
Pubmed Abstrakti / Pubmed kokoteksti | CrossRef kokoteksti
Zaborszky, L., Pang, K., Somogyi, J., Nadasdy, Z., and Kallo, I. (1999). Perusaivojen etuaivojen kortikopetaalinen järjestelmä uudistettu. Ann. N. Y. Acad. Sci. 877, 339–367. doi: 10.1111 / j.1749-6632. 1999.tb09276.x
Pubmed Abstrakti / Pubmed koko teksti | CrossRef koko teksti
Zhang, H. T., Li, L. Y., Zou, X. L., Song, X. B., Hu, Y. L., Feng,Z. T., et al. (2007). NGF: n, BDNF: n, NT-3: n ja NT-4: n immunohistokemiallinen jakautuminen aikuisen reesusapinan aivoissa. J. Histochem. Cytochem. 55, 1–19. doi: 10.1369/jhc.6A6952.2006
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text