- Bevezetés
- anyagok és módszerek
- Szövetkészítmény
- kettős címkével ellátott fluoreszcens immunhisztokémia
- Antitestjellemzés
- konfokális elemzés
- antitest-kontrollok
- eredmények
- NGF Immuncímkézés
- NGF és GABAerg Co-lokalizáció
- NGF és glutamáterg Co-lokalizáció
- Vita
- összeférhetetlenségi nyilatkozat
- Köszönetnyilvánítás
- Kiegészítő anyag
Bevezetés
a neurotrophin nervus growth factor (NGF) részt vesz számos kritikus folyamatok a fejlődő és érett emlős idegrendszer, beleértve a cél beidegzés, sejtdifferenciálódás és neuronális túlélés (Large et al., 1986; Li et al., 1995; Sofroniew et al., 2001; Lad et al., 2003). A felnőtt agyban az NGF kulcsszerepet játszik a bazális előagy kolinerg rendszerének fenntartásában és működésében (Lad et al., 2003). Az NGF szintje a legmagasabb azokon a területeken, ahol a legtöbb bazális előagy kolinerg vetülete van, nevezetesen a hippocampus és a cortex (Korsching et al., 1985; Shelton and Reichardt, 1986), valamint az NGF receptorai a kéregben nagyrészt a bazális előagy kortikopetális vetületeire korlátozódnak (Kordower et al., 1988; Sofroniew et al., 2001; Rossi et al., 2002). Az ideg növekedési faktor jelátvitel fenntartja a kolinerg kortikopetális vetületeket felnőttkorban (Chen et al., 1997; Debeir et al., 1999), és megakadályozhatja ezen idegsejtek degenerációját axonjaik transzekcióját követően (Hefti, 1986; Tuszynski et al., 1990; Kordower et al., 1994). Ezenkívül az NGF fokozza az acetilkolin felszabadulását a bazális előagy kultúrákból (Auld et al., 2001), és képes modulálni a kolinerg funkciót a kolinerg gén lokusz fenotípusos szabályozásával (Rylett et al., 1993; Hu et al., 1997).
a bazális előagy kolinerg rendszere befolyásolja a tanulást és a tapasztalatfüggő plaszticitást az agykéregben (Bakin and Weinberger, 1996; Kilgard and Merzenich, 1998; Conner et al., 2003, 2005), és az NGF jelátvitelről feltételezik, hogy támogatja és esetleg fokozza a bazális előagy által közvetített tanulást és plaszticitást. Például az NGF jelátvitel blokkolása az NGF antitestek ismételt injekcióival az insularis kéregben csökkenti a helyi kolinerg beidegzést, és megzavarja a két folyamat megszerzését, amelyek a kolinerg bemenetek integritásától, a kondicionált ízleléstől és a gátló elkerülési tanulástól függenek (Gutierrez et al., 1997). Egy nemrégiben készült tanulmány szerint Conner et al. (2009) kimutatta, hogy mind a térbeli tanulás, mind a hippokampusz hosszú távú potencírozása (LTP) fokozódik az NGF infúziója után a szeptális magba, amely a hippokampusz kolinerg beidegzésének elsődleges forrása.
az NGF fókuszos alkalmazása a patkányok hordókéregében a helyi pofaszakáll-reprezentáció gyors terjeszkedését is kiválthatja. Ez a folyamat a bazális előagy kolinerg vetületeitől függ (Prakash et al., 1996, 2004), ami arra utal, hogy a kortikális NGF jelátvitel stimulálhatja a gyors kolinerg-függő funkcionális átszervezést. Így a bazális előagy kolinerg sejtjeire gyakorolt hosszú távú trofikus hatása mellett az NGF részt vehet a rövid távú áramkör-átalakításban is. Ezt a” kettős hatású ” hipotézist alátámasztja az NGF konstitutív és aktivitásfüggő felszabadulási mechanizmusainak létezése (Blochl and Thoenen, 1995; Lessmann et al., 2003), amelyek potenciálisan az NGF hosszú távú trofikus, illetve rövid távú modulációs hatásainak alapjául szolgálhatnak. Ezenkívül mind a retrográd (hosszú távú), mind a helyi (rövid távú) jelátviteli útvonalakat megfigyelték az NGF esetében (Huang and Reichardt, 2003).
NGF-et expresszáló sejteket mutattak ki a kéregben, a kisagyban, a hippocampusban, a thalamusban, a striatumban, a bazális előagyban és az agytörzsben (Gall and Isackson, 1989; Maisonpierre et al., 1990; Isackson et al., 1991; Conner és Varon, 1992; Hayashi et al., 1993; Mufson et al., 1994; Zhang et al., 2007). Bár az NGF mRNS-t állítólag megfigyelték asztrocitákban és más glia-kban, a kortikális NGF túlnyomó többségét neuronok termelik (Sofroniew et al., 2001). A kéregben NGF-et termelő neuronok specifikus típusai azonban nem ismertek, és kimutatták, hogy a kolinerg kortikopetális vetületek mind az ingerlő, mind a gátló idegsejteket beidegzik a kéregben (Zaborszky et al., 1999). Az extrakortikális régiókban, mint például a hippocampus, a striatum és a bazális előagy, az NGF termelés elsősorban a GABAerg gátló neuronokra lokalizálódik (Lauterborn et al., 1993, 1995; Pascual et al., 1998; Bizon et al., 1999). Az NGF-termelő sejtek azonosítása a kéregben fontos a kolinerg kortikális bemenetek modulációjának alapjául szolgáló lehetséges mechanizmusok azonosításához, valamint a kortikális plaszticitás mechanizmusai. A jelenlegi tanulmányban a kortikális GABAerg sejtek egy részhalmazát azonosítjuk az NGF termelés elsődleges forrásaként a felnőtt kéregben, viszonylag ritka termeléssel glutamaterg neuronok.
anyagok és módszerek
minden beteget az állatgondozásra vonatkozó intézményi irányelveknek megfelelően kezeltek. Az agykérgi NGF expresszió alacsony endogén szintje miatt, amely megtiltotta az NGF specifikus sejttípusú forrásainak azonosítását a korábbi vizsgálatokban helyi kolchicin infúziókat végeztünk a mikrotubulus polimerizációjának gátlására, ezáltal blokkolva az NGF transzportot a sejttestből, ami a detektálható NGF antigén felhalmozódását eredményezi a termelő sejtek szómájában (Schubert et al., 1972; Hokfelt et al., 1975; Hanson és Edstr, 1978; Conner és Varon, 1992). Korábbi jelentések kimutatták, hogy a kolhicin kezelés növeli az NGF kimutatását immunhisztokémiai technikák alkalmazásával (Conner and Varon, 1992). Ezenkívül a jelenlegi vizsgálatban alkalmazotthoz hasonló kolchicinszintek nem okoznak bruttó rendellenességeket a NEUROTROFIN család tagjának BDNF neuronális eloszlásában (Conner et al., 1997).
Szövetkészítmény
nyolc felnőtt Fischer 344 patkányt (4 hím, 4 nőstény; Harlan Sprague Dawley) 2 ml/kg 25 mg/ml ketaminnal, 1, 3 mg/ml xilazinnal és 0, 25 mg/ml acepromazin koktéllal érzéstelenítettünk, és 5-öt injektáltunk.0 (acsf-Ben 10 (acsf-Ben 10), 0,5 (10)/perc sebességgel a kérgi területeken, 10 (6)/perc sebességgel, Hamilton-fecskendővel. Az infúziót követően a tű négy percig a helyén maradt, hogy megfelelő diffúziót biztosítson a környező szövetekbe. Négy állat kapott kétoldali injekciót a primer motoros kéregbe (M1) +1,2 mm elülső (A/P) és 6,5 mm oldalirányú (M/L) bregma-ba. Az oldat felét 1,6 mm-rel az agy felszíne alatt (D/V), a többit 1,0 mm-en injektáltuk. a fennmaradó négy állat mindegyike egyoldalú injekciót kapott a prefrontális kéregben (A/P: +3.0, M/L: +0,5, D/V: -2,3 és -1,8), temporális kéreg (a/P: -6,5, M/L: +5,0, D/V: -7,5 és -7,0) és parietális kéreg (a/P: -3,0, M/L: +5,0, D / V: -1,8 és -1,3). 48 óra elteltével az állatokat mélyen érzéstelenítettük és transzkardiálisan perfundáltuk 250 ml hideg foszfát pufferolt sóoldattal (pH 7,4), majd 250 ml hideg 2% paraformaldehid + 0,2% parabenzokinon 0,1 M foszfát pufferben. Az agyakat kivontuk, 2 órán át rögzítettük ugyanabban a fixálószerben, és 0,1 M-es foszfátpufferben, amely 30% szacharózt tartalmaz, legalább 72 órán át krioprotektáltuk 4CC-n. A koronaszakaszokat (40 ft) egy fagyasztó csúszó mikrotómon vágtuk, és krioprotektánsban (TCS) tároltuk 4 ft C hőmérsékleten, amíg tovább nem dolgoztuk immunhisztokémia céljából.
kettős címkével ellátott fluoreszcens immunhisztokémia
szekvenciális kettős címkével ellátott immunhisztokémiát használtunk az NGF-et és GABAerg vagy glutamaterg sejtmarkereket expresszáló neuronok megjelenítésére. A szabadon lebegő szakaszokat Tris pufferolt sóoldatban (TBS) mostuk, 0,25% Triton X-100-mal permeabilizáltuk, majd a nem specifikus címkézést 5% szamárszérummal blokkoltuk. A szekciókat 72 órán át inkubáltuk 4CC-n, nyúl anti-NGF antitestben (Conner and Varon, 1992) 1:1000 arányban TBS-ben, 0,25% Triton X-100-ban és 5% szamárszérumban hígítva. Az elsődleges antitest inkubációt követően a szekciókat szamárnyúl elleni biotin-konjugált IgG-ben inkubáltuk (1:200; Vector Laboratories, Burlingame, CA, USA). Tyramid jelerősítést (TSA; PerkinElmer, Waltham, MA, USA) alkalmaztunk az NGF jel erősítésére, majd a szakaszokat TBS-ben mostuk és inkubáltuk Alexa Fluor 488 vagy 594-konjugált sztreptavidinben (Invitrogen, Carlsbad, CA, USA) 1:200 arányban 3 órán át hígítva 4CC-n. Rövid mosás után a szekciókat inkubáltuk mind az egér anti-glutamát dekarboxilázban (GAD) 65 (GAD-6, AntibodyRegistry:AB_528264, 1:2000; Developmental Studies Hybridoma Bank,Iowa City, IA, USA), mind az egér anti-GAD67-ben (AnitbodyRegistry: AB_2278725, 1:1500; Millipore, Temecula, CA, USA), vagy egér anti-GAD-ban parvalbumin (antibodyregistry: ab_2174013, 1:30000; Millipore, Temecula, CA, USA), egér anti-CALBINDIN-d-28k (antibodyregistry: Ab_476894, 1:1500; Sigma-Aldrich, St. Louis, MO, USA) vagy egér anti-Ca2+/kalmodulin-függő protein kináz IIA (CAMKIIA, antibodyregistry: ab_2067919, 1:1500; Millipore) 72 órán át 4 6CC-n. végül a szakaszokat mossuk, inkubáljuk az Alexa Fluor 594 vagy 488 konjugált szamár anti-egérben (Invitrogen) 3 órán át szobahőmérsékleten, ismét mossuk, üveglemezekre szereljük, és Fluoromount-G-ben (Southern Biotech, Birminghan, AL, USA) fedjük le. A GABAerg sejtek maximális azonosítása érdekében gad65 és GAD67 antitesteket inkubáltunk együtt. A szakaszok egy részét a ProLong Gold-ban lefedték DAPI-val (Invitrogen) a sejtmagok megjelenítésére.
Antitestjellemzés
az ebben a vizsgálatban használt NGF antitest egy affinitással tisztított poliklonális nyúlban a tisztított egér NGF ellen (Conner and Varon, 1992). Az antitest felismeri a tisztított egér és a rekombináns humán NGF-et, de nem lép keresztreakcióba a rekombináns BDNF-fel vagy NT-3-mal (Conner and Varon, 1996). Továbbá az NGF expresszió immunreaktív mintázata a patkány agyban szorosan megegyezik a patkány agy in situ elemzésével (Conner and Varon, 1997).
a GAD-65 monoklonális antitestet (Developmental Studies Hybridoma Bank, Gad-6) egerek immunizálásával állítottuk elő GAD fehérjével immunoaffinity-patkány agyból tisztítva. A patkány agy homogenizátumainak Western blot elemzése kimutatta, hogy az antitest szelektíven felismeri a GAD-65-öt, de a GAD-67-et nem (Chang and Gottlieb, 1988). További vizsgálatok kimutatták, hogy a GAD-6 antitest felismeri a GAD-65 C-terminálisának 475-571 aminosavai között elhelyezkedő epitópot (Butler et al., 1993).
a GAD-67 egér monoklonális (Millipore, MAB 5406, lot: 25010139) az emberi GAD-67 4-101 aminosavmaradékai ellen emelték fel, és egyetlen 67 kDa sávot ismer fel a patkány agy Western blot elemzésével (a gyártó műszaki adatai). Az antitest GST-GAD-67 fúziós fehérjével történő előinkubálása nem eredményezett immunopozitív jelet az agyban (Ito et al., 2007).
az egér monoklonális Anti-CaMKIIa (Millipore, MAB 8699, lot: LV1366080) specifikusan felismeri a kalcium/kalmodulin-függő protein-kináz II alfa alegységét. A Western blot elemzés azt mutatja, hogy az antitest egyetlen 50 kDa-os sávot azonosít, és felismeri mind a foszforilált, mind a nem foszforilált formákat (Erondu and Kennedy, 1985).
monoklonális anti-calbindin-D-28k (Sigma–Aldrich, C9848, lot: 088k4799) származik balb/c egerek immunizált tisztított szarvasmarha vese calbindin-D-28k. Immunoblotting kimutatta, az antitest felismeri a 28-kDa sáv, és nem reagál a hasonló molekulák, mint például a calbindin-D-9K, calretinin, miozin könnyű lánc, és parvalbumin (a gyártó műszaki adatai). Kimutatták, hogy a csirke és patkány agyából tisztított calbindin-D-27 kDa fehérjével végzett preabszorpció megszünteti a calbindin immunfestést az agyban (Pasteels et al., 1987).
Anti-parvalbumint (Millipore, MAB 1572, lot: LV1378387) gyűjtöttek béka izomból tisztított parvalbumin ellen immunizált egerekből. A monoklonális antitest egy epitóp ellen irányul az első Ca2 + – kötőhelyen, és az immunoblot elemzés azt mutatja, hogy felismeri a 12 kDa agyfehérjét (a gyártó műszaki adatai).
konfokális elemzés
a képeket Olympus AX70 Magnafire szoftverrel (2.0 verzió; Karl Storz Imaging, Goleta, CA, USA) készítették. Mivel az NGF jelölése lényegében körülbelül 2 mm-rel csökkent a kolhicin injekciós helyeinek elülső/hátsó részén, feltehetően a kolhicin diffúziójának hiánya és az ebből eredő szomatikus NGF felhalmozódás hiánya miatt, csak az egyes kolhicin injekciós helyektől számított 1,5 mm-en belüli szakaszokat elemeztük. Minden 10. szakaszt (400 Ft) egy kérgi régióban vizsgáltunk. A sejteket manuálisan megszámoltuk, és alanyonként legalább három szakaszt elemeztünk minden kortikális régióban és antitest kombinációban. Csak három állatot értékeltek az időbeli régióban a kimutathatatlan NGF címkézés miatt a negyedikben. Az egy – és kétcímkés cellákat egy-és kétcsatornás képek segítségével számszerűsítettük. Számos kritériumot alkalmaztak a jelölt sejtek azonosítására, beleértve a méretet, morfológia, jel vs.háttérés egybeeső DAPI címkézés a DAPI-festett szövet értékelésekor. A szakaszok egy részhalmazában 5 db z-halmot gyűjtöttünk össze egy Olympus Fluoview FV1000 segítségével, hogy biztosítsuk a jelölt objektum neuronális lokalizációját. A kettős jelölésű sejtek aránya, nem pedig abszolút száma iránti érdeklődésünk miatt sztereológiai módszereket nem használtunk.
a kettős jelölt sejtek százalékos arányát immunreaktív (IR) sejtcsoportonként minden képmezőre meghatároztuk. A vizsgált kérgi régiókra kiszámítottuk az átlagos standard hibát. Egyirányú varianciaanalízist (ANOVA) használtunk a kortikális régiók közötti különbségek értékelésére. Fisher HSD-jét használták post-hoc elemzés. Az összes statisztikai elemzést SPSS 15.0 for Windows rendszerrel végeztük.
antitest-kontrollok
a kontrollok közé tartozott az elsődleges antitestek kihagyása, a másodlagos antitestek kihagyása, valamint az elsődleges antitest nem specifikus antitesttel (nyúl IgG) való helyettesítése. Minden manipulációnak megvolt a várt hatása, és alátámasztotta azt az állítást, hogy a jelölt sejtek valódi antigéncímkézést képviselnek a megfelelő antitestekkel.
eredmények
NGF Immuncímkézés
a különálló NGF-jelölés 1-es sugarú körben volt látható.5 mm-re a colchicine corticalis injekció helyétől. Ezeken a területeken az NGF címkézés túlnyomórészt a sejtszomatára korlátozódott (1.ábra). Ritkán egy vagy több sejtes folyamatot is meg lehet különböztetni. Ezen az 1,5 mm-es sugáron kívül az NGF címkézés gyakorlatilag nem volt kimutatható a kéregben. Mivel a TRKA és a p75 NGF receptorok kortikális expressziója a kolinerg kortikopetális rostokra korlátozódik, az NGF megfigyelt jelölése valószínűleg nem tükrözi az endocitált NGF-et, hanem az NGF-t termelő sejtekre utal (Holtzman et al., 1995; Rossi et al., 2002; Stephens et al., 2005). Amint arról korábban beszámoltunk (Ribak et al., 1978), a kolchicin-kezelés fokozta a GAD címkézését a sejttestekben, valamint az idegsejtekben folyamatok. A kolchicinnek nem volt kimutatható hatása a parvalbumin, a calbindin vagy a CaMKIIa címkézésére.
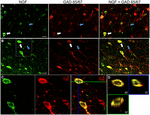
1. ÁBRA. Az idegnövekedési faktor nagymértékben kolokalizálódik gátló sejtmarkerekkel. Immunreaktív sejtek az (a) primer motoros kéregben és (B) prefrontális kéregben. A képek azt mutatják, hogy az NGF-vel jelölt sejtek (zöld) nagymértékben kolokalizálódnak a GAD 65/67-vel jelölt sejtekkel (piros). A fehér nyilak példát mutatnak sejt immunreaktív mind az NGF, mind a GAD 65/67 esetében az egyes kérgi régiókban. A kék nyilak csak a GAD 65/67 immunreaktív sejteket mutatják. (C) nagyított kép a terület belsejében fehér doboz (B). D) A C) pontban megjelölt kettős jelölésű cella X–Y–Z rekonstrukciója. A zöld és a kék vonalak XZ és YZ síkokban jelzik a disszekciós szinteket. Skála sávok = 25 db.
NGF és GABAerg Co-lokalizáció
az Idegnövekedési faktor nagymértékben együtt lokalizálódott a Gad65 és GAD67 GABAerg sejtmarkerekkel, függetlenül a vizsgált kérgi területtől (1.ábra; 1. táblázat). Összességében az NGF-vel jelölt kérgi sejtek 91 0,9% – a gad65/67-re is fel van tüntetve. A GAD65/67-et együtt expresszáló NGF-jelölt sejtek százalékos aránya csekély különbséget mutatott a prefrontális (90,0 6,5%), a motoros (91,7 1,5%), a parietális (89,6 3,5%) és a temporális (93,4 8,1%) kérgek (egyirányú ANOVA; p = 0,78) között. Ezzel szemben az NGF csak 55-vel lokalizálódott 2.Az összes gad65/67-jelölt sejt 3% – a. Annak meghatározására, hogy az NGF termelés a GABAerg neuron egy meghatározott altípusára korlátozódott-e, együtt jelöltük a szövetet NGF-re vagy parvalbuminra vagy kalbindinre (2.ábra). Megfigyelték, hogy az NGF-vel jelölt sejtek mindkét markerrel kolokalizálódnak. Az NGF kolokalizációja azonban parvalbuminnal (67,8 kb 3,6%) több mint 2 db-nál nagyobb volt, mint a calbindinnel (29,1 kb 3,9%). Továbbá, az NGF-IR sejtek az összes parvalbumin (47,7 ~ 4,6%) és a kalbindin (25,7 ~ 4,9%) immunreaktív sejt kevesebb mint felét alkották.

2. ÁBRA. Az NGF gátló neuron alosztály markerekkel van ellátva. A motoros kéreg szeleteit NGF-re, vagy parvalbuminra vagy calbindinre jelöltük. (A) A sejtek kiterjedt átfedést mutattak az NGF és a parvalbumin jelölésben (fehér nyilak). B) ezzel szemben az NGF és a calbindin együttes jelölése kevésbé volt gyakori. Skála sávok = 25 db.

TÁBLÁZAT 1. NGF – és GAD65/67-immunreaktív sejtek kérgi régió szerint.
ideg növekedési faktort expresszáló neuronokat figyeltek meg az összes kortikális rétegben. Korábbi tanulmányok az NGF-vel jelölt neuronok egyenetlen eloszlásáról számoltak be a kortikális rétegekben (Pitts and Miller, 2000; Patz and Wahle, 2006). A rétegenkénti kvantitatív elemzést azonban a jelenlegi vizsgálatban nem végezték el, mivel az NGF címkézési intenzitása a kolchicin injekció helyétől való távolság növekedésével csökkent.
NGF és glutamáterg Co-lokalizáció
a CaMKIIa jelölését elsősorban a sejtszomatában és a proximális folyamatokban figyelték meg (3.ábra). Az NGF és GABAerg markerekkel megfigyelt kiterjedt együttes lokalizációtól eltérően az NGF-jelölt sejtek ritkán lokalizálódnak együtt a CaMKIIa-jelölt sejtekkel (3.ábra; 2. táblázat). Összességében az NGF-immunreaktív sejtek 4, 9 6, 1%-A volt együtt jelölt CaMKIIa antitestekkel. A Ko-lokalizáció szignifikánsan különbözött a kérgi régiótól (egyirányú ANOVA; p = 0,03); Fisher post hoc kimutatta, hogy a prefrontális kéregben nagyobb volt a kettős jelölt NGF sejtek aránya (7,6 ~ 2,1%), mint az elsődleges motoros kéregben (2,4 ~ 1,0%; p = 0,02) és a parietális kéregben (2,9% ~ 1,5; p = 0,01).

3. ÁBRA. Az idegnövekedési faktor minimálisan kolokalizálódik a gerjesztő sejtmarkerrel CaMKIIa. Immunreaktív sejtek a prefrontális kéregben. Az NGF (zöld) és a CaMKIIa (piros) sejtek ritkán voltak colacellázva, függetlenül a vizsgált kérgi régiótól. Az arany nyilak csak egy NGF-re immunreaktív sejtre mutatnak példát. Skála sávok = 25 db.

2. TÁBLÁZAT. NGF-és CaMKIIa-immunreaktív sejtek kortikális régióban.
a CaMKIIa immunreaktív sejtjei jelentősen meghaladták az NGF antitestekkel jelölt sejteket. Az NGF jelet egyidejűleg expresszáló CaMKIIa-jelölt sejtek teljes aránya 2 0,6% volt. Ez a százalékarány jelentősen különbözött régiónként (egyirányú ANOVA p = 0,003), a prefrontális kéreg nagyobb arányban mutat kettős jelölt NGF/CaMKIIa sejteket (3,7 6,1%), mint az elsődleges motoros kéreg (0,8% 0,3; p = 0,001), a parietális kéreg (1,4% 0,6; p = 0,01) és a temporális kéreg (1,5 0,6%; p = 0,01).
Vita
a jelenlegi tanulmány azt mutatja, hogy a kéreg NGF-termelő neuronjainak túlnyomó többsége (> 90%) GABAerg, míg az összes GABAerg Neuron fele NGF-vel kolokalizálódik. Ezzel szemben a gerjesztő neuronok markerei csak ritka együttes lokalizációt mutatnak az NGF – vel. Ezek az eredmények konzisztensek voltak az ebben a vizsgálatban elemzett több kortikális régióban, jelezve, hogy az NGF-et elsősorban gátló interneuronok termelik a patkány neocortexben.
bár az NGF immunreaktivitása ritkán esett egybe a gerjesztő sejtmarkerekkel (CAMKIIa), egy kis százalék (~5%) pozitív volt a CaMKIIa szempontjából az összes vizsgált kortikális régióban. A konfokális elemzés megerősítette, hogy ez a kettős jelölés ugyanabból a fókuszsíkból származik, és nem az átfedő sejtekből származó diszkrét jelnek köszönhető. Az NGF expresszió funkcionális jelentősége a gerjesztő sejtek ilyen kis részében nem ismert, de lehetséges, hogy ezek az NGF-termelő neuronok a neocortexben az gerjesztő neuronok korábban azonosítatlan alosztályát képviselik.
eredményeink összhangban vannak más agyi régiókban végzett korábbi vizsgálatok eredményeivel, amelyek azt mutatják, hogy az NGF szinte kizárólag a striatum, a bazális előagy és a hippokampusz GABAerg sejtjeivel lokalizálódik (Lauterborn et al., 1993, 1995; Pascual et al., 1998; Bizon et al., 1999). Így a GABAerg sejtek NGF-termelése az összes célpont általános tulajdonsága lehet, amely bazális előagy kolinerg beidegzést kap (beleértve magát a bazális előagyat is). Ezek a kolinerg neuronális populációk NGF-et igényelnek fenotípusuk és vetületeik fenntartásához (Rylett et al., 1993; Chen et al., 1997; Hu et al., 1997; Debeir et al., 1999). A vizsgálatok során a gátló interneuronok az NGF trofizmus elsődleges forrásaként jelennek meg a bazális előagy kolinerg neuronjai számára.
bár a bazális előagy kolinerg neuronjai mind a gerjesztő, mind a gátló kortikális hálózatokat beidegzik (Zaborszky et al., 1999), a trofikus támogatás forrása túlnyomórészt a gátló populációból származik, amelyről ismert, hogy kritikus szerepet játszik a kortikális áramkörök plaszticitásának közvetítésében (Hensch and Stryker, 2004; Yazaki-Sugiyama et al., 2009; Donato et al., 2013). Úgy tűnik, hogy a kolinerg jelátvitel hozzájárul a különböző gátló szubpopulációk differenciális aktiválásához, ezáltal modulálva az gerjesztő-gátló egyensúlyt (Xiang et al., 1998; Froemke et al., 2007). Az NGF ezáltal visszacsatolási jelként szolgálhat az erősen műanyag gátló hálózatok és az azokat aktiváló kolinerg bemenetek között. Valójában az NGF növeli a plaszticitást és a viselkedési tanulást kolinerg-függő mechanizmusokon keresztül (Prakash et al., 1996, 2004; Gutierrez et al., 1997; Conner et al., 2009). Az NGF tevékenységfüggő felszabadulása (Blochl and Thoenen, 1995; Lessmann et al., 2003), párosulva az NGF képességével a kolinerg aktivitás növelésére (Rylett et al., 1993; Hu et al., 1997; Auld et al., 2001) azt javasolja, hogy az NGF elősegítheti az aktív áramkörök átszervezését fokozott kolinerg funkcióval.
a jövőbeni vizsgálatok megkísérlik azonosítani, hogy a gátló neuronok mely alosztályai expresszálják az NGF-et, és hogy ez a kifejezés pontosan hogyan befolyásolja az agykérgi áramköröket. Ebből a célból előzetes lépéseket tettünk annak meghatározására, hogy az NGF együtt lokalizálódik-e a gátló neuronok két közös markerével, a parvalbuminnal (elsősorban a kosár-és csillársejtekkel) és a calbindinnel (számos gátló sejttípussal társítva; McBain and Fisahn, 2001; Markram et al., 2004). Eredményeink azt mutatják, hogy az NGF-et elsősorban a parvalbumin-immunreaktív sejtekben detektálták, bár sok parvalbuminnal jelölt sejt nem expresszálta együtt az NGF-et. Fontos, hogy az NGF-IR sejtek kalbindinnel jelölt sejtekkel is kolokalizálódtak, ami arra utal, hogy a gátló neuron egynél több alosztálya termel NGF-et.
összefoglalva, a patkány neocortexben az NGF-et elsősorban gátló neuronok fejezik ki, amely tulajdonság úgy tűnik, hogy konzerválódott a filogenetikailag idősebb agyterületektől, és amely általánosíthat az agy egészére. Eredményeink arra utalnak, hogy a kortikális gátló interneuronok létfontosságú szerepet játszanak a bazális előagy kolinerg vetületi neuronjainak fenntartásában. A GABAerg interneuronok tehát elősegíthetik a kortikális átszervezést szabályozott NGF jelátvitel útján.
összeférhetetlenségi nyilatkozat
a szerzők kijelentik, hogy a kutatást olyan kereskedelmi vagy pénzügyi kapcsolatok hiányában végezték, amelyek potenciális összeférhetetlenségnek tekinthetők.
Köszönetnyilvánítás
az NIH (AG10435), a Veterans Administration, az Alzheimer Szövetség és a Dr. Miriam és Sheldon G. Adelson Orvosi Kutatási Alapítvány finanszírozta.
Kiegészítő anyag
a cikk kiegészítő anyaga megtalálható az interneten:: http://www.frontiersin.org/journal/10.3389/fncel.2014.00220/abstract
Auld, D. S., Mennicken, F. és Quirion, R. (2001). Az idegnövekedési faktor gyorsan indukálja az acetilkolin elhúzódó felszabadulását a tenyésztett bazális előagy neuronjaiból: differenciálódás a neuromodulációs és a neurotróf hatások között. J. Neurosci. 21, 3375–3382.
Pubmed absztrakt / Pubmed teljes szöveg
Bakin, J. S. és Weinberger, N. M. (1996). Fiziológiai memória indukálása az agykéregben a nucleus basalis stimulálásával. Proc. NAT. Acad. Sci. U. S. A. 93, 11219-11224. doi: 10.1073 / pnas.93.20.11219
CrossRef teljes szöveg
Bizon, J. L., Lauterborn, J. C. és Gall, C. M. (1999). A striatális interneuronok szubpopulációit a neurotróf faktor expresszió alapján lehet megkülönböztetni. J. Comp. Neurol. 408, 283–298. doi: 10.1002/(SICI)1096-9861(19990531)408:2<283::AID-CNE9>3.0.CO;2-2
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Blochl, A. és Thoenen, H. (1995). Az idegnövekedési faktor (NGF) hippokampusz neuronokból történő felszabadulásának jellemzése: bizonyíték egy konstitutív és egy nem konvencionális nátriumfüggő szabályozott útvonalra. Eur. J. Neurosci. 7, 1220–1228. doi: 10.1111 / j. 1460-9568. 1995.tb01112.X
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Butler, M. H., Solimena, M., Dirkx, R. Jr., Hayday, A. és De Camilli, P. (1993). A glutaminsav-dekarboxiláz (GAD-65) domináns epitópjának azonosítása, amelyet autoantitestek ismernek fel a stiff-man szindrómában. J. Felh. Med. 178, 2097–2106. doi: 10.1084 / jem.178.6.2097
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Chang, Y. C. és Gottlieb, D. I. (1988). A glutaminsav-dekarboxilázzal szembeni monoklonális antitestekkel tisztított fehérjék jellemzése. J. Neurosci. 8, 2123–2130.
Chen, K. S., Nishimura, M. C., Armanini, M. P., Crowley, C., Spencer, S. D. és Phillips, H. S. (1997). Az ideg növekedési faktor gén egyetlen alléljának megzavarása a bazális előagy kolinerg neuronjainak atrófiáját és memóriahiányt eredményez. J. Neurosci. 17, 7288–7296.
Pubmed absztrakt / Pubmed teljes szöveg
Conner, J. M., Chiba, A. A. és Tuszynski, M. H. (2005). A bazális előagy kolinerg rendszere elengedhetetlen az agykérgi plaszticitáshoz és az agysérülést követő funkcionális helyreállításhoz. Neuron 46, 173-179. doi: 10.1016 / j. neuron.2005.03.003
Pubmed Absztrakt / Pubmed Teljes Szöveg / CrossRef Teljes Szöveg
Conner, J. M., Culberson, A., Packowski, C., Chiba, A. A. és Tuszynski, M. H. (2003). A bazális előagyi kolinerg rendszer elváltozásai rontják a feladatok megszerzését és megszüntetik a motoros készségtanuláshoz kapcsolódó kortikális plaszticitást. Neuron 38, 819-829. doi: 10.1016 / S0896-6273(03)00288-5
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Conner, J. M., Franks, K. M., Titterness, A. K., Russell, K., Merrill, D. A., Christie, B. R. et al. (2009). Az NGF elengedhetetlen a hippokampusz plaszticitásához és a tanuláshoz. J. Neurosci. 29, 10883–10889. doi: 10.1523 / JNEUROSCI.2594-09.2009
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Conner, J. M., Lauterborn, J. C., Yan, Q., Gall, C. M. és Varon, S. (1997). Az agyból származó neurotróf faktor (BDNF) fehérje és mRNS eloszlása a normál felnőtt patkány központi idegrendszerében: bizonyíték az anterográd axonális transzportra. J. Neurosci. 17, 2295–2313.
Pubmed absztrakt / Pubmed teljes szöveg
Conner, J. M. és Varon, S. (1992). Az ideg növekedési faktorszerű immunreaktív neuronok eloszlása a felnőtt patkány agyában kolhicin kezelést követően. J. Comp. Neurol. 326, 347–362. doi: 10.1002 / cne.903260304
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Conner, J. M. és Varon, S. (1996). Az idegnövekedési faktor elleni antitestek jellemzése: vizsgálatfüggő variabilitás a keresztreaktivitásban más neurotrofinokkal. J. Neurosci. Módszerek 65, 93-99. doi: 10.1016/0165-0270(95)00151-4
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Conner, J. M. és Varon, S. (1997). Az NGF immunreaktivitás fejlődési profilja a patkány agyban: az NGF lehetséges szerepe a kolinerg terminális mezők létrehozásában a hippocampusban és a kéregben. Brain Res. Dev. Brain Res. 101, 67-79. doi: 10.1016 / S0165-3806(97)00051-5
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Debeir, T., Saragovi, H. U. és Cuello, A. C. (1999). Egy idegnövekedési faktor mimetikus TrkA antagonista a kortikális kolinerg boutonok megvonását okozza felnőtt patkányokban. Proc. NAT. Acad. Sci. U. S. A. 96, 4067-4072. doi: 10.1073 / pnas.96.7.4067
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Donato, F., Rompani, S. B. és Caroni, P. (2013). A tapasztalat által kiváltott parvalbumin-expresszáló kosár-sejt hálózat plaszticitása szabályozza a felnőttkori tanulást. Természet 504, 272-276. doi: 10.1038 / nature12866
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Erondu, N. E. és Kennedy, M. B. (1985). Típusú Ca2+/kalmodulin-függő protein kináz regionális eloszlása patkány agyban. J. Neurosci. 5, 3270–3277.
Froemke, R. C., Merzenich, M. M. és Schreiner, C. E. (2007). Szinaptikus memória nyom a kortikális receptív mező plaszticitásához. Természet 450, 425-429. doi: 10.1038 / nature06289
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Gall, C. M. és Isackson, P. J. (1989). A limbikus rohamok növelik az idegnövekedési faktor messenger RNS neuronális termelését. Tudomány 245, 758-761. doi: 10.1126 / tudomány.2549634
CrossRef teljes szöveg
Gutierrez, H., Miranda, M. I. és Bermudez-Rattoni, F. (1997). Tanulási zavar és kolinerg deafferentáció a kortikális ideg növekedési faktor nélkülözés után. J. Neurosci. 17, 3796–3803.
Pubmed absztrakt / Pubmed teljes szöveg
Hanson, M. és Edstr, A. (1978). Mitózisgátlók és axonális transzport. Int. Cytol Tiszteletes. Kiegészítő. 373–402.
Hayashi, M., Yamashita, A., Shimizu, K., Sogawa, K. és Fujii, Y. (1993). Az idegnövekedési faktor (NGF) gén expressziója a majom központi idegrendszerében. Brain Res. 618, 142-148. doi: 10.1016/0006-8993(93) 90437-R
CrossRef Teljes Szöveg
Hefti, F. (1986). Az idegnövekedési faktor elősegíti a septum kolinerg neuronok túlélését a fimbrialis transzekció után. J. Neurosci. 6, 2155–2162.
Hensch, T. K. és Stryker, M. P. (2004). Oszlopos építészet, amelyet GABA áramkörök faragtak a macska vizuális kéregének fejlesztésében. Tudomány 303, 1678-1681. doi: 10.1126 / tudomány.1091031
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Hokfelt, T., Kellerth, J. O., Nilsson, G. és Pernow, B. (1975). Kísérleti immunhisztokémiai vizsgálatok a P anyag lokalizációjáról és eloszlásáról cat primer szenzoros neuronjaiban. Brain Res. 100, 235-252. doi: 10.1016/0006-8993(75)90481-3
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
D. M., D. M., J., Li, Y., Cunningham, E. T. Jr., Lenn, N. J., Clary, D. O.,et al. (1995). TrkA expresszió a központi idegrendszerben: bizonyíték számos új NGF-re reagáló központi idegrendszeri Neuron létezésére. J. Neurosci. 15, 1567–1576.
Pubmed Absztrakt / Pubmed Teljes Szöveg
Hu, L., Cote, S. L. és Cuello, A. C. (1997). A nucleus basalis magnocellularis neuronok kolinerg fenotípusának differenciális modulációja NGF alkalmazásával a sejttesten vagy a kortikális terminális mezőkön. Felh. Neurol. 143, 162–171. doi: 10.1006 / exnr.1996.6357
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Huang, E. J. és Reichardt, L. F. (2003). Trk receptorok: szerepek a neuronális jelátvitelben. Annu. Biochem Tiszteletes. 72, 609–642. doi: 10.1146 / annurev.biochem.72.121801.161629
CrossRef teljes szöveg
Isackson, P. J., Huntsman, M. M., Murray, K. D. és Gall, C. M. (1991). A BDNF mRNS expressziója megnövekedett felnőtt patkány előagyában limbikus rohamok után: az indukció időbeli mintái különböznek az NGF-től. Neuron 6, 937-948. doi: 10.1016 / 0896-6273 (91) 90234-Q
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
T., T., H., Nakamura, K., Tanaka, Y., Nakade, H., Kaneko, T., et al. (2007). Gamma-amino-vajsavat tartalmazó szimpatikus preganglionos neuronok patkány mellkasi gerincvelőben axonjaikat a felső nyaki ganglionba küldik. J. Comp. Neurol. 502, 113–125. doi: 10.1002 / cne.21309
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Kilgard, M. P. és Merzenich, M. M. (1998). A kérgi térkép átszervezését a nucleus basalis aktivitás teszi lehetővé. Tudomány 279, 1714-1718. doi: 10.1126 / tudomány.279.5357.1714
Pubmed Absztrakt / Pubmed Teljes Szöveg / CrossRef Teljes Szöveg
Kordower, J. H., Bartus, R. T., Bothwell, M., Schatteman, G. és Gash, D. M. (1988). Ideg növekedési faktor receptor immunore aktivitás a főemlősökben (Cebus apella): Eloszlás, morfológia és kolokalizáció kolinerg enzimekkel. J. Comp. Neurol. 277, 465–486. doi: 10.1002 / cne.902770402
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Kordower, J. H., Winn, S. R., Liu, Y. T., Mufson, E. J., Sladek, J. R. Jr., Hammang, J. P., et al. (1994). Az idős majom bazális előagy: az axotomizált bazális előagy neuronok megmentése és csírázása az emberi ideg növekedési faktort szekretáló kapszulázott sejtek oltása után. Proc. NAT. Acad. Sci. U. S. A. 91, 10898-10902. doi: 10.1073 / pnas.91.23.10898
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Korsching, S., Auburger, G., Heumann, R., Scott, J. és Thoenen, H. (1985). A patkány központi idegrendszerében az idegnövekedési faktor és mRNS szintje korrelál a kolinerg beidegzéssel. EMBO J. 4, 1389-1393.
Pubmed absztrakt / Pubmed teljes szöveg
Lad, S. P., Neet, K. E. és Mufson, E. J. (2003). Ideg növekedési faktor: szerkezet, funkció és terápiás következmények az Alzheimer-kórban. Curr. A gyógyszer a központi idegrendszer Neurolját célozza meg. Disord. 2, 315–334. doi: 10.2174/1568007033482724
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Nagy, T. H., Bodary, S. C., Clegg, D. O., Weskamp, G., Otten, U. és Reichardt, L. F. (1986). Ideg növekedési faktor génexpresszió a fejlődő patkány agyban. Tudomány 234, 352-355. doi: 10.1126 / tudomány.3764415
CrossRef teljes szöveg
Lauterborn, J. C., Bizon, J. L., Tran, T. M. és Gall, C. M. (1995). Az NGF mRNS-t GABAerg, de nem kolinerg neuronok expresszálják patkány bazális előagyában. J. Comp. Neurol. 360, 454–462. doi: 10.1002 / cne.903600307
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Lauterborn, J. C., Tran, T. M., Isackson, P. J. és Gall, C. M. (1993). Az ideg növekedési faktor mRNS-t GABAerg neuronok fejezik ki patkány hippocampusban. Neuroreport 5, 273-276. doi: 10.1097/00001756-199312000-00023
CrossRef teljes szöveg
Lessmann, V., Gottmann, K. és Malcangio, M. (2003). Neurotrofin szekréció: aktuális tények és jövőbeli kilátások. Prog. Neurobiol. 69, 341–374. doi: 10.1016 / S0301-0082(03)00019-4
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
J., J., L. M., Kromer, L. F., Kaplan, D. R., Chua-Couzens, J., Clary, D. O., et al. (1995). A TrkA és a ChAT expresszió szabályozása a fejlődő patkány bazális előagyban: bizonyíték arra, hogy mind az exogén, mind az endogén NGF szabályozza a kolinerg neuronok differenciálódását. J. Neurosci. 15, 2888–2905.
Pubmed absztrakt / Pubmed teljes szöveg
Maisonpierre, P. C., Belluscio, L., Friedman, B., Alderson, R. F., Wiegand, S. J., Furth, M. E., et al. (1990). NT-3, BDNF és NGF a fejlődő patkány idegrendszerben: párhuzamos és kölcsönös expressziós minták. Neuron 5, 501-509. doi: 10.1016 / 0896-6273 (90) 90089-X
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Markram, H., Toledo-Rodriguez, M., Wang, Y., Gupta, A., Silberberg, G. és Wu, C. (2004). A neokortikális gátló rendszer interneuronjai. Nat. Neurosci Tiszteletes. 5, 793–807. doi: 10.1038 / nrn1519
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
McBain, C. J. és Fisahn, A. (2001). Interneuronok kötetlen. Nat. Neurosci Tiszteletes. 2, 11–23. doi: 10.1038/35049047
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Mufson, E. J., Conner, J. M., Varon, S. és Kordower, J. H. (1994). Ideg növekedési faktor-szerű immunreaktív profilok a főemlősök bazális előagyában és a hippokampusz képződésében. J. Comp. Neurol. 341, 507–519. doi: 10.1002 / cne.903410407
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Pascual, M., Rocamora, N., Acsady, L., Freund, T. F. és Soriano, E. (1998). Az ideg növekedési faktor és a neurotrofin-3 mRNS expressziója a hippokampusz interneuronjaiban: morfológiai jellemzése, expressziós szintje és az ideg növekedési faktor és a neurotrofin-3 kolokalizációja. J. Comp. Neurol. 395, 73–90. doi: 10.1002/(SICI)1096-9861(19980525)395:1<73::AID-CNE6>3.0.CO; 2-E
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Pasteels, B., Miki, N., Hatakenaka, S. és Pochet, R. (1987). Immunhisztokémiai keresztreaktivitás és elektroforetikus komigráció a calbindin D-27 kDa és a visinin között. Brain Res. 412, 107-113. doi: 10.1016/0006-8993(87)91444-2
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Patz, S. és Wahle, P. (2006). A neurotrofin mRNS expressziójának fejlődési változásai a patkány vizuális kéreg rétegeiben. Eur. J. Neurosci. 24, 2453–2460. doi: 10.1111 / j. 1460-9568.2006. 05126.X
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Pitts, A. F. és Miller, M. W. (2000). Az idegnövekedési faktor, az agyból származó neurotróf faktor és a neurotrofin-3 expressziója az érett patkány szomatoszenzoros kéregében: koexpresszió nagy affinitású neurotrofin receptorokkal. J. Comp. Neurol. 418, 241–254. doi: 10.1002/(SICI)1096-9861(20000313)418:3<241::AID-CNE1>3.0.CO;2-M
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Prakash, N., Cohen-Cory, S. és Frostig, R. D. (1996). A BDNF és az NGF gyors és ellentétes hatásai a felnőtt kéreg funkcionális szervezetére in vivo. Természet 381, 702-706. doi: 10.1038/381702a0
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Prakash, N., Cohen-Cory, S., Penschuck, S. és Frostig, R. D. (2004). A bazális előagy kolinerg rendszere részt vesz a gyors idegnövekedési faktor (NGF) által kiváltott plaszticitásban a felnőtt patkányok hordókéregében. J. Neurofiziol. 91, 424–437. doi: 10.1152 / jn.00489.2003
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Ribak, C. E., Vaughn, J. E. és Saito, K. (1978). A glutaminsav-dekarboxiláz immuncitokémiai lokalizációja neuronális szomatában az axonális transzport kolchicin gátlását követően. Brain Res. 140, 315-332. doi: 10.1016/0006-8993(78)90463-8
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Rossi, F. M., Sala, R. és Maffei, L. (2002). A trka és a p75NTR ideg növekedési faktor receptorok expressziója a patkány vizuális kéregében: fejlődés és szabályozás a kolinerg bemenet által. J. Neurosci. 22, 912–919.
Pubmed absztrakt / Pubmed teljes szöveg
Rylett, R. J., Goddard, S., Schmidt, B. M. és Williams, L. R. (1993). Acetilkolin szintézis és felszabadulás NGF folyamatos intracerebrális beadását követően felnőtt és idős Fischer-344 patkányokban. J. Neurosci. 13, 3956–3963.
Pubmed absztrakt / Pubmed teljes szöveg
Schubert, P., Kreutzberg, G. W. és Lux, H. D. (1972). Neuroplazmatikus transzport dendritekben: a kolhicin hatása a motoneuronok morfológiájára és fiziológiájára a macskában. Brain Res. 47, 331-343. doi: 10.1016/0006-8993(72)90643-9
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Shelton, D. L. és Reichardt, L. F. (1986). A béta-ideg növekedési faktor (NGF) gén expressziójának vizsgálata a központi idegrendszerben: az NGF mRNS szintje és regionális eloszlása arra utal, hogy az NGF trofikus faktorként működik több különböző neuronpopulációban. Proc. NAT. Acad. Sci. U. S. A. 83, 2714-2718. doi: 10.1073 / pnas.83.8.2714
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Sofroniew, M. V., Howe, C. L. és Mobley, W. C. (2001). Ideg növekedési faktor jelátvitel, neuroprotekció és neurális javítás. Annu. Neurosci Tiszteletes. 24, 1217–1281. doi: 10.1146 / annurev.neuro.24.1.1217
CrossRef teljes szöveg
Stephens, H. E., Belliveau, A. C., Gupta, J. S., Mirkovic, S. és Kablar, B. (2005). A neurotrofinok szerepe a gerincvelő motoros neuronjainak és a dorsalis gyökér ganglionok proprioceptív szenzoros neuronjainak fenntartásában. Int. J. Dev. Neurosci. 23, 613–620. doi: 10.1016 / j. ijdevneu.2005.07.002
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Tuszynski, M. H., Armstrong, D. M. és Gage, F. H. (1990). Bazális előagyi sejtvesztés fimbria/fornix transzekció után. Brain Res. 508, 241–248. doi: 10.1016 / 0006-8993 (90) 90402-W
CrossRef teljes szöveg
Xiang, Z., Hugenard, J. R. és Prince, D. A. (1998). Kolinerg kapcsolás a neokortikális gátló hálózatokon belül. Tudomány 281, 985-988. doi: 10.1126 / tudomány.281.5379.985
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Jazaki-Sugiyama, Y., Kang, S., Cateau, H., Fukai, T., és Hensch, T. K. (2009). Kétirányú plaszticitás gyorsan tüskés GABA áramkörökben vizuális élmény alapján. Természet 462, 218-221. doi: 10.1038 / nature08485
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Zaborszky, L., Pang, K., Somogyi, J., Nádasdy, Z. és Kallo, I. (1999). A bazális előagy kortikopetális rendszerét felülvizsgálták. Ann. N. Y. Acad. Sci. 877, 339–367. doi: 10.1111 / j. 1749-6632. 1999.tb09276.X
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Csang, H. T., Li, L. Y., Zou, X. L., Song, X. B., Hu, Y. L., Feng, Z. T., et al. (2007). Az NGF, BDNF, NT-3 és NT-4 immunhisztokémiai eloszlása felnőtt rhesus majmok agyában. J. Histochem. Cytochem. 55, 1–19. doi: 10.1369/jhc.6A6952.2006
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text