はじめに
グリオキシル酸サイクルは、クレブスサイクルの脱炭酸段階を迂回し、アセチルCoAからの液体炭素の同化を引き起こす。 イソクエン酸リアーゼ(EC4.1.3.1)およびリンゴ酸シンターゼ(EC2.3.3.9)は、この代謝経路の唯一の酵素である。 グリオキシル酸サイクルは、種子の発芽(Eastmond&Graham、2001)、c.elegans(Edwards、Copes、Brito、Canfield、&Bradshaw、2013)のようないくつかの無脊椎動物、およびEのような微生物で起こる。 とができることを示唆している。 この経路は、1957年に炭素源として酢酸およびエタノール上で増殖した微生物に関する研究の間に記載された(Kornberg&Krebs、1957)。
グリオキシル酸サイクル中のアセチルCoAはオキサロ酢酸と結合し、それぞれクエン酸塩およびイソクエン酸塩を産生する。 後者はイソクエン酸リアーゼによって触媒される反応でグリオキシレートとコハク酸を生成する。 さらに、グリオキシレートは、リンゴ酸シンターゼによって触媒される反応において第二のアセチルCoA分子と凝縮し、生成されたリンゴ酸がオキサロ酢酸に酸化された後、中間体を再生する(工程B-1-B-5、図1)。 2つのアセチル−Coa分子がグリオキシル酸サイクルの各反復で導入され、1つのコハク酸分子の液体合成が起こる(Beeckmans,2 0 0 9;Berg,Stryer,<9 1 3 4>Tymoczko,2 0 1 5;Torres<9 1 3 4>Marzzoco,2 0 0 7)。
さらに、油糧種子中の予備脂質から生成された炭水化物は、葉緑体が葉緑体で分化し始め、光合成を開始するまで植物に分配され、炭素源として利 脂肪および油は、大豆、ピーナッツ、綿およびヒマワリ(Junqueira、2012)のような重要な農学的種を含む、還元された形態ではあるが、多くの種子の炭素貯蔵において重要 ラウリン酸(12:0)、ミリスチン酸(14:0)、パルミチン酸(16:0)およびステアリン酸(18:0)は、野菜中で最も重要な飽和脂肪酸です; 一方、不飽和酸はオレイン酸(1 8:1(Δ9))、リノール酸(1 8:2(Δ9,1 2))およびリノレン酸(1 8:3(Δ9,1 2,1 5))である(Taiz<9 1 3 4>Zeiger,2 0 0 2)。

図1.
脂肪酸または酢酸異化はグリオキシル酸サイクルを介してエネルギーを産生し、γ酸化(ステップA-1からA-4)、グリオキシル酸サイクル(ステップB-1からB-5)、クレブスサイクル(ステップC-1からC-8)、糖新生(ステップD-1からD-3)および解糖(ステップE-1)の間の統合を証明する。
ペア数の炭素を持つ脂肪酸は、動物では炭水化物合成をもたらさない(Nelson&Cox,2009)。 この事実は、この場合、脂肪酸がアセチル-CoAに異化されるので、糖新生をサポートするためのオキサロ酢酸の正味の産生がないために起こる。 中間体はクレブスサイクルで酸化され、アセチルCoAとして入る二つの炭素ごとに、二つの炭素はCO2として失われる(Eastmond&Graham、2001;Nelson&Cox、2009)。
哺乳動物におけるグリオキシル酸サイクルの欠如は、抗菌剤の開発における選択的毒性の標的であり得る。 結核菌におけるイソシトレートリアーゼに対する3-ニトロプロピオンアミドの阻害活性(Sriram et al. ら、2 0 1 1)、ブロモフェノール(O H e t a l. ら、2 0 1 0)およびc.albicans中のイソクエン酸リアーゼ上のスポンジからのアルカロイド(Lee e t a l. ら、2 0 0 8;O H e t a l.,2010)が分析されている。
グリオキシル酸サイクルを介した脂質異化を伴うエネルギー的側面に関する文献にはデータがない。 この文脈では、本研究は、グリオキシル酸サイクルで生成されるエネルギー量と脂肪酸鎖サイズとの関係を調べ、グリオキシル酸サイクルを欠いている動物細胞と、このアプローチを使用する細胞におけるエネルギー効率を比較した。
Materialand methods
エネルギーの生産と消費とのステップのエネルギーバランスを行い、炭素数が4の倍数の脂肪酸の鎖サイズとその分解によって生成されるエネル 生成式では,アシル-Coaに対する脂肪酸の活性化に関与するエネルギーコストは考慮されなかった。 これはβ酸化の前の段階であり、2つの高エネルギーリン酸結合の破壊を伴う。
提案された式は、グリオキシル酸サイクルを含む脂肪酸分解に関与する代謝経路の各ステップにおける酸化的リン酸化および基質レベルのリン酸化によって生成されるATP量を添加したATP速度と、その適用によって得られたATP量を比較することによって検証された。 脂肪酸分解には、グリオキシソームのβ酸化、グリオキシル酸サイクル、クレブスサイクル、糖新生と解糖の一部、ピルビン酸脱炭酸、再びクレブスサイクルが含まれます(図1)。
グリオキシル酸サイクルを含む脂肪酸の分解のエネルギー効率を、動物細胞における脂肪酸の異化と比較した。 この比較では、以前に検証された式を使用し、動物で発生するβ酸化で生成されるエネルギー量を計算した(Gonçalves、Valduga、&Pereira、2012)、現在の研究で開発された式と相まって。 グリオキシル酸サイクルにおけるエネルギー効率係数(E%)は,グリオキシル酸サイクルと動物異化を考慮した脂肪酸異化で産生されるATPの比によって定義された。 このパラメータを脂肪酸の炭素原子数に対してプロットした。 さらに、CH2ユニティによって生成されたATP速度は、脂肪酸鎖の炭素数の関数として表された。 GrapPad Prism6.0は、変数間の関係を表す数学モデルを生成しました。
結果と考察
ミトコンドリアマトリックスは、動物細胞において脂肪酸の酸化が起こる主要な部位である。 しかし、これらの生体分子の異化は、主に葉組織のペルオキシソームおよび植物の種子発芽中のグリオキシソームにおいて起こる(Buchanan,Gruissem,Vickers,&Jones,2015)。 グリオキシソーム中の脂肪酸の分解には、表1に示す代謝経路が含まれる。
エネルギー生産と並行して、脂肪酸の炭水化物への変換は、ペントースリン酸経路を介した構造多糖類およびヌクレオチドの生成などの他の機能を有 エネルギー利得に関しては、おそらく進化によって選択されたより短く、よりエネルギー的に経済的な方法は、解糖経路によって分解されるホスホエノールピルビン酸(図1のステップD-3)までの糖新生を含む。
脂肪酸のグリオキシソーム分解中に生成されるエネルギー(ATP)の量
脂肪酸のグリオキシソーム分解から生じるATP量(x)は、ホスホエノールピルビン酸とその異化までの糖新生によってエネルギーを生成するために、β酸化(ATP β-OX)、グリオキシル酸サイクル(ATP C GLYOX)で生成され消費されるATP速度の合計によって計算することができる。式(1)に従って、クレブスサイクル(ATP C Krebs)、糖新生(Atp oxal−PEP)および解糖/krebsサイクル(atp PEP−CO2)を再度実施する。:

グリオキシソームおよびペルオキシソームにおけるβ酸化中の炭素-炭素結合の各切断は、一つのNADHを生成し、inoxidativeリン酸化で2.5ATPsを生成する(図1のステップA-3)。 ペルオキシソームでは、β酸化の最初のステップで除去された電子エネルギーは熱として放散されます(図1のステップa-1)。

従って、FADH2酸化からの正味エネルギーは存在しない(Buchanan e t a l., 2015). Α炭素は補酵素Aでエステル化されるので、β酸化は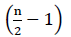 回起こり、ここでnは脂肪酸鎖中の炭素数である。 グリオキシル酸サイクルにおけるβ酸化によって生成されるATPs量は、式で与えられる(2):
回起こり、ここでnは脂肪酸鎖中の炭素数である。 グリオキシル酸サイクルにおけるβ酸化によって生成されるATPs量は、式で与えられる(2):

グリオキシル酸サイクルに向けられた二つのアセチルCoA分子ごとに、n/4コハク酸分子が生成されるように、アセチルCoA量の半分に相当する一つのコハク酸分子の正味の生産がある。 クレブスサイクルでは、コハク酸はオキサロ酢酸に酸化され、1つのFADH2と1つのNADHを生成し、酸化リン酸化で4つのATPを生成する(ステップC-6とC-8、図1)。 この値にn/4コハク酸分子を掛けた値は、式(3)で表され、クレブスサイクルで最初に生成されたATPamountを表します:

シュウ酢酸イングリオキシレートサイクルの再生にはリンゴ酸の酸化が関与し、1つのNADHが生成され、酸化的リン酸化で2.5ATPsが生成される(図1のステップB-5)。 したがって、グリオキシル酸サイクルで生成されるエネルギー(ATP)の量は、式で表すことができます(4):

Krebscycleで産生される過剰のオキサロ酢酸は、糖新生に向けられる可能性がある。 エネルギーを生成するためには、ホスホエノールピルビン酸の形成においてグルコース形成が起こり、1つのGTPが費やされる(図1のstepd3)、式(5)で表される。 ヘキソース由来の代謝産物の形成のための糖新生の継続は、種子を発芽させる重要なプロセスである(Buchanan et al. 2015年、イーストモンド&グラハム、2001年、ケティエ&イーストモンド、2009年):

ホスホエノールピルビン酸異化は、ピルビン酸を生成する基質レベルのリン酸化(ステップE-1、図1)、ピルビン酸の酸化的脱炭酸(ステップF-1)を1Nadh産生とし、アセチルCoAをCO2に酸化することを含む。 アセチルCoA酸化では、3つのNADH、1つのFADH2および1つのGTPの生産は10の高エネルギーのphosphatebondsに対応します。 この値は、基質レベルのリン酸化および酸化的リン酸化に加えられ、ピルビン酸のNADH生成脱炭酸と関連し、合計13.5ATPを有する(式6)。

方程式を代入する(2), (3), (4),(5) そして(6)式(1)において、式(7)が得られる。 代数的に単純化すると、式(8)は、生成されるエネルギーの量(x)と脂肪酸鎖のサイズ(n)との間の直接的な比を確立する。

式(8)の検証グリオキシル酸サイクル
を介して脂肪酸分解によって生成されるエネルギー(ATP)を計算するために、式(8)を検証することができるように、その適用から得られたATP量を、グリオキシソーム中の特定の炭素原子数を有する酸の酸化において生成されるアセチルCoA、NAHDおよびFADH2分子数および基質レベルのリン酸化の合計から個別に計算されるATP量と比較した(表2)。 両方の条件では、得られたATP量は同等である。 これらのequivalentresultsを考慮に入れて、現在の研究で開発された方程式は、二十以上のステップを含む代謝経路の統合を考慮して、脂質異化で生成されるエネルギー量を決定した。

さらに、その検証に続いて、エネルギーバランスforgenerating方程式は、異なる代謝経路の分析のための重要なツールである可能性があります。 生化学では、代謝経路における化学量論的関係のような側面は、現在の研究でtheresultsを使用してアプローチすることができます。

比較グリオキシル酸サイクルによる脂肪酸の分解効率と動物の代謝
これまでの研究によると、脂肪酸の分解によってATPで産生される動物細胞のエネル この関係は、式(9)で表される(Gonçalves et al. これは、現在の研究で開発された式(8)と比較することができる。 グリオキシル酸サイクルが起こる動物細胞と生物細胞におけるγ酸化の間のエネルギー効率を比較するために二つの評価を用いることができる。

式(8)を式(9)で除算し、100を掛けることにより、動物の異化に関連して、式(10)で表されるように、脂肪酸分解がエネルギーを生成する効率の割合(E%)が得られる。

脂肪酸鎖の長さに対してE%をプロットすると(図2)、炭化水素鎖の増加とともに効率が低下することが確認されます。 さらに、グリオキシル酸サイクルを有する細胞内の脂肪酸酸化から得られるエネルギーは、動物細胞内の同様の経路によって生成されるエネルギー準位の90%未満に達する。
酸化された炭素原子あたりに生成されるATP速度(ATP/n)は、脂肪酸の長さ鎖にも依存し、最大ATP/nに近い速度で(図3-a)、この速度は動物細胞でより高い(図3-b)。

図2。
脂肪酸の長鎖に起因するグリオキシル酸サイクル酵素を有する動物におけるβ酸化および生物におけるβ酸化における脂肪酸分解のエネルギー効率の比較。
動物とは対照的に、野菜や一部の微生物はアセチルCoAを脂肪酸の酸化から糖に変換することができます。 生物は、グリオキシソーム/ペルオキシソーム、ミトコンドリアおよびサイトゾルの間で区画化されているグリオキシル酸サイクルとgluconeogenesisreactionsを組み合わせます。 この特徴はより高い新陳代謝の多様性を与え、発生の間に使用されるべきエネルギー源として種のstorelipidsにエネルギー源および植物としてアセテートを利

図3。
グリオキシル酸サイクル(a)における酸脂肪の炭素原子(n)および動物異化(b)による炭素原子(ATP/n)によって生成されるATP速度。 ATP/n率は、約n=20まで有意に増加し、以降の速度はあまり有意ではない方法で増加する。
結論
エネルギー生成のためのグリオキシル酸サイクルによる脂肪酸の分解は、グリオキシソーム、グリオキシル酸サイクル、クレブスサイクル、糖新生および解糖における特定の特性を有するβ酸化を伴う。 これらのステップと代謝経路にもかかわらず、脂肪酸の鎖長とその分解で生成されるエネルギー量との間の化学量論的関係は代数的に確立され得る。
これらの代謝経路に関与する化学量論エネルギッシュと、動物細胞で起こるようなβ酸化の化学量論エネルギッシュとの比較は、動物代謝と比較した場合、エネルギー効率の低下を示す。 クレブスサイクルの脱炭酸反応のバイパスは、存在する場合に生物に進化的適応を与えるが、それはまた、動物の脂肪酸の分解と比較して炭素原子ごとに生成されるより少ないエネルギー量を決定する。