Kvantitativní opatření fyziologické vlastnosti, jako je aktivita enzymu jsou často vyjadřuje jako jednotky aktivity na mg bílkoviny. I když četné testy byly vyvinuty pro měření obsahu bílkovin, včetně kolorimetrické testy Amido Black (1), Biuret (2), Bicinchoninic Acid (3) a Coomassie Blue (4,5), Lowry test (6) nebo jeho modifikace (7,8) jsou více běžně používaný než ostatní testy (9). Lowryho test je jednoduchý, citlivý a přesný a je nejcitovanějším (10) postupem pro kvantitativní stanovení bílkovin.
širokou škálu sloučenin, které reagují s Folin-Ciocalteu fenol (Folin) činidla (11) jsou zdrojem potenciálního rušení v Lowry a modifikované Lowryho proteinové testy. Naštěstí korekce vhodným polotovarem postačují pro většinu sloučenin (6,7) s výjimkou lipidů (12), detergentů (13) a barevných látek (14). Problémy v analýzou proteinů v přítomnosti lipidů a detergentů (používá se v solubilizace tukové tkáně, myelinu a kosterních svalů) byly překonány pomocí modifikované Lowryho metody (15; uvedené v tomto dokumentu jako U-1988 testu, 16). Barevná interference při určování obsahu bílkovin v červeném víně (14,17,18) byla překonána použitím rozsáhlé chromatografie. Výše uvedený přístup je těžkopádný a není příliš praktický pro manipulaci s velkým počtem vzorků. Žádný ze známých proteinových testů nebyl vhodný pro měření proteinů v barevných biologických vzorcích, např., barevné ovoce a zelenina, červené víno, pigmentované mikroby a žluč přežvýkavců.
Náš vývoj U-2012 testu od svých předchůdců U-1988 a the Lowry testu dosáhl tři hlavní výhody (i) pohodlí prostřednictvím stability činidla formulace, (ii) měření bílkovin v oba bezbarvé a barevné biologické vzorky, aniž by byla ohrožena citlivost, a (iii) analýzou bílkovin při velmi nízkých koncentracích. Tento nový test bude použitelný pro kvantitativní stanovení proteinu v bezbarvých i barevných homogenátech biologických vzorků, včetně těch bohatých na lipidy(např.
- Materiály a metody
- Biologických vzorků – červená řepa, borůvky a červené víno
- chemická činidla
- Zlepšení U-1988 assay
- test U-2012
- Odhad barva kolize v U-2012 assay
- pro vývoj standardních křivek byla použita standardní křivka a její parametry
- Výpočet obsahu bílkovin v homogenáty
- Výsledky a diskuse
- Zlepšení v U-1988 assay
- odhad proteinu v barevných biologických vzorcích
- extrakce proteinu
- Odstranění rušivých látek
- Standardní křivky a jejich parametry
- obsah Bílkovin barevných homogenátu
- poděkování
- konkurenční zájmy
- Doplňující údaje
Materiály a metody
Biologických vzorků – červená řepa, borůvky a červené víno
červená Řepa a borůvky homogenáty byly připraveny, jak je popsáno v Doplňkovém Materiálu. Červené víno nevyžadovalo extrakci bílkovin před testem U-2012.
chemická činidla
Všechna chemická činidla, kromě chlornanu sodného a kyseliny chloristé (PCA), byla získána z Sigma nebo Sigma-Aldrich (St Louis, MO. USA). Chlornan sodný pochází z Acros Organic, New Jersey, USA. PCA byla získána od BDH (Anglie).
Zlepšení U-1988 assay
Přepnutí z uhličitanu fosfátového pufru při pH 12.0 lepší reagencie stabilita a dal malé zvýšení citlivosti. Acetonitril byl zaveden, aby se zabránilo bublinám vyvolaným detergentem. NaOH nahradil KOH, aby se zabránilo srážení v testu bílkovin. Kromě toho byla účinnost zvýšena kombinací různých složek Lowryho činidla do jedné směsi činidel.
test U-2012
úplné podrobnosti testu U-2012 jsou uvedeny v doplňkovém materiálu. Protokol, stručně shrnuty na Obrázku 1, popisuje zpracování červeného vína a homogenáty z červené řepy a borůvek, a zahrnuje vylepšení U-1988 testu. Test U-2012 byl použit pro nezpracované, zpracované a zpětně zpracované (ošetření H2O2 následované srážením TCA nebo PCA) proteiny. Testy byly provedeny na BSA, karboanhydrázy, cytochromu C, isocitrate dehydrogenázy, lysozym a trypsin pro rozvoj standardní křivky a barevné biologických vzorků. Stanovení proteinů v biologických vzorcích bylo provedeno kalibrací na příslušné standardní křivky.
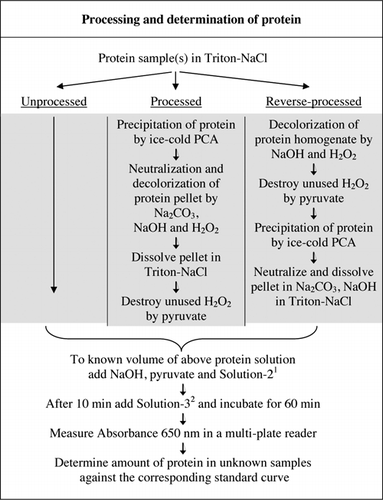
1Solution-2 obsahoval síran měďnatý (CuSO4.5H2O), Na-K-Tartrát, SDS a acetonitrilu v 100 mM fosfátovém pufru (pH 12.0). 2pro roztok-3 bylo fenolové činidlo Folin-Ciocalteu zředěno 1:1 s deionizovanou vodou těsně před použitím.
Odhad barva kolize v U-2012 assay
Barva rušení byla stanovena porovnáním absorbance ze zpracovaných a nezpracovaných červená řepa, borůvky a červené víno vzorků, a to jak s a bez použití Folin je činidlem, jak je popsáno na Obrázku 1. Poměr byl použit ke stanovení rozsahu rušení, kde Abs1 je absorbance nezpracované vzorky s Folin činidla; Abs2 je absorbance nezpracované vzorky bez Folin činidla; Abs3 je absorbance zpracované vzorky, činidla Folin; a Abs4 je absorbance zpracovaných vzorků bez Folinova činidla.
pro vývoj standardních křivek byla použita standardní křivka a její parametry
řešení-1B a 1C popsané v sekci Recepty připojeného doplňkového materiálu. Koncentrace BSA a odpovídající hodnoty absorbance byly vyneseny pomocí grafu rozptylu XY. Forma tohoto grafu (Obrázek 2) ukazuje nasycení reakce při vyšších koncentracích s velmi omezenou počáteční lineární odezvu. Jednalo se o preferovanou formu křivky hlášenou dříve (20). Zpočátku to bylo modelováno pomocí exponenciální formy (19), ale pozdější studie ukázaly, že obdélníková hyperbola poskytla lepší zarovnání s odpovědí, zejména při nižších koncentracích. Tato druhá forma byla nyní standardizována a k popisu vztahu koncentrace absorbance a proteinu byla použita následující rovnice se třemi parametry:

Koncentrace = koncentrace Proteinu,
A = Absorbance na Koncentrace,
A0 = Absorbance při nulové koncentraci
JSEM= Absorbance při maximální koncentraci,
C50= Koncentrace dává absorbance
(AM + A0)/2.
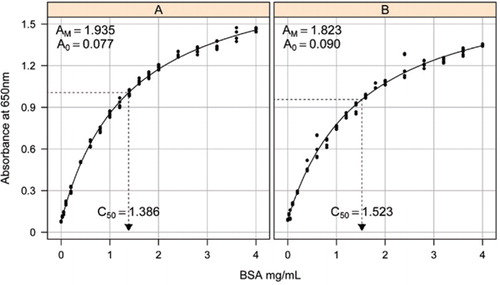
Odhad standardní křivky mezi absorbance (650 nm) a koncentrace BSA proteinu byla provedena na tři technické replikáty (A) nezpracovaných protein assay (parametry A0= 0.077, Am=1.935, C50=1.386) a (B) test zpracovaného proteinu (parametry A0=0,90, Am=1,823, C50=1,523). Na pozorovaná data byl namontován obdélníkový model hyperboly (rovnice). Odhady parametrů jsou identifikovány v křivkách s odhadem C50 na ose x (tečkovaná černá čára).
parametr A0 byl experimentálně stanoven, zatímco AM a C50 byly odhadnuty pomocí funkce Microsoft Excel Toolbox add-in Řešitel. Zkušební sada parametrů byla použita pro výpočet modelované absorbance při každé ze standardních koncentrací (Conc) pomocí rovnice . Řešiteli bylo poté přikázáno minimalizovat zbytkovou směrodatnou odchylku mezi měřenou a modelovanou absorpcí pro standardní sadu úpravou AM a C50.
Jsme pozorovali vztah mezi absorbancí a koncentrací vykazují nelineární křivka po celé koncentrační rozmezí, což je pravděpodobně způsobeno složkou rozptylu světla, které zvyšuje koncentrace bílkovin se zvyšuje při měření absorbance. Špatné lineární uložení při nízké absorpci hlásili také Coakley a James (20).
Výpočet obsahu bílkovin v homogenáty
Testy byly provedeny na zpracované a nezpracované červené víno a homogenáty z červené řepy a borůvek. BSA a další vzorky proteinů byly ošetřeny identicky pro vhodné standardní křivky pro stanovení hodnot A0, AM a C50. Tyto parametry byly následně použity pro konverzi vzorku absorbance (A) na koncentraci proteinu v každé homogenátu pomocí:

Protože rovnice má nasycení formě, citlivost snižuje jako absorbance (A), a tedy koncentraci, se zvyšuje. Chyby v odhadech proteinů mohou být minimalizovány úpravou koncentrací homogenátů v testu tak, aby nadměrně nepřekročily hodnotu C50.
Homogenátu Conc hodnotu byl pak převeden na tkáňové koncentrace proteinu (Tkáňové Koncentrace v mg/g tkáně) pomocí následujícího vzorce:

kde Homogenátu Koncentrace (v mg proteinu/mL) byla opravena pro všechny pre-koncentrace nebo ředění během testu. Procento homogenátu bylo 100 g tkáně homogenizované na celkový objem 200 mL(v našem případě 50%).
v samostatné studii byl použit obdélníkový model hyperboly s použitím balíčku nelineárních smíšených efektů (nlme) (21) V R (22) (Obrázek 2). Každé řešení BSA, vyrobené nezávisle v laboratoři, bylo modelováno jako náhodný efekt se společným koeficientem A0, ale odlišným koeficientem AM a C50. To modeluje hierarchii biologických vzorků replikuje a technické testy replikuje.
Výsledky a diskuse
Zlepšení v U-1988 assay
omezení U-1988 a the Lowry testu je nestabilita vápenatý-založené činidla. Uhličitanový pufr (pH 11,4 při 2% = 188,7 mM) v U-1988 byl nahrazen 40 mM fosfátem při hodnotách pH v rozmezí od 11,4 do 12,5. Byly vypočteny počáteční sklony ze standardních křivek proteinového testu za použití BSA při 0,5 mg BSA/ mL a 1,0 mg BSA / ml. Počáteční svahy s fosfátovými pufry při pH 11,4 a při optimálním pH 12,0 byly 99 x10-6 a 197 x10-6respektivně. Sklon uhličitanového pufru (pH 11,4)byl 162 x10-6.Protože hodnota sklonu je přímou indikací citlivosti testu, fosfátový pufr (pH 12.0) byl vybrán jako náhrada uhličitanového pufru, čímž se zvýšila citlivost o 25%.
Větší stability bylo dosaženo zvýšením koncentrace fosfátového pufru na 100 mM. Výsledný fosfát/CuSO4/Na-K-tartrát roztok byl stabilní při pokojové teplotě po dobu dvou týdnů, výrazně delší než uhličitan/CuSO4/Na-K-tartrát řešení, které musí být připraveny denně před protein assay. Pro všechny budoucí experimenty byl k přípravě roztoku CuSO4/Na-k-tartrátu použit 100 mM fosfát (pH 12,0). Věříme, že nahrazení uhličitanu fosfátem zvýší pohodlí testu U-2012.
Pracího prostředku vyvolané bubliny se stal hlavním zdrojem chyb v měření absorbance při použití multi-plate reader (není problém s kyvety). Tyto bubliny byly značně redukovány přidáním řady polárních rozpouštědel (např. acetonu, acetonitrilu, ethanolu a methanolu). Acetonitril, nejvíce polární těchto rozpouštědel (23) byl vybrán pro svou účinnost a jsou zahrnuty v Řešení-2 (viz Obrázek 1 titulek a Recepty sekce Doplňkový Materiál).
fosfátový pufr, CuSO4, na-k-tartrát, SDS a acetonitril lze přidávat jednotlivě a pořadí jejich přidání neovlivňuje výslednou absorbanci. Použití předem smíšeného roztoku však dále zvyšuje pohodlí, zejména pokud se má testovat velké množství vzorků. Proto jsme seskupili tyto složky testovací směsi do roztoku-2 (Obrázek 1). Takový předem smíšený roztok nebyl proveditelný pro původní Lowryho test (6) kvůli nestabilitě uhličitanového roztoku. Pokus zahrnout Řešení-3 v Roztoku-2 za následek dramatické snížení ve vývoji modrá barva a nebyla dále posuzována.
odhad proteinu v barevných biologických vzorcích
extrakce proteinu
proteiny z červené řepy a borůvky byly extrahovány v roztoku Triton X-100-NaCl s mírnou homogenizací. Tyto homogenáty si zachovávají své enzymatické aktivity (15). Tato extrakce nebyla nutná pro červené víno.
Odstranění rušivých látek
Pro barevné vzorky je nutné odstranit rušení v důsledku vlastní vzorek barvy a jiné non-proteinové látky, které reagují s proteiny činidla než kolorimetrické protein assay. Novinkou U-2012 je návrh odbarvovacího protokolu kompatibilního s kolorimetrickým proteinovým testem.
odbarvení barevných pigmentů chlornanem sodným nebo H2O2 a selektivní srážení proteinů PCA nebo TCA byly zvažovány pro odstranění interferujících látek. Chlornan sodný, H2O2, TCA a PCA byly hodnoceny z hlediska jejich kompatibility s testem U-2012 za použití BSA jako testovaného proteinu. Mezi chlornanem sodným a H2O2 byl kompatibilní pouze H2O2, protože se v přítomnosti chlornanu vytvořila sraženina. Proteiny vysrážené TCA nebo PCA mohou být testovány U-2012 po adekvátní neutralizaci zbytkové kyseliny v peletě. Byla hlášena nadřazenost PCA nad TCA pro srážení bílkovin (24,25). Naproti tomu v našem srovnávacím hodnocení odhalily podobné hodnoty C50 pro PCA (1.395) a TCA (1.400). Preferovali jsme PCA, protože je snadno dostupný jako předem připravený roztok (70% obj. / OBJ.), a proto se snadno zředí na požadovanou pevnost. TCA je hygroskopická pevná látka, kterou je obtížné přesně vážit kvůli proměnlivému obsahu vody.
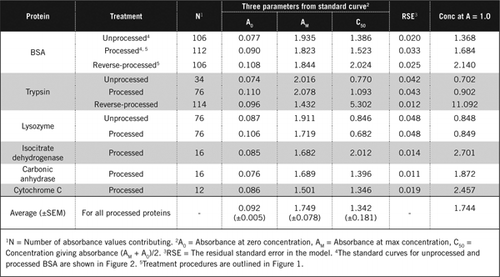
existují dva možné způsoby kombinace PCA a H2O2. U „zpracovaných“ proteinů následovalo ošetření PCA H2O2 a u“ reverzně zpracovaného “ proteinu předcházelo ošetření H2O2 srážení PCA. Výhody použití „zpracovány“ proteinu bylo odstranění několika rušivých látek v supernatantu a možné inaktivace proteolytických enzymů během přípravy vzorku. To bylo potvrzeno analýzou zpracovaného a zpětně zpracovaného trypsinu a BSA (viz tabulka 1). Ke stanovení skutečného obsahu bílkovin v barevných biologických vzorcích byly použity pouze zpracované vzorky
Oba PCA a H2O2 ošetření barevné vzorky byly nezbytné pro rušení eliminace v U-2012 testu. Samotné kyselé srážení barevných vzorků neodstranilo rušení úplně. U všech barevných vzorků byla v supernatantu vyřazena nějaká barva, ale pelety byly také zbarveny. Barva byla z pelet odstraněna ošetřením H2O2. Alkalické podmínky byly nutné pro efektivní odbarvování pomocí H2O2 (26) a barva vývoj pomocí činidla Folin, aby bylo zajištěno, že hladiny proteinů jsou měřeny správně. Ačkoli NaOH i KOH mohly poskytnout požadovanou alkalitu, pouze NaOH byl kompatibilní s testem U-2012. V přítomnosti KOH byla vytvořena sraženina. V peletách byl PCA neutralizován pomocí Na2CO3 a NaOH (27). Během testu bylo přidáno další NaOH; optimalizovaný objem byl mezi 50 až 70 µL (běžně se používalo 60 µL); viz Obrázek 1.
červená řepa, borůvka a červené víno byly odbarveny 15 µL 30% H2O2 při 0,5 a 2 h při 50°C a pokojové teplotě. Dvacet mikrolitrů 30% H2O2 po dobu 1 hodiny při 50°C bylo použito pro zvládnutí silnějších barevných vzorků. Oxidace látek, jako jsou cukry vázané na proteiny H2O2 při 50°C, se zdá být kritická, protože zpracování při pokojové teplotě nadhodnocuje obsah bílkovin. V případě červené řepy snížilo zpracování 50°C zdánlivý odhad bílkovin na 14% nezpracovaných, zatímco zpracování při pokojové teplotě tento odhad snížilo pouze na polovinu.
z kolorimetrických testů provedených po ošetření peroxidem vodíku bylo zřejmé, že některé H2O2 nebyly použity při odbarvení. V takovém vzorku byla konečná barva Lowryho testu částečně zničena. Bylo proto nutné zničit zbývající peroxid vodíku před testem bílkovin. Existují dva zdroje H2O2 v U-2012 testu; H2O2 přidán pro odbarvování a H2O2 přítomen jako kontaminant v Triton X-100 (0.22% informace o Výrobku: Triton X-100, www.sigmaaldrich.com). Peroxid vodíku je běžně degradován pomocí enzymu katalasy. Vysoké pH proteinového testu by však inaktivovalo známé katalázy. Přidání katalázy by také vedlo k přidání extra proteinu. Zvolili jsme chemickou destrukci H2O2 pomocí pyruvátu (28). Chemie interakční rovnice pyruvát-H2O2 je dobře zavedená (28,29). Pyruvát ničí H2O2 při pokojové teplotě, podle následující reakce:

Zbytkové H2O2 na pelety suspenze byla zničena tím, že zachází s 0,9 M pyruvát (1,5 x koncentraci H2O2) po dobu 0,5 h při pokojové teplotě. K potlačení kontaminujícího H2O2 v Tritonu X-100 byl do proteinového testu přidán také další pyruvát (Obrázek 1). Přidání pyruvátu dalo nižší absorpci pro neproteinový polotovar . Navrhujeme, aby peroxidový kontaminant v Tritonu X-100 reagoval s acetonitrilem v roztoku-2, což dává mírně vyšší savost.
barva rušení spojené s barevné biologických vzorků nelze jednoduše zohlednit běží protein assay v nepřítomnosti Folin činidla. Vypočtené poměry (Abs1-Abs2)/(Abs3-Abs4) uvedl, že rušení od vzorku barvy byl nejvyšší pro červené víno ( = 40) a méně borůvkový ( = 6) a červená řepa ( = 2). Toto rušení přeloženo do abnormálně vysoké odhady skutečných úrovní bílkovin; například, koncentrace bílkovin pomocí nezpracované a zpracované řepy homogenáty (20.21 versus 2.89 mg proteinu / g tkáně, v tomto pořadí). Kromě barevné interference obsahuje červené víno a homogenáty červené řepy a borůvek pravděpodobně látky, které budou reagovat s Folinovým činidlem v testu U-2012 (e .g., malé peptidy a komplexní cukry). Ty byly odstraněny selektivním vysrážením proteinů ledově studeným PCA v konečné koncentraci 5% (Obrázek 1).
Standardní křivky a jejich parametry
Standardní křivky pro nezpracované a zpracované BSA jsou uvedeny na Obrázku 2. Odvozené parametry (A0, AM a C50) jsou také uvedeny v tabulce 1 pro BSA a další proteiny.
výsledky ukazují, že zbytková standardní chyba v modelu je nízká (0,012 až 0,048), což naznačuje lepší přizpůsobení dat pravoúhlému trendu hyperboly. Pro porovnání informací mezi různými proteiny a jejich zpracováním byly parametry převedeny na koncentraci pro absorbanci = 1,0 při 650 nm (pravý sloupec v tabulce 1).
tyto výsledky ukazují, že ztráta proteinu (ve srovnání s nezpracovaným proteinem) ve zpracovaných vzorcích byla menší než u zpětně zpracovaných vzorků. Tato ztráta byla patrnější v případě trypsinu a lze ji vysvětlit na základě jeho autokatalytické aktivity během zpětného zpracování. Doporučujeme, aby „zpracovaný“ protokol (doplňkový materiál) byl dodržován pouze u biologických vzorků, které pravděpodobně obsahují proteolytické enzymy.
V původní Lowryho metody (6) a jeho modifikovaná verze U-1988 (15), pouze lineární část standardní křivky získané vynesením absorbance proti množství bílkovin byl použit kvantitativní stanovení bílkovin. V U-2012 testu jsme použít data efektivněji tím, že montáž pravoúhlého hyperbola rovnice, jak je popsáno v Materiálech a metodách oddílu v souladu s Coakley a James (20).
obsah Bílkovin barevných homogenátu
Proteinové koncentrace v neznámých vzorcích byly vypočteny podle rovnice a proti zpracované BSA standard a průměr všech zpracovaných proteinů uvedených v Tabulce 1. Ten bude blíže skutečnému odhadu biologických vzorků, které obsahují směs proteinů. Množství bílkovin v borůvkách a červené řepě jsme odhadli ve srovnání s červeným vínem přibližně 60krát a 230 krát (Tabulka 2).
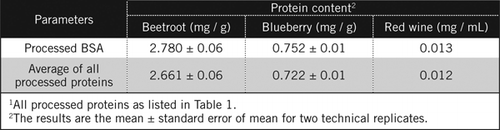
Jako BSA, červené víno a 50% homogenáty z červené řepy a borůvek byly zpracovány PCA srážek a odbarvování pomocí H2O2 (Obrázek 1). V této fázi byly biologické vzorky koncentrovány 40krát pro červené víno a 4krát pro červenou řepu a borůvky. Podobně BSA (2 mg/mL) byl také koncentrován 4krát na 8 mg/ml. Absorbance barevných vzorků, která byla blízká absorbanci pro C50 (pro nezpracovanou BSA), byla použita pro výpočet obsahu proteinu, jak je popsáno v rovnici a.
Na závěr, U-2012 testu byl zaměstnán stabilní činidla, za předpokladu, lepší citlivost (i bezbarvé biologické vzorky) a překonat barva-indukované rušení pro barevné biologických vzorků. U-2012 testu není omezen na lineární část reakce mezi proteiny koncentrace a absorbance a umožňuje efektivnější využití dat v nelineární oblasti prostřednictvím obdélníkový hyperbolické křivky model je opatřen norem pomocí jednoduchých postupů v aplikaci Microsoft Excel.
poděkování
autoři uznávají Nadaci pro výzkum, vědu a technologii Nový Zéland za finanční podporu (C06X0809).
konkurenční zájmy
autoři prohlašují, že žádné konkurenční zájmy.
Doplňující údaje
zobrazit doplňující údaje, které doprovázejí tento dokument naleznete na stránkách časopisu na adrese: www.future-science.com/doi/suppl/10.2144/000113818
- 1. Kaplan, R. S. A P. L. Pedersen. 1985. Stanovení mikrogramů množství bílkovin v přítomnosti miligram hladiny lipidů s amido black 10B. Anal. Biochem. 150:97–104.Crossref, Medline, CAS, Google Scholar
- 2. Gornall, a. G., C. J. Bardawill, a M. M. David. 1949. Stanovení sérových proteinů pomocí biuretové reakce. J. Biol. Cheme. 177:751–766.Medline, CAS, Google Scholar
- 3. Smith, P. K., R. I. Krohn, G. T. Hermanson, A. K. Mallia, F. H., Gartner, M. D. Provenzana, E. K., Fujimoto, N. M. Goeke, et al.. 1985. Měření bílkovin pomocí kyseliny bicinchoninové. Anální. Biochem. 150:76–85.Crossref, Medline, CAS, Google Scholar
- 4. Bradford, M.M. 1976. Rychlá a citlivá metoda pro kvantifikaci mikrogramových množství proteinu s využitím principu vazby protein-barvivo. Anální. Biochem. 72:248–254.Crossref, Medline, CAS, Google Scholar
- 5. Zor, T. A Z. Selingerovi. 1996. Linearizace Bradfordova proteinového testu zvyšuje jeho citlivost: teoretické a experimentální studie. Anální. Biochem. 236:302–308.Crossref, Medline, CAS, Google Scholar
- 6. Lowry, o. h., N. J. Rosbrough, a. L. Farr a R. J. Randall. 1951. Měření proteinů pomocí Folin-fenolového činidla. J.Biol. Cheme. 193:265–275.Medline, CAS, Google Scholar
- 7. Peterson, G.L. 1979. Přehled metody kvantifikace folinového fenolového proteinu Lowry, Rosebrough, Farr a Randall. Anální. Biochem. 100:201–220.Crossref, Medline, CAS, Google Scholar
- 8. Sapan, C. V., R. L. Lundablad, a N. C. Cena. 1999. Techniky stanovení kolorimetrického proteinu. Biotechnol. Appl. Biochem. 29:99–108.Medline, CAS, Google Scholar
- 9. Okutucu, B., A. Dınçer, Ö. Habiba A F. Zıhnıoglua. 2007. Porovnání pěti metod pro stanovení celkové koncentrace proteinu v plazmě. J. Biochem. Biophys. Metody 70: 709-711.Crossref, Medline, CAS, Google Scholar
- 10. Kresge, N., R. D. Simoni a R. L. Hill. 2005. Nejcitovanější článek v historii publikování: stanovení bílkovin Oliverem h.Lowry. J.Biol. Cheme. 25:280.Google Scholar
- 11. Everette, J. D., Q M. Bryant, A. M. Green, Y. a. Abbey, G. W. Wangila, a. B. R. Walker. 2010. Důkladná studie reaktivity různých tříd sloučenin vůči činidlu Folin-Ciocalteu. J. Agric. Jídlo Chem. 58:8139–8144.Crossref, Medline, CAS, Google Scholar
- 12. Eichberg, J. A L. C. Mokrasch. 1969. Interference oxidovanými lipidy při stanovení proteinu metodou Lowry. Anální. Biochem. 30:386–390.Crossref, Medline, CAS, Google Scholar
- 13. Dulley, J. R. A P. a. truchlí. 1975. Jednoduchá technika pro eliminaci rušení detergenty v Lowry metodě stanovení bílkovin. Anální. Biochem. 64:136–141.Crossref, Medline, CAS, Google Scholar
- 14. Brillouet, J.-M., M.-P. Belleville a M. Moutounet. 1991. Možné komplexy protein-polysacharid v červených vínech. Rána. J. Enol. Vitic. 42:150–152.CAS, Google Scholar
- 15. Upreti, G. C., R. a. Ratcliff, a. P. C. Bohatství. 1988. Odhad proteinu v tkáních obsahujících vysoké hladiny lipidů: modifikace Lowryho metody stanovení proteinu. Anální. Biochem. 168:421–427.Crossref, Medline, CAS, Google Scholar
- 16. Upreti, G. C., C. Davis a J. Oliver. 1991. Příprava reprezentativních homogenátů biologických tkání: účinek soli na extrakci bílkovin. Anální. Biochem. 198:298–301.Crossref, Medline, CAS, Google Scholar
- 17. Smith, M. R., M. H. Penner, s. e. Bennett, a. a. T. Bakalinsky. 2011. Kvantitativní kolorimetrický test celkového proteinu aplikovaný na červené víno Pinot Noir. J. Agric. Jídlo Chem. 59:6871–6876.Crossref, Medline, CAS, Google Scholar
- 18. Wigand, P., S. Tenzer, h. Schild a H. Decker. 2009. Analýza proteinového složení červeného vína ve srovnání s růžovými a bílými víny elektroforézou a vysokotlakou kapalinovou chromatografií – hmotnostní spektrometrií (HPLC-MS). J. Agric. Jídlo Chem. 57:4328–4333.Crossref, Medline, CAS, Google Scholar
- 19. Upreti, G. C., Y. Wang, a. Sharrock, N. Feisst, m. Davy, and B. Jordan. 2009. Stabilní a citlivý proteinový test (u-2009 modified assay) pro barevné biologické vzorky. ComBiol., Novozélandský Závěrečný Program Prosinec 2009. University of Canterbury, Christchurch, Nový Zéland.Google Scholar
- 20. Coakley, W. T.A C. J. James. 1978. Jednoduchá lineární transformace pro kalibrační křivku Folin-Lowryho proteinu na 1,0 mg / ml. Anální. Biochem. 85:90–97.Crossref, Medline, CAS, Google Scholar
- 21. Pinheiro, J. C. A D. M. Bates. 2000. Modely se smíšenými efekty v S A S-PLUS, statistické a výpočetní řady. Springer-Verlag, New York, NY.Google Scholar
- 22. R Vývoj Jádro Týmu. 2009. R: jazyk a prostředí pro statistické výpočty. R Foundation for Statistical Computing, Vídeň, Rakousko, ISBN 3-900051-07-0, URL http://www.R-project.org.Google Scholar
- 23. Chačik, F., G. R. Beecher, J. T. Vanderslice, a G. Brázda. 1988. Kapalinové chromatografické artefakty a špičkové zkreslení: interakce vzorek-rozpouštědlo při separaci karotenoidů. Anální. Cheme. 60:807–811.Crossref, Medline, CAS, Google Scholar
- 24. Cernik, A.A. 1970. Stanovení chelátu olova s kyselinou ethylendiamintetra-octovou v krvi po vysrážení proteinu kyselinou chloristou. Brit. J. Průmysl Med. 27:40–42.Medline, CAS, Google Scholar
- 25. Moughan, P. J., a. J. Darragh, W. C. Smith, a. C. a. Zadky. 1990. Kyselina chloristá a trichloroctová jako sraženiny proteinu v endogenní ileální digestě od potkana. J.Sci. Jídlo Agric. 52:13–21.Crossref, CAS, Google Scholar
- 26. Galbács, Z. M. A L. J. Csányi. 1983. Alkalicky indukovaný rozklad peroxidu vodíku. J. Chem. SOC. Dalton Trans. 11:2353–2357.Crossref, Google Scholar
- 27. Scopes, R.K. 1988. Čištění proteinů: principy a praxe, druhý ed. Springer-Verlag New York Inc., New York, NY.Google Scholar
- 28. Upreti, G.C., K. Jensen, R. Munday, D. M. Duganzich, R. Vishwanath a J. F. Smith. 1998. Studie o aktivitě aromatické aminokyseliny oxidázy u spermií ram: role pyruvátu jako antioxidantu. Animo. Reprod. Věda. 51:275–287.Crossref, Medline, CAS, Google Scholar
- 29. Holleman, M.A. F. 1904. Oznámení sur l ‚action de l‘ eau oxygenee sur les acids α-cetoniques et sur les dicetones 1.2. Recl. Trave. Chime. Pays-Bas Belg. 23:169–172.Crossref, CAS, Google Scholar