kwantitatieve metingen van fysiologische eigenschappen zoals enzymactiviteit worden vaak uitgedrukt als eenheden van activiteit per milligram-eiwit. Hoewel talrijke tests zijn ontwikkeld om het eiwitgehalte te meten, waaronder de colorimetrische tests van Amido Black( 1), Biuret (2), Bicinchoninezuur (3) en Coomassie Blue (4,5), worden de Lowry-test (6) of de modificaties ervan (7,8) vaker gebruikt dan andere tests (9). De Lowry-analyse is eenvoudig, gevoelig en nauwkeurig en is de meest geciteerde (10) procedure voor kwantitatieve eiwitbepaling.
een grote verscheidenheid aan verbindingen die reageren met Folin-Ciocalteu fenol (Folin ‘ s) reagens (11) zijn een bron van mogelijke interferentie in Lowry-en gemodificeerde Lowry-eiwitbepalingen. Gelukkig zijn correcties door een geschikte blanco voldoende voor de meeste verbindingen (6,7), met uitzondering van lipiden (12), detergentia (13) en gekleurde stoffen (14). Moeilijkheden bij het testen van eiwitten in aanwezigheid van lipiden en detergentia (gebruikt in de oplosbaarheid van vetweefsel, myeline en skeletspieren) werden overwonnen door de gemodificeerde Lowry-Test (15; in dit artikel aangeduid als de U-1988-test, 16). Kleurinterferentie bij het bepalen van het eiwitgehalte in rode wijn (14,17,18) werd overwonnen door gebruik te maken van uitgebreide chromatografie. De bovenstaande aanpak is omslachtig en niet erg praktisch voor het hanteren van grote aantallen monsters. Geen van de bekende eiwittesten was geschikt voor het meten van eiwitten in gekleurde biologische monsters, bijv., gekleurd fruit en groenten, rode wijn, gepigmenteerde microben en gal van herkauwers.
onze ontwikkeling van de U-2012 assay van zijn voorgangers de U-1988 en de Lowry assay heeft drie belangrijke voordelen bereikt (I) gemak door stabiliteit van de reagensformuleringen, (ii) meting van eiwit in zowel kleurloze als gekleurde biologische monsters zonder afbreuk te doen aan de gevoeligheid, en (iii) het testen van eiwitten bij zeer lage concentraties. Deze nieuwe analyse zal van toepassing zijn op kwantitatieve bepaling van eiwit in zowel kleurloze en gekleurde biologische steekproefhomogenaten, met inbegrip van die rijk aan lipiden (bijv., avocado) en die moeilijk te homogeniseren.
- materialen en methoden
- biologische monsters-rode biet, bosbessen en rode wijn
- chemische reagentia
- verbeteringen in de U-1988 assay
- de U-2012-test
- de schatting van kleurinterferenties in de U-2012-test
- de standaardkromme en de parameters
- berekening van het eiwitgehalte van de homogenaten
- resultaten en discussie
- verbeteringen in de U-1988-test
- Eiwitschatting in gekleurde biologische monsters
- eiwitextractie
- storende stoffen elimineren
- Standaardkrommen en hun parameters
- eiwitgehalte van gekleurd homogenaat
- Dankbetuigingen
- concurrerende belangen
- aanvullende gegevens
materialen en methoden
biologische monsters-rode biet, bosbessen en rode wijn
de homogenaten van rode biet en bosbessen zijn bereid zoals beschreven in het aanvullende materiaal. Voor rode wijn was vóór de U-2012-test geen eiwitextractie nodig.
chemische reagentia
alle chemische reagentia, met uitzondering van natriumhypochloriet en perchloorzuur (PCA), werden verkregen uit Sigma of Sigma-Aldrich (St Louis, MO. VERENIGDE). Natriumhypochloriet kwam uit Acros Organic, New Jersey, USA. PCA werd verkregen van BDH (Engeland).
verbeteringen in de U-1988 assay
overstappen van carbonaat naar fosfaatbuffer bij pH 12,0 verbeterden de reagensstabiliteit en gaven een kleine toename van de gevoeligheid. Acetonitril werd geïntroduceerd om door detergenten geïnduceerde bellen te voorkomen. NaOH verving KOH om precipitatie in de eiwitanalyse te vermijden. Bovendien werd de efficiëntie verbeterd door verschillende componenten van het Lowry-reagens in één reagensmengsel te combineren.
de U-2012-test
volledige details van de U-2012-test worden gegeven in aanvullend materiaal. Het protocol, kort samengevat in Figuur 1, beschrijft de verwerking van rode wijn en de homogenaten van rode biet en bosbessen, en bevat de verbeteringen aan de U-1988-test. De U-2012 analyse werd aangewend voor onverwerkte, verwerkte en omgekeerde verwerkte (H2O2 behandeling gevolgd door TCA of PCA precipitatie) proteã nen. De analyses werden uitgevoerd op BSA, koolzuuranhydrase, cytochroom C, isocitraatdehydrogenase, lysozyme en trypsine voor de ontwikkeling van standaardkrommen en in gekleurde biologische steekproeven. De bepaling van proteã nen in de biologische steekproeven werd uitgevoerd door aan aangewezen standaardkrommen te kalibreren.
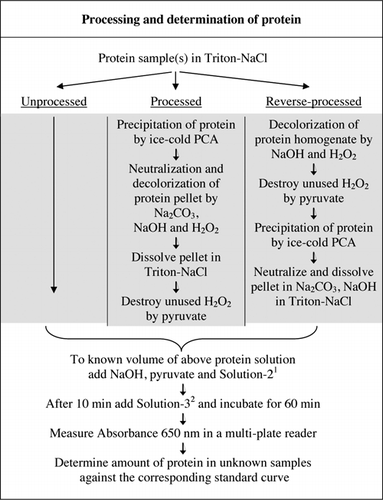
1Solution-2 bevatte kopersulfaat (CuSO4, 5H2O), Na-K-tartraat, SDS en acetonitril in 100 mM fosfaatbuffer (pH 12,0). 2Voor Oplossing-3 werd het fenolreagens van Folin-Ciocalteu verdund 1:1 met gedeïoniseerd water vlak voor gebruik.
de schatting van kleurinterferenties in de U-2012-test
Kleurinterferentie werd bepaald door de absorptie van verwerkte en onbewerkte biet -, bosbessen-en rode wijnmonsters te vergelijken, zowel met als zonder het gebruik van Folin-reagens, zoals beschreven in Figuur 1. De verhouding werd gebruikt om de mate van interferentie vast te stellen, waarbij Abs1 absorptie is van onverwerkte monsters met het reagens van Folin; Abs2 absorptie is van onverwerkte monsters zonder het reagens van Folin; Abs3 absorptie van verwerkte monsters met het reagens van Folin; en Abs4 is absorptie van verwerkte monsters zonder het reagens van Folin.
de standaardkromme en de parameters
oplossing-1B en 1c, beschreven in de sectie recepten van het bijgevoegde aanvullende materiaal, werden gebruikt voor de ontwikkeling van de standaardkrommen. De concentratie van BSA en de bijbehorende absorptiewaarden werden uitgezet met behulp van een X-Y-spreidingsgrafiek. De vorm van deze grafiek (Figuur 2) toont een verzadigde respons bij hogere concentraties met een zeer beperkte initiële lineaire respons. Dit was een voorkeurscurvevorm die eerder werd gerapporteerd (20). In eerste instantie werd dit gemodelleerd met behulp van een exponentiële vorm (19), maar latere studies toonden aan dat een rechthoekige hyperbool een betere afstemming op de respons gaf, vooral bij lagere concentraties. Deze laatste vorm is nu gestandaardiseerd en de volgende drie-parametervergelijking werd gebruikt om de relatie tussen absorptie en eiwitconcentratie te beschrijven:

Conc = Eiwit concentratie,
A = Absorptie bij Conc,
A0 = Absorptie op nul concentratie,
AM= Absorptie bij max concentratie,
C50= Concentratie geven absorptie
(AM + A0)/2.
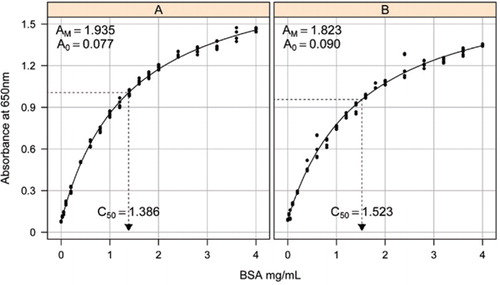
schatting van de standaardcurve tussen de absorptie (650 nm) en de concentraties van BSA-eiwit werd gemaakt op drie technische replicaten naar (A) de onverwerkte eiwittest (parameters A0= 0,077, Am=1,935, C50=1.386), en (B) de processed protein assay (parameters A0=0,90, Am=1,823, C50=1,523). Een rechthoekig hyperbolamodel (vergelijking ) werd aan de waargenomen gegevens gekoppeld. Parameterschattingen worden geïdentificeerd in de krommen met de C50-schatting op de x-as (gestippelde zwarte lijn).
Parameter A0 werd experimenteel bepaald, terwijl AM en C50 werden geschat met behulp van Microsoft Excel ‘ s Toolbox add-in Solver functie. Er werd een reeks proefparameters gebruikt om de gemodelleerde absorptie bij elk van de standaardconcentraties (Conc) te berekenen met behulp van een vergelijking . Solver werd vervolgens opgedragen om de resterende standaardafwijking tussen de gemeten en gemodelleerde absorptie voor de standaard set te minimaliseren door AM en C50 aan te passen.
de relatie tussen absorptie en concentratie vertoont een niet-lineaire curve over het gehele concentratiebereik, wat waarschijnlijk te wijten is aan een component van lichtverstrooiing die toeneemt naarmate de concentratie van eiwitten toeneemt bij het meten van absorptie. Een slechte lineaire pasvorm bij lage absorptie werd ook gemeld door Coakley en James (20).
berekening van het eiwitgehalte van de homogenaten
tests werden uitgevoerd op verwerkte en onverwerkte rode wijn en homogenaten van rode biet en bosbessen. BSA en andere eiwitmonsters werden identiek behandeld voor geschikte standaardkrommen om A0 -, AM-en C50-waarden te bepalen. Deze parameters werden toen gebruikt om monsterabsorptie (A) om te zetten in eiwitconcentratie in elk homogenaat gebruikend:

omdat de vergelijking een verzadigde vorm heeft, neemt de gevoeligheid af naarmate de absorptie (A), en dus de concentratie, toeneemt. Fouten in eiwitschattingen kunnen tot een minimum worden beperkt door de concentraties homogenaten in de bepaling zodanig aan te passen dat zij de C50-waarde niet te veel overschrijden.
de Concwaarde van homogenaat werd vervolgens omgezet in weefseleiwitconcentratie (Weefsel Conc in mg/g weefsel) met behulp van de volgende formule:

wanneer de concentratie homogenaat (in mg eiwit / mL) is gecorrigeerd voor elke preconcentratie of verdunning tijdens de assay. Het homogenaatpercentage was 100 g weefsel gehomogeniseerd tot een totaal volume van 200 mL (in ons geval 50%).
In een afzonderlijke studie werd een rechthoekig hyperbolamodel aangebracht met behulp van het non linear mixed effects (NLME) – pakket (21) in R (22) (Figuur 2). Elke BSA-oplossing, onafhankelijk gemaakt in het laboratorium, werd gemodelleerd als een willekeurig effect, met een gemeenschappelijke A0 maar verschillende AM-en C50-coëfficiënten. Dit modelleert de hiërarchie van biologische steekproef herhaalt en technische analyse herhaalt.
resultaten en discussie
verbeteringen in de U-1988-test
de beperking van de U-1988-en de Lowry-test is de instabiliteit van het op carbonaat gebaseerde reagens. De carbonaatbuffer (pH 11,4 bij 2% = 188,7 mM) werd in u-1988 vervangen door 40 mM fosfaat bij pH-waarden variërend van 11,4 tot 12,5. Initiële hellingen van de standaardkrommen van de eiwittest met BSA bij 0,5 mg BSA/ mL en 1,0 mg BSA / mL werden berekend. De initiële hellingen met fosfaatbuffers bij pH 11,4 en bij de optimale pH 12,0 waren respectievelijk 99 x10-6 en 197 x10-6. De helling voor de carbonaatbuffer (pH 11,4) was 162 x10-6.Aangezien de hellingswaarde een directe indicatie is van de gevoeligheid van de assay, wordt fosfaatbuffer (pH 12.0) werd gekozen om carbonaatbuffer te vervangen, wat een gevoeligheid van 25% opleverde.
grotere stabiliteit werd bereikt door de concentratie van de fosfaatbuffer te verhogen tot 100 mM. de resulterende fosfaat / CuSO4 / Na-K – tartraatoplossing was gedurende twee weken stabiel bij kamertemperatuur, aanzienlijk langer dan de carbonaat/CuSO4/Na-K-tartraatoplossing, die dagelijks moet worden bereid vóór de eiwitbepaling. Voor alle toekomstige experimenten werd 100 mM fosfaat (pH 12,0) gebruikt om de CuSO4/Na-K-tartraatoplossing te bereiden. Wij geloven dat vervanging van carbonaat door fosfaat het gemak van de U-2012 assay zal verbeteren.
door detergenten geïnduceerde bubbels worden een belangrijke bron van fouten in de absorptiemetingen bij het gebruik van een multi-well plaatlezer (geen probleem met cuvetten). Deze belletjes werden aanzienlijk verminderd door de toevoeging van een aantal polaire oplosmiddelen (bijvoorbeeld aceton, acetonitril, ethanol en methanol). Acetonitril, de meest polaire van deze oplosmiddelen (23), werd gekozen voor zijn effectiviteit en opgenomen in oplossing-2 (zie afbeelding 1 bijschrift en recepten van aanvullend materiaal).
fosfaatbuffer, CuSO4, Na-K-tartraat, SDS en acetonitril kunnen afzonderlijk worden toegevoegd en de volgorde van toevoeging heeft geen invloed op de resulterende absorptie. Het gebruik van een voorgemengde oplossing verbetert echter het gemak verder, vooral wanneer grote aantallen monsters moeten worden geanalyseerd. Daarom groepeerden wij deze componenten van het assaymengsel in oplossing-2 (Figuur 1). Een dergelijke voorgemengde oplossing was niet haalbaar voor de oorspronkelijke Lowry-test (6) vanwege de instabiliteit van de carbonaatoplossing. De poging om Oplossing-3 in oplossing-2 op te nemen resulteerde in een dramatische vermindering van de ontwikkeling van blauwe kleur en werd niet verder overwogen.
Eiwitschatting in gekleurde biologische monsters
eiwitextractie
eiwitten uit rode biet en bosbes werden geëxtraheerd in Triton X-100-NaCl-oplossing met milde homogenisatie. Dergelijke homogenaten behouden hun enzymactiviteit (15). Deze extractie was niet nodig voor rode wijn.
storende stoffen elimineren
voor gekleurde monsters moet de interferentie als gevolg van de inherente kleur van het monster en andere niet-eiwithoudende stoffen die reageren met de eiwitreagentia vóór colorimetrische eiwitbepaling worden verwijderd. De nieuwigheid van U-2012 is in het bedenken van een het ontkleuren protocol compatibel met een colorimetrische eiwitanalyse.
ontkleuring van gekleurde pigmenten door natriumhypochloriet of H2O2 en selectieve precipitatie van eiwitten door PCA of TCA werden overwogen voor verwijdering van storende stoffen. Natriumhypochloriet, H2O2, TCA en PCA werden beoordeeld op hun verenigbaarheid met de U-2012-test waarbij BSA als testeiwit werd gebruikt. Tussen natriumhypochloriet en H2O2 was alleen H2O2 compatibel omdat een precipitaat werd gevormd in aanwezigheid van hypochloriet. De proteã nen die door TCA of PCA worden neergeslagen kunnen door u-2012 na adequate neutralisatie van overblijvend zuur in de pellet worden bepaald. De superioriteit van PCA ten opzichte van TCA voor eiwitprecipitatie is gemeld (24,25). In tegenstelling, in onze vergelijkende evaluatie, toonde vergelijkbare C50 waarden voor PCA (1.395) en TCA (1.400). Wij gaven de voorkeur aan PCA omdat het gemakkelijk verkrijgbaar is als pre-made oplossing (70% v / v) en daardoor gemakkelijk verdund kan worden tot de gewenste sterkte. TCA is een hygroscopische vaste stof die vanwege het variabele watergehalte moeilijk te wegen is.
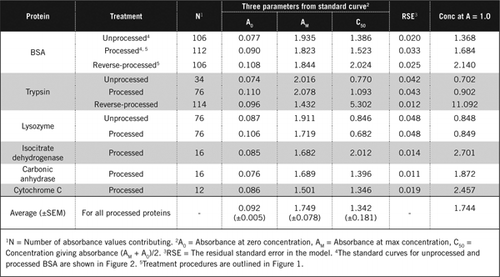
er zijn twee mogelijkheden om PCA en H2O2 te combineren. Voor “verwerkte” eiwitten werd PCA-behandeling gevolgd door H2O2-behandeling en voor “reverse-processed” eiwitten werd H2O2-behandeling voorafgegaan door PCA-precipitatie. Voordelen van het gebruik van’ verwerkt ‘ eiwit waren de verwijdering van een aantal storende stoffen in het supernatans en de mogelijke inactivering van proteolytische enzymen tijdens de monstervoorbereiding. Dit werd bevestigd door het testen van verwerkte en omgekeerde verwerkte trypsine en BSA (zie Tabel 1). Slechts verwerkte steekproeven werden gebruikt om het daadwerkelijke eiwitgehalte van gekleurde biologische steekproeven te bepalen
zowel PCA als H2O2 behandelingen van gekleurde monsters waren noodzakelijk voor interferentie eliminatie in u-2012 assay. De zure neerslag alleen van de gekleurde steekproeven verwijderde interferentie niet volledig. Met alle gekleurde monsters werd wat kleur weggegooid in het supernatant, maar de pellets waren ook gekleurd. Kleur werd uit de pellets geëlimineerd door H2O2 behandeling. De alkalische voorwaarden werden vereist voor zowel efficiënte ontkleuring door H2O2 (26) als de kleurontwikkeling door het reagens van Folin om ervoor te zorgen dat eiwitniveaus correct worden gemeten. Hoewel zowel NaOH als KOH de vereiste alkaliniteit konden leveren, was alleen NaOH compatibel met de U-2012-test. Een neerslag werd gevormd in de aanwezigheid van KOH. In pellets werd de PCA geneutraliseerd met Na2CO3 en NaOH (27). Tijdens de test werd extra NaOH toegevoegd; het geoptimaliseerde volume lag tussen 50 en 70 µL (60 µL werd routinematig gebruikt); zie Figuur 1.Rode wijn, rode bosbes en rode wijn werden ontkleurd met 15 µL 30% H2O2, waarbij 0,5 en 2 uur bij 50°C en kamertemperatuur werden ingenomen. Twintig microliters van 30% H2O2 gedurende 1 uur bij 50°C werden gebruikt om het hoofd te bieden aan sterker gekleurde monsters. Oxidatie van stoffen zoals suikers die bij 50°C aan eiwitten worden gebonden door H2O2 lijkt van cruciaal belang omdat de verwerking bij kamertemperatuur het eiwitgehalte overschat. In het geval van rode biet heeft de verwerking bij 50°C de schijnbare eiwitschatting teruggebracht tot 14% van de onbewerkte biet, terwijl de verwerking bij kamertemperatuur deze schatting slechts halveerde.
uit de colorimetrische analyses die na de behandeling met waterstofperoxide werden uitgevoerd, bleek dat een deel van H2O2 niet werd gebruikt bij de ontkleuring. In zo ‘ n monster werd de eindkleur van de Lowry-analyse gedeeltelijk vernietigd. Het was daarom noodzakelijk om de resterende waterstofperoxide vóór de eiwittest te vernietigen. Er zijn twee bronnen van H2O2 in de U-2012 assay; H2O2 toegevoegd voor ontkleuring en H2O2 aanwezig als verontreiniging in Triton X-100 (0,22%, productinformatie: Triton X-100, www.sigmaaldrich.com). waterstofperoxide wordt algemeen afgebroken door het enzym catalase. Nochtans, zou de hoge pH van de eiwitanalyse bekende catalases inactiveren. Ook, zou het toevoegen van catalase tot de toevoeging van extra proteã ne leiden. We kozen voor chemische vernietiging van H2O2 met pyruvaat (28). De chemie van de pyruvaat-H2O2-interactievergelijking is duidelijk vastgesteld (28,29). Pyruvaat vernietigt H2O2 bij kamertemperatuur volgens de volgende reactie:

restant H2O2 in de pelletsuspensie werd vernietigd door 0,5 uur bij kamertemperatuur te behandelen met 0,9 M pyruvaat (1,5 x concentratie van H2O2). Om de besmettende H2O2 in Triton X-100 tegen te gaan, werd ook extra pyruvaat toegevoegd in de eiwittest (figuur 1). De toevoeging van pyruvaat gaf een lagere absorptie voor een niet-eiwit blanco . We stellen voor dat de peroxidecontaminant in Triton X-100 reageert met het acetonitril in oplossing-2, wat een iets hoger absorptievermogen oplevert.
de met de gekleurde biologische monsters verbonden kleurinterferentie kan niet zomaar in aanmerking worden genomen door een eiwittest uit te voeren zonder het Foline-reagens. De berekende verhoudingen (Abs1-Abs2) / (Abs3-Abs4) gaven aan dat de interferentie door de kleur van het monster het hoogst was voor rode wijn (=40) en minder voor bosbessen (=6) en rode biet (=2). Deze interferentie vertaalde zich in de abnormaal hoge schattingen van de werkelijke eiwitniveaus; bijvoorbeeld, de concentratie van eiwit met onverwerkte en verwerkte biethomogenaten (20,21 versus 2,89 mg eiwit / g weefsel, respectievelijk). Naast kleurinterferentie bevatten rode wijn en homogenaten van rode biet en bosbes waarschijnlijk stoffen die reageren met het reagens van Foline in de U-2012-test (e.g., kleine peptiden en complexe suikers). Deze werden verwijderd door selectief eiwitten te precipiteren met ijskoude PCA bij een eindconcentratie van 5% (Figuur 1).
Standaardkrommen en hun parameters
Standaardkrommen voor onbewerkte en verwerkte BSA zijn weergegeven in Figuur 2. De afgeleide parameters (A0, AM en C50) zijn ook vermeld in Tabel 1 voor BSA en andere eiwitten.
de resultaten tonen aan dat de resterende standaardfout in het model laag is (0,012 tot 0,048), wat aangeeft dat de gegevens beter aansluiten op de rechthoekige hyperbool-trend. Voor het vergelijken van informatie tussen diverse proteã nen en hun verwerking, werden de parameters omgezet in de concentratie voor absorptie = 1.0 bij 650 nm (juiste kolom in Tabel 1).
deze resultaten tonen aan dat het verlies aan eiwit (vergeleken met onverwerkte eiwitten) in verwerkte monsters kleiner was dan de omgekeerde verwerkte monsters. Dit verlies was duidelijker in het geval van trypsine en kan worden verklaard op basis van zijn auto-katalytische activiteit tijdens de reverse-processing. Wij raden aan het’ verwerkte ‘ protocol (aanvullend materiaal) alleen te volgen voor biologische monsters die waarschijnlijk proteolytische enzymen bevatten.
In de oorspronkelijke Lowry-test (6) en de gewijzigde versie U-1988 (15) werd bij de kwantitatieve bepaling van het eiwit alleen het lineaire gedeelte van de standaardkromme gebruikt dat werd verkregen door de absorptie af te zetten tegen de hoeveelheid eiwit. In de U-2012 assay gebruiken we de gegevens effectiever door een rechthoekige hyperbolavergelijking toe te passen zoals beschreven in de materialen en methoden sectie in lijn met Coakley en James (20).
eiwitgehalte van gekleurd homogenaat
eiwitconcentraties in onbekende monsters werden berekend door vergelijking en tegen verwerkte BSA-standaard en het gemiddelde van alle verwerkte eiwitten vermeld in Tabel 1. De laatste zal dichter bij een echte schatting voor biologische steekproeven zijn die een mengsel van proteã nen bevatten. We schatten de hoeveelheden eiwit in bosbes en rode biet ten opzichte van rode wijn respectievelijk op ongeveer 60 en 230-voudig (Tabel 2).
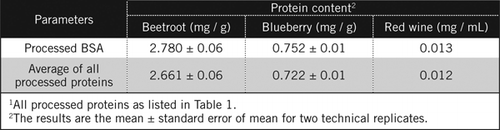
net als BSA, rode wijn en 50% homogenaten van rode biet en bosbessen werden verwerkt door PCA precipitatie en ontkleuring door H2O2 (figuur 1). In dit stadium werden de biologische monsters 40 keer geconcentreerd voor rode wijn en 4 keer voor rode biet en bosbessen. Evenzo was BSA (2 mg/mL) ook 4 maal geconcentreerd tot 8 mg/mL. De absorptie van de gekleurde monsters die dicht bij de absorptie voor C50 (voor onbewerkte BSA) was, werd gebruikt om het eiwitgehalte te berekenen, zoals beschreven door vergelijking en .
concluderend kan worden gesteld dat de U-2012-test stabiele reagentia heeft gebruikt, een verbeterde gevoeligheid heeft opgeleverd (zelfs voor kleurloze biologische monsters) en kleur-geïnduceerde interferentie voor gekleurde biologische monsters heeft overwonnen. De U-2012-analyse wordt niet beperkt tot het lineaire gedeelte van de respons tussen eiwitconcentratie en absorptie en maakt efficiënter gebruik van gegevens in het niet-lineaire gebied door een rechthoekig hyperbolisch krommemodel dat aan de normen wordt aangepast gebruikend eenvoudige procedures binnen Microsoft Excel.
Dankbetuigingen
auteurs erkennen de Stichting voor Onderzoek, Wetenschap en technologie Nieuw-Zeeland voor financiële steun (C06X0809).
concurrerende belangen
de auteurs verklaren geen concurrerende belangen.
aanvullende gegevens
om de aanvullende gegevens bij dit document te bekijken, kunt u terecht op de website van het tijdschrift: www.future-science.com/doi/suppl/10.2144/000113818
- 1. Kaplan, R. S., P. L. Pedersen. 1985. Bepaling van microgram hoeveelheden eiwit in aanwezigheid van milligram niveaus van lipide met amido black 10B.Anaal. Biochem. 150:97–104.Crossref, Medline, CAS, Google Scholar
- 2. Gornall, A. G., C. J. Bardawill, and M. M. David. 1949. Bepaling van serumeiwitten door middel van de biureetreactie. J. Biol. Scheikunde. 177:751–766.Medline, CAS, Google Scholar
- 3. Smith, P. K., R. I. Krohn, G. T. Hermanson, A. K. Mallia, F. H. Gartner, M. D. Provenzano, E. K. Fujimoto, N. M. Goeke, et al.. 1985. Meting van eiwit met bicinchoninezuur. Anaal. Biochem. 150:76–85.Crossref, Medline, CAS, Google Scholar
- 4. Bradford, M. M. 1976. Een snelle en gevoelige methode voor de kwantificering van microgram hoeveelheden eiwit met behulp van het principe van eiwit-kleurstofbinding. Anaal. Biochem. 72:248–254.Crossref, Medline, CAS, Google Scholar
- 5. Zor, T. en Z. Selinger. 1996. Linearisatie van de Bradford protein assay verhoogt de gevoeligheid: theoretische en experimentele studies. Anaal. Biochem. 236:302–308.Crossref, Medline, CAS, Google Scholar
- 6. Lowry, O. H., N. J. Rosbrough, A. L. Farr, and R. J. Randall. 1951. Eiwitmeting met het Folin fenolreagens. J. Biol. Scheikunde. 193:265–275.Medline, CAS, Google Scholar
- 7. Peterson, G. L. 1979. Review of the folin phenol protein quantification method of Lowry, Rosebrough, Farr and Randall. Anaal. Biochem. 100:201–220.Crossref, Medline, CAS, Google Scholar
- 8. Sapan, C. V., R. L. Lundablad, en N. C. Price. 1999. Colorimetrische eiwit assay technieken. Biotechnol. Appl. Biochem. 29:99–108.Medline, CAS, Google Scholar
- 9. Okutucu, B., A. Dınçer, Ö. Habib, en F. Zıhnıoglu. 2007. Vergelijking van vijf methoden voor de bepaling van de totale plasma-eiwitconcentratie. J. Biochem. Biophys. Methoden 70: 709-711.Crossref, Medline, CAS, Google Scholar
- 10. Kresge, N., R. D. Simoni, and R. L. Hill. 2005. The mostly cited paper in publishing history: protein determination by Oliver H. Lowry. J. Biol. Scheikunde. 25:280.Google Scholar
- 11. Everette, J. D., Q. M. Bryant, A. M. Green, Y. A. Abbey, G. W. Wangila, and R. B. Walker. 2010. Grondige studie van de reactiviteit van verschillende compoundklassen naar het Folin-Ciocalteu-reagens. J. Agric. Voedselchem. 58:8139–8144.Crossref, Medline, CAS, Google Scholar
- 12. Eichberg, J., L. C. Mokrasch. 1969. Interferentie door geoxideerde lipiden in de bepaling van eiwit door de Lowry procedure. Anaal. Biochem. 30:386–390.Crossref, Medline, CAS, Google Scholar
- 13. Dulley, J. R. en P. A. Grieve. 1975. Een eenvoudige techniek voor het elimineren van interferentie door detergentia in de Lowry methode voor eiwitbepaling. Anaal. Biochem. 64:136–141.Crossref, Medline, CAS, Google Scholar
- 14. Brillouet, J.-M., M.-P. Belleville, and M. Moutounet. 1991. Mogelijke eiwitpolysaccharidecomplexen in rode wijnen. Is. J. Enol. Vitic. 42:150–152.CAS, Google Scholar
- 15. Upreti, G. C., R. A. Ratcliff, en P. C. Riches. 1988. Eiwitschatting in weefsels met een hoog lipidengehalte: modificaties aan de Lowry-methode voor eiwitbepaling. Anaal. Biochem. 168:421–427.Crossref, Medline, CAS, Google Scholar
- 16. Upreti, G. C., C. Davis, and J. Oliver. 1991. Bereiding van representatieve homogenaten van biologische weefsels: effect van zout op eiwitextractie. Anaal. Biochem. 198:298–301.Crossref, Medline, CAS, Google Scholar
- 17. Smith, M. R., M. H. Penner, S. E. Bennett, and A. T. Bakalinsky. 2011. Kwantitatieve colorimetrische bepaling voor het totale eiwit toegepast op de rode wijn Pinot Noir. J. Agric. Voedselchem. 59:6871–6876.Crossref, Medline, CAS, Google Scholar
- 18. Wigand, P., S. Tenzer, H. Schild, en H. Decker. 2009. Analyse van de eiwitsamenstelling van rode wijn in vergelijking met Rosé en witte wijn door elektroforese en hogedrukvloeistofchromatografie-massaspectrometrie (HPLC-MS). J. Agric. Voedselchem. 57:4328–4333.Crossref, Medline, CAS, Google Scholar
- 19. Upreti, G. C., Y. Wang, A. Sharrock, N. Feisst, M. Davy, en B. Jordan. 2009. Een stabiele en gevoelige eiwitanalyse (u-2009 gewijzigde analyse) voor gekleurde biologische steekproeven. ComBiol., Nieuw-Zeeland Definitief Programma December 2009. Universiteit van Canterbury, Christchurch, Nieuw-Zeeland.Google Scholar
- 20. Coakley, W. T., C. J. James. 1978. Een eenvoudige lineaire transformatie voor de Folin-Lowry – eiwitkalibratiekromme tot 1,0 mg / mL. Anaal. Biochem. 85:90–97.Crossref, Medline, CAS, Google Scholar
- 21. Pinheiro, J. C., D. M. Bates. 2000. Mixed-Effects modellen in s en S-PLUS, statistieken en Computing Series. Springer-Verlag, New York, NY.Google Scholar
- 22. R Development Core Team. 2009. R: een taal en omgeving voor statistische gegevensverwerking. R Foundation for Statistical Computing, Vienna, Austria, ISBN 3-900051-07-0, URL http://www.R-project.org.Google Scholar
- 23. Khachik, F., G. R. Beecher, J. T. Vanderslice, and G. Furrow. 1988. Vloeistofchromatografische artefacten en piekvervorming: interactie tussen monster en oplosmiddel bij de scheiding van carotenoïden. Anaal. Scheikunde. 60:807–811.Crossref, Medline, CAS, Google Scholar
- 24. Cernik, A. A. 1970. Bepaling van lood gecheleerd met ethyleendiaminetetra-azijnzuur in bloed na precipitatie van eiwit met perchloorzuur. Brit. J. Industry Med. 27:40–42.Medline, CAS, Google Scholar
- 25. Moughan, P. J., A. J. Darragh, W. C. Smith, and C. A. Butts. 1990. Perchloorzuur en trichloorazijnzuur als precipitanten van eiwitten in endogene ileale digesta van de rat. J. Sci. Voedsel Agric. 52:13–21.Crossref, CAS, Google Scholar
- 26. Galbács, Z. M., L. J. Csányi. 1983. Alkali-geïnduceerde ontleding van waterstofperoxide. J. Chem. Soc. Dalton Trans. 11:2353–2357.Crossref, Google Scholar
- 27. Scopes, R. K. 1988. Protein Purification: Principles and Practice, Second Ed. Springer-Verlag New York Inc. New York, NY.Google Scholar
- 28. Upreti, G. C., K. Jensen, R. Munday, D. M. Duganzich, R. Vishwanath, and J. F. Smith. 1998. Studies over aromatische aminozuuroxidase activiteit in ram spermatozoa: rol van pyruvaat als een antioxidant. Anim. Reprod. Sci. 51:275–287.Crossref, Medline, CAS, Google Scholar
- 29. Holleman, M. A. F. 1904. Notice sur l ‘action de l’ eau oxygenee sur les acids α-cetoniques et sur les dicetones 1.2. Recl. Trav. Chim. Pays-Bas Belg. 23:169–172.Crossref, CAS, Google Scholar