Le misure quantitative dei tratti fisiologici come l’attività enzimatica sono spesso espresse come unità di attività per proteina milligrammo. Sebbene siano stati sviluppati numerosi saggi per misurare il contenuto proteico, compresi i saggi colorimetrici di acido nero (1), Biureto (2), acido bicinchoninico (3) e Coomassie Blue (4,5), il saggio di Lowry (6) o le sue modifiche (7,8) sono più comunemente usati rispetto ad altri saggi (9). Il dosaggio di Lowry è semplice, sensibile e preciso ed è la procedura più citata (10) per la determinazione quantitativa delle proteine.
Un’ampia varietà di composti che reagiscono con il reagente di Folin-Ciocalteu fenolo (Folin) (11) sono una fonte di potenziale interferenza nei saggi di Lowry e di Lowry modificati. Fortunatamente, le correzioni attraverso un vuoto appropriato sono sufficienti per la maggior parte dei composti (6,7) tranne i lipidi (12), i detergenti (13) e le sostanze colorate (14). Le difficoltà nell’analisi delle proteine in presenza di lipidi e detergenti (utilizzati nella solubilizzazione del tessuto adiposo, della mielina e dei muscoli scheletrici) sono state superate dal test di Lowry modificato (15; indicato in questo articolo come test U-1988, 16). L’interferenza del colore nel determinare il contenuto proteico nel vino rosso (14,17,18) è stata superata impiegando un’ampia cromatografia. L’approccio di cui sopra è ingombrante e non molto pratico per la gestione di un gran numero di campioni. Nessuno dei saggi proteici noti era adatto per la misurazione di proteine in campioni biologici colorati, ad es., frutta e verdura colorata, vino rosso, microbi pigmentati e bile dei ruminanti.
Il nostro sviluppo dell’analisi U-2012 dai suoi predecessori l’U-1988 e l’analisi di Lowry ha raggiunto tre vantaggi principali (i) convenienza attraverso la stabilità delle formulazioni del reagente, (ii) misura della proteina in entrambi i campioni biologici incolori e colorati senza compromettere la sensibilità e (iii) analisi delle proteine a concentrazioni molto basse. Questo nuovo saggio sarà applicabile alla determinazione quantitativa delle proteine in omogenati biologici sia incolori che colorati, compresi quelli ricchi di lipidi (ad esempio, avocado) e quelli difficili da omogeneizzare.
- Materiali e metodi
- Campioni biologici – barbabietole, mirtilli e vino rosso
- Reagenti chimici
- Miglioramenti al test U-1988
- Il test U-2012
- La stima delle interferenze del colore nel test U-2012
- La curva standard e i suoi parametri
- Calcolo del contenuto proteico negli omogenati
- Risultati e discussione
- Miglioramenti nel saggio U-1988
- Stima delle proteine in campioni biologici colorati
- Estrazione delle proteine
- Eliminare le sostanze interferenti
- Le curve standard e i loro parametri
- Contenuto proteico di omogenato colorato
- Riconoscimenti
- Interessi concorrenti
- Dati supplementari
Materiali e metodi
Campioni biologici – barbabietole, mirtilli e vino rosso
Omogenati di barbabietole e mirtilli sono stati preparati come descritto nel Materiale supplementare. Il vino rosso non ha richiesto l’estrazione di proteine prima del test U-2012.
Reagenti chimici
Tutti i reagenti chimici, ad eccezione dell’ipoclorito di sodio e dell’acido perclorico (PCA), sono stati ottenuti da Sigma o Sigma-Aldrich (St Louis, MO. USA). L’ipoclorito di sodio proveniva da Acros Organic, New Jersey, USA. PCA è stato ottenuto da BDH (Inghilterra).
Miglioramenti al test U-1988
Il passaggio dal tampone carbonato a fosfato a pH 12,0 ha migliorato la stabilità del reagente e ha dato un piccolo aumento della sensibilità. L’acetonitrile è stato introdotto per evitare bolle indotte dal detersivo. NaOH ha sostituito KOH per evitare la precipitazione nel test delle proteine. Inoltre, l’efficienza è stata migliorata combinando vari componenti del reagente Lowry in una miscela di reagenti.
Il test U-2012
I dettagli completi del test U-2012 sono forniti in materiale supplementare. Il protocollo, brevemente riassunto nella figura 1, descrive la lavorazione del vino rosso e degli omogenati di barbabietola rossa e mirtillo e include i miglioramenti del saggio U-1988. Il test U-2012 è stato impiegato per proteine non trasformate, trasformate e trasformate (trattamento H2O2 seguito da precipitazione TCA o PCA). Sono stati effettuati saggi su BSA, anidrasi carbonica, citocromo C, isocitrato deidrogenasi, lisozima e tripsina per lo sviluppo di curve standard e in campioni biologici colorati. La determinazione delle proteine nei campioni biologici è stata effettuata calibrando le curve standard appropriate.
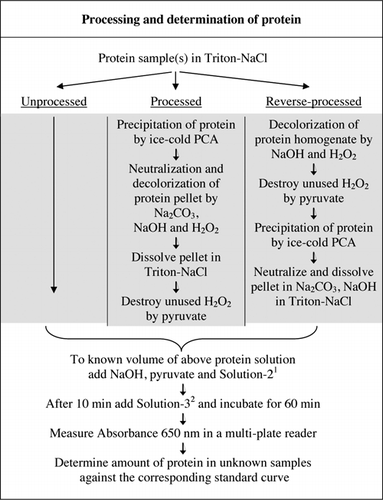
1Solution-2 conteneva solfato di rame (CuSO4.5H2O), Na-K-Tartrato, SDS e acetonitrile in tampone fosfato da 100 mm (pH 12,0). 2Per la soluzione-3, il reagente fenolico di Folin-Ciocalteu è stato diluito 1:1 con acqua deionizzata appena prima dell’uso.
La stima delle interferenze del colore nel test U-2012
L’interferenza del colore è stata determinata confrontando l’assorbenza da campioni di barbabietola rossa, mirtillo e vino rosso trasformati e non trasformati sia con che senza l’uso del reagente di Folin come descritto nella Figura 1. Il rapporto è stato utilizzato per stabilire l’entità dell’interferenza, dove Abs1 è l’assorbanza dei campioni non trasformati con il reagente di Folin; Abs2 è l’assorbanza dei campioni non trasformati senza il reagente di Folin; Abs3 è l’assorbanza dei campioni elaborati con il reagente di Folin; e Abs4 è l’assorbanza dei campioni elaborati senza il reagente di Folin.
La curva standard e i suoi parametri
Soluzione-1B e 1C descritti nella sezione Ricette del materiale supplementare allegato sono stati utilizzati per lo sviluppo delle curve standard. La concentrazione di BSA e i corrispondenti valori di assorbanza sono stati tracciati utilizzando un grafico a dispersione XY. La forma di questo grafico (Figura 2) mostra una risposta di saturazione a concentrazioni più elevate con una risposta lineare iniziale molto limitata. Questa era una forma curva preferita riportata in precedenza (20). Inizialmente questo è stato modellato utilizzando una forma esponenziale (19), ma studi successivi hanno dimostrato che un’iperbole rettangolare ha dato un migliore allineamento con la risposta, in particolare a concentrazioni più basse. Quest’ultima forma è stata ora standardizzata e la seguente equazione a tre parametri è stata utilizzata per descrivere la relazione concentrazione assorbanza-proteina:

Conc = concentrazione di Proteine,
A = Assorbanza a Conc,
A0 = Assorbanza a concentrazione zero,
AM= Assorbanza a max concentrazione,
C50= Concentrazione dando assorbanza
(AM + A0)/2.
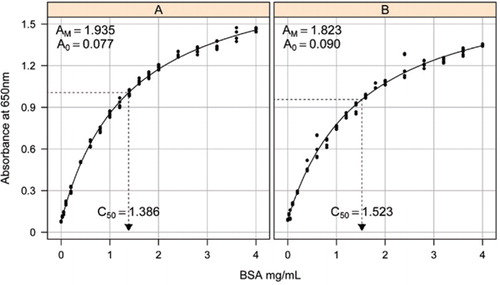
La stima della curva standard tra l’assorbanza (650 nm) e le concentrazioni della proteina BSA è stata effettuata su tre repliche tecniche per (A) il test della proteina non trasformata (parametri A0= 0,077, Am=1,935, C50=1.386), e B) il test delle proteine trasformate (parametri A0=0,90, Am=1,823, C50=1,523). Un modello di iperbole rettangolare (equazione ) è stato montato sui dati osservati. Le stime dei parametri sono identificate nelle curve con la stima C50 sull’asse x (linea nera tratteggiata).
Il parametro A0 è stato determinato sperimentalmente mentre AM e C50 sono stati stimati utilizzando la funzione di risolutore aggiuntivo Toolbox di Microsoft Excel. Un set di prova di parametri è stato utilizzato per calcolare l’assorbanza modellata a ciascuna delle concentrazioni standard (Conc) utilizzando l’equazione . Il risolutore è stato quindi comandato di ridurre al minimo la deviazione standard residua tra l’assorbanza misurata e modellata per il set standard regolando AM e C50.
Abbiamo osservato la relazione tra assorbanza e concentrazione per mostrare una curva non lineare sull’intero intervallo di concentrazione, che è probabilmente dovuta a una componente di dispersione della luce che aumenta all’aumentare della concentrazione di proteine quando si misura l’assorbanza. Uno scarso adattamento lineare a bassa assorbanza è stato riportato anche da Coakley e James (20).
Calcolo del contenuto proteico negli omogenati
Sono stati effettuati saggi su vino rosso trasformato e non trasformato e omogenati di barbabietola rossa e mirtillo. BSA e altri campioni di proteine sono stati trattati in modo identico per curve standard appropriate per determinare i valori A0, AM e C50. Questi parametri sono stati quindi utilizzati per convertire l’assorbanza del campione (A) in concentrazione proteica in ciascun omogeneizzato utilizzando:

Poiché l’equazione ha una forma di saturazione, la sensibilità si riduce come assorbanza (A), e quindi la concentrazione, aumenta. Gli errori nelle stime delle proteine possono essere ridotti al minimo regolando le concentrazioni di omogenati nel saggio in modo che non superino eccessivamente il valore C50.
Il valore di Conc omogeneizzato è stato quindi convertito in concentrazione di proteine tissutali (Conc tissutale in mg/g di tessuto) utilizzando la seguente formula:

dove l’omogenato Conc (in mg di proteina/mL) è stato corretto per qualsiasi preconcentrazione o diluizione durante il saggio. La percentuale di omogeneizzato era di 100 g di tessuto omogeneizzato ad un volume totale di 200 mL (nel nostro caso 50%).
In uno studio separato, un modello iperbole rettangolare è stato montato utilizzando il pacchetto non linear mixed effects (NLME) (21) in R (22) (Figura 2). Ogni soluzione BSA, realizzata indipendentemente in laboratorio, è stata modellata come un effetto casuale, con un comune A0 ma diversi coefficienti AM e C50. Ciò modella la gerarchia delle repliche biologiche del campione e delle repliche tecniche del saggio.
Risultati e discussione
Miglioramenti nel saggio U-1988
La limitazione del saggio U-1988 e di Lowry è l’instabilità del reagente a base di carbonato. Il tampone carbonato (pH 11,4 al 2% = 188,7 mM) nell’U-1988 è stato sostituito con fosfato da 40 mm a valori di pH compresi tra 11,4 e 12,5. Sono state calcolate pendenze iniziali dalle curve standard del test proteico con BSA a 0,5 mg BSA/ mL e 1,0 mg BSA / mL. Le pendenze iniziali con tamponi di fosfato a pH 11.4 e al suo pH ottimale 12.0 erano 99 x10-6 e 197 x10-6rispettivamente. La pendenza per il tampone carbonato (pH 11,4) era 162 x10-6.Poiché il valore di pendenza è un’indicazione diretta della sensibilità del saggio, tampone fosfato (pH 12.0) è stato scelto per sostituire il tampone carbonato, dando un aumento del 25% della sensibilità.
Una maggiore stabilità è stata ottenuta aumentando la concentrazione del tampone fosfato a 100 mm. La soluzione risultante di fosfato/CuSO4/Na-K-tartrato è rimasta stabile a temperatura ambiente per due settimane, considerevolmente più a lungo della soluzione di carbonato/CuSO4/Na-K-tartrato, che deve essere preparata giornalmente prima del dosaggio delle proteine. Per tutti gli esperimenti futuri, è stato utilizzato 100 mm di fosfato (pH 12,0) per preparare la soluzione di CuSO4/Na-K-tartrato. Crediamo che la sostituzione del carbonato con il fosfato migliorerà la convenienza dell’analisi U-2012.
Le bolle indotte dal detersivo diventano una delle principali fonti di errore nelle misurazioni dell’assorbanza quando si utilizza un lettore di piastre multi-well (non un problema con le cuvette). Queste bolle sono state notevolmente ridotte con l’aggiunta di una serie di solventi polari (ad esempio, acetone, acetonitrile, etanolo e metanolo). L’acetonitrile, il più polare di questi solventi (23) è stato scelto per la sua efficacia e incluso nella Soluzione-2 (vedi Figura 1 didascalia e sezione Ricette di materiale supplementare).
Tampone fosfato, CuSO4, Na-K-tartrato, SDS e acetonitrile possono essere aggiunti singolarmente e l’ordine della loro aggiunta non influisce sull’assorbanza risultante. Tuttavia, l’uso di una soluzione premiscelata aumenta ulteriormente la praticità, specialmente quando si devono analizzare un gran numero di campioni. Abbiamo quindi raggruppato questi componenti della miscela di dosaggio in Soluzione-2 (Figura 1). Tale soluzione premiscelata non era realizzabile per il saggio originale di Lowry (6) a causa dell’instabilità della soluzione di carbonato. Il tentativo di includere la Soluzione-3 nella Soluzione-2 ha comportato una drastica riduzione dello sviluppo del colore blu e non è stato considerato ulteriormente.
Stima delle proteine in campioni biologici colorati
Estrazione delle proteine
Le proteine di barbabietola e mirtillo sono state estratte in soluzione Triton X-100-NaCl con omogeneizzazione lieve. Tali omogenati mantengono le loro attività enzimatiche (15). Questa estrazione non era necessaria per il vino rosso.
Eliminare le sostanze interferenti
Per i campioni colorati è necessario rimuovere l’interferenza dovuta al colore intrinseco del campione e ad altre sostanze non proteiche che reagiscono con i reagenti proteici prima del test proteico colorimetrico. La novità di U-2012 sta nell’ideare un protocollo decolorante compatibile con un test proteico colorimetrico.
La decolorazione di pigmenti colorati da ipoclorito di sodio o H2O2 e la precipitazione selettiva di proteine da parte di PCA o TCA sono state prese in considerazione per la rimozione di sostanze interferenti. Ipoclorito di sodio, H2O2, TCA e PCA sono stati valutati per la loro compatibilità con il test U-2012 utilizzando BSA come proteina di prova. Tra ipoclorito di sodio e H2O2, solo H2O2 era compatibile in quanto si formava un precipitato in presenza di ipoclorito. Le proteine precipitate da TCA o PCA possono essere analizzate da U-2012 dopo un’adeguata neutralizzazione dell’acido residuo nel pellet. È stata riportata la superiorità del PCA rispetto al TCA per la precipitazione delle proteine (24,25). Al contrario, nella nostra valutazione comparativa, ha rivelato valori simili C50 per PCA (1.395) e TCA (1.400). Abbiamo preferito PCA perché è facilmente disponibile come soluzione pre-made (70% v / v) e quindi facilmente diluito alla forza richiesta. TCA è un solido igroscopico difficile da pesare con precisione a causa del suo contenuto di acqua variabile.
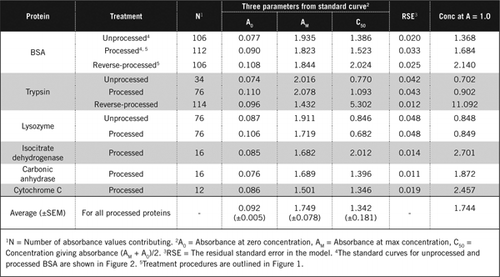
Esistono due modi possibili per combinare PCA e H2O2. Per le proteine ” trasformate “il trattamento con PCA è stato seguito da un trattamento con H2O2 e per le proteine” trasformate”, il trattamento con H2O2 ha preceduto la precipitazione con PCA. I vantaggi dell’utilizzo della proteina “processata” sono stati la rimozione di un certo numero di sostanze interferenti nel surnatante e la possibile inattivazione degli enzimi proteolitici durante la preparazione del campione. Ciò è stato confermato dall’analisi della tripsina e della BSA trattate e inverse (vedere Tabella 1). Sono stati utilizzati solo campioni elaborati per determinare il contenuto proteico effettivo dei campioni biologici colorati
Entrambi i trattamenti PCA e H2O2 di campioni colorati erano necessari per l’eliminazione delle interferenze nel test U-2012. La sola precipitazione acida dei campioni colorati non ha rimosso completamente l’interferenza. Con tutti i campioni colorati, un po ‘ di colore è stato scartato nel surnatante, ma anche i pellet sono stati colorati. Il colore è stato eliminato dal pellet mediante trattamento H2O2. Sono state necessarie condizioni alcaline sia per un’efficace decolorazione da parte di H2O2 (26) sia per lo sviluppo del colore da parte del reagente di Folin per garantire che i livelli di proteine siano misurati correttamente. Sebbene sia NaOH che KOH potessero fornire l’alcalinità richiesta, solo NaOH era compatibile con il test U-2012. Un precipitato si è formato in presenza di KOH. Nel pellet, il PCA è stato neutralizzato usando Na2CO3 e NaOH (27). Durante il saggio è stato aggiunto NaOH aggiuntivo; il volume ottimizzato è stato compreso tra 50 e 70 µL (60 µL sono stati usati di routine); vedere Figura 1.
Barbabietola, mirtillo e vino rosso sono stati decolorati con 15 µL di 30% H2O2 assumendo 0,5 e 2 h a 50°C e temperatura ambiente, rispettivamente. Venti microlitri del 30% di H2O2 per 1 h a 50°C sono stati utilizzati per far fronte a campioni colorati più forti. L’ossidazione di sostanze come gli zuccheri legati alle proteine da H2O2 a 50°C sembra critica in quanto l’elaborazione a temperatura ambiente sovrastima il contenuto proteico. Nel caso della barbabietola rossa, la lavorazione a 50°C ha ridotto la stima apparente delle proteine al 14% della non trasformata, mentre la lavorazione a temperatura ambiente ha solo dimezzato tale stima.
Dai test colorimetrici effettuati dopo il trattamento con perossido di idrogeno è emerso che alcuni H2O2 non sono stati utilizzati nella decolorazione. In tale campione, il colore finale del test di Lowry è stato parzialmente distrutto. Era quindi necessario distruggere il perossido di idrogeno rimanente prima del dosaggio delle proteine. Ci sono due fonti di H2O2 nel saggio U-2012; H2O2 aggiunto per la decolorazione e H2O2 presente come contaminante nel Triton X-100 (0,22%, Informazioni sul prodotto: Triton X-100, www.sigmaaldrich.com). Il perossido di idrogeno è comunemente degradato dall’enzima catalasi. Tuttavia, l’elevato pH del saggio proteico inattiverebbe le catalasi note. Inoltre, l’aggiunta di catalasi porterebbe all’aggiunta di proteine extra. Abbiamo scelto la distruzione chimica di H2O2 usando il piruvato (28). La chimica dell’equazione di interazione piruvato-H2O2 è ben stabilita (28,29). Il piruvato distrugge H2O2 a temperatura ambiente secondo la seguente reazione:

L’H2O2 residuo nella sospensione del pellet è stato distrutto trattando con 0,9 M di piruvato (concentrazione 1,5 x di H2O2) per 0,5 h a temperatura ambiente. Per contrastare l’H2O2 contaminante in Triton X-100, è stato aggiunto anche piruvato extra nel test delle proteine (Figura 1). L’aggiunta di piruvato ha dato una minore assorbanza per un bianco non proteico . Suggeriamo che il contaminante del perossido in Triton X-100 reagisca con l’acetonitrile in Soluzione-2, dando un’assorbenza leggermente superiore.
L’interferenza del colore associata ai campioni biologici colorati non può essere semplicemente presa in considerazione eseguendo un test proteico in assenza del reagente di Folin. I rapporti calcolati (Abs1-Abs2) / (Abs3-Abs4) indicavano che l’interferenza del colore del campione era la più alta per il vino rosso (=40) e minore per il mirtillo (=6) e la barbabietola rossa (=2). Questa interferenza si è tradotta nelle stime anormalmente elevate dei veri livelli proteici; ad esempio, la concentrazione di proteine utilizzando omogenati di barbabietola non trasformati e trasformati (20,21 contro 2,89 mg di proteine / g di tessuto, rispettivamente). Oltre all’interferenza del colore, è probabile che il vino rosso e gli omogenati di barbabietola e mirtillo contengano sostanze che reagiranno con il reagente di Folin nel test U-2012 (e.g., piccoli peptidi e zuccheri complessi). Questi sono stati rimossi precipitando selettivamente le proteine con PCA ghiacciata ad una concentrazione finale del 5% (Figura 1).
Le curve standard e i loro parametri
Le curve standard per BSA non elaborate e elaborate sono mostrate nella Figura 2. I parametri derivati (A0, AM e C50) sono anche elencati nella Tabella 1 per BSA e altre proteine.
I risultati mostrano che l’errore standard residuo nel modello è basso (da 0,012 a 0,048) che indica la migliore adattamento dei dati all’andamento dell’iperbole rettangolare. Per confrontare le informazioni tra le varie proteine e la loro elaborazione, i parametri sono stati convertiti nella concentrazione per assorbanza = 1,0 a 650 nm (colonna di destra nella tabella 1).
Questi risultati mostrano che la perdita di proteine (rispetto alle proteine non trasformate) nei campioni trattati era inferiore ai campioni trattati al contrario. Questa perdita era più evidente nel caso della tripsina e può essere spiegata sulla base della sua attività auto-catalitica durante l’elaborazione inversa. Raccomandiamo di seguire il protocollo “processato” (Materiale supplementare) solo per campioni biologici che possono contenere enzimi proteolitici.
Nel test originale di Lowry (6) e nella sua versione modificata U-1988 (15), solo la porzione lineare della curva standard ottenuta tracciando l’assorbanza rispetto alla quantità di proteine è stata utilizzata nella determinazione quantitativa della proteina. Nel test U-2012 utilizziamo i dati in modo più efficace adattando un’equazione iperbolica rettangolare come descritto nella sezione Materiali e metodi in linea con Coakley e James (20).
Contenuto proteico di omogenato colorato
Le concentrazioni proteiche in campioni sconosciuti sono state calcolate mediante equazione e confrontate con lo standard BSA elaborato e con la media di tutte le proteine trasformate elencate nella Tabella 1. Quest’ultimo sarà più vicino a una vera stima per i campioni biologici che contengono una miscela di proteine. Abbiamo stimato le quantità di proteine nel mirtillo e nella barbabietola rispetto al vino rosso rispettivamente di circa 60 e 230 volte (Tabella 2).
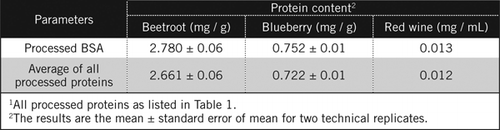
Come il BSA, il vino rosso e gli omogenati al 50% di barbabietola e mirtillo sono stati trasformati mediante precipitazione PCA e decolorazione da parte di H2O2 (Figura 1). In questa fase i campioni biologici sono stati concentrati 40 volte per il vino rosso e 4 volte per barbabietola e mirtillo. Allo stesso modo BSA (2 mg/mL) è stato anche concentrato 4 volte a 8 mg/mL. L’assorbanza dei campioni colorati che era vicino all’assorbanza per C50 (per BSA non trasformati) è stata utilizzata per calcolare il contenuto proteico, come descritto dall’equazione e .
In conclusione, il test U-2012 ha impiegato reagenti stabili, ha fornito una migliore sensibilità (anche per campioni biologici incolori) e ha superato le interferenze indotte dal colore per i campioni biologici colorati. Il test U-2012 non è vincolato alla porzione lineare della risposta tra concentrazione proteica e assorbanza e rende più efficiente l’uso dei dati nella regione non lineare attraverso un modello di curva iperbolica rettangolare adattato agli standard utilizzando semplici procedure all’interno di Microsoft Excel.
Riconoscimenti
Gli autori riconoscono la Fondazione per la Ricerca, Scienza e Tecnologia Nuova Zelanda per il sostegno finanziario (C06X0809).
Interessi concorrenti
Gli autori non dichiarano interessi concorrenti.
Dati supplementari
Per visualizzare i dati supplementari che accompagnano questo documento si prega di visitare il sito web della rivista all’indirizzo: www.future-science.com/doi/suppl/10.2144/000113818
- 1. Kaplan, R. S. e P. L. Pedersen. 1985. Determinazione delle quantità di microgrammi di proteine in presenza di livelli di milligrammo di lipidi con acido nero 10B.Anal. Biochimica. 150:97–104.Crossref, Medline, CAS, Google Scholar
- 2. Gornall, A. G., C. J. Bardawill, e M. M. David. 1949. Determinazione delle proteine sieriche mediante la reazione del biureto. J. Biol. Chimica. 177:751–766.Medline, CAS, Google Scholar
- 3. Smith, P. K., R. I. Krohn, G. T. Hermanson, A. K. Mallia, F. H. Gartner, M. D. Provenzano, E. K. Fujimoto, N. M. Goeke, et al.. 1985. Misurazione delle proteine con acido bicinchoninico. Anale. Biochimica. 150:76–85.Crossref, Medline, CAS, Google Scholar
- 4. Bradford, M. M. 1976. Un metodo rapido e sensibile per la quantificazione delle quantità di microgrammi di proteine utilizzando il principio del legame proteina-colorante. Anale. Biochimica. 72:248–254.Crossref, Medline, CAS, Google Scholar
- 5. Zor, T. e Z. Selinger. 1996. La linearizzazione del test della proteina di Bradford aumenta la sua sensibilità: studi teorici e sperimentali. Anale. Biochimica. 236:302–308.Crossref, Medline, CAS, Google Scholar
- 6. Il sito utilizza cookie tecnici e di terze parti. 1951. Misurazione delle proteine con il reagente fenolo Folin. J. Biol. Chimica. 193:265–275.Medline, CAS, Google Scholar
- 7. Peterson, G. L. 1979. Revisione del metodo di quantificazione della proteina fenolica di folin di Lowry, Rosebrough, Farr e Randall. Anale. Biochimica. 100:201–220.Crossref, Medline, CAS, Google Scholar
- 8. Sapan, C. V., R. L. Lundablad, e N. C. Prezzo. 1999. Tecniche di analisi colorimetrica delle proteine. Biotecnologia. Appl. Biochimica. 29:99–108.Medline, CAS, Google Scholar
- 9. Okutucu, B., A. Dınçer, Ö. Habib, e F. Zıhnıoglu. 2007. Confronto di cinque metodi per la determinazione della concentrazione totale di proteine plasmatiche. J. Biochem. Biophys. Metodi 70: 709-711.Crossref, Medline, CAS, Google Scholar
- 10. Il sito utilizza cookie tecnici e di terze parti. 2005. Il documento più citato nella storia dell’editoria: determinazione delle proteine di Oliver H. Lowry. J. Biol. Chimica. 25:280.Google Scholar
- 11. Il sito utilizza cookie tecnici e cookie di profilazione di terze parti. 2010. Studio approfondito della reattività di varie classi di composti verso il reagente Folin-Ciocalteu. J. Agric. Chimica alimentare. 58:8139–8144.Crossref, Medline, CAS, Google Scholar
- 12. Eichberg, J. e L. C. Mokrasch. 1969. Interferenza dei lipidi ossidati nella determinazione delle proteine mediante la procedura di Lowry. Anale. Biochimica. 30:386–390.Crossref, Medline, CAS, Google Scholar
- 13. Dulley, J. R. e P. A. si addolorano. 1975. Una semplice tecnica per eliminare l’interferenza dei detergenti nel metodo Lowry di determinazione delle proteine. Anale. Biochimica. 64:136–141.Crossref, Medline, CAS, Google Scholar
- 14. Brillouet, J.-M., M.-P. Belleville, e M. Moutounet. 1991. Possibili complessi proteico-polisaccaridici nei vini rossi. Essere. J. Enol. Vitic. 42:150–152.CAS, Google Scholar
- 15. Upreti, G. C., R. A. Ratcliff, e P. C. Riches. 1988. Stima delle proteine nei tessuti contenenti alti livelli di lipidi: modificazioni del metodo di determinazione delle proteine di Lowry. Anale. Biochimica. 168:421–427.Crossref, Medline, CAS, Google Scholar
- 16. Upreti, G. C., C. Davis, e J. Oliver. 1991. Preparazione di omogenati rappresentativi di tessuti biologici: effetto del sale sull’estrazione di proteine. Anale. Biochimica. 198:298–301.Crossref, Medline, CAS, Google Scholar
- 17. Smith, M. R., M. H. Penner, SE Bennett, e A. T. Bakalinsky. 2011. Dosaggio Colorimetrico Quantitativo per Proteine Totali applicate al Vino Rosso Pinot Nero. J. Agric. Chimica alimentare. 59:6871–6876.Crossref, Medline, CAS, Google Scholar
- 18. Wigand, P., S. Tenzer, H. Schild, e H. Decker. 2009. Analisi della composizione proteica del vino rosso rispetto ai vini rosati e bianchi mediante elettroforesi e cromatografia liquida ad alta pressione-Spettrometria di massa (HPLC-MS). J. Agric. Chimica alimentare. 57:4328–4333.Crossref, Medline, CAS, Google Scholar
- 19. Il sito utilizza cookie tecnici e di terze parti. 2009. Un saggio di proteine stabile e sensibile (saggio modificato U-2009) per campioni biologici colorati. ComBiol., Programma finale della Nuova Zelanda dicembre 2009. Università di Canterbury, Christchurch, Nuova Zelanda.Google Scholar
- 20. E ‘ il primo album in studio del gruppo. 1978. Una semplice trasformazione lineare per la curva di calibrazione della proteina Folin-Lowry a 1,0 mg / ml. Anale. Biochimica. 85:90–97.Crossref, Medline, CAS, Google Scholar
- 21. Pinheiro, J. C. e D. M. Bates. 2000. Modelli a effetti misti in S e S-PLUS, statistiche e serie di calcolo. La nostra azienda si occupa diGoogle Scholar
- 22. R Team di sviluppo di base. 2009. R: Un linguaggio e un ambiente per il calcolo statistico. R Foundation for Statistical Computing, Vienna, Austria, ISBN 3-900051-07-0, URLhttp://www.R-project.org.Google Scholar
- 23. Il suo nome deriva dal greco antico, che significa “terra”, “terra”, “terra”, “terra”, “terra”, “terra”, “terra”, “terra”, “terra”, “terra” e “terra”. Solco. 1988. Artefatti cromatografici liquidi e distorsione di picco: interazione campione-solvente nella separazione dei carotenoidi. Anale. Chimica. 60:807–811.Crossref, Medline, CAS, Google Scholar
- 24. Cernik, A. A. 1970. Determinazione del piombo chelato con acido etilendiamminotetra-acetico nel sangue dopo precipitazione di proteine con acido perclorico. Brit. J. Industria Med. 27:40–42.Medline, CAS, Google Scholar
- 25. Il sito utilizza cookie tecnici e di terze parti. 1990. Acidi perclorici e tricloroacetici come precipitanti di proteine in digesta ileale endogeno dal ratto. J. Sic. Cibo Agric. 52:13–21.Crossref, CAS, Google Scholar
- 26. Galbács, Z. M. e L. J. Csányi. 1983. Decomposizione indotta da alcali del perossido di idrogeno. J. Chem. Soc., Dalton Trans. 11:2353–2357.Crossref, Google Scholar
- 27. Scopes, R. K. 1988. Purificazione delle proteine: Principi e pratica, Seconda Ed. Benvenuti nel nostro sito- A New York, a New York.Google Scholar
- 28. Il suo nome deriva da quello di un uomo, un uomo, un uomo, un uomo, un uomo, un uomo, un uomo, un uomo, un uomo, un uomo e una donna. 1998. Studi sull’attività aromatica dell’amminoacido ossidasi negli spermatozoi ram: ruolo del piruvato come antiossidante. Anim. Reprod. Sic. 51:275–287.Crossref, Medline, CAS, Google Scholar
- 29. Holleman, M. A. F. 1904. Notice sur l’action de l’eau oxygenee sur les acids α-cetoniques et sur les dicetones 1.2. Recl. Trav. Chim. Pays-Bas Belg. 23:169–172.Crossref, CAS, Google Scholar