Las medidas cuantitativas de rasgos fisiológicos como la actividad enzimática a menudo se expresan como unidades de actividad por miligramo de proteína. Aunque se han desarrollado numerosos ensayos para medir el contenido de proteínas, incluidos los ensayos colorimétricos de Amido Negro (1), Biuret (2), Ácido Biciconínico (3) y Azul de Coomassie (4,5), el ensayo Lowry (6) o sus modificaciones (7,8) se utilizan más comúnmente que otros ensayos (9). El ensayo Lowry es simple, sensible y preciso, y es el procedimiento más citado (10) para la determinación cuantitativa de proteínas.
Una amplia variedad de compuestos que reaccionan con el reactivo de fenol de Folin-Ciocalteu (11) son una fuente de interferencia potencial en los ensayos de proteínas Lowry y Lowry modificadas. Afortunadamente, las correcciones a través de un espacio en blanco adecuado son suficientes para la mayoría de los compuestos (6,7), excepto los lípidos (12), los detergentes (13) y las sustancias coloreadas (14). Las dificultades en el análisis de proteínas en presencia de lípidos y detergentes (utilizados en la solubilización de tejido adiposo, mielina y músculos esqueléticos) se superaron con el ensayo Lowry modificado (15; referido en este artículo como el ensayo U-1988, 16). La interferencia del color en la determinación del contenido de proteínas en el vino tinto (14,17,18) se superó mediante el empleo de una amplia cromatografía. El enfoque anterior es engorroso y no es muy práctico para manipular grandes cantidades de muestras. Ninguno de los ensayos de proteínas conocidos fue adecuado para medir proteínas en muestras biológicas coloreadas, p. ej. frutas y verduras de colores, vino tinto, microbios pigmentados y bilis de rumiantes.
Nuestro desarrollo del ensayo U-2012 a partir de sus predecesores el ensayo U-1988 y el ensayo Lowry ha logrado tres ventajas principales (i) conveniencia a través de la estabilidad de las formulaciones de reactivos, (ii) medición de proteínas en muestras biológicas incoloras y coloreadas sin comprometer la sensibilidad, y (iii) análisis de proteínas a concentraciones muy bajas. Este novedoso ensayo será aplicable a la determinación cuantitativa de proteínas en homogeneizados de muestras biológicas incoloras y coloreadas, incluidas las ricas en lípidos (por ejemplo, aguacate) y las difíciles de homogeneizar.
- Materiales y métodos
- Muestras biológicas-remolacha, arándano y vino tinto
- Reactivos químicos
- Mejoras en el ensayo U-1988
- El ensayo U-2012
- La estimación de las interferencias de color en el ensayo U-2012
- La curva estándar y sus parámetros
- Cálculo del contenido de proteínas en los ensayos de homogeneizados
- Resultados y discusión
- Mejoras en el ensayo U-1988
- Estimación de proteínas en muestras biológicas coloreadas
- Extracción de proteínas
- Eliminar sustancias interferentes
- Curvas estándar y sus parámetros
- El contenido de proteína de homogeneizado coloreado
- Agradecimientos
- intereses contrapuestos
- Datos complementarios
Materiales y métodos
Muestras biológicas-remolacha, arándano y vino tinto
Se prepararon homogeneizados de remolacha y arándano como se describe en el Material Suplementario. El vino tinto no requería extracción de proteínas antes del ensayo U-2012.
Reactivos químicos
Todos los reactivos químicos, excepto el hipoclorito de sodio y el ácido perclórico (PCA), se obtuvieron de Sigma o Sigma-Aldrich (St Louis, MO. USA). El hipoclorito de sodio era de Acros Organic, Nueva Jersey, EE.UU. El PCA se obtuvo de BDH (Inglaterra).
Mejoras en el ensayo U-1988
El cambio de carbonato a tampón de fosfato a pH 12.0 mejoró la estabilidad del reactivo y dio un pequeño aumento en la sensibilidad. Se introdujo acetonitrilo para evitar burbujas inducidas por detergentes. NaOH reemplazó a KOH para evitar la precipitación en el ensayo de proteínas. Además, se mejoró la eficiencia combinando varios componentes del reactivo Lowry en una sola mezcla de reactivos.
El ensayo U-2012
Los detalles completos del ensayo U-2012 se proporcionan en el material complementario. El protocolo, resumido brevemente en la Figura 1, describe el procesamiento del vino tinto y los homogeneizados de remolacha y arándano, e incluye las mejoras del ensayo U-1988. El ensayo U-2012 se empleó para proteínas sin procesar, procesadas y procesadas a la inversa (tratamiento de H2O2 seguido de precipitación de TCA o PCA). Se realizaron ensayos con ASC, anhidrasa carbónica, citocromo C, isocitrato deshidrogenasa, lisozima y tripsina para el desarrollo de curvas estándar y en muestras biológicas coloreadas. La determinación de proteínas en las muestras biológicas se llevó a cabo calibrando las curvas estándar apropiadas.
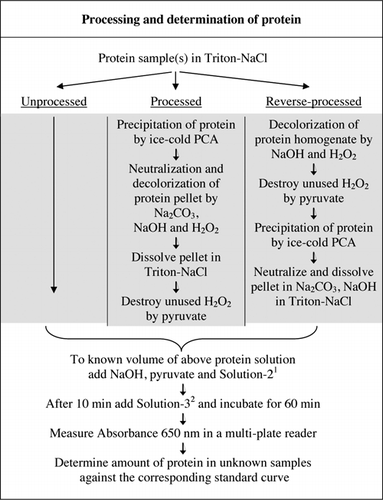
1Solution-2 contenía sulfato de cobre (CuSO4. 5H2O), Na-K-Tartrato, SDS y acetonitrilo en tampón de fosfato de 100 mM (pH 12,0). 2Para la solución-3, se diluyó el reactivo fenólico de Folin-Ciocalteu 1:1 con agua desionizada justo antes de su uso.
La estimación de las interferencias de color en el ensayo U-2012
se determinó comparando la absorbencia de muestras de remolacha, arándano y vino tinto procesadas y no procesadas, con y sin el uso de reactivo de Folin, como se describe en la Figura 1. La relación se utilizó para establecer el grado de interferencia, donde Abs1 es absorbancia de muestras sin procesar con el reactivo de Folin; Abs2 es absorbancia de muestras sin procesar sin el reactivo de Folin; Abs3 es absorbancia de muestras procesadas con el reactivo de Folin; y Abs4 es la absorbancia de muestras procesadas sin reactivo de Folin.
La curva estándar y sus parámetros
Solución-1B y 1C descritas en la sección Recetas del Material Suplementario adjunto se utilizaron para el desarrollo de las curvas estándar. La concentración de ASC y los valores de absorbancia correspondientes se trazaron utilizando un gráfico de dispersión X-Y. La forma de este gráfico (Figura 2) muestra una respuesta saturante a concentraciones más altas con una respuesta lineal inicial muy limitada. Esta era una forma de curva preferida notificada anteriormente (20). Inicialmente, esto se modeló usando una forma exponencial (19), pero estudios posteriores mostraron que una hipérbola rectangular daba una mejor alineación con la respuesta, particularmente a concentraciones más bajas. Esta última forma se ha estandarizado y se utilizó la siguiente ecuación de tres parámetros para describir la relación absorbancia-concentración de proteínas:

Conc = concentración de Proteína,
A = Absorbancia a Conc,
A0 = Absorbancia concentración cero,
AM= Absorbancia en el máximo de concentración,
C50= Concentración de dar la absorbancia
(AM + A0)/2.
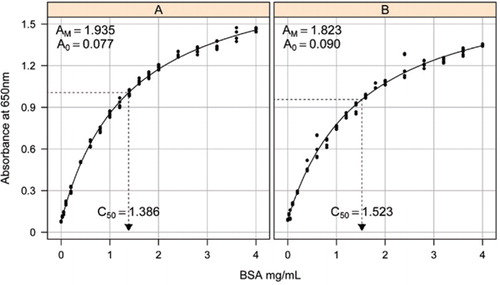
La estimación de la curva estándar entre la absorbancia (650 nm) y las concentraciones de proteína BSA se realizó en tres réplicas técnicas para (A) el ensayo de proteínas sin procesar (parámetros A0= 0.077, Am=1.935, C50=1).386), y (B) el ensayo de proteínas procesadas (parámetros A0=0,90, Am=1,823, C50=1,523). Se ajustó un modelo de hipérbola rectangular (ecuación ) a los datos observados. Las estimaciones de parámetros se identifican en las curvas con la estimación C50 en el eje x (línea negra punteada).
El parámetro A0 se determinó experimentalmente, mientras que AM y C50 se estimaron utilizando la función Solucionador de complementos Toolbox de Microsoft Excel. Se utilizó un conjunto de parámetros de ensayo para calcular la absorbancia modelada en cada una de las concentraciones estándar (Conc) utilizando la ecuación . A continuación, se ordenó al solucionador minimizar la desviación estándar residual entre la absorbancia medida y modelada para el conjunto estándar ajustando AM y C50.
Observamos que la relación entre absorbancia y concentración muestra una curva no lineal en todo el rango de concentración, lo que probablemente se deba a un componente de dispersión de luz que aumenta a medida que aumenta la concentración de proteínas al medir la absorbancia. Coakley y James también informaron de un ajuste lineal deficiente a baja absorbancia (20).
Cálculo del contenido de proteínas en los ensayos de homogeneizados
se llevaron a cabo en vino tinto procesado y no procesado y homogeneizados de remolacha y arándano. El ASC y otras muestras de proteínas se trataron de forma idéntica para obtener curvas estándar apropiadas para determinar los valores de A0, AM y C50. Estos parámetros se utilizaron para convertir la absorbancia de la muestra (A) en concentración de proteínas en cada homogeneizado utilizando:

Debido a que la ecuación tiene una forma saturante, la sensibilidad se reduce a medida que aumenta la absorbancia (A) y, por lo tanto, la concentración. Los errores en las estimaciones de proteínas pueden minimizarse ajustando las concentraciones de homogeneizados en el ensayo para que no excedan excesivamente el valor de C50.
El valor de Conc Homogeneizado se convirtió luego en concentración de proteína tisular (Conc tisular en mg/g de tejido) utilizando la siguiente fórmula:

cuando se haya corregido el Conc de homogeneizado (en mg de proteína/ml) en función de cualquier preconcentración o dilución durante el ensayo. El porcentaje de homogeneización fue de 100 g de tejido homogeneizado hasta un volumen total de 200 mL (en nuestro caso 50%).
En un estudio separado, se ajustó un modelo hipérbola rectangular utilizando el paquete de efectos mixtos no lineales (NLME) (21) en R (22) (Figura 2). Cada solución de ASC, hecha de forma independiente en el laboratorio, se modeló como un efecto aleatorio, con un coeficiente A0 común pero diferente de AM y C50. Esto modela la jerarquía de réplicas de muestras biológicas y réplicas de ensayos técnicos.
Resultados y discusión
Mejoras en el ensayo U-1988
La limitación del ensayo U-1988 y el ensayo Lowry es la inestabilidad del reactivo a base de carbonatos. El tampón de carbonatos (pH 11,4 al 2% = 188,7 mm) en U-1988 fue reemplazado por fosfato de 40 mM a valores de pH que oscilaban entre 11,4 y 12,5. Se calcularon las pendientes iniciales de las curvas estándar del ensayo de proteínas utilizando ASC a 0,5 mg de ASC/ ml y 1,0 mg de ASC / ml. Las pendientes iniciales con tampones de fosfato a pH 11,4 y a su pH óptimo 12,0 fueron 99 x10-6 y 197 x10-6 respectivamente. La pendiente del tampón de carbonatos (pH 11,4) fue de 162 x10-6.Dado que el valor de la pendiente es una indicación directa de la sensibilidad del ensayo, tampón de fosfato (pH 12.0) se eligió para reemplazar el tampón de carbonatos, dando un aumento del 25% en la sensibilidad.
Se logró una mayor estabilidad aumentando la concentración del tampón de fosfato a 100 mm. La solución de fosfato/CuSO4/Na-K-tartrato resultante fue estable a temperatura ambiente durante dos semanas, considerablemente más que la solución de carbonato/CuSO4/Na-K-tartrato, que debe prepararse diariamente antes del ensayo de proteínas. Para todos los experimentos futuros, se utilizó fosfato de 100 mM (pH 12,0)para preparar la solución de tartrato de CuSO4 / Na-K. Creemos que la sustitución de carbonato por fosfato mejorará la conveniencia del ensayo U-2012.
Las burbujas inducidas por detergentes se convierten en una fuente importante de error en las mediciones de absorbancia cuando se utiliza un lector de placas de múltiples pocillos (no es un problema con las cubetas). Estas burbujas se redujeron considerablemente mediante la adición de varios disolventes polares (por ejemplo, acetona, acetonitrilo, etanol y metanol). El acetonitrilo, el más polar de estos disolventes (23), se eligió por su eficacia y se incluyó en la Solución-2 (véase la sección de Pie de foto y Recetas de la Figura 1 del Material suplementario).
Tampón de fosfato, CuSO4, Na-K-tartrato, SDS y acetonitrilo se pueden agregar individualmente y el orden de su adición no afecta la absorbancia resultante. Sin embargo, el uso de una solución premezclada mejora aún más la comodidad, especialmente cuando se van a analizar grandes cantidades de muestras. Por lo tanto, agrupamos estos componentes de la mezcla de ensayo en Solución-2 (Figura 1). Esta solución premezclada no era viable para el ensayo Lowry original (6) debido a la inestabilidad de la solución de carbonato. El intento de incluir la Solución-3 en la Solución-2 resultó en una reducción dramática en el desarrollo del color azul y no se consideró más.
Estimación de proteínas en muestras biológicas coloreadas
Extracción de proteínas
Las proteínas de remolacha y arándano se extrajeron en solución Triton X-100-NaCl con homogeneización suave. Estos homogeneizados conservan sus actividades enzimáticas (15). Esta extracción no era necesaria para el vino tinto.
Eliminar sustancias interferentes
Para muestras coloreadas es necesario eliminar la interferencia debido al color inherente de la muestra y otras sustancias no proteicas que reaccionan con los reactivos proteicos antes del ensayo colorimétrico de proteínas. La novedad de U-2012 consiste en diseñar un protocolo decolorante compatible con un ensayo colorimétrico de proteínas.
Se consideró la decoloración de pigmentos coloreados por hipoclorito de sodio o H2O2 y la precipitación selectiva de proteínas por PCA o TCA para la eliminación de sustancias interferentes. Se evaluó la compatibilidad de hipoclorito de sodio, H2O2, TCA y PCA con el ensayo U-2012 utilizando BSA como proteína de prueba. Entre el hipoclorito de sodio y el H2O2, solo el H2O2 era compatible, ya que se formaba un precipitado en presencia de hipoclorito. Las proteínas precipitadas por TCA o PCA pueden ser analizadas por U-2012 después de la neutralización adecuada del ácido residual en el pellet. Se ha reportado la superioridad del PCA sobre el TCA para la precipitación de proteínas (24,25). En contraste, en nuestra evaluación comparativa, revelamos valores similares de C50 para PCA (1,395) y TCA (1,400). Preferimos el PCA porque está fácilmente disponible como solución prefabricada (70% v / v) y, por lo tanto, se diluye fácilmente hasta la concentración requerida. El TCA es un sólido higroscópico que es difícil de pesar con precisión debido a su contenido de agua variable.
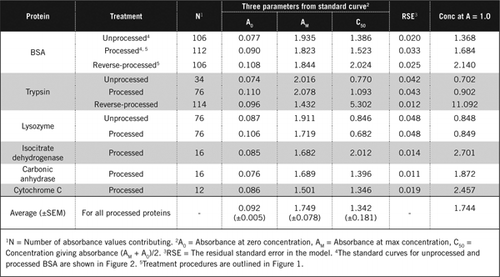
Hay dos formas posibles de combinar PCA y H2O2. Para las proteínas» procesadas», el tratamiento con PCA fue seguido por el tratamiento con H2O2 y para las proteínas» procesadas inversamente», el tratamiento con H2O2 precedió a la precipitación de PCA. Las ventajas de utilizar proteínas «procesadas» eran la eliminación de una serie de sustancias interferentes en el sobrenadante y la posible inactivación de enzimas proteolíticas durante la preparación de la muestra. Esto se confirmó mediante el análisis de tripsina y ASC procesadas y transformadas (véase el cuadro 1). Solo se utilizaron muestras procesadas para determinar el contenido real de proteínas de muestras biológicas coloreadas
Los tratamientos de PCA y H2O2 de muestras coloreadas fueron necesarios para eliminar la interferencia en el ensayo U-2012. La precipitación ácida sola de las muestras coloreadas no eliminó la interferencia por completo. Con todas las muestras de color, se descartó algo de color en el sobrenadante, pero los gránulos también eran de color. El color se eliminó de los gránulos mediante tratamiento con H2O2. Se requerían condiciones alcalinas para la decoloración efectiva por H2O2 (26) y el desarrollo de color por el reactivo de Folin para garantizar que los niveles de proteína se midieran correctamente. Aunque tanto el NaOH como el KOH podían proporcionar la alcalinidad requerida, solo el NaOH era compatible con el ensayo U-2012. Se formó un precipitado en presencia de KOH. En pellets, el PCA fue neutralizado usando Na2CO3 y NaOH (27). Se añadió NaOH adicional durante el ensayo; el volumen optimizado se situó entre 50 y 70 µL (se utilizaron de forma rutinaria 60 µL); ver Figura 1.
Remolacha, arándano y vino tinto se decoloraron con 15 µL de 30% H2O2 tomando 0.5 y 2 h a 50°C y temperatura ambiente, respectivamente. Se utilizaron veinte microlitros de 30% de H2O2 durante 1 h a 50°C para hacer frente a muestras de colores más fuertes. La oxidación de sustancias como azúcares unidos a proteínas por H2O2 a 50°C parece crítica, ya que el procesamiento a temperatura ambiente sobrestima el contenido de proteínas. En el caso de la remolacha, la transformación a 50°C redujo la estimación aparente de proteínas al 14% de la no transformada, mientras que la transformación a temperatura ambiente solo redujo esa estimación a la mitad.
A partir de los ensayos colorimétricos realizados después del tratamiento con peróxido de hidrógeno, fue evidente que no se utilizó algo de H2O2 en la decoloración. En una muestra de este tipo, el color final del ensayo Lowry se destruyó parcialmente. Por lo tanto, era necesario destruir el peróxido de hidrógeno restante antes del ensayo de proteínas. Hay dos fuentes de H2O2 en el ensayo U-2012; H2O2 añadido para decoloración y H2O2 presente como contaminante en el Triton X-100 (0,22%, Información del producto: Triton X-100, www.sigmaaldrich.com El peróxido de hidrógeno es comúnmente degradado por la enzima catalasa. Sin embargo, el alto pH del ensayo de proteínas inactivaría las catalasas conocidas. Además, la adición de catalasa llevaría a la adición de proteína adicional. Elegimos la destrucción química del H2O2 utilizando piruvato (28). La química de la ecuación de interacción piruvato-H2O2 está bien establecida (28,29). El piruvato destruye el H2O2 a temperatura ambiente de acuerdo con la siguiente reacción:

El H2O2 residual en la suspensión de pellets se destruyó mediante tratamiento con piruvato de 0,9 M (1,5 x concentración de H2O2) durante 0,5 h a temperatura ambiente. Para contrarrestar el H2O2 contaminante en Triton X-100, también se añadió piruvato extra en el ensayo de proteínas (Figura 1). La adición de piruvato dio una menor absorbancia para un blanco sin proteínas . Sugerimos que el contaminante de peróxido en Triton X-100 reacciona con el acetonitrilo en la Solución-2, dando una absorción ligeramente mayor.
La interferencia de color asociada con las muestras biológicas coloreadas no se puede tener en cuenta simplemente ejecutando un ensayo de proteínas en ausencia del reactivo de Folina. Las proporciones calculadas (Abs1-Abs2) / (Abs3-Abs4) indicaron que la interferencia del color de la muestra fue la más alta para el vino tinto (=40) y menor para el arándano (=6) y la remolacha (=2). Esta interferencia se tradujo en estimaciones anormalmente altas de los niveles verdaderos de proteínas; por ejemplo, la concentración de proteínas utilizando homogeneizados de remolacha sin procesar y procesados (20,21 frente a 2,89 mg de proteína / g de tejido, respectivamente). Además de la interferencia de color, es probable que el vino tinto y los homogeneizados de remolacha y arándano contengan sustancias que reaccionarán con el reactivo de Folin en el ensayo U-2012 (e.g., péptidos pequeños y azúcares complejos). Estos se eliminaron precipitando selectivamente proteínas con PCA helado a una concentración final del 5% (Figura 1).
Curvas estándar y sus parámetros
Curvas estándar para ASC sin procesar y procesadas se muestran en la Figura 2. Los parámetros derivados (A0, AM y C50) también se enumeran en la Tabla 1 para BSA y otras proteínas.
Los resultados muestran que el error estándar residual en el modelo es bajo (0,012 a 0,048), lo que indica el mejor ajuste de los datos a la tendencia de hipérbola rectangular. Para comparar la información entre varias proteínas y su procesamiento, los parámetros se convirtieron a la concentración de absorbancia = 1,0 a 650 nm (columna derecha en la Tabla 1).
Estos resultados muestran que la pérdida de proteína (en comparación con la proteína no procesada) en las muestras procesadas fue menor que en las muestras procesadas a la inversa. Esta pérdida fue más evidente en el caso de la tripsina y puede explicarse sobre la base de su actividad auto-catalítica durante el procesamiento inverso. Recomendamos que el protocolo «procesado» (Material suplementario) solo se siga para muestras biológicas que puedan contener enzimas proteolíticas.
En el ensayo Lowry original (6) y en su versión modificada U-1988 (15), en la determinación cuantitativa de proteínas solo se utilizó la porción lineal de la curva estándar obtenida trazando la absorbancia frente a la cantidad de proteína. En el ensayo U-2012 utilizamos los datos de manera más efectiva ajustando una ecuación hipérbola rectangular como se describe en la sección Materiales y métodos en línea con Coakley y James (20).
El contenido de proteína de homogeneizado coloreado
Las concentraciones de proteína en muestras desconocidas se calcularon por ecuación y contra el estándar de ASC procesado y el promedio de todas las proteínas procesadas enumeradas en la Tabla 1. Este último estará más cerca de una estimación verdadera para muestras biológicas que contienen una mezcla de proteínas. Se calculó que las cantidades de proteína en arándanos y remolachas en relación con el vino tinto eran aproximadamente 60 y 230 veces, respectivamente (Tabla 2).
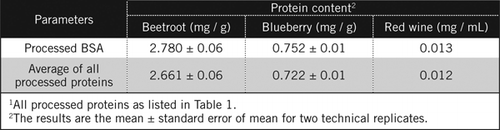
Al igual que el BSA, el vino tinto y los homogeneizados al 50% de remolacha y arándano se procesaron por precipitación de PCA y decoloración por H2O2 (Figura 1). En esta etapa, las muestras biológicas se concentraron 40 veces para el vino tinto y 4 veces para la remolacha y el arándano. De manera similar, el ASC (2 mg/ml) también se concentró de 4 a 8 mg/ml. La absorbancia de las muestras coloreadas que estaba cerca de la absorbancia de C50 (para ASC sin procesar) se utilizó para calcular el contenido de proteína, como se describe en la ecuación y .
En conclusión, el ensayo U-2012 ha empleado reactivos estables, ha proporcionado una sensibilidad mejorada (incluso para muestras biológicas incoloras) y ha superado la interferencia inducida por el color para muestras biológicas coloreadas. El ensayo U-2012 no se limita a la porción lineal de la respuesta entre la concentración de proteínas y la absorbancia y hace un uso más eficiente de los datos en la región no lineal a través de un modelo de curva hiperbólica rectangular ajustado a los estándares utilizando procedimientos simples dentro de Microsoft Excel.
Agradecimientos
Los autores agradecen el apoyo financiero de la Fundación para la Investigación, la Ciencia y la Tecnología de Nueva Zelandia (C06X0809).
intereses contrapuestos
Los autores declaran no hay intereses contrapuestos.
Datos complementarios
Para ver los datos complementarios que acompañan a este artículo, visite el sitio web de la revista en: www.future-science.com/doi/suppl/10.2144/000113818
- 1. Kaplan, R. S. and P. L. Pedersen. 1985. Determinación de cantidades de microgramos de proteína en presencia de niveles de miligramos de lípidos con amido negro 10B.Anal. Bioquímica. 150:97–104.Crossref, Medline, CAS, Google Scholar
- 2. Gornall, A. G., C. J. Bardawill, and M. M. David. 1949. Determinación de proteínas séricas por medio de la reacción biuret. J. Biol. Chem. 177:751–766.Medline, CAS, Google Scholar
- 3. Smith, P. K., R. I. Krohn, G. T. Hermanson, A. K. Mallia, F. H. Gartner, M. D. Provenzano, E. K. Fujimoto, N. M. Goeke, et al.. 1985. Medición de proteínas con ácido biciconínico. Anal. Bioquímica. 150:76–85.Crossref, Medline, CAS, Google Scholar
- 4. Bradford, M. M. 1976. Método rápido y sensible para la cuantificación de cantidades de microgramo de proteína que utiliza el principio de unión a proteínas y colorantes. Anal. Bioquímica. 72:248–254.Crossref, Medline, CAS, Google Scholar
- 5. Zor, T. y Z. Selinger. 1996. La linealización del ensayo de proteína Bradford aumenta su sensibilidad: estudios teóricos y experimentales. Anal. Bioquímica. 236:302–308.Crossref, Medline, CAS, Google Scholar
- 6. Lowry, O. H., N. J. Rosbrough, A. L. Farr, and R. J. Randall. 1951. Medición de proteínas con el reactivo Folin fenol. J. Biol. Chem. 193:265–275.Medline, CAS, Google Scholar
- 7. Peterson, G. L. 1979. Revisión del método de cuantificación de proteínas folin fenólicas de Lowry, Rosebrough, Farr y Randall. Anal. Bioquímica. 100:201–220.Crossref, Medline, CAS, Google Scholar
- 8. Sapan, C. V., R. L. Lundablad, y N. C. Price. 1999. Técnicas de ensayo colorimétrico de proteínas. Biotechnol. Appl. Bioquímica. 29:99–108.Medline, CAS, Google Scholar
- 9. Okutucu, B., A. Dınçer, Ö. Habib, y F. Zıhnıoglu. 2007. Comparación de cinco métodos para determinar la concentración total de proteínas plasmáticas. J. Biochem. Biophys. Methods 70: 709-711.Crossref, Medline, CAS, Google Scholar
- 10. Kresge, N., R. D. Simoni, and R. L. Hill. 2005. The most highly cited paper in publishing history: protein determination by Oliver H. Lowry. J. Biol. Chem. 25:280.Google Scholar
- 11. Everette, J. D., Q. M. Bryant, A. M. Green, Y. A. Abbey, G. W. Wangila y R. B. Walker. 2010. Estudio exhaustivo de la reactividad de varias clases de compuestos hacia el reactivo Folin-Ciocalteu. J. Agric. Química de Alimentos. 58:8139–8144.Crossref, Medline, CAS, Google Scholar
- 12. Eichberg, J. y L. C. Mokrasch. 1969. Interferencia de lípidos oxidados en la determinación de proteínas por el procedimiento Lowry. Anal. Bioquímica. 30:386–390.Crossref, Medline, CAS, Google Scholar
- 13. Dulley, J. R. and P. A. Grieve. 1975. Una técnica sencilla para eliminar la interferencia de detergentes en el método Lowry de determinación de proteínas. Anal. Bioquímica. 64:136–141.Crossref, Medline, CAS, Google Scholar
- 14. Brillouet, J.-M., M.-P. Belleville, and M. Moutounet. 1991. Posibles complejos de proteínas y polisacáridos en vinos tintos. Ser. J. Enol. Vitic. 42:150–152.CAS, Google Scholar
- 15. Upreti, G. C., R. A. Ratcliff, and P. C. Riches. 1988. Estimación de proteínas en tejidos que contienen altos niveles de lípidos: modificaciones al método Lowry de determinación de proteínas. Anal. Bioquímica. 168:421–427.Crossref, Medline, CAS, Google Scholar
- 16. Upreti, G. C., C. Davis, and J. Oliver. 1991. Preparación de homogeneizados representativos de tejidos biológicos: efecto de la sal en la extracción de proteínas. Anal. Bioquímica. 198:298–301.Crossref, Medline, CAS, Google Scholar
- 17. Smith, M. R., M. H. Penner, S.E. Bennett, and A. T. Bakalinsky. 2011. Ensayo Colorimétrico Cuantitativo de la Proteína Total Aplicada al Vino Tinto Pinot Noir. J. Agric. Química de Alimentos. 59:6871–6876.Crossref, Medline, CAS, Google Scholar
- 18. Wigand, P., S. Tenzer, H. Schild, and H. Decker. 2009. Análisis de la Composición Proteica del Vino Tinto en Comparación con los Vinos Rosados y Blancos mediante Electroforesis y Cromatografía Líquida de Alta Presión-Espectrometría de Masas (HPLC-MS). J. Agric. Química de Alimentos. 57:4328–4333.Crossref, Medline, CAS, Google Scholar
- 19. Upreti, G. C., Y. Wang, A. Sharrock, N. Feisst, M. Davy, and B. Jordan. 2009. Un ensayo de proteínas estable y sensible (ensayo modificado U-2009) para muestras biológicas coloreadas. ComBiol., Programa Final de Nueva Zelandia, diciembre de 2009. Universidad de Canterbury, Christchurch, Nueva Zelanda.Google Scholar
- 20. Coakley, W. T. and C. J. James. 1978. Una transformación lineal simple para la curva de calibración de proteínas Folin-Lowry a 1,0 mg / ml. Anal. Bioquímica. 85:90–97.Crossref, Medline, CAS, Google Scholar
- 21. Pinheiro, J.C. and D. M. Bates. 2000. Modelos de Efectos mixtos en Series S y S-PLUS, Estadísticas e Informática. Springer-Verlag, Nueva York, NY.Google Scholar
- 22. R Development Core Team. 2009. R: Un lenguaje y entorno para la computación estadística. R Foundation for Statistical Computing, Viena, Austria, ISBN 3-900051-07-0, URL http://www.R-project.org.Google Scholar
- 23. Khachik, F., G. R. Beecher, J. T. Vanderslice, and G. Surco. 1988. Artefactos cromatográficos líquidos y distorsión de picos: Interacción muestra-disolvente en la separación de carotenoides. Anal. Chem. 60:807–811.Crossref, Medline, CAS, Google Scholar
- 24. Cernik, A. A. 1970. Determinación de plomo quelado con ácido etilendiaminotetraacético en sangre después de la precipitación de proteínas con ácido perclórico. Brit. J. Industry Med. 27:40–42.Medline, CAS, Google Scholar
- 25. Moughan, P. J., A. J. Darragh, W. C. Smith, and C. A. Butts. 1990. Ácidos perclóricos y tricloroacéticos como precipitantes de proteínas en digesta ileal endógena de rata. J. Sci. Alimentos Agrícolas. 52:13–21.Crossref, CAS, Google Scholar
- 26. Galbács, Z. M. and L. J. Csányi. 1983. Descomposición del peróxido de hidrógeno inducida por álcalis. J. Chem. Soc., Dalton Trans. 11:2353–2357.Crossref, Google Scholar
- 27. Scopes, R. K. 1988. Purificación de proteínas: Principios y práctica, Segunda Edición. Springer-Verlag New York Inc., Nueva York, NY.Google Scholar
- 28. Upreti, G. C., K. Jensen, R. Munday, D. M. Duganzich, R. Vishwanath, and J. F. Smith. 1998. Estudios sobre la actividad de la oxidasa de aminoácidos aromáticos en espermatozoides ram: papel del piruvato como antioxidante. Anim. Reproche. Sci. 51:275–287.Crossref, Medline, CAS, Google Scholar
- 29. Holleman, M. A. F. 1904. Notice sur l’action de l’eau oxygenee sur les acids α-cetoniques et sur les dicetones 1.2. Recl. Trav. Chim. Pays-Bas Belg. 23:169–172.Crossref, CAS, Google Scholar