măsurile cantitative ale trăsăturilor fiziologice, cum ar fi activitatea enzimei, sunt adesea exprimate ca unități de activitate pe proteină miligram. Deși au fost dezvoltate numeroase teste pentru a măsura conținutul de proteine, inclusiv testele colorimetrice ale Amido Black (1), Biuret (2), Acid Bicinconinic (3) și albastru Coomassie (4,5), testul Lowry (6) sau modificările sale (7,8) sunt mai frecvent utilizate decât alte teste (9). Testul Lowry este simplu, sensibil și precis și este cea mai citată (10) procedură pentru determinarea cantitativă a proteinelor.
o mare varietate de compuși care reacționează cu reactivul Folin-Ciocalteu fenol (Folin ‘ s) (11) sunt o sursă de interferență potențială în testele Lowry și Lowry protein modificate. Din fericire, corecțiile printr-un martor adecvat sunt suficiente pentru majoritatea compușilor (6,7), cu excepția lipidelor (12), a detergenților (13) și a substanțelor colorate (14). Dificultățile de testare a proteinelor în prezența lipidelor și detergenților (utilizate în solubilizarea țesutului adipos, a mielinei și a mușchilor scheletici) au fost depășite de testul Lowry modificat (15; denumit în această lucrare testul U-1988, 16). Interferența culorii în determinarea conținutului de proteine din vinul roșu (14,17,18) a fost depășită prin utilizarea cromatografiei extinse. Abordarea de mai sus este greoaie și nu foarte practică pentru manipularea unui număr mare de probe. Niciunul dintre testele proteice cunoscute nu a fost adecvat pentru măsurarea proteinelor în probe biologice colorate, de ex., fructe și legume colorate, vin roșu, microbi pigmentați și bilă de rumegătoare.
dezvoltarea testului U-2012 de la predecesorii săi testul U-1988 și testul Lowry a obținut trei avantaje majore (i) comoditate prin stabilitatea formulărilor de reactivi, (ii) măsurarea proteinei atât în probe biologice incolore, cât și colorate, fără a compromite sensibilitatea și (iii) testarea proteinelor la concentrații foarte scăzute. Acest test nou va fi aplicabil determinării cantitative a proteinelor atât în omogenatele probei biologice incolore, cât și în cele colorate, inclusiv cele bogate în lipide (de exemplu, avocado) și cele dificil de omogenizat.
- materiale și metode
- probe biologice – sfeclă roșie, afine și vin roșu
- reactivi chimici
- îmbunătățiri ale testului U-1988
- testul U-2012
- estimarea interferențelor de culoare în testul U-2012
- curba standard și parametrii săi
- calculul conținutului de proteine în omogenații
- rezultate și discuții
- îmbunătățiri ale testului U-1988
- estimarea proteinelor în probe biologice colorate
- extracția proteinelor
- eliminarea substanțelor interferente
- curbele Standard și parametrii lor
- conținutul proteic al omogenatului colorat
- mulțumiri
- interese concurente
- date suplimentare
materiale și metode
probe biologice – sfeclă roșie, afine și vin roșu
omogenații de sfeclă și afine au fost preparați conform descrierii din materialul suplimentar. Vinul roșu nu a necesitat extracția proteinelor înainte de testul U-2012.
reactivi chimici
toți reactivii chimici, cu excepția hipocloritului de sodiu și a acidului percloric (PCA), au fost obținuți din Sigma sau Sigma-Aldrich (St Louis, MO. SUA). Hipocloritul de sodiu a fost din Acros Organic, New Jersey, SUA. PCA a fost obținut de la BDH (Anglia).
îmbunătățiri ale testului U-1988
trecerea de la carbonat la tampon fosfat la pH 12,0 a îmbunătățit stabilitatea reactivului și a dat o mică creștere a sensibilității. Acetonitrilul a fost introdus pentru a evita bulele induse de detergent. NaOH a înlocuit KOH pentru a evita precipitarea în testul proteic. În plus, eficiența a fost îmbunătățită prin combinarea diferitelor componente ale reactivului Lowry într-un singur amestec de reactivi.
testul U-2012
detaliile complete ale testului U-2012 sunt furnizate în materiale suplimentare. Protocolul, rezumat pe scurt în Figura 1, descrie prelucrarea vinului roșu și omogenatele de sfeclă roșie și afine și include îmbunătățirile testului U-1988. Testul U-2012 a fost utilizat pentru proteinele neprelucrate, prelucrate și prelucrate invers (tratament H2O2 urmat de precipitarea TCA sau PCA). Testele au fost efectuate pe BSA, anhidrază carbonică, citocrom C, izocitrat dehidrogenază, lizozimă și tripsină pentru dezvoltarea curbelor standard și în probe biologice colorate. Determinarea proteinelor din probele biologice a fost efectuată prin calibrarea la curbe standard adecvate.
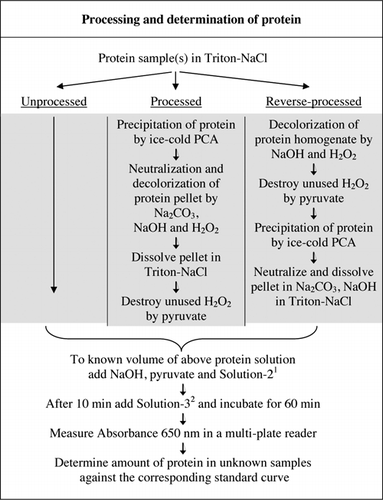
1soluția – 2 conținea sulfat de cupru (CuSO4.5h2o), Na-K-tartrat, SDS și acetonitril în tampon fosfat de 100 mM (pH 12,0). 2Pentru soluție-3, reactivul fenol Folin-Ciocalteu a fost diluat 1:1 cu apă deionizată chiar înainte de utilizare.
estimarea interferențelor de culoare în testul U-2012
Interferența de culoare a fost determinată prin compararea absorbției din probele de sfeclă roșie, afine și vin roșu prelucrate și neprelucrate, atât cu cât și fără utilizarea reactivului Folin așa cum este descris în Figura 1. Raportul a fost utilizat pentru a stabili gradul de interferență, unde Abs1 este absorbanța probelor neprelucrate cu reactivul Folin; Abs2 este absorbanța probelor neprelucrate fără reactivul Folin; Abs3 este absorbanța probelor prelucrate cu reactivul Folin; și Abs4 este absorbanța probelor prelucrate fără reactivul Folin.
curba standard și parametrii săi
soluție-1b și 1C descrise în secțiunea Rețete a materialului suplimentar atașat au fost utilizate pentru dezvoltarea curbelor standard. Concentrația BSA și valorile de absorbție corespunzătoare au fost reprezentate grafic folosind un grafic de dispersie X-Y. Forma acestui grafic (Figura 2) prezintă un răspuns saturant la concentrații mai mari, cu un răspuns liniar inițial foarte limitat. Aceasta a fost o formă curbată preferată raportată anterior (20). Inițial, aceasta a fost modelată folosind o formă exponențială (19), dar studiile ulterioare au arătat că o hiperbolă dreptunghiulară a dat o aliniere îmbunătățită cu răspunsul, în special la concentrații mai mici. Această ultimă formă a fost acum standardizată și următoarea ecuație cu trei parametri a fost utilizată pentru a descrie relația concentrație absorbanță-proteină:

Conc = concentrația proteică,
A = absorbanța la Conc,
A0 = absorbanța la concentrația zero,
AM= absorbanța la concentrația maximă,
C50= concentrația care dă absorbanța
(am + a0)/2.
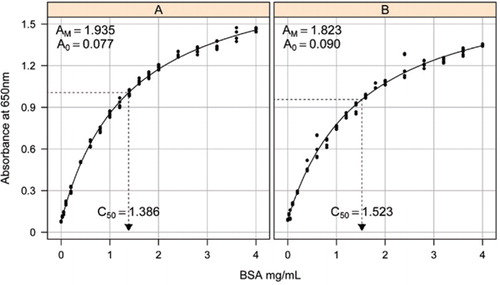
estimarea curbei standard între absorbanță (650 nm) și concentrațiile proteinei BSA a fost realizată pe trei duplicate tehnice la (a) testul proteinei neprelucrate (parametrii a0= 0,077, am=1,935, C50=1.386) și (B) testul proteic prelucrat (parametrii a0=0,90, Am=1,823, C50=1,523). Un model de hiperbolă dreptunghiulară (ecuație ) a fost montat pe datele observate. Estimările parametrilor sunt identificate în curbe cu estimarea C50 pe axa x (linia neagră punctată).
parametrul A0 a fost determinat experimental în timp ce AM și C50 au fost estimate folosind funcția de rezolvare a instrumentelor Microsoft Excel. Un set de parametri de încercare a fost utilizat pentru a calcula absorbanța modelată la fiecare dintre concentrațiile standard (Conc) folosind ecuația . Solver a fost apoi comandat pentru a minimiza deviația standard reziduală între absorbanța măsurată și modelată pentru setul standard prin ajustarea AM și C50.
am observat relația dintre absorbanță și concentrație pentru a prezenta o curbă neliniară pe întregul interval de concentrație, care este probabil să se datoreze unei componente a împrăștierii luminii care crește pe măsură ce concentrația proteinei crește la măsurarea absorbanței. O potrivire liniară slabă la absorbție scăzută a fost, de asemenea, raportată de Coakley și James (20).
calculul conținutului de proteine în omogenații
s-au efectuat teste pe vin roșu prelucrat și neprelucrat și omogenați de sfeclă roșie și afine. BSA și alte probe de proteine au fost tratate identic pentru curbe standard adecvate pentru a determina valorile a0, am și C50. Acești parametri au fost apoi utilizați pentru a converti absorbanța probei (A) la concentrația de proteine în fiecare omogenat folosind:

deoarece ecuația are o formă saturantă, sensibilitatea se reduce pe măsură ce absorbanța (A) și, prin urmare, concentrația crește. Erorile în estimările proteinelor pot fi reduse la minimum prin ajustarea concentrațiilor de omogenați în test, astfel încât acestea să nu depășească excesiv valoarea C50.
valoarea conc omogenat a fost apoi transformată în concentrația de proteine tisulare (conc tisular în mg/g de țesut) folosind următoarea formulă:

în cazul în care omogenatul Conc (în mg proteină/mL) a fost corectat pentru orice pre-concentrație sau diluție în timpul testului. Procentul de omogenat a fost de 100 g de țesut omogenizat la un volum total de 200 mL (în cazul nostru 50%).
într-un studiu separat, un model de hiperbolă dreptunghiulară a fost montat folosind pachetul de efecte mixte neliniare (nlme) (21) în R (22) (Figura 2). Fiecare soluție BSA, realizată independent în laborator, a fost modelată ca un efect aleatoriu, cu un coeficient comun A0, dar diferit am și C50. Aceasta modelează ierarhia replicatelor de probe biologice și a replicatelor de testare tehnică.
rezultate și discuții
îmbunătățiri ale testului U-1988
limitarea testului U-1988 și Lowry este instabilitatea reactivului pe bază de carbonat. Tamponul carbonat (pH 11,4 la 2% = 188,7 mM) în U-1988 a fost înlocuit cu fosfat de 40 mM la valori ale pH-ului cuprinse între 11,4 și 12,5. Au fost calculate pantele inițiale de la curbele standard ale testului proteic utilizând BSA la 0,5 mg BSA/ mL și 1,0 mg BSA / mL. Pantele inițiale cu tampoane fosfatice la pH 11,4 și la pH-ul OPTIM 12,0 au fost 99 x10-6 și 197 x10-6respectiv. Panta pentru tamponul carbonat (pH 11,4) a fost de 162 x10-6.Deoarece valoarea pantei este o indicație directă a sensibilității testului, tampon fosfat (pH 12.0) a fost ales pentru a înlocui tamponul carbonat, oferind o creștere de 25% a sensibilității.
s-a obținut o stabilitate mai mare prin creșterea concentrației tamponului fosfat la 100 mM. soluția rezultată de fosfat/CuSO4/Na-K-tartrat a fost stabilă la temperatura camerei timp de două săptămâni, considerabil mai lungă decât soluția de carbonat/CuSO4/Na-K-tartrat, care trebuie preparată zilnic înainte de testul proteic. Pentru toate experimentele viitoare, s-a utilizat fosfat de 100 mM (pH 12,0) pentru prepararea soluției de CuSO4/Na-K-tartrat. Credem că înlocuirea carbonatului cu fosfat va spori confortul testului U-2012.
bulele induse de Detergent devin o sursă majoră de eroare în măsurătorile de absorbție atunci când se utilizează un cititor de plăci cu mai multe puțuri (nu este o problemă cu cuvele). Aceste bule au fost reduse considerabil prin adăugarea unui număr de solvenți polari (de exemplu, acetonă, acetonitril, etanol și metanol). Acetonitrilul, cel mai polar dintre acești solvenți (23) a fost ales pentru eficacitatea sa și inclus în soluția-2 (vezi Figura 1 secțiunea legendă și rețete din Material suplimentar).
tampon fosfat, CuSO4, Na-K-tartrat, SDS și acetonitril pot fi adăugate individual și ordinea adăugării lor nu afectează absorbanța rezultată. Cu toate acestea, utilizarea unei soluții preamestecate îmbunătățește și mai mult confortul, mai ales atunci când urmează să fie testat un număr mare de probe. Prin urmare, am grupat aceste componente ale amestecului de testare în soluție-2 (Figura 1). O astfel de soluție preamestecată nu a fost fezabilă pentru testul inițial Lowry (6) din cauza instabilității soluției de carbonat. Încercarea de a include soluția-3 în soluția – 2 a dus la o reducere dramatică a dezvoltării culorii albastre și nu a fost luată în considerare în continuare.
estimarea proteinelor în probe biologice colorate
extracția proteinelor
proteinele din sfeclă și afine au fost extrase în soluție de Triton X-100-NaCl cu omogenizare ușoară. Astfel de omogenați își păstrează activitățile enzimatice (15). Această extracție nu a fost necesară pentru vinul roșu.
eliminarea substanțelor interferente
pentru probele colorate este necesar să se elimine interferența datorată culorii inerente a eșantionului și a altor substanțe neproteice care reacționează cu reactivii proteici înainte de testul proteic colorimetric. Noutatea U-2012 constă în elaborarea unui protocol de decolorare compatibil cu un test de proteine colorimetrice.
decolorarea pigmenților colorați prin hipoclorit de sodiu sau H2O2 și precipitarea selectivă a proteinelor prin PCA sau TCA au fost luate în considerare pentru îndepărtarea substanțelor interferente. Hipocloritul de sodiu, H2O2, TCA și PCA au fost evaluate pentru compatibilitatea lor cu testul U-2012 folosind BSA ca proteină de testare. Între hipocloritul de sodiu și H2O2, numai H2O2 a fost compatibil, deoarece s-a format un precipitat în prezența hipocloritului. Proteinele precipitate de TCA sau PCA pot fi testate de U-2012 după neutralizarea adecvată a acidului rezidual din peletă. A fost raportată superioritatea PCA față de TCA pentru precipitarea proteinelor (24,25). În schimb, în evaluarea noastră comparativă, a relevat valori similare C50 pentru PCA (1.395) și TCA (1.400). Am preferat PCA deoarece este ușor disponibil ca soluție pre-fabricată (70% v/v) și, prin urmare, ușor diluat la puterea necesară. TCA este un solid higroscopic greu de cântărit tocmai datorită conținutului său variabil de apă.
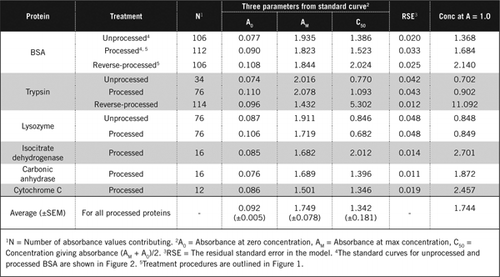
există două modalități posibile de a combina PCA și H2O2. Pentru proteinele ” procesate „tratamentul cu PCA a fost urmat de tratamentul cu H2O2, iar pentru proteina” procesată invers”, tratamentul cu H2O2 a precedat precipitarea PCA. Avantajele utilizării proteinei prelucrate au fost eliminarea unui număr de substanțe interferente în supernatant și posibila inactivare a enzimelor proteolitice în timpul preparării probei. Acest lucru a fost confirmat prin testarea tripsinei și BSA prelucrate și reversibile (a se vedea tabelul 1). Numai probele prelucrate au fost utilizate pentru a determina conținutul real de proteine al probelor biologice colorate
atât tratamentele PCA, cât și H2O2 ale probelor colorate au fost necesare pentru eliminarea interferențelor în testul U-2012. Numai precipitațiile acide ale probelor colorate nu au îndepărtat complet interferențele. Cu toate probele colorate, o anumită culoare a fost aruncată în supernatant, dar peletele au fost, de asemenea, colorate. Culoarea a fost eliminată din pelete prin tratament H2O2. Au fost necesare condiții alcaline atât pentru decolorarea eficientă de către H2O2 (26), cât și pentru dezvoltarea culorii de către reactivul Folin pentru a se asigura că nivelurile de proteine sunt măsurate corect. Deși atât NaOH, cât și KOH ar putea furniza alcalinitatea necesară, numai NaOH a fost compatibil cu testul U-2012. Un precipitat a fost format în prezența KOH. În pelete, PCA a fost neutralizat folosind Na2CO3 și NaOH (27). În timpul testului s-a adăugat NaOH suplimentar; volumul optimizat a fost cuprins între 50 și 70 de centicli (60 de centicli au fost utilizați în mod curent); a se vedea Figura 1.
sfeclă roșie, afine și vin roșu au fost decolorate cu 15 ILQ de 30% H2O2 luând 0,5 și 2 h la 50 ILC C și, respectiv, temperatura camerei. Douăzeci de microlitri de 30% H2O2 pentru 1 h la 50 de centi C au fost utilizați pentru a face față probelor colorate mai puternice. Oxidarea substanțelor cum ar fi zaharurile legate de proteine de către H2O2 la 50 centimetric C pare critică, deoarece procesarea la temperatura camerei supraestimează conținutul de proteine. În cazul sfeclei roșii, prelucrarea la 50% C a redus estimarea aparentă a proteinei la 14% din cea neprelucrată, în timp ce prelucrarea la temperatura camerei a redus doar la jumătate estimarea respectivă.
a fost evident din testele colorimetrice efectuate după tratamentul cu peroxid de hidrogen că o parte din H2O2 nu a fost utilizată în decolorare. Într-un astfel de eșantion, culoarea finală a testului Lowry a fost parțial distrusă. Prin urmare, a fost necesară distrugerea peroxidului de hidrogen rămas înainte de testul proteic. Există două surse de H2O2 în testul U-2012; H2O2 adăugat pentru decolorare și H2O2 prezent ca contaminant în Triton X-100 (0,22%, informații despre produs: Triton X-100, www.sigmaaldrich.com). peroxidul de hidrogen este în mod obișnuit degradat de enzima catalază. Cu toate acestea, pH-ul ridicat al testului proteic ar inactiva catalazele cunoscute. De asemenea, adăugarea catalazei ar duce la adăugarea de proteine suplimentare. Am ales distrugerea chimică a H2O2 folosind piruvat (28). Chimia ecuației de interacțiune piruvat-H2O2 este bine stabilită (28,29). Piruvatul distruge H2O2 la temperatura camerei conform următoarei reacții:

H2O2 rezidual în suspensia de pelete a fost distrus prin tratarea cu 0,9 m piruvat (1,5 x concentrație de H2O2) timp de 0,5 ore la temperatura camerei. Pentru a contracara H2O2 contaminant în Triton X-100, s-a adăugat și piruvat suplimentar în testul proteic (Figura 1). Adăugarea de piruvat a dat o absorbție mai mică pentru un martor non-proteic . Sugerăm ca peroxidul contaminant din Triton X-100 să reacționeze cu acetonitrilul în soluția-2, oferind o absorbție ușor mai mare.
Interferența de culoare asociată cu probele biologice colorate nu poate fi luată în considerare pur și simplu prin efectuarea unui test de proteine în absența reactivului Folinei. Raporturile calculate (Abs1-Abs2) / (Abs3-Abs4) au indicat că interferența culorii eșantionului a fost cea mai mare pentru vinul roșu (=40) și mai puțin pentru afine (=6) și sfeclă roșie (=2). Această interferență s-a tradus în estimările anormal de mari ale nivelurilor reale de proteine; de exemplu, concentrația de proteine folosind omogenați de sfeclă neprelucrată și prelucrată (20,21 față de 2,89 mg proteină / g țesut, respectiv). În plus față de interferențele de culoare, vinul roșu și omogenatele de sfeclă roșie și afine sunt susceptibile să conțină substanțe care vor reacționa cu reactivul Folin în testul U-2012 (e.peptide mici și zaharuri complexe). Acestea au fost eliminate prin precipitarea selectivă a proteinelor cu PCA rece ca gheața la o concentrație finală de 5% (Figura 1).
curbele Standard și parametrii lor
curbele Standard pentru BSA neprelucrate și prelucrate sunt prezentate în Figura 2. Parametrii derivați (A0, am și C50) sunt, de asemenea, enumerați în tabelul 1 Pentru BSA și alte proteine.
rezultatele arată că eroarea standard reziduală din model este scăzută (0,012 până la 0,048), indicând o mai bună potrivire a datelor cu tendința hiperbolă dreptunghiulară. Pentru compararea informațiilor între diferite proteine și prelucrarea lor, parametrii au fost convertiți la concentrația pentru absorbanță = 1,0 la 650 nm (coloana din dreapta în tabelul 1).
aceste rezultate arată că pierderea de proteine (comparativ cu proteina neprelucrată) în probele prelucrate a fost mai mică decât probele prelucrate invers. Această pierdere a fost mai evidentă în cazul tripsinei și poate fi explicată pe baza activității sale auto-catalitice în timpul procesării inverse. Recomandăm ca protocolul’ procesat ‘ (material suplimentar) să fie urmat numai pentru probele biologice care pot conține enzime proteolitice.
în testul Lowry original (6) și în versiunea sa modificată U-1988 (15), numai porțiunea liniară a curbei standard obținută prin reprezentarea grafică a absorbanței în raport cu cantitatea de proteină a fost utilizată în determinarea cantitativă a proteinei. În testul U-2012 folosim datele mai eficient prin montarea unei ecuații dreptunghiulare de hiperbolă așa cum este descris în secțiunea Materiale și metode în conformitate cu Coakley și James (20).
conținutul proteic al omogenatului colorat
concentrațiile proteice în probe necunoscute au fost calculate prin ecuație și în raport cu standardul BSA prelucrat și media tuturor proteinelor prelucrate enumerate în tabelul 1. Acesta din urmă va fi mai aproape de o estimare reală pentru probele biologice care conțin un amestec de proteine. Am estimat cantitățile de proteine din afine și sfeclă roșie în raport cu vinul roșu ca fiind de aproximativ 60 și, respectiv, de 230 de ori (Tabelul 2).
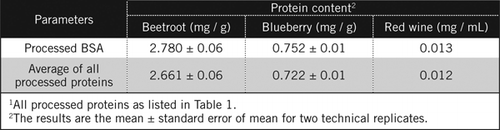
ca și BSA, vinul roșu și 50% omogenați de sfeclă roșie și afine au fost prelucrate prin precipitarea PCA și decolorarea prin H2O2 (Figura 1). În această etapă probele biologice au fost concentrate de 40 de ori pentru vinul roșu și de 4 ori pentru sfeclă și afine. În mod similar, BSA (2 mg/mL) a fost, de asemenea, concentrată de 4 ori până la 8 mg/mL. Absorbanța probelor colorate care a fost apropiată de absorbanța pentru C50 (pentru BSA neprelucrată) a fost utilizată pentru a calcula conținutul de proteine, așa cum este descris de ecuația și .
în concluzie, testul U-2012 a folosit reactivi stabili, a oferit o sensibilitate îmbunătățită (chiar și pentru probele biologice incolore) și a depășit interferențele induse de culoare pentru probele biologice colorate. Testul U-2012 nu este limitat la porțiunea liniară a răspunsului dintre concentrația proteinei și absorbanță și face o utilizare mai eficientă a datelor în regiunea neliniară printr-un model dreptunghiular de curbă hiperbolică adaptat standardelor folosind proceduri simple în cadrul Microsoft Excel.
mulțumiri
autorii recunosc Fundația pentru cercetare, știință și Tehnologie Noua Zeelandă pentru sprijin financiar (C06X0809).
interese concurente
autorii nu declară interese concurente.
date suplimentare
pentru a vizualiza datele suplimentare care însoțesc această lucrare, vă rugăm să vizitați site-ul revistei la adresa: www.future-science.com/doi/suppl/10.2144/000113818
- 1. Kaplan, R. S. și P. L. Pedersen. 1985. Determinarea cantităților de micrograme de proteine în prezența nivelurilor de miligrame de lipide cu amido black 10B. Anal. Biochem. 150:97–104.Crossref, Medline, CAS, Google Scholar
- 2. Gornall, A. G., C. J. Bardawill și M. M. David. 1949. Determinarea proteinelor serice prin reacția biuret. J. Biol. Chem. 177:751–766.Medline, CAS, Google Scholar
- 3. A. M. Gartner, M. D. Provenzano, E. K. Fujimoto, N. M. Goeke și colab.. 1985. Măsurarea proteinei folosind acid bicinconinic. Anal. Biochem. 150:76–85.Crossref, Medline, CAS, Google Scholar
- 4. Bradford, M. M. 1976. O metodă rapidă și sensibilă pentru cuantificarea cantităților de micrograme de proteine utilizând principiul legării proteinei-colorant. Anal. Biochem. 72:248–254.Crossref, Medline, CAS, Google Scholar
- 5. Zor, T. și Z. Selinger. 1996. Liniarizarea testului proteinei Bradford își mărește sensibilitatea: studii teoretice și experimentale. Anal. Biochem. 236:302–308.Crossref, Medline, CAS, Google Scholar
- 6. Lowry, O. H., N. J. Rosbrough, A. L. Farr și R. J. Randall. 1951. Măsurarea proteinelor cu reactivul Folin fenol. J. Biol. Chem. 193:265–275.Medline, CAS, Google Scholar
- 7. Peterson, G. L. 1979. Revizuirea metodei de cuantificare a proteinei Folin fenol a Lowry, Rosebrough, Farr și Randall. Anal. Biochem. 100:201–220.Crossref, Medline, CAS, Google Scholar
- 8. Sapan, C. V., R. L. Lundablad și N. C. Price. 1999. Tehnici de testare a proteinelor colorimetrice. Biotehnol. Appl. Biochem. 29:99–108.Medline, CAS, Google Scholar
- 9. Okutucu, B., A. D. Habib, și F. Z. 2007. Compararea a cinci metode pentru determinarea concentrației totale de proteine plasmatice. J. Biochem. Biophys. Metode 70: 709-711.Crossref, Medline, CAS, Google Scholar
- 10. Kresge, N., R. D. Simoni și R. L. Hill. 2005. Cea mai citată lucrare din istoria publicării: determinarea proteinelor de Oliver H. Lowry. J. Biol. Chem. 25:280.Google Scholar
- 11. De asemenea, este important să vă asigurați că aveți nevoie de ajutor și să vă asigurați că aveți nevoie de ajutor. 2010. Studiul aprofundat al reactivității diferitelor clase de compuși față de reactivul Folin-Ciocalteu. J. Agric. Chimie Alimentară. 58:8139–8144.Crossref, Medline, CAS, Google Scholar
- 12. Eichberg, J. și L. C. Mokrasch. 1969. Interferența lipidelor oxidate în determinarea proteinei prin procedura Lowry. Anal. Biochem. 30:386–390.Crossref, Medline, CAS, Google Scholar
- 13. Dulley, J. R. și P. A. jelesc. 1975. O tehnică simplă pentru eliminarea interferențelor detergenților în metoda Lowry de determinare a proteinelor. Anal. Biochem. 64:136–141.Crossref, Medline, CAS, Google Scholar
- 14. Brillouet, J.-M., M.-P. Belleville și M. Moutounet. 1991. Posibile complexe proteice-polizaharidice în vinurile roșii. Am. J. Enol. Vitic. 42:150–152.CAS, Google Scholar
- 15. Upreti, G. C., R. A. Ratcliff și P. C. Riches. 1988. Estimarea proteinelor în țesuturile care conțin niveluri ridicate de lipide: modificări ale metodei Lowry de determinare a proteinelor. Anal. Biochem. 168:421–427.Crossref, Medline, CAS, Google Scholar
- 16. Upreti, G. C., C. Davis și J. Oliver. 1991. Prepararea omogenatelor reprezentative ale țesuturilor biologice: efectul sării asupra extracției proteinelor. Anal. Biochem. 198:298–301.Crossref, Medline, CAS, Google Scholar
- 17. Smith, M. R., M. H. Penner, S. E. Bennett și A. T. Bakalinsky. 2011. Test Colorimetric cantitativ pentru proteina totală aplicată pe vinul roșu Pinot Noir. J. Agric. Chimie Alimentară. 59:6871–6876.Crossref, Medline, CAS, Google Scholar
- 18. Wigand, P., S. Tenzer, H. Schild și H. Decker. 2009. Analiza compozitiei proteice a vinului rosu in comparatie cu vinul rosu si vinurile albe prin electroforeza si cromatografia lichida de inalta presiune-spectrometrie de masa (HPLC-MS). J. Agric. Chimie Alimentară. 57:4328–4333.Crossref, Medline, CAS, Google Scholar
- 19. Upreti, G. C., Y. Wang, A. Sharrock, N. Feisst, M. Davy și B. Jordan. 2009. Un test proteic stabil și sensibil (test modificat U-2009) pentru probe biologice colorate. ComBiol., Programul Final Noua Zeelandă Decembrie 2009. Universitatea din Canterbury, Christchurch, Noua Zeelandă.Google Scholar
- 20. Coakley, W. T. și C. J. James. 1978. O transformare liniară simplă pentru curba de calibrare a proteinei Folin-Lowry la 1,0 mg / mL. Anal. Biochem. 85:90–97.Crossref, Medline, CAS, Google Scholar
- 21. Pinheiro, J. C. și D. M. Bates. 2000. Modele cu efecte mixte în S și S-PLUS, statistici și serii de calcul. Springer-Verlag, New York, NY.Google Scholar
- 22. Echipa De Bază De Dezvoltare R. 2009. R: un limbaj și un mediu pentru calculul statistic. R Fundația pentru calcul statistic, Viena, Austria, ISBN 3-900051-07-0, URLhttp://www.R-project.org.Google savant
- 23. Khachik, F., G. R. Beecher, J. T. Vanderslice și G. Brazdă. 1988. Artefacte cromatografice lichide și distorsiuni de vârf: interacțiunea eșantion-solvent în separarea carotenoidelor. Anal. Chem. 60:807–811.Crossref, Medline, CAS, Google Scholar
- 24. Cernik, AA 1970. Determinarea plumbului chelat cu acid etilendiaminetetra-acetic în sânge după precipitarea proteinei cu acid percloric. Brit. J. Industria Med. 27:40–42.Medline, CAS, Google Scholar
- 25. Moughan, P. J., A. J. Darragh, W. C. Smith și C. A. Butts. 1990. Acizii perclorici și tricloroacetici ca precipitanți ai proteinelor în digesta ileală endogenă de la șobolan. J. Sci. Alimente Agricole. 52:13–21.Crossref, CAS, Google Scholar
- 26. Galben, Z. M. și L. J. C. 1983. Descompunerea indusă de alcali a peroxidului de hidrogen. J. Chem. Soc. Dalton Trans. 11:2353–2357.Crossref, Google Scholar
- 27. Scopes, R. K. 1988. Purificarea proteinelor: principii și practică, a doua Ed. Springer-Verlag New York Inc., New York, NY.Google Scholar
- 28. Upreti, G. C., K. Jensen, R. Munday, D. M. Duganzich, R. Vishwanath și J. F. Smith. 1998. Studii privind activitatea aromatică a aminoacizilor oxidazei în spermatozoizii Berbecului: rolul piruvatului ca antioxidant. Anim. Reprod. Sci. 51:275–287.Crossref, Medline, CAS, Google Scholar
- 29. Holleman, M. A. F. 1904. Notă sur l ‘action de l’ eau oxygenee sur les acids-cetoniques et sur les dicetones 1.2. Recl. Trav. Chim. Pays-Bas Belg. 23:169–172.Crossref, CAS, Google Scholar