ilościowe miary cech fizjologicznych, takich jak aktywność enzymu, są często wyrażane jako jednostki aktywności na miligram białka. Chociaż opracowano liczne testy do pomiaru zawartości białka, w tym kolorymetryczne testy Amido czarnego (1), Biuretowego (2), kwasu Bicynchoninowego (3) i błękitu Coomassie 'ego (4,5), częściej stosuje się test Lowry’ ego (6) lub jego modyfikacje (7,8) niż inne testy (9). Test Lowry ’ ego jest prosty, czuły i precyzyjny i jest najczęściej cytowaną (10) procedurą do ilościowego oznaczania białek.
szeroka gama związków, które reagują z Odczynnikiem Folin-Ciocalteu fenol (Folin 's) (11), jest źródłem potencjalnej interferencji w testach Lowry’ ego i zmodyfikowanych białek Lowry ’ ego. Na szczęście korekty za pomocą odpowiedniej ślepej próby są wystarczające dla większości związków (6,7) z wyjątkiem lipidów (12), detergentów (13) i substancji barwiących (14). Trudności w oznaczaniu białek w obecności lipidów i detergentów (stosowanych w rozpuszczaniu tkanki tłuszczowej, mieliny i mięśni szkieletowych) zostały przezwyciężone przez zmodyfikowany test Lowry ’ ego (15; opisany w niniejszym artykule jako test U-1988, 16). Interferencja kolorów w określaniu zawartości białka w czerwonym winie (14,17,18) została pokonana przez zastosowanie ekstensywnej chromatografii. Powyższe podejście jest uciążliwe i niezbyt praktyczne w przypadku obsługi dużej liczby próbek. Żaden ze znanych testów białkowych nie był odpowiedni do pomiaru białek w kolorowych próbkach biologicznych, np., kolorowe owoce i warzywa, czerwone wino, pigmentowane drobnoustroje i żółć przeżuwaczy.
nasz rozwój testu U-2012 od jego poprzedników U-1988 i testu Lowry ’ ego osiągnął trzy główne zalety: (i) wygodę dzięki stabilności preparatów odczynnika, (ii) pomiar białka zarówno w bezbarwnych, jak i kolorowych próbkach biologicznych bez pogorszenia czułości oraz (iii) oznaczanie białek w bardzo niskich stężeniach. Ten nowy test będzie miał zastosowanie do ilościowego oznaczania białka zarówno w bezbarwnych, jak i kolorowych homogenizowanych próbkach biologicznych, w tym tych bogatych w lipidy (np. awokado) i tych trudnych do homogenizacji.
- materiały i metody
- próbki biologiczne – buraki, borówki i czerwone wino
- odczynniki chemiczne
- Poprawa testu U-1988
- Test U-2012
- oszacowanie interferencji barwnych w teście u-2012
- do opracowania krzywych standardowych wykorzystano krzywą wzorcową i jej parametry
- Obliczanie zawartości białka w homogenizatorach
- wyniki i dyskusja
- poprawa w teście U-1988
- szacowanie białka w kolorowych próbkach biologicznych
- ekstrakcja białka
- wyeliminuj substancje zakłócające
- standardowe krzywe i ich parametry
- zawartość białka w barwnym homogeniacie
- podziękowania
- konkurencyjne interesy
- dane uzupełniające
materiały i metody
próbki biologiczne – buraki, borówki i czerwone wino
homogenizaty buraków i borówki zostały przygotowane zgodnie z opisem w materiale uzupełniającym. Czerwone wino nie wymagało ekstrakcji białka przed testem U-2012.
odczynniki chemiczne
wszystkie odczynniki chemiczne, z wyjątkiem podchlorynu sodu i kwasu nadchlorowego (PCA), otrzymano z Sigma lub Sigma-Aldrich (St Louis, MO. USA). Podchloryn sodu pochodził z Acros Organic, New Jersey, USA. PCA uzyskano z BDH (Anglia).
Poprawa testu U-1988
przejście z buforu węglanowego na fosforanowy przy pH 12,0 poprawiło stabilność odczynnika i dało niewielki wzrost czułości. Acetonitryl wprowadzono w celu uniknięcia pęcherzyków wywołanych detergentem. NaOH zastąpił KOH, aby uniknąć wytrącania w teście białek. Ponadto zwiększono wydajność poprzez połączenie różnych składników odczynnika Lowry ’ ego w jedną mieszankę odczynników.
Test U-2012
pełne szczegóły testu U-2012 przedstawiono w materiale uzupełniającym. Protokół, skrótowo podsumowany na fig. 1, opisuje przetwarzanie czerwonego wina i homogenizowanych buraków i borówki oraz zawiera ulepszenia testu U-1988. W teście U-2012 zastosowano białka nieprzetworzone, przetworzone i poddane obróbce odwrotnej (obróbka H2O2, a następnie wytrącanie TCA lub PCA). Testy przeprowadzono na BSA, anhydrazie węglanowej, cytochromie C, dehydrogenazie izocyt, lizozymie i trypsynie w celu opracowania krzywych standardowych oraz w kolorowych próbkach biologicznych. Oznaczanie białek w próbkach biologicznych przeprowadzono poprzez kalibrację do odpowiednich krzywych standardowych.
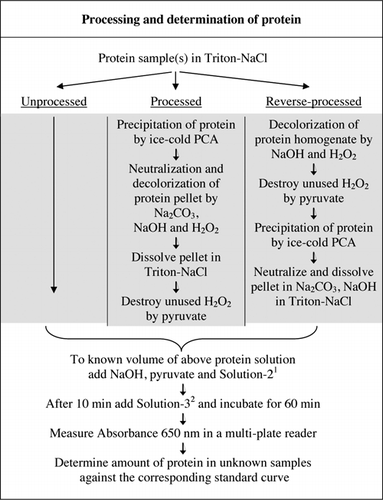
1Solution-2 zawierał siarczan miedzi (CuSO4.5H2O), Na-K-winian, SDS i acetonitryl w buforze fosforanowym 100 mM (pH 12,0). 2W przypadku roztworu-3, odczynnik fenolowy Folin-Ciocalteu rozcieńczono 1:1 z dejonizowaną wodą tuż przed użyciem.
oszacowanie interferencji barwnych w teście u-2012
interferencji barwnych oznaczono przez porównanie chłonności przetworzonych i nieprzetworzonych próbek buraków, jagód i czerwonego wina, zarówno z użyciem odczynnika Folin, jak i bez niego, jak opisano na fig.1. Stosunek został użyty do ustalenia zakresu interferencji, gdzie Abs1 to absorbancja nieprzetworzonych próbek z odczynnikiem Folina; Abs2 to absorbancja nieprzetworzonych próbek bez odczynnika Folina; Abs3 to absorbancja przetworzonych próbek z odczynnikiem Folina; Abs4 to absorbancja przetworzonych próbek bez odczynnika Folina.
do opracowania krzywych standardowych wykorzystano krzywą wzorcową i jej parametry
rozwiązanie-1B i 1c opisane w sekcji przepisy dołączonego materiału uzupełniającego. Stężenie BSA i odpowiadające im wartości absorbancji wykreślono za pomocą wykresu punktowego X-Y. Postać tego wykresu (Rysunek 2) przedstawia odpowiedź nasycającą przy wyższych stężeniach z bardzo ograniczoną początkową odpowiedzią liniową. Była to preferowana forma krzywej opisana wcześniej (20). Początkowo modelowano to za pomocą formy wykładniczej (19), ale późniejsze badania wykazały, że prostokątna hiperbola dawała lepsze dopasowanie do odpowiedzi, szczególnie przy niższych stężeniach. Ta ostatnia forma została znormalizowana i do opisu zależności absorbancja-stężenie białka Użyto następującego równania trzech parametrów:

Conc = stężenie białka,
a = Absorbancja w stężeniu Conc,
A0 = Absorbancja przy zerowym stężeniu,
AM= Absorbancja przy maksymalnym stężeniu,
C50= stężenie dające absorbancję
(AM + A0)/2.
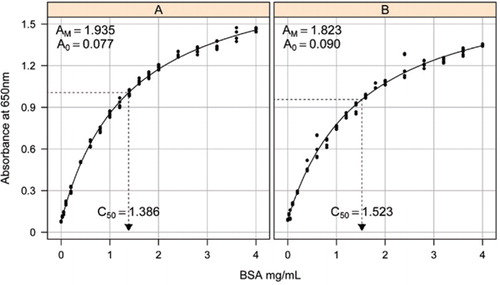
oszacowanie krzywej wzorcowej między absorbancją (650 nm) a stężeniami białka BSA wykonano na trzech technicznych replikatach do (a) testu białek nieprzetworzonych (parametry A0= 0,077, Am=1,935, C50=1.386) i (B) test przetworzonego białka (parametry A0=0,90, Am=1,823, C50=1,523). Do obserwowanych danych dopasowano prostokątny model hiperboli (równanie). Estymacje parametrów są identyfikowane na krzywych z estymacją C50 na osi x (kropkowana czarna linia).
parametr A0 określono eksperymentalnie, podczas gdy Am I C50 oszacowano za pomocą funkcji Solver programu Microsoft Excel Toolbox add-in. Do obliczenia wzorowanej absorbancji dla każdego ze standardowych stężeń (Conc) wykorzystano próbny zestaw parametrów za pomocą równania . Następnie solver otrzymał polecenie zminimalizowania resztkowego odchylenia standardowego między mierzoną i modelowaną absorbancją dla zestawu standardowego poprzez dostosowanie AM I C50.
zaobserwowaliśmy zależność między absorbancją a stężeniem, wykazując nieliniową krzywą w całym zakresie stężeń, co prawdopodobnie jest spowodowane składnikiem rozpraszania światła, który wzrasta wraz ze wzrostem stężenia białka podczas pomiaru absorbancji. Słabe dopasowanie liniowe przy niskiej absorbancji zostało również zgłoszone przez Coakleya i Jamesa (20).
Obliczanie zawartości białka w homogenizatorach
przeprowadzono testy na przetworzonych i nieprzetworzonych winach czerwonych oraz homogenizatorach buraków i borówki. BSA i inne próbki białka były traktowane identycznie dla odpowiednich krzywych standardowych w celu określenia wartości A0, AM I C50. Parametry te zostały następnie wykorzystane do konwersji absorbancji próbki (a) do stężenia białka w każdym homogeniacie za pomocą:

ponieważ równanie ma postać nasycającą, czułość zmniejsza się wraz ze wzrostem absorbancji (a), a tym samym stężenia. Błędy w estymacjach białek można zminimalizować poprzez dostosowanie stężeń homogenianów w teście tak, aby nie przekraczały one nadmiernie wartości C50.
wartość Conc Homogeniatu przekształcono następnie do stężenia białka w tkance (Conc w tkance w mg/g tkanki), stosując następujący wzór:

w przypadku gdy Homogeniat Conc (w mg białka/mL) został skorygowany o jakiekolwiek wstępne stężenie lub rozcieńczenie podczas badania. Procent homogenizacji wynosił 100 g tkanki homogenizowanej do całkowitej objętości 200 mL (w naszym przypadku 50%).
w oddzielnym badaniu zastosowano prostokątny model hiperboli z wykorzystaniem nieliniowego pakietu efektów mieszanych (nlme) (21) W R (22) (Rysunek 2). Każde rozwiązanie BSA, wykonane niezależnie w laboratorium, było modelowane jako efekt losowy, ze wspólnym współczynnikiem A0, ale innym współczynnikiem AM I C50. Modeluje to hierarchię replikacji próbek biologicznych i replikacji testów technicznych.
wyniki i dyskusja
poprawa w teście U-1988
ograniczeniem testu u-1988 i testu Lowry ’ ego jest niestabilność odczynnika na bazie węglanu. Bufor węglanowy (pH 11,4 przy 2% = 188,7 mM) w U-1988 został zastąpiony fosforanem 40 mM przy wartościach pH w zakresie od 11,4 do 12,5. Obliczono początkowe odchylenia od standardowych krzywych testu białkowego z użyciem BSA przy 0,5 mg BSA / mL i 1,0 mg BSA / mL. Początkowe nachylenia z buforami fosforanowymi przy pH 11,4 i przy optymalnym pH 12,0 wynosiły 99 x10-6 i 197 x10-6. Nachylenie buforu węglanowego (pH 11,4) wynosiło 162 x10-6.Ponieważ wartość nachylenia jest bezpośrednim wskaźnikiem czułości testu, bufor fosforanowy (pH 12.0) wybrano, aby zastąpić bufor węglanowy, co daje 25% wzrost czułości.
większą stabilność uzyskano przez zwiększenie stężenia buforu fosforanowego do 100 mM. otrzymany roztwór fosforanu/CuSO4/Na-K-winianu był stabilny w temperaturze pokojowej przez dwa tygodnie, znacznie dłużej niż roztwór węglanu / CuSO4 / na-K-winianu, który musi być przygotowywany codziennie przed oznaczeniem białkowym. Do wszystkich przyszłych eksperymentów użyto 100 mm fosforanu (pH 12,0) do przygotowania roztworu CuSO4 / Na-K-winianu. Uważamy, że zastąpienie węglanu fosforanem zwiększy wygodę testu U-2012.
pęcherzyki wywołane detergentem stają się głównym źródłem błędów w pomiarach absorbancji przy użyciu czytnika płyt wielodrożnych (nie jest to problem z kuwetami). Pęcherzyki te zostały znacznie zmniejszone przez dodanie wielu rozpuszczalników polarnych (np. aceton, acetonitryl, etanol i metanol). Acetonitryl, najbardziej polarny z tych rozpuszczalników (23), został wybrany ze względu na jego skuteczność i włączony do roztworu-2 (patrz rysunek 1 Podpis i przepisy sekcji materiału uzupełniającego).
bufor fosforanowy, CuSO4, Na-K-winian, SDS i acetonitryl można dodawać indywidualnie, a kolejność ich dodawania nie wpływa na otrzymaną absorbancję. Jednak stosowanie wstępnie zmieszanego roztworu dodatkowo zwiększa wygodę, zwłaszcza gdy ma być badana duża liczba próbek. W związku z tym pogrupowaliśmy te składniki mieszanki testowej w roztwór-2 (Fig.1). Taki zmieszany roztwór nie był wykonalny dla pierwotnego testu Lowry ’ ego (6) z powodu niestabilności roztworu węglanu. Próba włączenia rozwiązania-3 do rozwiązania-2 doprowadziła do dramatycznego ograniczenia rozwoju koloru niebieskiego i nie była dalej rozważana.
szacowanie białka w kolorowych próbkach biologicznych
ekstrakcja białka
białka z buraka i borówki jagodowej ekstrahowano w roztworze Triton X-100-NaCl z łagodną homogenizacją. Takie homogenizatory zachowują swoją aktywność enzymatyczną (15). Ta ekstrakcja nie była wymagana dla czerwonego wina.
wyeliminuj substancje zakłócające
w przypadku próbek kolorowych konieczne jest usunięcie interferencji spowodowanej nieodłącznym kolorem próbki i innymi substancjami niebiałkowymi, które reagują z odczynnikami białkowymi przed kolorymetrycznym oznaczeniem białek. Nowością U-2012 jest opracowanie protokołu odbarwiania zgodnego z kolorymetrycznym testem białkowym.
odbarwianie barwnych pigmentów podchlorynem sodu lub H2O2 i selektywne wytrącanie białek przez PCA lub TCA rozważano w celu usunięcia substancji zakłócających. Podchloryn sodu, H2O2, TCA i PCA oceniano pod kątem ich zgodności z testem U-2012 przy użyciu BSA jako białka testowego. Pomiędzy podchlorynem sodu a H2O2 tylko H2O2 był zgodny, ponieważ w obecności podchlorynu powstał osad. Białka wytrącone przez TCA lub PCA mogą być oznaczane przez U-2012 po odpowiedniej neutralizacji resztkowego kwasu w granulce. Stwierdzono wyższość PCA nad TCA dla wytrącania białek (24,25). Natomiast w naszej ocenie porównawczej ujawniono podobne wartości C50 dla PCA (1,395) i TCA (1,400). Preferowaliśmy PCA, ponieważ jest łatwo dostępny w postaci gotowego roztworu (70% v/v) i dlatego łatwo rozcieńcza się do wymaganej wytrzymałości. TCA jest higroskopijnym ciałem stałym, które trudno jest dokładnie zważyć ze względu na zmienną zawartość wody.
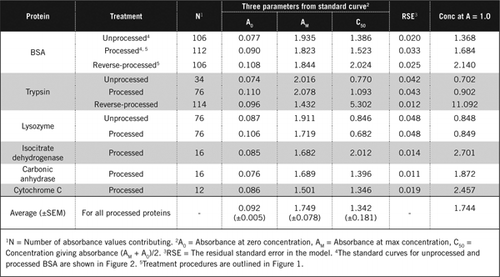
istnieją dwa możliwe sposoby łączenia PCA i H2O2. W przypadku” przetworzonych ” białek leczenie PCA poprzedzało leczenie H2O2, a w przypadku „przetworzonego” białka leczenie H2O2 poprzedzało wytrącanie PCA. Zaletami stosowania „przetworzonego” białka było usunięcie wielu substancji zakłócających w supernatancie i możliwa inaktywacja enzymów proteolitycznych podczas przygotowywania próbki. Potwierdzono to poprzez oznaczanie trypsyny przetworzonej i przetworzonej odwróconej oraz BSA (patrz Tabela 1). Tylko przetworzone próbki zostały wykorzystane do określenia rzeczywistej zawartości białka w kolorowych próbkach biologicznych
zarówno obróbka PCA, jak i H2O2 kolorowych próbek była konieczna do eliminacji zakłóceń w teście U-2012. Wytrącanie kwasu z kolorowych próbek nie usunęło całkowicie zakłóceń. W przypadku wszystkich kolorowych próbek, w supernatancie odrzucono pewien kolor, ale granulki również były kolorowe. Kolor został wyeliminowany z granulek przez obróbkę H2O2. Warunki alkaliczne były wymagane zarówno dla skutecznej odbarwiania przez H2O2 (26), jak i rozwoju koloru przez odczynnik Folin, aby zapewnić prawidłowy pomiar poziomu białka. Chociaż zarówno NaOH, jak i KOH mogły zapewnić wymaganą zasadowość, tylko NaOH był zgodny z testem U-2012. W obecności KOH powstał osad. W granulkach PCA zneutralizowano przy użyciu Na2CO3 i NaOH (27). Podczas badania dodano dodatkowy NaOH; zoptymalizowana objętość wynosiła od 50 do 70 µL (rutynowo stosowano 60 µL); patrz Fig.1.
buraki, jagody i czerwone wino odbarwiono 15 µL 30% H2O2, stosując odpowiednio 0,5 i 2 godziny w temperaturze 50°C i temperaturze pokojowej. 20 mikrolitrów 30% H2O2 przez 1 h w temperaturze 50°C zostało użytych do radzenia sobie z silniejszymi próbkami barwnymi. Utlenianie substancji takich jak cukry związane z białkami przez H2O2 w temperaturze 50°C wydaje się krytyczne, ponieważ przetwarzanie w temperaturze pokojowej zawyża zawartość białka. W przypadku buraka ćwikłowego przetwarzanie w temperaturze 50°C zmniejszyło pozorną wartość szacunkową białka do 14% wartości nieprzetworzonej, podczas gdy przetwarzanie w temperaturze pokojowej zmniejszyło tę wartość jedynie o połowę.
z testów kolorymetrycznych przeprowadzonych po obróbce nadtlenkiem wodoru wynika, że niektóre H2O2 nie zostały wykorzystane do odbarwiania. W takiej próbce kolor końcowy testu Lowry ’ ego został częściowo zniszczony. W związku z tym konieczne było zniszczenie pozostałego nadtlenku wodoru przed badaniem białek. Istnieją dwa źródła H2O2 w teście U-2012; H2O2 dodany do odbarwiania i H2O2 obecny jako zanieczyszczenie w Triton X-100 (0,22%, informacja o produkcie: Triton X-100, www.sigmaaldrich.com). nadtlenek wodoru jest zwykle rozkładany przez enzym katalazę. Jednak wysokie pH testu białkowego inaktywowałoby znane katalazy. Ponadto dodanie katalazy prowadziłoby do dodania dodatkowego białka. Wybraliśmy chemiczne niszczenie H2O2 przy użyciu pirogronianu (28). Chemia pirogronianu-H2O2 równanie interakcja jest dobrze ugruntowany (28,29). Pirogronian niszczy H2O2 w temperaturze pokojowej według następującej reakcji:

pozostałość H2O2 w zawiesinie granulatu została zniszczona przez potraktowanie 0,9 M pirogronianem (1,5 x stężenie H2O2) przez 0,5 godziny w temperaturze pokojowej. Aby przeciwdziałać zanieczyszczającemu H2O2 w Tritonie X-100, dodano również dodatkowy pirogronian w teście białkowym (Fig.1). Dodanie pirogronianu dawało niższą absorbancję dla ślepej próby niebiałkowej . Sugerujemy, że zanieczyszczenie nadtlenkiem w Triton X-100 reaguje z acetonitrylem w roztworze-2, dając nieco wyższą chłonność.
zakłócenia koloru związane z kolorowymi próbkami biologicznymi nie mogą być po prostu brane pod uwagę poprzez przeprowadzenie testu białkowego w przypadku braku odczynnika Folinowego. Obliczone współczynniki (Abs1-Abs2) / (Abs3-Abs4) wskazywały, że interferencja koloru próbki była najwyższa dla wina czerwonego (=40), a mniejsza dla Borówki (=6) i buraka (=2). Interferencja ta przełożyła się na nienormalnie wysokie szacunki rzeczywistych poziomów białka; na przykład stężenie białka przy użyciu nieprzetworzonych i przetworzonych homogenizatorów buraczanych (odpowiednio 20,21 w porównaniu z 2,89 mg białka / G tkanki). Oprócz interferencji barw, czerwone Wino i homogenizatory buraków i borówki mogą zawierać substancje, które będą reagować z Odczynnikiem Folin w teście U-2012 (e.g., małe peptydy i cukry złożone). Usunięto je przez wybiórcze wytrącanie białek zimnym lodem PCA w końcowym stężeniu 5% (Fig.1).
standardowe krzywe i ich parametry
Standardowe krzywe dla nieprzetworzonych i przetworzonych BSA przedstawiono na rysunku 2. Pochodne parametry (A0, AM I C50) są również wymienione w tabeli 1 dla BSA i innych białek.
wyniki pokazują, że pozostały błąd standardowy w modelu jest niski (0,012 do 0,048), co wskazuje na lepsze dopasowanie danych do prostokątnego trendu hiperboli. W celu porównania informacji między różnymi białkami i ich przetwarzaniem parametry przekształcono na stężenie dla absorbancji = 1,0 przy 650 nm (prawa kolumna w tabeli 1).
wyniki te pokazują, że utrata białka (w porównaniu z nieprzetworzonym białkiem) w przetworzonych próbkach była mniejsza niż w próbkach poddanych odwrotnej obróbce. Strata ta była bardziej widoczna w przypadku trypsyny i można ją wyjaśnić na podstawie jej aktywności autokatalitycznej podczas przetwarzania odwrotnego. Zalecamy, aby protokół „przetworzony” (materiał uzupełniający) był przestrzegany tylko w przypadku próbek biologicznych, które mogą zawierać enzymy proteolityczne.
w oryginalnym teście Lowry ’ ego (6) i jego zmodyfikowanej wersji U-1988 (15) do ilościowego oznaczania białka wykorzystano jedynie liniową część krzywej wzorcowej uzyskaną przez wykreślenie absorbancji względem ilości białka. W teście U – 2012 korzystamy z danych bardziej efektywnie, dopasowując prostokątne równanie hiperboli opisane w sekcji Materiały i metody zgodnie z coakleyem i Jamesem (20).
zawartość białka w barwnym homogeniacie
stężenia białka w nieznanych próbkach obliczono za pomocą równania i w stosunku do przetworzonego standardu BSA i średniej wszystkich przetworzonych białek wymienionych w tabeli 1. Ten ostatni będzie bliżej prawdziwego oszacowania dla próbek biologicznych, które zawierają mieszaninę białek. Ilość białka w borówce i burakach w porównaniu z czerwonym winem oszacowaliśmy odpowiednio na około 60 i 230-krotnie (Tabela 2).
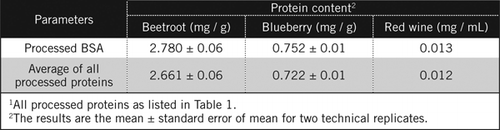
podobnie jak BSA, czerwone Wino i 50% homogenizatory buraka i borówki były przetwarzane przez strącanie PCA i odbarwianie przez H2O2 (ryc. 1). Na tym etapie próbki biologiczne zatężono 40 razy dla czerwonego wina i 4 razy dla buraka i borówki. Podobnie BSA (2 mg/mL) również zatężono 4 razy do 8 mg/mL. Do obliczenia zawartości białka wykorzystano absorbancję kolorowych próbek, która była zbliżona do absorbancji dla C50 (dla nieprzetworzonego BSA), zgodnie z równaniem i.
podsumowując, w teście U-2012 zastosowano stabilne odczynniki, zapewniając lepszą czułość (nawet w przypadku bezbarwnych próbek biologicznych) i przezwyciężenie interferencji wywołanej kolorem dla kolorowych próbek biologicznych. Test U-2012 nie jest ograniczony do liniowej Części odpowiedzi między stężeniem białka a absorbancją i umożliwia bardziej efektywne wykorzystanie danych w obszarze nieliniowym poprzez prostokątny model krzywej hiperbolicznej dopasowany do standardów przy użyciu prostych procedur w programie Microsoft Excel.
podziękowania
autorzy uznają Foundation for Research, Science and Technology New Zealand za wsparcie finansowe (C06X0809).
konkurencyjne interesy
autorzy nie deklarują konkurencyjnych interesów.
dane uzupełniające
aby zapoznać się z danymi uzupełniającymi dołączonymi do niniejszego artykułu, odwiedź stronę internetową czasopisma pod adresem: www.future-science.com/doi/suppl/10.2144/000113818
- 1. Kaplan, R. S. and P. L. Pedersen. 1985. Oznaczanie mikrogramowych ilości białka w obecności miligramowych poziomów lipidów za pomocą amido black 10B.Anal. Biochem. 150:97–104.Crossref, Medline, CAS, Google Scholar
- 2. Gornall, A. G., C. J. Bardawill, and M. M. David. 1949. Oznaczanie białek surowicy za pomocą reakcji biuret. J. Biol. Chem. 177:751–766.Medline, CAS, Google Scholar
- 3. Smith, P. K., R. I. Krohn, G. T. Hermanson, A. K. Mallia, F. H. Gartner, M. D. Provenzano, E. K. Fujimoto, N. M. Goeke, et al.. 1985. Pomiar białka przy użyciu kwasu bicynchoninowego. Anal. Biochem. 150:76–85.Crossref, Medline, CAS, Google Scholar
- 4. Bradford, M. M. 1976. Szybka i wrażliwa metoda oznaczania ilościowego ilości mikrogramowych białek z wykorzystaniem zasady wiązania białkowo-barwnikowego. Anal. Biochem. 72:248–254.Crossref, Medline, CAS, Google Scholar
- 5. Zor, T. i Z. Selinger. 1996. Linearyzacja testu białek Bradforda zwiększa jego czułość: badania teoretyczne i eksperymentalne. Anal. Biochem. 236:302–308.Crossref, Medline, CAS, Google Scholar
- 6. Lowry, O. H., N. J. Rosbrough, A. L. Farr, and R. J. Randall. 1951. Pomiar białka za pomocą odczynnika fenolowego Folin. J. Biol. Chem. 193:265–275.Medline, CAS, Google Scholar
- 7. Peterson, G. L. 1979. Review of the folin phenol protein quantification method of Lowry, Rosebrough, Farr and Randall. Anal. Biochem. 100:201–220.Crossref, Medline, CAS, Google Scholar
- 8. Sapan, C. V., R. L. Lundablad i N. C. Price. 1999. Kolorymetryczne techniki oznaczania białek. Biotechnol. Appl. Biochem. 29:99–108.Medline, CAS, Google Scholar
- 9. Okutucu, B., A. Dınçer, Ö. Habib, and F. Zıhnıoglu. 2007. Porównanie pięciu metod oznaczania całkowitego stężenia białek w osoczu. J. Biochem. Biophys. Metody 70:709-711.Crossref, Medline, CAS, Google Scholar
- 10. Kresge, N., R. D. Simoni, and R. L. Hill. 2005. Najczęściej cytowany artykuł w historii publikacji: oznaczanie białek autorstwa Olivera H. Lowry ’ ego. J. Biol. Chem. 25:280.Google Scholar
- 11. Everette, J. D., Q. M. Bryant, A. M. Green, Y. A. Abbey, G. W. Wangila, and R. B. Walker. 2010. Dokładne badanie reaktywności różnych klas związków wobec odczynnika Folin-Ciocalteu. J. Agric. Chem.Żywności 58:8139–8144.Crossref, Medline, CAS, Google Scholar
- 12. Eichberg, J. and L. C. Mokrasch. 1969. Interferencja utlenionych lipidów w oznaczaniu białka metodą Lowry ’ ego. Anal. Biochem. 30:386–390.Crossref, Medline, CAS, Google Scholar
- 13. Dulley, J. R. and P. A. Grieve. 1975. Prosta technika eliminacji interferencji detergentów w metodzie Lowry ’ ego oznaczania białek. Anal. Biochem. 64:136–141.Crossref, Medline, CAS, Google Scholar
- 14. Brillouet, J.-M., M.-P. Belleville, and M. Moutounet. 1991. Możliwe kompleksy białkowo-polisacharydowe w winach czerwonych. Am. J. Enol. Vitic. 42:150–152.CAS, Google Scholar
- 15. Upreti, G. C., R. A. Ratcliff i P. C. Riches. 1988. Estymacja białek w tkankach zawierających wysoki poziom lipidów: modyfikacje metody Lowry ’ ego oznaczania białek. Anal. Biochem. 168:421–427.Crossref, Medline, CAS, Google Scholar
- 16. Upreti, G. C., C. Davis, and J. Oliver. 1991. Przygotowanie reprezentatywnych homogeniatów tkanek biologicznych: wpływ soli na ekstrakcję białka. Anal. Biochem. 198:298–301.Crossref, Medline, CAS, Google Scholar
- 17. Smith, M. R., M. H. Penner, S. E. Bennett, and A. T. Bakalinsky. 2011. Ilościowy test kolorymetryczny dla białka całkowitego zastosowanego do czerwonego wina Pinot Noir. J. Agric. Chem.Żywności 59:6871–6876.Crossref, Medline, CAS, Google Scholar
- 18. Wigand, P., S. Tenzer, H. Schild, and H. Decker. 2009. Analiza składu białka wina czerwonego w porównaniu z winami różowymi i białymi metodą elektroforezy i wysokociśnieniowej chromatografii cieczowej-spektrometrii masowej (HPLC-MS). J. Agric. Chem.Żywności 57:4328–4333.Crossref, Medline, CAS, Google Scholar
- 19. Upreti, G. C., Y. Wang, A. Sharrock, N. Feisst, M. Davy, and B. Jordan. 2009. Stabilny i wrażliwy test białkowy (zmodyfikowany Test U-2009) dla kolorowych próbek biologicznych. ComBiol., Nowa Zelandia Program Końcowy Grudzień 2009. University Of Canterbury, Christchurch, Nowa Zelandia.Google Scholar
- 20. Coakley, W. T. and C. J. James. 1978. Prosta transformata liniowa dla krzywej kalibracji białka Folin-Lowry do 1,0 mg/mL. Anal. Biochem. 85:90–97.Crossref, Medline, CAS, Google Scholar
- 21. Pinheiro, J. C. and D. M. Bates. 2000. Modele efektów mieszanych w serii S I S-PLUS, Statystyka i obliczenia. Springer-Verlag, New York, NY.Google Scholar
- 22. R Development Core Team. 2009. R: język i środowisko do obliczeń statystycznych. R Foundation for Statistical Computing, Wiedeń, Austria, ISBN 3-900051-07-0, URL http://www.R-project.org.Google Scholar
- 23. Chachik, F., G. R. Beecher, J. T. Vanderslice, and G. Bruzda. 1988. Artefakty chromatografii cieczowej i zniekształcenia szczytowe: interakcja próbka-rozpuszczalnik W separacji karotenoidów. Anal. Chem. 60:807–811.Crossref, Medline, CAS, Google Scholar
- 24. Cernik, A. A. 1970. Oznaczanie ołowiu schelatowanego kwasem etylenodiaminetetra-octowym we krwi po wytrąceniu białka kwasem nadchlorowym. Brit. J. Industry Med. 27:40–42.Medline, CAS, Google Scholar
- 25. Moughan, P. J., A. J. Darragh, W. C. Smith, and C. A. Butts. 1990. Kwasy nadchlorowe i trichlorooctowe jako substancje strącające białka w endogennej trawie jelitowej szczura. J. Sci. Food Agric. 52:13–21.Crossref, CAS, Google Scholar
- 26. Galbács, Z. M. and L. J. Csányi. 1983. Indukowany alkaliami rozkład nadtlenku wodoru. J. Chem. Soc., Dalton Trans 11:2353–2357.Crossref, Google Scholar
- 27. Scopes, R. K. 1988. Oczyszczanie białek: zasady i praktyka, Wyd.drugie Springer-Verlag New York Inc., Nowy Jork, NY.Google Scholar
- 28. Upreti, G. C., K. Jensen, R. Munday, D. M. Duganzich, R. Vishwanath, and J. F. Smith. 1998. Badania nad aktywnością oksydazy aminokwasów aromatycznych w plemnikach ram: rola pirogronianu jako przeciwutleniacza. Anim. Reprod. Sci. 51:275–287.Crossref, Medline, CAS, Google Scholar
- 29. Holleman, M. A. F. 1904. Notice sur l 'action de l’ eau oxygenee sur les acids α-cetoniques et sur les dicetones 1.2. Recl. Trav. Chim. Pays-Bas Belg. 23:169–172.Crossref, CAS, Google Scholar