Einleitung
Der Glyoxylatzyklus umgeht die Decarboxylierungsschritte des Krebszyklus und bewirkt die Assimilation von flüssigem Kohlenstoff aus Acetyl-CoA. Isocitratlyase (EC 4.1.3.1) und Malatsynthase (EC 2.3.3.9) sind die einzigen Enzyme für diesen Stoffwechselweg. Der Glyoxylatzyklus tritt bei der Samenkeimung auf (Eastmond & Graham, 2001), bei einigen wirbellosen Tieren wie C. elegans (Edwards, Copes, Brito, Canfield, & Bradshaw, 2013) und in Mikroorganismen wie E. coli (Nelson & Cox, 2009) und S. cerevisiae (Rezaei, Aslankoohi, Verstrepen, & Courtin, 2015). Der Weg wurde 1957 bei Untersuchungen an Mikroorganismen beschrieben, die auf Acetat und Ethanol als Kohlenstoffquelle wuchsen (Kornberg & Krebs, 1957).
Acetyl-CoA bindet im Glyoxylatzyklus an Oxalacetat und produziert Citrat und Isocitrat. Letzteres erzeugt Glyoxylat und Succinat in der durch Isocitratlyase katalysierten Reaktion. Ferner kondensiert Glyoxylat mit einem zweiten Acetyl-CoA-Molekül in einer durch Malatsynthase katalysierten Reaktion, nachdem das erzeugte Malat zu Oxalacetat oxidiert und somit das Zwischenprodukt regeneriert wurde (Schritte B-1 bis B-5, Abbildung 1). Bei jeder Wiederholung des Glyoxylatzyklus werden zwei Acetyl-CoA-Moleküle eingeführt, und es erfolgt die Flüssigsynthese eines Succinatmoleküls (Beeckmans, 2009; Berg, Stryer, & Tymoczko, 2015; Torres & Marzzoco, 2007).
Ferner werden Kohlenhydrate, die aus Reservefetten in Ölsaaten hergestellt werden, an die Pflanze verteilt und als Kohlenstoffquelle genutzt, bis sich die Chloroplasten in den Foliolen zu differenzieren beginnen und mit der Photosynthese beginnen. Fette und Öle sind wichtige chemische Strukturen bei der Kohlenstoffspeicherung vieler Samen, wenn auch in reduzierter Form, die wichtige agronomische Arten wie Sojabohnen, Erdnüsse, Baumwolle und Sonnenblumen umfassen (Junqueira, 2012). Laurinsäure (12:0), Myristinsäure (14:0), Palmitinsäure (16:0) und Stearinsäure (18:0) sind die wichtigsten gesättigten Fettsäuren in Gemüse; ungesättigte Säuren sind dagegen Ölsäure (18:1(Δ9)), Linolsäure (18:2(Δ9, 12)) und Linolensäure (18:3(Δ9, 12, 15)) (Taiz & Zeiger, 2002).

Abbildung 1.
Fettsäuren oder Acetatkatabolismus produzieren Energie durch den Glyoxylatzyklus, was die Integration zwischenß-Oxidation (Schritte A-1 bis A-4), Glyoxylatzyklus (Schritte B-1 bis B-5), Krebszyklus (Schritte C-1 bis C-8), Gluconeogenese (Schritte D-1 bis D-3) und Glykolyse (Schritt E-1).
Fettsäuren mit einer großen Anzahl von Kohlenstoffen führen bei Tieren nicht zur Kohlenhydratsynthese (Nelson & Cox, 2009). Diese Tatsache tritt auf, weil es keine Nettoproduktion von Oxalacetat zur Unterstützung der Glukoneogenese gibt, da in diesem Fall Fettsäuren zu Acetyl-CoA katabolisiert werden. Das Zwischenprodukt wird im Krebs-Zyklus oxidiert, und für jeweils zwei Kohlenstoffe, die als Acetyl-CoA eintreten, gehen zwei Kohlenstoffe als CO2 verloren (Eastmond & Graham, 2001; Nelson & Cox, 2009).
Das Fehlen des Glyoxylatzyklus bei Säugetieren kann ein Ziel selektiver Toxizität bei der Entwicklung antimikrobieller Wirkstoffe sein. Die inhibitorische Aktivität von 3-Nitropropionamiden auf Isocitratlyase bei M. tuberculosis (Sriram et al., 2011), Bromphenole (Oh et al., 2010) und Alkaloide aus Schwämmen auf Isocitratlyase in C. albicans (Lee et al., 2008; Oh et al. 2010) analysiert.
Zu den energetischen Aspekten des Lipidkatabolismus über den Glyoxylatzyklus liegen in der Literatur keine Daten vor. In diesem Zusammenhang untersuchte die vorliegende Forschung die Beziehung zwischen der im Glyoxylatzyklus produzierten Energiemenge und der Fettsäurekettengröße und verglich die Energieeffizienz in Zellen, die diesen Ansatz verwenden, mit den tierischen Zellen, denen der Glyoxylatzyklus fehlt.
Materialund Methoden
Eine Energiebilanz von Schritten mit Produktion und Verbrauch von Energie wurde durchgeführt, um eine Gleichung zu erhalten, die direkt die Kettengröße einer Fettsäure mit einem Kohlenstoffzahl-Vielfachen von 4 mit der durch ihren Abbau erzeugten Energie in Beziehung setzt. In der generierten Gleichung wurden die Energiekosten für die Aktivierung der Fettsäure für Acyl-CoA nicht berücksichtigt. Es ist ein Schritt vor der β-Oxidation und beinhaltet das Brechen von zwei hochenergetischen Phosphatbindungen.
Die vorgeschlagene Gleichung wurde validiert, indem die durch ihre Anwendung erhaltene ATP-Menge mit den ATP-Raten verglichen wurde, die durch Zugabe der ATP-Menge erhalten wurden, die durch oxidative Phosphorylierung und Phosphorylierung auf Substratebene in jedem Schritt der Stoffwechselwege erzeugt wurde, die am Fettsäureabbau beteiligt sind, der den Glyoxylatzyklus umfasst. Der Fettsäureabbau umfasst β-Oxidation in Glyoxysomen, Glyoxylat-Zyklus, Krebs-Zyklus, Teil der Gluconeogenese und Glykolyse, die Pyruvat-Decarboxylierung und wieder Krebs-Zyklus (Abbildung 1).
Die Energieeffizienz des Fettsäureabbaus im Glyoxylatzyklus wurde mit dem Fettsäurekatabolismus in tierischen Zellen verglichen. Zuvor validierte Gleichungen wurden in diesem Vergleich verwendet und die Energiemenge, die bei der β-Oxidation erzeugt wird, wie sie bei Tieren auftritt, wurde berechnet (Gonçalves, Valduga, & Pereira, 2012), gekoppelt an Gleichungen, die in der aktuellen Forschung entwickelt wurden. Der Energieeffizienzfaktor im Glyoxylatzyklus (E%) wurde durch das Verhältnis von ATP definiert, das im Fettsäurekatabolismus unter Berücksichtigung des Glyoxylatzyklus und des tierischen Katabolismus produziert wird. Der Parameter wurde gegen die Anzahl der Kohlenstoffatome der Fettsäure aufgetragen. Darüber hinaus wurde die durch die CH2-Einheit erzeugte ATP-Rate als Funktion der Anzahl der Kohlenstoffe der Fettsäurekette dargestellt. AutoCAD Prism 6.0 generierte die mathematischen Modelle, die die Beziehung zwischen den Variablen darstellten.
Ergebnisseund Diskussion
Die Mitochondrienmatrix ist der Hauptort, an dem die Oxidation von Fettsäuren in tierischen Zellen stattfindet. Der Katabolismus dieser Biomoleküle tritt jedoch hauptsächlich in den Peroxisomen von Blattgeweben und in Glyoxysomen während der Samenkeimung der Pflanzen auf (Buchanan, Gruissem, Vickers, & Jones, 2015). Der Abbau von Fettsäuren in Glyoxysomen umfasst die in Tabelle 1 gezeigten Stoffwechselwege.
Parallel zur Energieerzeugung hat die Umwandlung von Fettsäuren in Kohlenhydrate andere Funktionen wie die Produktion von strukturellen Polysacchariden und Nukleotiden über den Pentosephosphatweg (Nelson & Cox, 2009). In Bezug auf den Energiegewinn umfasst der kürzere und energetisch wirtschaftlichere Weg, der wahrscheinlich von der Evolution ausgewählt wurde, die Gluconeogenese bis Phosphoenolpyruvat (Schritt D-3 in Abbildung 1), das auf dem glykolytischen Weg abgebaut wird.
Menge an Energie (ATP), die während des glyoxysomalen Abbaus von Fettsäuren erzeugt wird
Die ATP-Menge (x), die sich aus dem glyoxysomalen Abbau von Fettsäuren mit einem Kohlenstoffzahl-Vielfachen von 4 ergibt, gefolgt von der Glukoneogenese bis zum Phosphoenolpyruvat und seinem Katabolismus, um Energie zu erzeugen, kann durch die Summe der ATP-Raten berechnet werden, die bei der β-Oxidation (ATP β-OX) ATP C GLYOX), Krebszyklus (ATP C KREBS), Glukoneogenese (ATP OXAL-PEP) und Glykolyse/Krebszyklus wieder (ATP PEP-CO2), gemäß Gleichung (1):

Jeder Bruch der Kohlenstoff-Kohlenstoff-Bindung während der β-Oxidation in Glyoxysomen und Peroxisomen erzeugt ein NADH, das durch inoxidative Phosphorylierung 2,5 ATPs erzeugt (Schritt A-3 in Abbildung 1). In Peroxisomen wird die Elektronenenergie, die während des ersten Schritts der β-Oxidation entfernt wird, als Wärme abgeführt (Schritt A-1 in Abbildung 1).

Daher gibt es keine Nettoenergie aus der FADH2-Oxidation (Buchanan et al., 2015). Da α-Kohlenstoff mit Coenzym A verestert ist, tritt die β-Oxidation 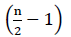 mal auf, wobei n die Kohlenstoffzahl in der Fettsäurekette ist. Die ATPs-Menge, die durch β-Oxidation im Glyoxylatzyklus erzeugt wird, ist gegeben durch Gleichung (2):
mal auf, wobei n die Kohlenstoffzahl in der Fettsäurekette ist. Die ATPs-Menge, die durch β-Oxidation im Glyoxylatzyklus erzeugt wird, ist gegeben durch Gleichung (2):

Für jeweils zwei Acetyl-CoA-Moleküle, die in den Glyoxylatzyklus geleitet werden, entsteht netto ein Succinatemolekül, was der Hälfte der Acetyl-CoA-Menge entspricht, so dass n/4succinatmoleküle entstehen. Im Krebs-Zyklus wird das Succinat zu Oxalacetat oxidiert, wobei 1 FADH2 und 1 NADH erzeugt werden, die bei der oxidativen Phosphorylierung 4 ATP produzieren (Schritte C-6 und C-8, Abbildung 1). Dieser Wert multipliziert mit n / 4succinatmolekülen wird durch Gleichung (3) ausgedrückt, die die ATP-Menge darstellt, die zuerst im Krebszyklus erzeugt wird:

Die Regeneration des Oxalacetat-Inglyoxylat-Zyklus beinhaltet die Malatoxidation, die 1 NADH erzeugt, das bei der oxidativen Phosphorylierung 2,5 ATPs liefert (Schritt B-5 in Abbildung 1). Folglich kann die im Glyoxylatzyklus erzeugte Energiemenge (ATP) durch Gleichung ausgedrückt werden(4):

Überschüssiges Oxalacetat, das im Krebszyklus produziert wird, kann auf die Glukoneogenese gerichtet sein. Um Energie zu erzeugen, erfolgt die Glukoneogenese in der Phosphoenolpyruvatbildung, wobei 1 GTP verbraucht wird (Schritt D3 in Abbildung 1), ausgedrückt in Gleichung (5). Die Glukoneogenese-Fortsetzungfür die Bildung von Metaboliten aus Hexose ist ein wichtiger Prozess bei der Keimung von Samen (Buchanan et al., 2015; Eastmond & Graham, 2001; Quettier& Eastmond, 2009):

Phosphoenolpyruvatkatabolismus umfasst eine Phosphorylierung auf Substratebene, die Pyruvat erzeugt (Schritt E-1, Abbildung 1), oxidative Decarboxylierung von Pyruvat (Schritt F-1) mit 1 NADHproduktion und Acetyl-CoA-Oxidation zu CO2. Bei der Acetyl-CoA-Oxidation entspricht die Produktion von 3 NADH, 1 FADH2 und 1 GTP 10 hochenergetischen Phosphatbindungen. Dieser Wert addierte sich zur Substratphosphorylierung und oxidativen Phosphorylierung, verbunden mit der NADH erzeugten Decarboxylierung von Pyruvat, in Höhe von insgesamt 13,5 ATP (Gleichung 6).

Gleichungen ersetzen (2), (3), (4),(5) und (6) in Gleichung (1) erhält man Gleichung (7). Bei der algebraischen Vereinfachungstellt Gleichung (8) ein direktes Verhältnis zwischen der produzierten Energiemenge (x) und der Größe der Fettsäurekette (n) her.

Validierung von Gleichung (8) zur Berechnung der Energie (ATP), die durch Fettsäureabbau durch den Glyoxylatzyklus erzeugt wird
Damit Gleichung (8) validiert werden kann, wurde die aus ihrer Anwendung erhaltene ATP-Menge mit der ATP-Menge verglichen, die einzeln aus der Summe der Acetyl-CoA-, NAHD- und FADH2-Moleküleanzahl und der Phosphorylierung auf Substratebene berechnet wurde, die bei der Oxidation von Fettsäuren mit einer bestimmten Anzahl von Kohlenstoffatomen in Glyoxysomen Tabelle 2). Inbeide Bedingungen sind die erhaltenen ATP-Mengen äquivalent. Unter Berücksichtigung dieser äquivalenten Ergebnisse bestimmte die in der aktuellen Studie entwickelte Gleichung die beim Lipidkatabolismus erzeugte Energiemenge unter Berücksichtigung der Integration von Stoffwechselwegen, die mehr als zwanzig Schritte umfasst.

Darüber hinaus kann die Energiebilanz für Erzeugungsgleichungen, gefolgt von ihrer Validierung, ein wichtiges Instrument für die Analyse verschiedener Stoffwechselwege sein. In der Biochemie können Aspekte wie stöchiometrische Beziehungen in Stoffwechselwegen anhand der Ergebnisse der aktuellen Forschung angegangen werden.

Vergleich Zwischen der Effizienz des Fettsäureabbaus durch den Glyoxylatzyklus und dem Tierkatabolismus
Nach früheren Studien kann die Energiemenge in tierischen Zellen, die durch den Abbau von Fettsäuren mit der Anzahl der Kohlenpaare in ATP erzeugt wird, algebraisch mit der Kettengröße der Fettsäure zusammenhängen. Diese Beziehung wird durch Gleichung (9) ausgedrückt (Gonçalves et al., 2012), die mit der in der aktuellen Studie entwickelten Gleichung (8) verglichen werden kann. Die beiden Gleichungen können verwendet werden, um die Energieeffizienz zwischen ß-Oxidation in tierischen Zellen und Zellen von Organismen, in denen der Glyoxylatzyklus stattfindet, zu vergleichen.

Durch Division von Gleichung (8) durch Gleichung (9) und Multiplikation mit 100 wird die prozentuale Effizienz (E%) des Fettsäureabbaus zur Energieerzeugung in Bezug auf den tierischen Katabolismus erhalten, wie durch Gleichung (10) ausgedrückt.

Die Darstellung von E% gegen die Fettsäurekettenlänge (Abbildung 2) bestätigt, dass die Effizienz mit zunehmender Kohlenwasserstoffkette abnimmt. Darüber hinaus erreicht die Energie, die aus der Oxidation von Fettsäuren in Zellen mit Glyoxylatzyklus gewonnen wird, weniger als 90% des Energieniveaus, das auf dem ähnlichen Weg in einer tierischen Zelle erzeugt würde.
Die ATP-Rate, die pro oxidiertem Kohlenstoffatom (ATP / n) erzeugt wird, hängt auch von der Kettenlänge der Fettsäure ab, und zwar mit einer maximalen Rate von fast sechs ATP / n (Abbildung 3-a), während diese Rate in tierischen Zellen höher ist (Abbildung 3-b).

Abbildung 2.
Vergleich zwischen der energetischen Effizienz des Fettsäureabbaus bei tierischer β-Oxidation und der β-Oxidation in Organismen mit Glyoxylatzyklusenzymen aufgrund der Fettsäurelängenkette.
Im Gegensatz zu Tieren, Gemüse und einigen Mikroorganismen ist es möglich, das Acetyl-CoA aus der Oxidation von Fettsäuren in Zucker umzuwandeln. Die Organismen kombinieren den Glyoxylatzyklus und Gluconeogenesisreaktionen, die zwischen Glyoxysomen / Peroxisomen, Mitochondrien und Cytosol kompartimentiert sind. Diese Eigenschaft gibt höhere metabolische Vielseitigkeit und erlaubt Bakterien, Azetat als Energiequelle und Anlagen zu storelipids in den Samen als Energiequelle zu verwenden, während der Keimung verwendet zu werden.

Abbildung 3.
ATP-Rate produziert durch Kohlenstoffatom (ATP / n) aufgrund der Kohlenstoffatome (n) des Säurefetts im Glyoxylatzyklus (a) und im tierischen Katabolismus (b). Die ATP / n-Rate steigt signifikant anungefähr n = 20, fortan steigt die Rate weniger signifikant an.
Schlussfolgerung
Der Abbau von Fettsäuren durch den Glyoxylatzyklus zur Energieerzeugung beinhaltet die β-Oxidation mit ihren besonderen Eigenschaften in Glyoxysomen, Glyoxylatzyklus, Krebszyklus, Gluconeogenese und Glykolyse. Trotz dieser Schritte und Stoffwechselwege kann algebraisch ein stöchiometrischer Zusammenhang zwischen der Kettenlänge von Fettsäuren und der beim Abbau erzeugten Energiemenge hergestellt werden.
Der Vergleich zwischen der Stöchiometrieenergie, die an diesen Stoffwechselwegen beteiligt ist, und der Stöchiometrieenergie der β-Oxidation, wie sie in tierischen Zellen auftritt, zeigt eine Verringerung der Energieeffizienz im Vergleich zum tierischen Stoffwechsel. Während die Umgehung von Decarboxylierungsreaktionen des Krebs-Zyklus den Organismen evolutionäre Anpassungen verleiht, wenn sie vorhanden sind, bestimmt sie auch eine geringere Energiemenge, die pro Kohlenstoffatom erzeugt wird, im Vergleich zum Abbau der Fettsäuren bei Tieren.