tämä opetusohjelma käsittelee massaspektrometrian perusnäkökohtia, jotka auttavat sinua päättämään tutkimusnäytteidesi oikeat tekniikat ja mittaukset.
- mitä massaspektrometria on?
- massaspektrometri
- Ionisaatiomenetelmät
- elektronien Törmäysionisaatio
- Kemiallinen ionisaatio
- Matriisiavusteinen Laserdesorptio
- Ilmanpaine Kemiallinen ionisaatio
- Elektrospray-ionisaatio
- ionien analyysi
- Tandem-massaspektrometria
- Erotusmenetelmät, joilla kytketään massaspektrometria
mikä on massaspektrometria?
massaspektrometria on analyyttinen tekniikka, jossa tutkitaan ionisoituneiden molekyylien kaasufaasia tavoitteena yksi tai useampi seuraavista:
- molekyylipainon määritys
- rakenteellinen Luonnehdinta
- Kaasufaasien reaktiivisuustutkimus
- seoksen aineosien kvalitatiivinen ja kvantitatiivinen analyysi.
massaspektrometria koostuu periaatteessa kaasufaasin punnitusioneista. Käytettyä välinettä voidaan pitää hienostuneena tasapainona, joka määrittää erittäin tarkasti yksittäisten atomien ja molekyylien massat. Riippuen näytteiden kemiallisista ja fysikaalisista ominaisuuksista voidaan käyttää erilaisia ionisointitekniikoita. Yksi päätekijä valittaessa mitä ionisointitekniikkaa käytetään on termolability. Näytteissä, jotka eivät ole molabiileja ja suhteellisen haihtuvia, voidaan tehokkaasti käyttää ionisaatiota, kuten elektronien törmäystä ja/tai kemiallista ionisaatiota. Termolabiilien näytteiden, kuten peptidien, proteiinien ja muiden biologisesti merkittävien näytteiden, osalta on harkittava pehmeää ionisointitekniikkaa. Käytetyimpiä pehmeitä ionisointitekniikoita ovat Elektrospray (ESI) ja Matriisiavusteinen Laserdesorptio (MALDI). Tietylle massaspektrometritekniikalle annettu nimi viittaa yleensä käytettävään ionisaatiomenetelmään.
atomi-ja molekyylimassat on määritetty suhteessa hiilen isotoopin massaan 12C, jonka atomipainoksi on määritelty tasan 12. 12C: n todellinen massa on 12 daltonia, yhden Daltonin ollessa 1.661 10-24 g. molekyylin tai ionin massa voidaan esittää daltoneina (Da) tai kilodaltoneina (kDa).
Massaspektrometrissä
Massaspektrometrissä käytetään mittalaitetta nimeltä massaspektrometri. Massaspektrometrin pääkomponentit ovat:
- Imujärjestelmä (LC, GC, suora anturi jne…)
- Ionilähde (EI, CI, ESI, APCI, MALDI jne…)
- massa-analysaattori (Kvadrupoli, TOF, Ioniloukku, Magneettisektori)
- detektori (Elektronikerroin, Mikrokanavalevyt MCPs)
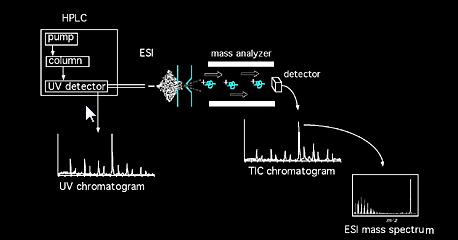
näytteet voidaan viedä massaspektrometriin suoraan kiinteiden aineiden anturilla tai seosten tapauksessa kromatografialaitteen (esim.kaasukromatografia, nestekromatografia, Kapillaarielektroforeesi jne.) välityksellä…). Kun näyte on päässyt lähteeseen, se joutuu ionisoitumaan. Lähteessä muodostuvat ionit (molekyyli-ja fragmentti-ionit) saavat jonkin verran liike-energiaa ja poistuvat lähteestä. Kalibroitu analysaattori analysoi sitten kulkevat ionit niiden massan ja varauksen suhteen funktiona. Voidaan käyttää erilaisia analysaattoreita, magneettisia, nelikulmaisia, Ioniloukkuja, Fourier-muunnoksia, lentoaikoja jne…Tämän jälkeen analysaattorikokoonpanosta poistuva ionisuihku havaitaan ja signaali rekisteröidään. Yleisiä ionisaatiomenetelmän lyhenteitä ovat:
- EI=elektronien törmäys;
- CI=Kemiallinen ionisaatio;
- SIMS=sekundaariset ionit massaspektrometri;
- FAB=nopea atomipommitus;
- LDMS=Laser Desorptiomassan spektrometri;
- PDMS=plasman Desorptiomassan spektrometri;
- TS=Thermospray;
- AS=Aerospray;
- ESMS = Electrospray Mass Spec.
yleisiä massa-analysaattorin lyhenteitä ovat:
- EB=Sähköstaattinen-magneettinen;
- IT=ioniloukku;
- Q=Quadrupole;
- Tof = lentoaika.
Ionisaatiomenetelmät
oikean ionisaatiomenetelmän valinta näytteesi analysointia varten on erittäin tärkeää. Vaikka voimme tarjota ehdotuksia, on sinun vastuullasi ymmärtää ja valita menetelmä(t) sopiva tutkimusyhdisteille.
- elektronien törmäys EI-ionisaatio
- Kemiallinen ionisaatio ci
- negatiivinen Ionikemiallinen ionisaatio
- Elektrospray-Ionisaatiomenetelmät
- Matriisiavusteinen Lazer-desorptio (ei saatavilla laitoksessamme, mutta käytettävissä kaikkialla kampuksella)
- Ilmanpaine Kemiallinen ionisaatio APCI
elektronien Törmäysionisaatio
M + E- (70ev)- – – – – > M+. + 2e –
EI-ionisaatiomenetelmä soveltuu ei-termolabiileille yhdisteille. Näytteen volatiliteetti vaaditaan. Höyryn tilassa olevia näytemolekyylejä pommittavat nopeasti liikkuvat elektronit, perinteisesti 70 eV: n energia. Tällöin muodostuu ioneja. Korkeimmasta orbitaalienergiasta irtoaa yksi elektroni, minkä seurauksena muodostuu molekyyli-ioneja. Osa tästä molekyyli-ioneista hajoaa ja muodostuu fragmentti-ioneja. Tietyn ionin pirstoutuminen johtuu sen vaatimasta ylimääräisestä energiasta ionisaatiossa. Fragmentti-ionit voivat olla parittomia elektroneja tai parillisia elektroneja. Elektronin törmäysionisaatiossa muodostuneet molekyyli-ionit ovat parittomia elektroni-ioneja. Parittomat elektronikappale-ionit muodostuvat suoralla pilkkoutumisella(esim. C – C-sidoksen suora pilkkominen). Jopa elektronikappale-ioneja muodostuu usein uudelleenjärjestäytymällä (esimerkiksi protoninsiirrolla). Näyte voidaan viedä EI-lähteeseen kaasukromatografialaitteen kautta, esimerkiksi seosten tapauksessa, tai suoraan kiinteiden aineiden näytteenottolaitteen kautta. Kokeeseen tarvittava määrä on yleensä alle mikrogramman verran materiaalia.
EI-massaspektrit sisältävät useimmissa tapauksissa intensiivisiä fragmentti-ionipiikkejä ja paljon vähemmän intensiivisiä molekyyli-ionipiikkejä. Kun molekyylien ionihuippua ei havaita massaspektrissä, voidaan molekyylien ionitiedon saamiseksi käyttää kemiallista ionisaatiota. Yksi hyödyllinen sääntö sen määrittämiseksi, onko ioni molekyyli-ioni, on Typpisääntö.
Typpisääntö: kuten edellä todettiin, EI-ionisaatiossa muodostuneet molekyyli-ionit ovat parittomia elektroni-ioneja. Jos niiden havaittu massan ja varauksen suhde on pariton, tutkittavassa molekyylissä on pariton määrä typpiatomeja. Jos tämä massan ja varauksen suhde on parillinen luku, siinä molekyylissä ei ole lainkaan tai jopa typpiatomeja.
Kemiallinen ionisaatio
orgaanisille kemisteille Kemiallinen ionisaatio (CI) on erityisen hyödyllinen tekniikka silloin, kun EI-massaspektrissä ei havaita molekyylien ioneja, ja myös silloin, kun molekyylien ionien massa-varaus-suhde vahvistetaan. Kemiallisessa ionisointitekniikassa käytetään käytännössä samaa ionilähdelaitetta kuin elektronien törmäyksessä, paitsi CI käyttää tiivistä ionilähdettä ja reagenssikaasua. Reagenssikaasuun (esimerkiksi ammoniakkiin) kohdistuu ensin elektronien törmäys. Näyte-ioneja muodostuu reagenssikaasu-ionien ja näytemolekyylien vuorovaikutuksesta. Ilmiötä kutsutaan ioni-molekyylireaktioiksi. Reagenssikaasumolekyylejä on suhteessa noin 100:1 suhteessa näytemolekyyleihin. CI-prosessissa muodostuu positiivisia ja negatiivisia ioneja. Riippuen laitteen asennuksesta (lähdejännitteet, ilmaisin jne…) vain positiivisia ioneja tai vain negatiivisia ioneja kirjataan.
CI: ssä ionimolekyylireaktiot tapahtuvat ionisoituneiden reagenssikaasumolekyylien (G) ja haihtuvien analyyttineutraalien molekyylien (M) välillä, jolloin muodostuu analyyti-ioneja. Pseudomolekyylistä Ionia MH+ (positiivinen ionitila) tai – (negatiivinen ionitila) havaitaan usein. Toisin kuin EI-menetelmällä saatavat molekulaariset ionit, mh+ ja – detektio tapahtuu suuressa saannossa ja fragmentti-ioneja havaitaan vähemmän.
positiivinen ionitila:
GH+ + M – – – – – > MH + + G
negatiivinen ionitila:
– + m——> – + G
nämä yksinkertaiset protoninsiirtoreaktiot ovat bronsted-Lowrey-mielessä todellisia Kaasufaasihappoemäsprosesseja. ”Tiivistä” ionilähdettä (paine=0,1-2 torr) käytetään maksimoimaan törmäykset, jolloin herkkyys kasvaa. Jotta nämä ionimolekyylireaktiot tapahtuisivat, niiden on oltava eksotermisiä. Protoninsiirto on yksi positiivisessa LUOTTAMUSVÄLISSÄ havaituista yksinkertaisista prosesseista:
RH+ + M – – – – > MH + + R
yksi ratkaiseva parametri tässä reaktiossa on protonin affiniteetti. Jotta reaktio tapahtuisi, molekyylin m protonin affiniteetin on oltava suurempi kuin kaasumolekyylin. Tärkeimmät CI: ssä käytetyt reagenssikaasut ovat ammoniakki, metaani ja isobutaani. Muodostuneet pääasialliset reaktantti-ionit on esitetty alla esitetyissä mekanismeissa. Reagenssikaasun valinta vaikuttaa kvasimolekyylisen ionin sirpaloitumisen laajuuteen.
metaani (positiivinen ionikemiallinen ionisaatio):
- CH4 + e —–> CH4+. + 2e ——> CH3+ + H.
- CH4+. + CH4 —–> CH5+ +CH3.
- CH4+. + CH4 —–> C2H5+ + H2 + H.
Isobutane (positive ion chemical ionization):
- i-C4H10 + e —–> i-C4H10+. + 2e
- i-C4H10+. + i-C4H10 ——> i-C4H9+ + C4H9 +H2
Ammonia (positive ion chemical ionization):
- NH3 + e —–> NH3+. + 2e
- NH3+. + NH3 ——> NH4+ + NH2.
- NH4+ + NH3 ———>N2H7+
metaanipositiivisessa ionitilassa kemiallisessa ionisaatiossa relevantit näyttepiikit ovat mh+, + ja +, mutta pääasiassa MH+. Tämä vastaa massoja M + 1, M+29 ja M+41.
isobutaanipositiivisessa ionitilassa kemiallinen ionisaatio tärkein havaittu huippu on MH+.
ammoniakkipositiivisessa ionitilassa kemiallisessa ionisaatiossa suurimmat havaitut piikit ovat MH+ ja +. Jos protonaatiokohdassa on useampi kuin yksi, voidaan nähdä lisää NH3 addukteja, jotka vastaavat arvoa +. Tämä vastaa massoja M + 1, M+18 ja M+35.
joissakin tapauksissa saattaa esiintyä protonoituneita dimeerejä tai muita addukteja; H2O: n häviämistä, jota seuraa protonaation tai adduktin ionimuodostus, on havaittavissa joissakin yhdisteluokissa. Jos tarkkailemassasi spektrissä ei näytä olevan oikeita addukti-ioneja tai se osoittaa laajaa pirstoutumista, ole varovainen, kun yrität tulkita tuloksia. Kirjallisuudessa on runsaasti tietoa tiettyihin yhdisteluokkiin sovellettavista kemiallisista ionisaatiomekanismeista.
kaksi tekijää määrittää käytettävän reagenssikaasun valinnan:
- protonin affiniteetti PA
- energian siirto
NH3 (ammoniakki) on käytetyin REAGENSSIKAASU CI: ssä, koska NH4+: n energian siirto on vähäistä esimerkiksi CH5+: aan verrattuna. Kun reagenssikaasuna on NH3, havaitaan yleensä MH+ ja MNH4+ (17 massayksikön ero).
negatiivinen Ionikemiallinen ionisaatio
kolme mekanismia voidaan alleviivata:
- elektronien kaappausreaktio, joka johtuu hitaasti liikkuvien, matalaenergisten ”termisoitujen” elektronien saavuttamisesta, jotka saattavat siirtyä tehokkaammin näytemolekyyleihin.
- Elektroninsiirto ionisoidusta reagenssikaasusta (esim.NH2 – voi siirtää elektronin molekyylille, jolla on suurempi elektroniaffiniteetti kuin NH2).
- Reagenssikaasuionit osallistuvat todellisiin CI-reaktioihin (esim.protonin abstraktio suhteellisten happojen mukaan).
negatiivisessa ionikemiallisessa ionisaatiomassaspektrissä havaitut molekyyli-ionit ovat yleensä M-tai -.
Elektrospray-Ionisaatiomenetelmä
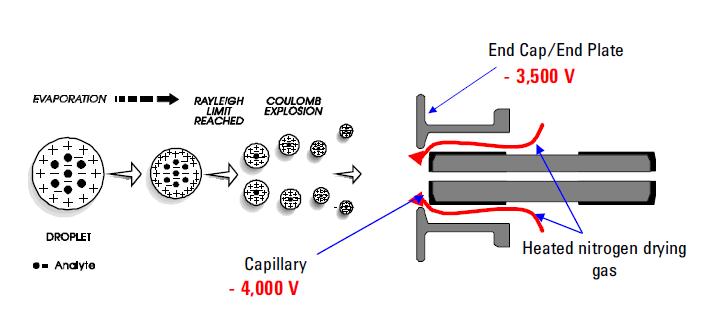
käytetyimpiä sumutusionisointitekniikoita on Electrospray Ionisation (ESI). Tämä tekniikka on edelleen valittu menetelmä termolabiilien kemikaalien analysointiin. Sen ominaisuudet on hyvin dokumentoitu. Se käyttää SÄHKÖJÄNNITYSTÄ ESI-koettimen ulostulon (esim.kapillaari) ja laskurielektrodin välillä, joka sijaitsee muutaman millimetrin päässä koettimesta. Prosessin tuloksena syntyy voimakkaasti varautuneita pisaroita suoraan infusoidusta liuoksesta. Monistuvat ja / tai yksittäin varautuneet analyyttimolekyylit desorboituvat ruiskutetuista pisaroista ja niistä otetaan näyte muun massaspektrometrin läpi. Eri on tunnettu kyvystään tuottaa moninkertaisesti varautuneita molekyyli-ioneja monista erilaisista polymeereistä, kuten proteiini-ja DNA-fragmenteista; se mahdollistaa myös yksin varautuneiden pienimolekyylisten polaaristen lajien, kuten lääkkeiden ja lääkeainemetaboliittien, herkän havaitsemisen. Positiivisten tai negatiivisten ionien muodostuminen (riippuen sovelletun Sähkökentän merkistä) tapahtuu suuressa saannossa. Positiivisessa ionitilassa massaspektrissä yleensä havaitut protonoidut ja/tai emäksiset adduktioanalyyttimolekyylit. Negatiivisessa ionitilassa havaitaan deprotonoituja analyyttimolekyylejä vastaavat toimintapiikit. ESI kuvataan hyvin ”pehmeäksi” ionisointitekniikaksi, jossa ympäröivä kylpykaasu vaikuttaa hidastavasti desorboitujen ionien sisäisiin ja translationaalisiin energioihin.
ERI: n edut:
- pehmeä ionisaatioprosessi, joten ehjiä molekyyli-ioneja havaitaan
- ESI mahdollistaa moninkertaistuneiden varautuneiden ionien tuotannon. Tämä johtaa kykyyn analysoida erittäin suuria molekyylipainoja käyttäen kaikkein saatavilla olevia massa-analysaattoreita (esim.kvadrupoleja).
- ESI on ilmanpaineprosessi. Tämä tekee siitä helppokäyttöisen ja helppokäyttöisen HPLC-ja CE-erotustekniikoiden kanssa.
Matriisiavusteinen Laser desorptio (MALDI)
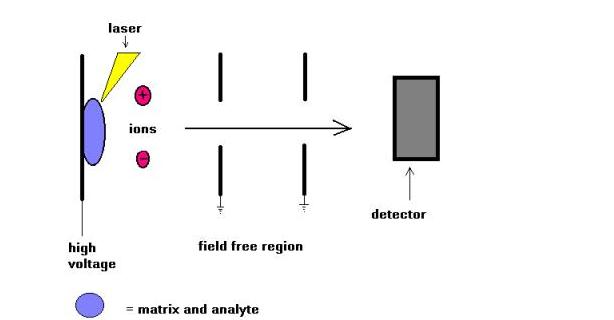
Matriisiavusteisen Laserdesorptiotekniikan (MALDI) ottivat käyttöön Karas ja Hillkamp vuonna 1988 peptidien ja proteiinien ionisointiin. Pian tämän jälkeen tekniikka pystyi analysoimaan muunlaisia biomolekyylejä, kuten oligosakkarideja, glykolipidejä, nukleotideja ja synteettisiä polymeerejä. Tässä tekniikassa näytteet kokristalloidaan UV-säteilyä absorboivalla aineella, jota kutsutaan matriisiksi. Esimerkiksi proteiineille valintamatriisi on usein sinapiinihappo. Yleisimmin käytetään 337 nm: n säteilyä typpilaserista. Laser auttaa tuomaan energiaa molekyylijärjestelmään siten, että se estää lämpöhajoamisen.
MALDIA käytetään usein lentoaikaisten massaspektrometrien ( TOF ) kanssa tekniikan sykkivyyden ja massan kantaman ominaisuuksien vuoksi. Molekyylipainoja voitiin mitata muutamiin satoihin daltoneihin asti. MALDI-ja ESI-ionisointitekniikoiden vertailua on yritetty viime vuosina. Mielestäni nämä kaksi tekniikkaa eivät ole kilpailukykyisiä vaan toisiaan täydentäviä. Vain muutamia mainitakseni, suurimolekyylisille lajeille MALDI johtaa yksittäin varautuneiden molekyyli-ionien muodostumiseen, kun taas ESI mahdollistaa moninkertaisesti varautuneiden molekyyli-ionien muodostumisen.
käytännön näkökohdat:
- lopullinen moolisuhde näyte / matriisi on noin 1/5000.
- näytteen lopullinen pitoisuus on 1 – 10 pmol / ul
- kokemuksemme MALDISTA osoittavat, että dynaaminen alue on 100 fmol/ul-muutamia satoja pmol/ul
- MALDI on suhteellisen kestävä ionisointitekniikka, joka sietää suolojen ja pinta-aktiivisten aineiden ja puskurien käyttöä. Vaikka se on parasta poistaa ne paremman suorituskyvyn.
peptidi-ja Proteiinistandardit MALDI: lle:
- angiotensiini II (ihmisen) MW: 1046, 2
- substanssi P (ihmisen) MW: 1347, 7
- insuliini (naudan) MW: 5733, 6
- sytokromi c (hevosen) MW: 12 360.1
- RNaasi A (Nauta) MW: 13,682.2
- Apo-myoglobiini (hevosen) MW: 16,951.5
- Trypsinogeeni (Nauta) MW: 23,980.9
Ilmanpaine Kemiallinen ionisaatio
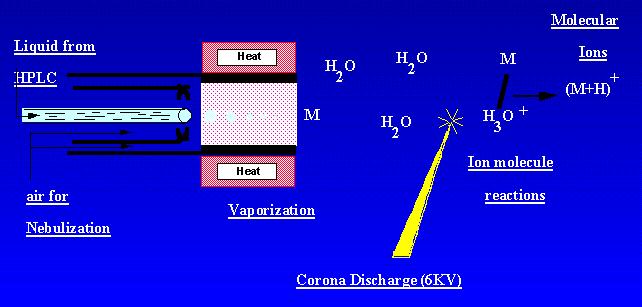
APCI on tekniikka, joka luo ioneja ilmakehän paineessa. Näyteliuos virtaa lämmitetyssä putkessa, jossa se haihtuu sumussa ja ruiskutetaan koronapurkaukseen typpisumutuksen avulla. Näytemolekyylit ionisoituvat ambiantin koronapurkaus-ionien ionimolekyylireaktioissa. Purkauksessa syntyy ioneja, jotka uutetaan massaspektrometriin. APCI soveltuu parhaiten suhteellisen polaarisiin, puolihävikkisiin näytteisiin. APCI: n massaspektri sisälsi yleensä kvasimolekyylisen ionin,-tai +.
ionien analysointi
on mahdollista käyttää useita erilaisia fysikaalisia parametreja massan erottamiseen. Yleisiä massa analysaattorit käsitellään jäljempänä. Jokaisella on etuja ja haittoja. Laitoksessamme on tällä hetkellä Quadrupole, Ion Trap, amd Time-of-Flight (Tof) – massaspektrometrit.
magneettisen sektorin massaspektrometri
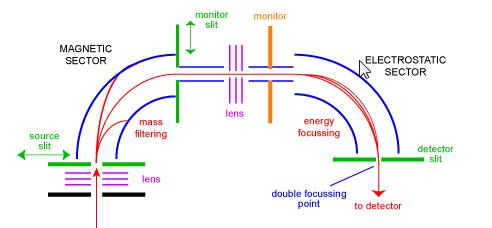
sektorimassaspektrometri oli yksi yleisimmistä massa-analysaattorin tyypeistä ja luultavasti arkitutkijalle tutuin. 1950-luvulla ensimmäiset kaupalliset massaspektrometrit olivat sektorimittareita. Ne koostuvat suuresta sähkömagneettisesta yhdistelmästä ja jonkinlaisesta sähköstaattisesta kohdistuslaitteesta. Eri valmistajat käyttävät erilaisia geometrioita. Kuvassa 1 on kaavamainen standardin ” BE ” geometrian kaksinkertainen kohdistuslaite. BE: n konfiguraatiota kutsutaan myös käänteisgeometrian sektorimassaspektrometriksi – eli kaksoissektorimittariksi, joka koostuu magneettisesta sektorista, jota seuraa sähköstaattinen sektori.
ionit tulevat instrumenttiin lähteestä (alavasemmalta), johon ne aluksi keskittyvät. Ne tulevat magneettiseen sektoriin lähteen raon kautta, jossa ne taipuvat vasemman käden säännön mukaan. Suurimassaiset ionit taipuvat vähemmän kuin pienimassaiset ionit. Magneetin skannaus mahdollistaa eri massaisten ionien kohdistamisen monitorin rakoon. Tässä vaiheessa ionit on erotettu toisistaan vain massojensa perusteella. Jotta saadaan hyvä spektri, jossa kaikki ionit, joilla on sama m / z, näyttävät olevan yhtä spektrin huippua, ioneja on suodatettava niiden liike-energioiden avulla. Toisen fokusointivaiheen jälkeen ionit siirtyvät sähköstaattiseen sektoriin, jossa saman m/z: n ionien energiajakaumat on korjattu ja ne kohdistetaan kahteen fokusointipisteeseen ilmaisimen rakoon.
Sektorisoittimilla oli valtava kaupallinen menestys 1950-ja 1960-luvuilla, sillä ne olivat ainoa käytännöllinen tapa saada korkearesoluutioista dataa. Viimeksi kuluneiden noin 20 vuoden aikana FTMS: n hinnat ovat laskeneet ja korkean resoluution vaihtoehtojen (esimerkiksi Q-Tof) kehitys on vähentynyt.
lentoajan massaspektrometri (TOF-MS)
lentoajan massaspektrometrissä käytetään siirtymäajan eroja eri massaisten ionien erottamiseen toisistaan. Se toimii pulssitilassa, joten ioneja on tuotettava tai erotettava pulsseissa. Sähkökenttä kiihdyttää kaikki ionit kentättömälle drift-alueelle, jonka liike-energia on qV, jossa q on ionivaraus ja V on sovellettu jännite. Koska ionien liike-energia on 0,5 MV2, kevyempien ionien nopeus on suurempi kuin raskaampien ionien ja ne saavuttavat drift-alueen päässä olevan detektorin nopeammin.
Teoria:
- K. E. = qV
- 1/2 mv2 = qV
- v = (2qV / m)1/2
siirtymäputken läpikulkuaika (t) on L / v, jossa L on liukuputken pituus
- T=L/(2V/m / q)1/2
lineaarisen TOF-MS: n kaava

tässä kaaviossa ionien ablaatio kiinteästä näytteestä pulssilaserilla. Reflektron on sarja renkaita tai hiloja, jotka toimivat ionipeilinä. Tämä peili kompensoi ionien liike-energioiden leviämistä niiden tullessa drift-alueelle ja parantaa laitteen resoluutiota. Ionianturin ulostulo näkyy oskilloskoopissa ajan funktiona massaspektrin tuottamiseksi.
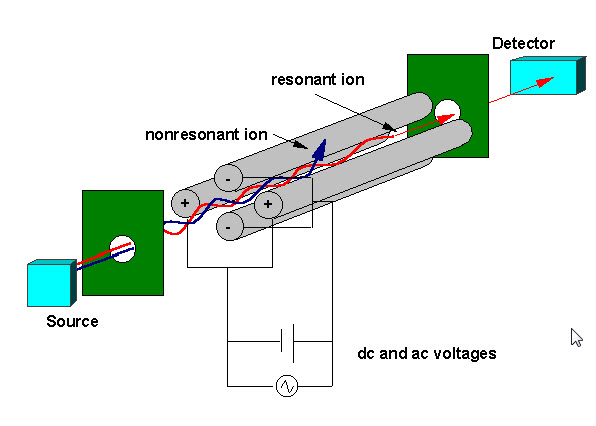
Ioniloukku
elektronin törmäyksen (EI), elektrosprayn (ESI) tai matriisiavusteisen laserdesorption (MALDI) ionisaation synnyttämät ionit keskitetään sähköstaattisen lensing-järjestelmän avulla ioniloukkuun. Sähköstaattinen ioniportti pulssaa auki (- V) ja kiinni (+V), jotta ionit pääsevät ioniloukkuun. Ioniportin sykkiminen erottaa ioniloukut” säde ” – instrumenteista, kuten kvadrupoleista, joissa ionit pääsevät jatkuvasti massa-analysaattoriin. Aika, jonka aikana ionit pääsevät ansaan, kutsutaan ”ionisaatiokestoksi”, on asetettu maksimoimaan signaali ja minimoimaan avaruusvarauksen vaikutukset. Avaruusvaraus johtuu siitä, että ansassa on liikaa ioneja, jotka aiheuttavat sähkökenttien vääristymän, joka johtaa suorituskyvyn yleiseen heikkenemiseen. Ioniloukku täytetään tyypillisesti heliumilla noin 1 mtorr: n paineeseen. Törmäykset heliumin kanssa vaimentavat ionien liike-energiaa ja supistavat nopeasti liikeratoja kohti ioniloukun keskustaa, mikä mahdollistaa ruiskutettujen ionien ansoittamisen. Loukkuun jääneet ionit keskittyvät edelleen kohti Ansan keskustaa käyttämällä värähtelevää potentiaalia, jota kutsutaan perustavaksi rf: ksi, jota sovelletaan rengaselektrodiin. Ioni jää vakaasti loukkuun riippuen ionin massan ja varauksen arvoista, ioniloukun koosta (r), perus-rf: n värähtelytaajuudesta ( w) ja rengaselektrodin jännitteen amplitudista ( V). Ioniliikkeen riippuvuutta näistä parametreista kuvaa dimensioton parametri qz, qz = 4ev / mr2w2
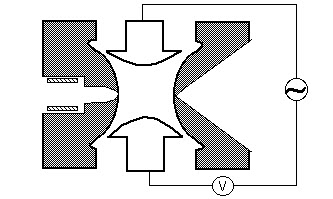
Kvadrupoli
kvadrupolimassasuodatin koostuu neljästä rinnakkaisesta metallitangosta, jotka on järjestetty kuten alla olevassa kuvassa. Kahdella vastakkaisella sauvalla on sovellettu potentiaali (U+Vcos (wt)) ja kahdella muulla sauvalla on potentiaali -(U+Vcos(wt)), jossa U on tasajännite ja Vcos (wt) on vaihtovirtajännite. Jännitteet vaikuttavat neljän sauvan välissä lentorataa pitkin kulkevien ionien lentorataan. Annetuilla tasavirta-ja vaihtovirtajännitteillä kvadrupolisuodattimen läpi kulkee vain tietyn massa-varaus-suhteen omaavia ioneja ja kaikki muut ionit sinkoutuvat pois alkuperäiseltä reitiltään. Massaspektri saadaan seuraamalla kvadrupolisuodattimen läpi kulkevia ioneja sauvojen jännitteiden vaihtuessa. On olemassa kaksi menetelmää: vaihteleva w ja pitävä U ja V vakio, tai vaihteleva U ja V (U/V) kiinteä vakio w.
kvadrupolimassasuodatin koostuu neljästä rinnakkaisesta metallitangosta, jotka on järjestetty kuten alla olevassa kuvassa. Kaksi vastakkaista sauvaa ha
Tandem-massaspektrometria:
tandem-massaspektrometria, josta käytetään yleensä nimitystä MS / MS, tarkoittaa kahden tai useamman massa-analysaattorin käyttöä. Sitä käytetään usein yksittäisten komponenttien analysointiin seoksessa. Tämä tekniikka lisää spesifisyyttä tiettyyn analyysiin. Vaikka tandem-massaspektrometria voidaan viitata MS / MS, MS / MS / MS jne…, tässä esityksessä aion kuvata vain MS/MS.
MS/MS: n perusidea on tietyn ionin m/z: n valinta, joka muodostuu ionilähteessä, ja altistaa tämän ionin sirpaloitumiselle, yleensä törmäämällä inerttiin kaasuun (esim. Argon). Tämän jälkeen tuoteionit havaitaan. Tämä on tehokas tapa vahvistaa tiettyjen yhdisteiden identiteetti ja määrittää tuntemattomien lajien rakenne. MS / MS on siis prosessi,johon kuuluu 3 vaihetta: ionisaatio,massan valinta, massa-analyysi.
MS/MS voitiin suorittaa esimerkiksi kolmoiskvadrupolin (QQQ), ioniloukun, lentoajan, fourier-muunnoksen jne… Kolmoiskvadrupoli on MS / MS: n yleisimmin käytetty massaspektrometri, ehkä muun muassa kustannusten ja helppokäyttöisyyden vuoksi.
Erotusmenetelmät, joilla kytketään massan Spec
- GC-MS: Näyteseokset höyrystetään suoraan ja syötetään sidottuihin kvartsikolonneihin. Seoksen komponentit erotetaan toisistaan niiden affiniteettieron perusteella sidotun faasin kanssa. Erotetut yhdisteet poistuvat kolonnista ja siirtyvät massaspektrometrin tyhjiöjärjestelmään. Näytemolekyylit ionisoidaan (EI tai CI) ja kiihdytetään esikalibroituun massa-analysaattoriin (esim.Q, Ioniloukku, TOF, FTMS jne…). Retentioajat, molekyylimassat ja fragmentaatiomallit kirjataan. Yksi GC/MS: n tärkeimmistä huomioista on, että näytteen(näytteiden) on oltava ei-termolable eli termisesti stabiili.
- LC-MS: lämpöstabiileille yhdisteille harkitaan LC/MS-menetelmää. Erottelu perustuu näytteiden affiniteettiin stationäärifaasin ja liikkuvan faasin kanssa. esim. hydrofobisuus RP-kromatografiassa.
- cze-MS: tämä menetelmä perustuu näytteiden elektroforeettiseen liikkuvuuteen silloin, kun kvartsilasikolonni on ruiskutuspuolen ja detektoripuolen potentiaalieron alla.
- CIEF-MS: tämä on muunnos cze: stä. Se perustuu diffrerensseihin analyyttien isoelektrisissä pisteissä.