denna handledning diskuterar grundläggande aspekter av masspektrometri som kommer att vara till hjälp för dig när du bestämmer rätt tekniker och mätningar för dina forskningsprover.
- Vad är masspektrometri?
- masspektrometern
- Joniseringsmetoder
- Elektronpåverkan jonisering
- kemisk jonisering
- Matrisassisterad Laserdesorption
- atmosfärstryck kemisk jonisering
- Elektrosprayjonisering
- analys av joner
- Tandem masspektrometri
- separationsmetoder för koppling med Mass Spec
Vad är masspektrometri?
masspektrometri är en analytisk teknik som involverar studier i gasfasen av joniserade molekyler i syfte att ett eller flera av följande:
- Molekylvikt bestämning
- strukturell karakterisering
- Gasfasreaktivitetsstudie
- kvalitativ och kvantitativ analys av komponenter i en blandning.
masspektrometri består i grunden av vägning av joner i gasfasen. Instrumentet som används kan betraktas som en sofistikerad balans som med hög precision bestämmer massorna av enskilda atomer och molekyler. Beroende på proverna kemiska och fysikaliska egenskaper kan olika joniseringstekniker användas. En av huvudfaktorerna för att välja vilken joniseringsteknik som ska användas är termolabilitet. För prover som inte är delabila och relativt flyktiga kan jonisering såsom Elektronpåverkan och/eller kemisk jonisering användas effektivt. För prover som är termolabila såsom peptider, proteiner och andra prover av biologiskt intresse ska mjukjoniseringstekniker övervägas. Bland de mest använda mjukjoniseringsteknikerna är elektrospray (ESI) och Matrisassisterad Laserdesorption (MALDI). Namnet som ges till en viss mass spec-teknik pekar vanligtvis på joniseringsmetoden som används.
Atom-och molekylmassor tilldelas i förhållande till massan av kolisotopen, 12C, vars atomvikt definieras som exakt 12. Den faktiska massan av 12c är 12 Dalton, med en dalton är lika med 1.661 10-24 g. massan av en molekyl eller en jon kan presenteras i Dalton (Da) eller kilodalton (kDa).
masspektrometern
masspektrometri använder ett instrument som kallas en masspektrometer. Huvudkomponenterna i en masspektrometer är:
- inloppssystem (LC, GC, direkt sond etc…)
- Jonkälla (ei, CI, ESI, APCI, MALDI, etc…)
- Massanalysator (Quadrupol, TOF, Jonfälla, magnetisk sektor)
- detektor (Elektronmultiplikator, Mikrokanalplattor MCP)
prover kan introduceras till masspektrometern direkt via fasta ämnen sond, eller i fallet med blandningar, genom förmedling av kromatografianordning (t.ex. gaskromatografi, vätskekromatografi, kapillärelektrofores, etc…). En gång i källan utsätts provmolekyler för jonisering. Joner som bildas i källan (molekylära och fragmentjoner) förvärvar viss kinetisk energi och lämnar källan. En kalibrerad analysator analyserar sedan de passande jonerna som en funktion av deras massa för att ladda förhållanden. Olika typer av analysatorer kan användas, magnetisk, Quadrulpole, Jonfälla, Fouriertransform, flygtid etc…Jonstrålen som lämnar analysatoraggregatet detekteras sedan och signalen registreras. Vanliga joniseringsmetod akronymer inkluderar:
- ei=Elektronpåverkan;
- CI=kemisk jonisering;
- SIMS=sekundära joner Mass Spec;
- FAB = snabb Atombombardemang;
- LDMS=Laser Desorption Mass Spec;
- PDMS=Plasma Desorption Mass Spec;
- TS=Termospray;
- AS=Aerospray;
- ESMS=elektrospray Mass Spec.
vanliga massanalysatorakronymer inkluderar:
- EB = elektrostatisk-magnetisk;
- IT=jonfälla;
- Q=Quadrupole;
- TOF=flygtid.
Joniseringsmetoder
val av korrekt joniseringsmetod för analys av ditt prov är extremt viktigt. Även om vi kan erbjuda förslag, är det ditt ansvar att förstå och välja den metod(er) som är lämplig för dina forskningsföreningar.
- Elektronpåverkan ei jonisering
- kemisk jonisering CI
- negativ jon kemisk jonisering
- Elektrosprayjoniseringstekniker
- Matrisassisterad Lazer-Desorption (erbjuds inte i vår anläggning, men tillgänglig elswhere på campus)
- atmosfärstryck kemisk jonisering APCI
Elektronpåverkan jonisering
M + E- (70ev)- – – – – > m+. + 2e –
ei joniseringsmetod är lämplig för icke termolabila föreningar. Provets volatilitet krävs. Provmolekyler i ångtillstånd bombarderas av snabbt rörliga elektroner, konventionellt 70 eV energi. Detta resulterar i jonbildning. En elektron från den högsta orbitalenergin lossas, och som en konsekvens bildas molekylära joner. Några av dessa molekylära joner sönderdelas och fragmentjoner bildas. Fragmenteringen av en given Jon beror på det överskott av energi som det kräver inom joniseringen. Fragmentjoner kan vara udda elektron eller till och med elektron. Molekylära joner bildade i elektronpåverkan jonisering är udda elektronjoner. Udda elektronfragmentjoner bildas genom direkt klyvning (t. ex. direkt klyvning av en C – C-bindning). Även elektronfragmentjoner bildas ofta genom omarrangemang(t.ex. protonöverföring). Provet kan introduceras till ei-källan via en gaskromatografianordning, till exempel i fallet med blandningar, eller direkt via en fast sondanordning. De kvantiteter som behövs för ett experiment är vanligtvis mindre än ett mikrogram material.
ei-masspektra innehåller i de flesta fall intensiva fragmentjontoppar och mycket mindre intensiv molekylär jontopp. När den molekylära jontoppen inte observeras i masspektret kan kemisk jonisering användas för att få molekylär joninformation. En användbar regel för att bestämma om en jon är en molekylär Jon är Kväveregeln.
Kväveregel: som angivits ovan är molekylära joner bildade vid EI-jonisering udda elektronjoner. Om deras observerade massa-laddningsförhållande är udda, innehåller molekylen som undersöks ett udda antal kväveatomer. Om det förhållandet mellan massa och laddning är ett jämnt antal innehåller den molekylen inga eller till och med kväveatomer.
kemisk jonisering
för organiska kemister är kemisk jonisering (CI) särskilt användbar teknik när ingen molekylär Jon observeras i ei-massspektrum, och även vid bekräftelse av mass-laddningsförhållandet för molekyljonen. Kemisk joniseringsteknik använder praktiskt taget samma jonkällanordning som i elektronpåverkan, förutom att CI använder tät jonkälla och reagensgas. Reagensgas (t.ex. ammoniak) utsätts först för elektronpåverkan. Provjoner bildas genom interaktionen mellan reagensgasjoner och provmolekyler. Detta fenomen kallas jonmolekylreaktioner. Reagensgasmolekyler är närvarande i förhållandet ca 100: 1 med avseende på provmolekyler. Positiva joner och negativa joner bildas i CI-processen. Beroende på instrumentets inställning (källspänningar, detektor etc…) endast positiva joner eller endast negativa joner registreras.
i CI uppstår jonmolekylreaktioner mellan joniserade reagensgasmolekyler (G) och flyktiga analytneutrala molekyler (M) för att producera analytjoner. Pseudo-molekylär Jon MH+ (positivt jonläge) eller – (negativt jonläge) observeras ofta. Till skillnad från molekylära joner erhållna i EI-metoden sker MH + och – detektion i högt utbyte och mindre fragmentjoner observeras.
positivt jonläge:
GH + + M – – – – – – > MH + + G
negativt jonläge:
– + M ——> – + G
dessa enkla protonöverföringsreaktioner är sanna gasfas-Syrabasprocesser i Bronsted-Lowrey-känslan. En” tät ” jonkälla (tryck=0,1-2 torr) används för att maximera kollisioner vilket resulterar i ökad känslighet. För att äga rum måste dessa jonmolekylreaktioner vara exoterma. Protonöverföring är en av de enkla processerna som observeras i positivt CI:
RH+ + M —–> MH+ + R
en av de avgörande parametrarna i denna reaktion är protonaffiniteten. För att reaktionen ska inträffa måste protonaffiniteten hos molekylen M vara högre än den i gasmolekylen. De huvudsakliga reagensgaserna som används i CI är: ammoniak, metan och isobutan. De dominerande reaktantjonerna som bildas ges i de mekanismer som visas nedan. Valet av reagensgas påverkar omfattningen av fragmenteringen av den kvasi-molekylära Jonen.
metan (positiv jon kemisk jonisering):
- CH4 + e —–> CH4+. + 2e ——> CH3+ + H.
- CH4+. + CH4 —–> CH5+ +CH3.
- CH4+. + CH4 —–> C2H5+ + H2 + H.
Isobutane (positive ion chemical ionization):
- i-C4H10 + e —–> i-C4H10+. + 2e
- i-C4H10+. + i-C4H10 ——> i-C4H9+ + C4H9 +H2
Ammonia (positive ion chemical ionization):
- NH3 + e —–> NH3+. + 2e
- NH3+. + NH3 ——> NH4+ + NH2.
- NH4 + + NH3 ———>N2H7+
i metanpositiv jonläge kemisk jonisering är de relevanta provtopparna observerade MH+ ,+ och +; men främst MH+. Detta motsvarar massorna M + 1, M+29 och M+41.
vid kemisk jonisering av isobutanpositiv jonläge är huvudtoppen observerad MH+.
i ammoniakpositiv jonläge kemisk jonisering är de observerade huvudtopparna MH+ och +. Om mer än ett protonationsställe finns, kan ytterligare NH3-addukter ses motsvarande +. Detta motsvarar massorna M + 1, M+18 och M+35.
i vissa fall kan protonerade dimerer eller andra addukter ses; förlust av H2O följt av protonation eller adduktjonbildning ses för vissa klasser av föreningar. Om spektrumet du observerar inte verkar visa rätt adduktjoner, eller visar omfattande fragmentering, var försiktig när du försöker tolka resultaten. Det finns ett överflöd av data tillgängliga i litteraturen som diskuterar kemiska joniseringsmekanismer som är tillämpliga på specifika klasser av föreningar.
två faktorer bestämmer valet av reagensgas som ska användas:
- Protonaffinitet PA
- energiöverföring
NH3 (ammoniak) är den mest använda reagensgasen i CI på grund av den låga energiöverföringen av NH4+ jämför till exempel CH5+. Med NH3 som reagensgas observeras vanligtvis MH+ och MNH4+ (17 massenheter skillnad).
negativ jon kemisk jonisering
tre mekanismer kan understrykas:
- Elektronupptagningsreaktion på grund av uppnåendet av långsam rörelse, låg energi ”termiserade” elektroner som kan överföras mer effektivt till provmolekyler.
- elektronöverföring från joniserad reagensgas (t.ex. NH2 – kan överföra en elektron till en molekyl som har en större elektronaffinitet än NH2).
- Reagensgasjoner deltar i Sanna CI-reaktioner (t.ex. protonabstraktion, enligt relativa surheter).
molekylära joner observerade i negativ jon kemisk jonisering masspektra är vanligtvis M – eller -.
Elektrosprayjoniseringsmetod
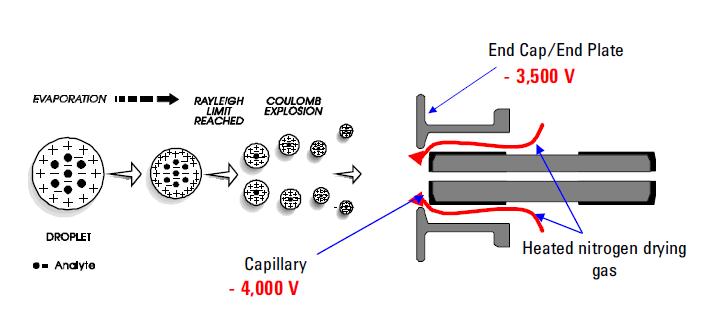
bland de mest använda sprutjoniseringsteknikerna är Elektrosprayjonisering (ESI). Denna teknik fortsätter att vara den metod som valts för att analysera termolabila kemikalier. Dess kapacitet är väl dokumenterad. Den använder en elektrisk spänning mellan ESI-sondutgången (t.ex. kapillär) och motelektroden, som ligger några millimeter från sonden. Processen resulterar i generering av högladdade droppar direkt från den infunderade lösningen. Multiplicera och / eller enstaka laddade analytmolekyler desorbe från de sprutade dropparna och samplas genom resten av masspektrometern. ESI har särskiljats för sin förmåga att producera multiplicerade laddade molekylära joner från en stor mängd polymerer såsom protein och DNA-fragment; det möjliggör också känslig detektion av enstaka laddade polära arter med låg molekylvikt, såsom läkemedel och läkemedelsmetaboliter. Bildandet av positiva eller negativa joner (beroende på tecknet på det applicerade elektriska fältet) sker i högt utbyte. I det positiva jonläget protonerade och / eller alkaliadduktanalytmolekyler observeras vanligtvis i masspektra. I det negativa jonläget observeras driftstoppar som motsvarar deprotonerade analytmolekyler. ESI beskrivs som en mycket ”mjuk” joniseringsteknik där den omgivande badgasen har en dämpande effekt på desorberade jonernas inre och translationella energier.
fördelar med ESI:
- Mjuk joniseringsprocess så intakta molekylära joner observeras
- ESI tillåter produktion av multiplicerade laddade joner. Detta resulterar i förmågan att analysera arter med mycket hög molekylvikt med hjälp av de mest tillgängliga massanalysatorerna (t.ex. quadrupoles).
- ESI är en atmosfärisk tryckprocess. Detta gör det enkelt att använda och lätt att Gränssnitt med HPLC och CE separationstekniker.
Matrisassisterad Laserdesorption (MALDI)
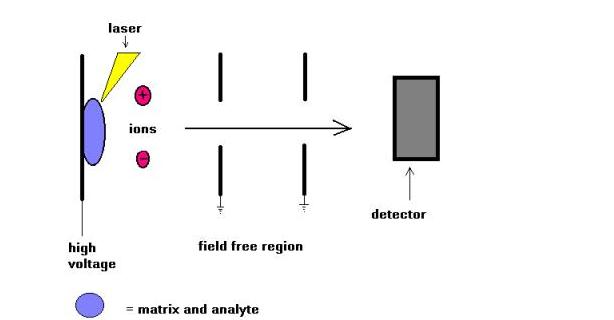
Matrix Assisted Laser Desorption (MALDI) masspektrometriteknik introducerades av Karas och Hillkamp 1988 för jonisering av peptider och proteiner. Snart där efter denna teknik kunde analysera andra typer av biomolekyler, såsom oligosackarider, glykolipider, nukleotider och syntetiska polymerer. I denna teknik samkristalliseras prover med en UV-absorberande substans som kallas matris. Till exempel för proteiner är matrisen av val ofta sinapinsyra. En 337 nm strålning från kvävelaser används oftast. Lasern hjälper till att införa energi i molekylsystemet på ett sådant sätt att förhindra termisk sönderdelning.
MALDI används ofta med time-of-flyg masspektrometrar (TOF) på grund av den pulserande naturen av tekniken, och massområdet kapacitet. Molekylvikter upp till några hundra Dalton kunde mätas. Jämförelse av MALDI-och ESI-joniseringstekniker försöktes under de senaste åren. Enligt min mening är dessa två tekniker inte konkurrenskraftiga utan kompletterande. Bara för att nämna några, för högmolekylära arter, leder MALDI till bildandet av enstaka laddade molekylära joner medan ESI tillåter bildandet av multiplicerade laddade molekylära joner.
praktiska överväganden:
- det slutliga molära förhållandet prov / matris är ungefär eller runt 1/5000.
- slutlig koncentration av provet är från 1 till 10 pmol/ul
- vår erfarenhet av MALDI pekar på ett dynamiskt område av 100 fmol/ul till några hundra pmol/ul
- MALDI är relativt robust joniseringsteknik som tolererar användningen av salter och ytaktiva ämnen och buffertar. Även om det är bäst att ta bort dem för bättre prestanda.
peptid – och Proteinstandarder för MALDI:
- Angiotensin II (humant) MW: 1046,2
- substans P (humant) MW: 1347,7
- Insulin (bovint) MW: 5733,6
- Cytokrom c (häst) MW: 12 360.1
- RNAs A (nötkreatur) MW: 13,682.2
- Apo-Myoglobin (häst) MW: 16,951.5
- Trypsinogen (nötkreatur) MW: 23,980.9
Atmosfäriskt tryck kemisk jonisering
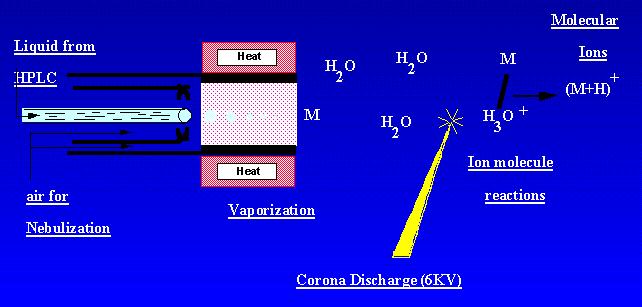
APCI är en teknik som skapar joner vid atmosfärstryck. En provlösning strömmar genom ett uppvärmt rör där det förflyktigas i en dimma och sprutas in i en koronaurladdning med hjälp av kväveförstöring. Provmolekyler joniseras av jonmolekylreaktioner från de ambianta koronaurladdningsjonerna. Joner produceras i urladdningen och extraheras i masspektrometern. APCI är bäst lämpad för relativt polära, halvflyktiga prover. Ett APCI-masspektrum innehöll vanligtvis den kvasi-molekylära Jonen, – eller +.
analys av joner
det är möjligt att använda flera olika fysiska parametrar för att uppnå massseperation. Vanliga typer av massanalysatorer diskuteras nedan. Var och en har fördelar och nackdelar. I vår anläggning har vi för närvarande Quadrupole, Ion Trap, amd Time-of-Flight (TOF) masspektrometrar.
magnetisk sektor masspektrometer
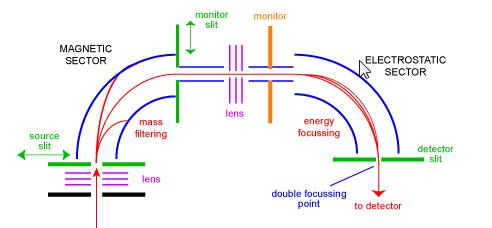
sektorns masspektrometer var en av de vanligaste typerna av massanalysator och förmodligen den mest kända för vardagsforskaren. På 1950-talet var de första kommersiella masspektrometrarna sektorinstrument. De består av en kombination av en stor elektromagnetisk och någon form av elektrostatisk fokuseringsanordning. Olika tillverkare använder olika geometrier. Figur 1 visar en schematisk bild av en standard ’BE’ geometri dubbel fokusering instrument. Be-konfigurationen kallas också omvänd geometri sektor masspektrometer-det vill säga ett instrument med dubbla sektorer som består av en magnetisk sektor följt av en elektrostatisk sektor.
joner kommer in i instrumentet från källan (längst ner till vänster) där de initialt fokuseras. De går in i den magnetiska sektorn genom källslitsen där de avböjs enligt vänsterregeln. Joner med högre massa avböjs mindre än joner med lägre massa. Genom att skanna magneten kan joner av olika massor fokuseras på bildskärmsslitsen. I detta skede har jonerna separerats endast av deras massor. För att få ett spektrum av god upplösning där alla joner med samma m/z verkar sammanfalla som en topp i spektrumet, måste joner filtreras av sina kinetiska energier. Efter ett annat steg av fokusering kommer jonerna in i den elektrostatiska sektorn där joner av samma m/z har sina energifördelningar korrigerade för och fokuseras vid den dubbla fokuseringspunkten på detektorslitsen.
Sektorsinstrument hade stora kommersiella framgångar på 1950-och 1960-talet eftersom de var det enda praktiska sättet att få högupplösta data. Under de senaste 20 åren eller så, med de sjunkande priserna på FTMS och utvecklingen av högupplösta alternativ (till exempel Q-Tof) sektorsinstrument är i nedgång.
Time-of-Flight Mass Spectrometry (TOF-MS)
en time-of-flight masspektrometer använder skillnaderna i transittid genom en driftregion för att separera joner av olika massor. Den fungerar i ett pulserat läge så att joner måste produceras eller extraheras i pulser. Ett elektriskt fält accelererar alla joner till en fältfri driftregion med en kinetisk energi av qV, där q är jonladdningen och V är den applicerade spänningen. Eftersom Jon kinetisk energi är 0.5mv2, har lättare joner en högre hastighet än tyngre joner och når detektorn i slutet av driftregionen tidigare.
Teori:
- K. E. = qV
- 1/2 mv2 = qV
- v = (2qv / m)1/2
transittiden (t) genom drivröret är L / v där L är längden på drivröret
- t=L / (2V / m / q)1/2
schematisk bild av en linjär TOF-MS

denna schematiska visar ablation av joner från ett fast prov med en pulserad laser. Reflektronen är en serie ringar eller galler som fungerar som en jonspegel. Denna spegel kompenserar för spridningen i jonernas kinetiska energier när de kommer in i drivområdet och förbättrar instrumentets upplösning. Utgången från en jondetektor visas på ett oscilloskop som en funktion av tiden för att producera masspektret.
Jonfälla
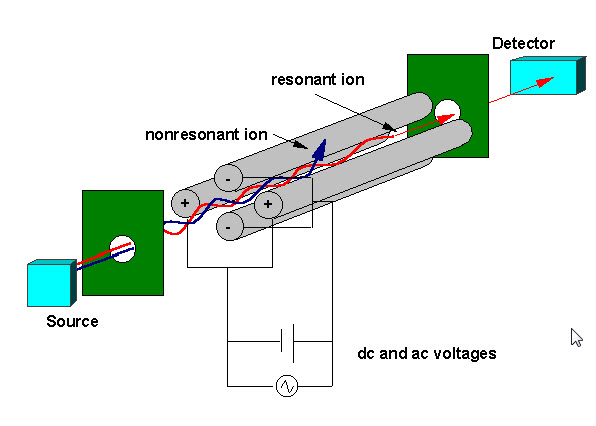
joner skapade av elektronpåverkan (EI), elektrospray (ESI) eller matrisassisterad laserdesorption (MALDI) jonisering fokuseras med hjälp av ett elektrostatiskt linssystem i jonfällan. En elektrostatisk jongrind pulserar öppen (- V) och stängd (+V) för att injicera joner i jonfällan. Pulseringen av jonporten skiljer jonfällor från” Balk ” – instrument som quadrupoles där joner kontinuerligt kommer in i massanalysatorn. Den tid under vilken joner tillåts i fällan, benämnd ”joniseringsvaraktigheten”, är inställd för att maximera signalen samtidigt som rymdladdningseffekter minimeras. Rymdladdning resulterar från för många joner i fällan som orsakar en snedvridning av de elektriska fälten som leder till en total minskning av prestanda. Jonfällan fylls typiskt med helium till ett tryck av ca 1 mtorr. Kollisioner med helium dämpar jonernas kinetiska energi och tjänar till att snabbt dra ihop banor mot mitten av jonfällan, vilket möjliggör fångst av injicerade joner. Fångade joner fokuseras vidare mot mitten av fällan genom användning av en oscillerande potential, kallad den grundläggande rf , applicerad på ringelektroden. En jon kommer att fångas stabilt beroende på värdena för jonens massa och laddning, storleken på jonfällan (r), den oscillerande frekvensen för den grundläggande rf ( w) och amplituden för spänningen på ringelektroden ( V). Beroendet av jonrörelse på dessa parametrar beskrivs av den dimensionslösa parametern qz, qz = 4eV / mr2w2
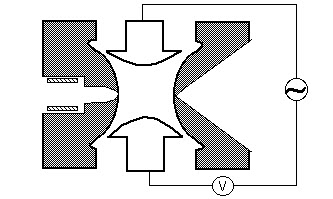
Quadrupole
ett quadrupolmassfilter består av fyra parallella metallstavar anordnade som i figuren nedan. Två motsatta stavar har en applicerad potential på (U + Vcos(wt)) och de andra två stavarna har en potential på- (U+Vcos (wt)), där U är en likspänning och Vcos (wt) är en växelspänning. De applicerade spänningarna påverkar banan för joner som reser ner i flygvägen centrerad mellan de fyra stavarna. För givna dc-och ac-spänningar passerar endast joner med ett visst mass-till-laddningsförhållande genom quadrupolfiltret och alla andra joner kastas ut ur sin ursprungliga väg. Ett masspektrum erhålls genom att övervaka jonerna som passerar genom quadrupolfiltret när spänningarna på stavarna varieras. Det finns två metoder: varierande w och håller U och V konstant, eller varierande U och V (U/V) fixerade för en konstant w.
ett quadrupolmassfilter består av fyra parallella metallstavar anordnade som i figuren nedan. Två motsatta stavar ha
Tandem masspektrometri:
Tandem masspektrometri, vanligtvis kallad MS/MS, innefattar användning av 2 eller flera massanalysatorer. Det används ofta för att analysera enskilda komponenter i en blandning. Denna teknik lägger till specificitet för en given analys. Även om tandemmasspektrometri kan hänvisas till MS / MS, MS / MS / MS, etc…, i denna presentation kommer jag att beskriva endast MS/MS.
grundtanken med MS/MS är ett urval av en m/z av en given Jon bildad i jonkällan och utsätter denna jon för fragmentering, vanligtvis genom kollision med inert gas (t. ex. Argongas). Produktjonerna detekteras sedan. Detta är ett kraftfullt sätt att bekräfta identiteten hos vissa föreningar och bestämma strukturen hos okända arter. Så MS / MS är en process som involverar 3 steg: jonisering,massval,massanalys.
MS / MS kan utföras på instrument som trippel quadrupol (QQQ), jonfälla, flygtid, fourier-Transformation etc… Triple quadrupol är den mest använda masspektrometern för MS / MS, kanske på grund av kostnaden och användarvänligheten bland andra faktorer.
separationsmetoder för koppling med Massspecifikation
- GC-MS: Provblandningar förångas direkt och går in i bundna smälta kiseldioxidkolonner. Komponenterna i blandningen separeras baserat på deras affinitetsskillnad med den bundna fasen. Separerade föreningar lämnar kolonnen och går in i masspektrometerns vakuumsystem. Provmolekyler joniseras (EI eller CI) och accelereras till en förkalibrerad massanalysator (t.ex. Q, Jonfälla, TOF, FTMS etc…). Retentionstider, molekylmassor och fragmenteringsmönster registreras. En av de viktigaste övervägandena av GC / MS är att provet(erna) måste vara icke termolabelt vilket betyder termiskt stabilt.
- LC-MS: för föreningar som är termiskt instabila beaktas LC/MS-metoden. Separationen är baserad på diffrence i affinitet av prover med stationär fas och mobil fas. t.ex. hydrofobicitet vid Rp-kromatografi.
- CZE-MS: denna metod är baserad på diffrenser av elektroforetisk rörlighet för prover när den smälta kiseldioxidkolonnen är under en potentialskillnad mellan injektionssidan och detektorsidan.
- CIEF-MS: Detta är en variant av CZE. Det är baserat på diffrerenser i isoelektriska punkter av analyter.