Introduzione
Il ciclo di gliossilato bypassa le fasi di decarbossilazione del ciclo di Krebs e provoca l’assimilazione del carbonio liquido dall’acetil-CoA. Isocitrato liasi (EC 4.1.3.1) e malato sintasi (EC 2.3.3.9) sono gli unici enzimi per questa via metabolica. Il ciclo gliossilato si verifica nella germinazione dei semi (Eastmond & Graham, 2001), in alcuni invertebrati, come C. elegans (Edwards, Copes, Brito, Canfield, & Bradshaw, 2013) e in microrganismi, come E. coli (Nelson & Cox, 2009) e S. cerevisiae (Rezaei, Aslankoohi, Verstrepen, & Courtin, 2015). Il percorso è stato descritto nel 1957 durante studi su microrganismi che crescevano su acetato ed etanolo come fonte di carbonio (Kornberg & Krebs, 1957).
Acetil-CoA nel ciclo gliossilato si lega con ossaloacetato, producendo rispettivamente citrato e isocitrato. Quest’ultimo produce gliossilato e succinato nella reazione catalizzata dall’isocitrato liasi. Inoltre, il gliossilato si condensa con una seconda molecola di acetil-CoA in una reazione catalizzata dalla malato sintasi, dopo che il malato prodotto è stato ossidato in ossaloacetato e quindi rigenerato l’intermedio (passaggi da B-1 a B-5, Figura 1). Due molecole di acetil-CoA vengono introdotte ad ogni ripetizione del ciclo gliossilato e si verifica la sintesi liquida di una molecola di succinato (Beeckmans, 2009; Berg, Stryer, & Tymoczko, 2015; Torres & Marzzoco, 2007).
Inoltre, i carboidrati prodotti dai lipidi di riserva nei semi oleosi vengono distribuiti alla pianta e utilizzati come fonte di carbonio fino a quando i cloroplasti iniziano a differenziarsi nei folioli e iniziano la fotosintesi. I grassi e gli oli sono importanti strutture chimiche nello stoccaggio del carbonio di molti semi, anche se in forma ridotta, comprendenti importanti specie agronomiche come soia, arachidi, cotone e girasole (Junqueira, 2012). Gli acidi laurico (12:0), miristico (14:0), palmitico (16:0) e stearico (18:0) sono gli acidi grassi saturi più importanti nelle verdure; mentre gli acidi insaturi sono acido oleico (18: 1 (Δ9)), acido linoleico(18:2 (Δ9, 12)) e acido linolenico(18:3 (Δ9, 12, 15)) (Taiz & Zeiger, 2002).

Figura 1.
Gli acidi grassi o il catabolismo dell’acetato toproducono energia attraverso il ciclo del gliossilato, evidenziando l’integrazione tra l’ossidazione (fasi da A – 1 a A-4), il ciclo del gliossilato (fasi da B-1 a B-5), il ciclo di Krebs (fasi da C-1 a C-8), la gluconeogenesi (fasi da D-1 a D-3) e la glicolisi (fase E-1).
Gli acidi grassi con un numero di atomi di carbonio non producono sintesi di carboidrati negli animali (Nelson & Cox, 2009). Questo fatto si verifica perché non esiste una produzione netta di ossaloacetato per supportare la gluconeogenesi poiché, in questo caso, gli acidi grassi sono catabolizzati in acetil-CoA. L’intermedio viene ossidato nel ciclo di Krebs, e per ogni due carboni che entrano come acetil-CoA, due carboni vengono persi come CO2 (Eastmond & Graham, 2001; Nelson & Cox, 2009).
L’assenza del ciclo del gliossilato nei mammiferi può essere un obiettivo di tossicità selettiva nello sviluppo di agenti antimicrobici. L’attività inibitoria di 3-nitropropionammidi su isocitrato liasi in M. tuberculosis (Sriram et al., 2011), bromofenoli (Oh et al., 2010) e alcaloidi da spugne su isocitrato liasi in C. albicans (Lee et al., 2008; Oh et al., 2010) sono stati analizzati.
Non ci sono dati in letteratura sugli aspetti energetici che coinvolgono il catabolismo lipidico attraverso il ciclo gliossilato. In questo contesto, la presente ricerca ha studiato la relazione tra la quantità di energia prodotta nel ciclo gliossilato, con la dimensione della catena degli acidi grassi, e ha confrontato l’efficienza energetica nelle cellule che utilizzano questo approccio, con le cellule animali prive del ciclo gliossilato.
Materialee metodi
È stato eseguito un bilancio energetico di fasi con produzione e consumo di energia per ottenere un’equazione che mette in relazione direttamente la dimensione della catena di un acido grasso con un numero di carbonio multiplo di 4, con l’energia prodotta dalla sua degradazione. Nell’equazione generata, il costo energetico coinvolto nell’attivazione dell’acido grasso per acil-CoA non è stato contabilizzato. È un passo prima della β-ossidazione e comporta la rottura di due legami fosfatici ad alta energia.
L’equazione proposta è stata convalidata confrontando la quantità di ATP ottenuta dalla sua applicazione, con i tassi di ATP ottenuti dall’aggiunta della quantità di ATP prodotta dalla fosforilazione ossidativa e dalla fosforilazione del livello del substrato in ogni fase delle vie metaboliche che partecipano alla degradazione degli acidi grassi che coinvolge il ciclo gliossilato. La degradazione degli acidi grassi comporta la β-ossidazione nei gliossisomi, il ciclo di gliossilato, il ciclo di Krebs, parte della gluconeogenesi e della glicolisi, la decarbossilazione del piruvato e di nuovo il ciclo di Krebs (Figura 1).
L’efficienza energetica della degradazione degli acidi grassi che coinvolge il ciclo del gliossilato è stata confrontata con il catabolismo degli acidi grassi nelle cellule animali. Le equazioni precedentemente convalidate sono state utilizzate in questo confronto e la quantità di energia prodotta nella β-ossidazione come avviene negli animali è stata calcolata (Gonçalves, Valduga, & Pereira, 2012), accoppiata alle equazioni sviluppate nella ricerca attuale. Il fattore di efficienza energetica nel ciclo gliossilato (E%) è stato definito dal rapporto tra ATP prodotto nel catabolismo degli acidi grassi tenendo conto del ciclo gliossilato e del catabolismo animale. Il parametro è stato tracciato rispetto al numero di atomi di carbonio di acido grasso. Inoltre, il tasso di ATP prodotto dall’unità di CH2 è stato rappresentato in funzione del numero di carboni della catena degli acidi grassi. GrapPad Prism 6.0 ha generato i modelli matematici che rappresentavano la relazione tra le variabili.
Risultatie discussione
La matrice mitocondriale è il sito principale in cui si verifica l’ossidazione degli acidi grassi nelle cellule animali. Tuttavia, il catabolismo di queste biomolecole si verifica principalmente nei perossisomi dei tessuti fogliari e negli gliossisomi durante la germinazione dei semi delle piante (Buchanan, Gruissem, Vickers, & Jones, 2015). La degradazione degli acidi grassi negli gliossisomi comprende le vie metaboliche indicate nella Tabella 1.
Parallelamente alla produzione di energia, la conversione degli acidi grassi in carboidrati ha altre funzioni come la produzione di polisaccaridi strutturali e nucleotidi attraverso la via del pentoso fosfato (Nelson & Cox, 2009). Per quanto riguarda il guadagno energetico, il modo più breve ed energeticamente più economico, probabilmente selezionato dall’evoluzione, include la gluconeogenesi fino al fosfoenolpiruvato (fase D-3 in Figura 1), degradato dalla via glicolitica.
Amountof di energia (ATP) prodotte durante il glyoxysomal degradazione degli acidi grassi
ATP quantità (x) risultante fromglyoxysomal degradazione degli acidi grassi con numero di atomi di carbonio più di 4, followedby gluconeogenesi fino a fosfoenolpiruvato e il suo catabolismo, per la produzione di energia,può essere calcolato mediante la somma di ATP costo di produzione e di consumo in β-ossidazione (ATP β-OX), ciclo del gliossilato (ATP C GLYOX),ciclo di Krebs (ATP C KREBS), la gluconeogenesi (ATP OXAL-PEP) e la glicolisi /ciclo di Krebs di nuovo (ATP PEP-CO2), secondo l’Equazione (1):

Ogni rottura del legame carbonio-carbonio durante la β-ossidazione nei gliossisomi e nei perossisomi produce un NADH che, fosforilazione inossidativa, produce 2,5 ATPS (fase A-3 in Figura 1). Nei perossisomi, l’energia dell’elettrone rimossa durante la prima fase della β-ossidazione viene dissipata sotto forma di calore (stepA-1 in Figura 1).

Pertanto, non c’è energia netta dall’ossidazione FADH2 (Buchanan et al., 2015). Poiché il carbonio α è esterificato con il coenzima A, la β-ossidazione si verifica 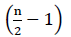 volte, dove n è il numero di carbonio nella catena degli acidi grassi. La quantità di ATPs prodotta dalla β-ossidazione nel ciclo di gliossilato è data dall’equazione (2):
volte, dove n è il numero di carbonio nella catena degli acidi grassi. La quantità di ATPs prodotta dalla β-ossidazione nel ciclo di gliossilato è data dall’equazione (2):

Per ogni due molecole di acetil-coadiretto al ciclo gliossilato, c’è una produzione netta di una succinatamolecola, che corrisponde alla metà della quantità di acetil-CoA, in modo da produrre n/4 molecole di succinato. Nel ciclo di Krebs, il succinato viene ossidato all’ossaloacetato, producendo 1 FADH2 e 1 NADH che produce 4 ATP nella fosforilazione ossidativa (fasi C-6 e C-8, Figura 1). Questo valore moltiplicato per n/4succinate molecole è espresso dall’Equazione (3), che rappresenta il ATPamount prodotto prima nel ciclo di Krebs:

La rigenerazione di oxalacetate inglyoxylate ciclo prevede malato di ossidazione, che produce 1 NADH che yields2.5 ATPs nella fosforilazione ossidativa (punto B-5 in Figura 1). Di conseguenza, la quantità di energia (ATP) prodotta nel ciclo gliossilato può essere espressa mediante equazione(4):

L’eccesso di ossaloacetato prodotto in Krebscycle può essere diretto alla gluconeogenesi. Per produrre energia, ilgluconeogenesi si verifica nella formazione di fosfoenolpiruvato, con 1 GTP speso (stepD3 in Figura 1), espresso nell’equazione (5). La continuazione della gluconeogenesi per la formazione di metaboliti derivati dall’esosio è un processo importante per la germinazione dei semi (Buchanan et al. Nel 2015, Eastmond & Graham, 2001; Quettier& Eastmond, 2009):

Il catabolismo del fosfoenolpiruvato comporta una fosforilazione a livello di substrato che produce piruvato (fase E-1,Figura 1), decarbossilazione ossidativa del piruvato (fase F-1) con 1 produzione di NADH e ossidazione dell’acetil-CoA a CO2. Nell’ossidazione dell’acetil-CoA, la produzione di 3 NADH, 1 FADH2 e 1 GTP corrisponde a 10 fosfati ad alta energia. Questo valore aggiunto al livello di substrato fosforilazione e fosforilazione ossidativaassociata al NADH ha generato la decarbossilazione del piruvato, per un totale di 13,5 ATP (Equazione 6).

Sostituzione di equazioni (2), (3), (4),(5) e (6) nell’equazione (1), si ottiene l’equazione (7). Quando semplificataalgebraicamente, l’equazione (8) stabilisce un rapporto diretto tra la quantità di energia prodotta (x) e la dimensione della catena degli acidi grassi (n).

Validationof Equazione (8) per calcolare l’energia (ATP) prodotto da grassi acidsdegradation attraverso il ciclo del gliossilato
in Modo che l’Equazione (8) può essere convalidato,la quantità di ATP, ottenuti dalla sua applicazione, è stato confrontato con l’ATP amountcalculated singolarmente dalla somma di acetil-CoA, NAHD e FADH2 moleculesnumber, e il substrato livello di fosforilazione, generato l’ossidazione offatty acidi con specifico numero di atomi di carbonio in glyoxysomes (Tabella 2). Inentrambe le condizioni, gli importi ATP ottenuti sono equivalenti. Prendendo in considerazione questi risultati equivalenti, l’equazione sviluppata nello studio corrente ha determinato la quantità di energia prodotta nel catabolismo lipidico, considerando l’integrazione delle vie metaboliche che coinvolge più di venti passaggi.

Inoltre, l’equilibrio energetico per equazioni rigenerative, seguito dalla loro validazione, può essere uno strumento importante per l’analisi di diverse vie metaboliche. In biochimica, aspetti come le relazioni stechiometriche nelle vie metaboliche possono essere affrontati utilizzando i risultati della ricerca attuale.

Comparison Between efficiency of fat acids ‘ degradation by glioxylate cycle and animalalcatabolism
According to previous studies, theamount of energy in animal cells produced in ATP by fat acids degradation with carbons pair number may be algebraically related to the chain size of the fattyacid. Questa relazione è espressa dall’equazione (9) (Gonçalves et al.,2012), che può essere paragonato all’equazione (8) sviluppata nello studio attuale. Le due equazioni possono essere impiegate per confrontare l’efficienza energetica tra ß-ossidazione nelle cellule animali e nelle cellule degli organismi, dove si verifica il ciclo del gliossilato.

Dividendo l’equazione (8) per l’equazione(9) e moltiplicando per 100, si ottiene l’efficienza percentuale (E%) della degradazione degli acidi grassi per produrre energia, in relazione al catabolismo animale, espressa dall’equazione (10).

Tracciando E % contro la lunghezza della catena degli acidi grassi (Figura 2) si verifica che l’efficienza diminuisce con l’aumento della catena idrocarburica. Inoltre, l’energia ottenuta dall’ossidazione degli acidi grassi nelle cellule con ciclo gliossilato raggiunge meno del 90% del livello di energia che sarebbe generato dalla via simile in una cellula animale.
Il tasso di ATP prodotto per atomo di carbonio ossidato (ATP/n) dipende anche dalla catena di lunghezza dell’acido grasso, ad un tasso massimo vicino a sei ATP/n (Figura 3-a), mentre questo tasso è più alto nelle cellule animali (Figura 3-b).

Figura 2.
Confronto tra efficienza energetica della degradazione degli acidi grassi nella β-ossidazione animale e β-ossidazione negli organismi con enzimi del ciclo del glicilossilato, a causa della catena di lunghezza degli acidi grassi.
Contrariamente agli animali, le verdure e alcuni microrganismi sono in grado di convertire l’acetil-CoA dall’ossidazione degli acidi grassi in zuccheri. Gli organismi combinano il ciclo gliossilato e le reazioni gluconeogenesis, che sono compartimentalizzate tra gliossisomi / perossisomi,mitocondri e citosol. Questa caratteristica conferisce una maggiore versatilità metabolica, consentendo ai batteri di utilizzare l’acetato come fonte di energia e alle piante di immagazzinare i semi come fonte di energia da utilizzare durante la germinazione.

Figura 3.
Tasso di ATP prodotto dall’atomo di carbonio (ATP/n)a causa degli atomi di carbonio di acidi grassi (n) nel ciclo gliossilato (a) e nel catabolismo inanimale (b). Il tasso di ATP / n aumenta significativamente fino acirca n = 20, d’ora in poi il tasso aumenta in modo meno significativo.
Conclusione
La degradazione degli acidi grassi da parte del ciclo gliossilato per la produzione di energia comporta la β-ossidazione, con le sue particolari caratteristiche nei gliossisomi, nel ciclo gliossilato, nel ciclo di Krebs, nella gluconeogenesi e nella glicolisi. Nonostante questi passaggi e le vie metaboliche, una relazione stechiometrica tra la lunghezza della catena degli acidi grassi e la quantità di energia prodotta nella sua degradazione può essere stabilita in termini algebrici.
Il confronto tra la stechiometria energetica coinvolta in queste vie metaboliche e la stechiometria energetica della β-ossidazione come avviene nelle cellule animali, mostra una riduzione dell’efficienza energetica, rispetto al metabolismo animale. Mentre il bypass delle reazioni di decarbossilazione del ciclo di Krebs conferisce adattamenti evolutivi agli organismi quando presenti, determina anche una minore quantità di energia generata per atomo di carbonio rispetto alla degradazione degli acidi grassi negli animali.