Introduction
RNA interference(RNAi)は、低分子干渉RNA(siRNA)が完全な相補配列で特定の標的遺伝子をダウンレギュレートする広く使用されている技術であり、ヒト疾患の治療応用に使用することが約束されている(Castanotto and Rossi,2009;Ketting,2011)。 ヒトは2 0,0 0 0個以上の遺伝子を有するが、高機能であり、その特異的標的以外の遺伝子に影響を及ぼさないsiRNAを使用することが望ましい。 この記事では、RNAiのメカニズムに基づいてsiRNAを設計するための最適化された方法をレビューします。 また、siRNA配列を選択するために公開されているウェブサイトを紹介します。
siRNAの最適化されたデザイン
2nt3’オーバーハング(siRNA)を持つ21ヌクレオチド(nt)RNAの二重鎖は、通常、RNAi実験に使用されます。 細胞内への送達の際に、siRNAは、二本鎖RNAとしてRNA誘導サイレンシング複合体(RISC)に組み込まれる。 RISCは、スライサー活性を有するアルゴノート蛋白質(Ago)を含有するエフェクター複合体である(Hammond e t a l. ら,2 0 0 1;Martinez e t a l., 2002). 熱力学的に安定性の低い5’末端を含有するsiRNAガイド鎖は、RISCによって優先的に保持される(Khvorova e t a l. ら,2 0 0 3;Schwarz e t a l. ら,2 0 0 3;Ui−Tei e t a l., 2004). RISC上にロードされた二本鎖siRNAの大部分の乗客鎖は、Ago2タンパク質によって切断され、分解される(Matranga e t a l. る。 ら,2 0 0 5;Leuschner e t a l., 2006). 保持されたガイド鎖対は、完全に相補的な配列を有するmRNAを標的とし、siRNAガイド鎖のヌクレオチド1 0位でAgo2蛋白質による切断によりそれを抑制す ら、2 0 0 1;Hammond e t a l., 2001; マルティネス他, 2002). しかしながら、ゲノムワイド実験からの蓄積された証拠は、ガイド鎖に部分的な相補性を有する多数のmRNAもまた減少することを示している(Jackson e t a l. ら,2 0 0 3,2 0 0 6;Lim e t a l. 2005年のバーミンガムet al. ら,2 0 0 6;Ui−Tei e t a l., 2008). この現象は、種子依存性オフターゲット効果と呼ばれ、好ましくはmRNA3’Utrで観察される。 このオフターゲット効果の標的認識機構は、miRNA媒介遺伝子サイレンシングのそれと類似していることが知られている(Lewis e t a l. ら,2 0 0 5;Limら,2 0 0 6;Mol. ら、2 0 0 5;Grimson e t a l., 2007). 5’末端から2-8に位置するシード領域に相補的な配列を有する転写物は、主に減少する。 シード領域は、Risc中の小Rnaの進入部位または核形成部位として機能するように、準ヘリカル形態でAgoの表面上に位置することが知られている(Ma e t a l. ら,2 0 0 5;Yuan e t a l., 2005). したがって、シード領域は、最初に標的m RNAを同定し、続いて、意図される標的m RNAと完全な塩基対形成を形成し、Ago2によってRnaiを誘導する。
RNAiのメカニズムに基づいて、標的遺伝子特異的siRNAは、以下の三つのステップに従って選択可能であると考えられる。
ステップ1:機能的siRNA配列の選択
siRNAのノックダウン効率は、それらの配列に大きく依存することが明らかになった。 我々は、高機能siRNAの特性を規定する経験的に基づいた規則を提唱した(Ui-Tei et al.,2004),このようなルールはUi-Teiルールと呼ばれています(図1). Ui−Tei規則によって選択されたsiRNAは、以下の4つの条件を同時に満たす。: (1)siRNAガイド鎖の5’末端から1位のAまたはU、(2)19位のGまたはC、(3)1-7位のAUリッチ(AU≥4)、および(4)長いGCストレッチ≥10がない。 (4)を除いて、本発明者らの規則は、機能性siRNAが5’末端および3’末端において非対称安定性を有することを示した。 ルシフェラーゼレポーターアッセイを用いた我々の実験的検証は、上記の条件を満たすsirnaの98%が33%以下のルシフェラーゼレポーターの発現を減少させたことを示した(Ui-Tei et al., 2004). 他のグループはまた、Reynolds規則と呼ばれる高機能siRNAの規則を実証した(Reynolds e t a l. 2004)とAmarzguiouiルール(Amarzguioui and Prydz,2004)図1に要約されています。 これらの規則はまた、機能的sirnaが非対称であることを明確に示した:不安定な5’末端を有するRNA鎖は、ガイド鎖として有効であった。 さらに、これらの規則では一般的に、機能性siRNAガイド鎖の5’末端がAまたはUであることが好ましい。, 2010). ヒトAGO2とNMR滴定実験からの中間(中間)ドメインの結晶構造は、ヌクレオチド一リン酸、AMPとΓは、真核生物AGOタンパク質のミッドドメインにおけるヌクレオチド特異的相互作用のための構造的証拠を提供し、CMPまたはGMPのいずれかよりも最大30倍の高い親和性で結合することを示した。
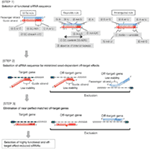
図1. 機能的およびオフターゲット効果低減siRNAを選択するための模式図。 Ui−Tei、Reynolds、Amarzguioui規則、またはそれらの組み合わせによる高機能siRNAの選択(ステップ1)。 種子標的二重鎖中の安定性が低いsiRNAの選択(ステップ2)。 非標的遺伝子へのほぼ完全に一致した配列を有するsiRNAの排除(ステップ3)。 各規則において、ヌクレオチド位置は、ガイド鎖の5’末端から数えたヌクレオチドの数を示す。  :
: 位置1のA/U。 <3 1 8 2>位置1 9のG/C。
位置1のA/U。 <3 1 8 2>位置1 9のG/C。 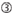 4から7A/usの位置1-7。
4から7A/usの位置1-7。 
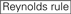 :
: GC含有量(30%-52%)。
GC含有量(30%-52%)。 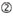 位置1-5のA/U≥3。
位置1-5のA/U≥3。 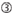
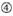 aは1位。
aは1位。 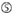 aは17位に位置しています。
aは17位に位置しています。 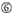 Uは10位に位置しています。
Uは10位に位置しています。 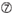 位置1ではG/Cではない。
位置1ではG/Cではない。 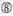 位置7ではGではない。
位置7ではGではない。 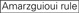 :
: 複式アパートの端の安定性の非対称性(複式アパートのどちらかの端の3つの末端のベースペアのA/Uの差動として測定される)。
複式アパートの端の安定性の非対称性(複式アパートのどちらかの端の3つの末端のベースペアのA/Uの差動として測定される)。 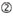 位置19のGまたはC。
位置19のGまたはC。 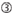 位置1のAまたはU。
位置1のAまたはU。 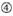 位置14のAまたはU。
位置14のAまたはU。 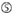 位置19ではUではありません。
位置19ではUではありません。  位置1ではGではない。
位置1ではGではない。
ステップ2: 減少したオフターゲット効果を有するsiRNA配列の選択
シード依存性オフターゲット効果を回避するために、一つのアプローチは、シード配列がすべての非標的化遺伝子の3’UTR内の任意の配列に相補的ではないsiRNAガイド鎖を選択することであり得る。 しかし、このアプローチは、最もまれなseven-ntシード配列を有するヒトsirnaは、まだいくつかの非標的mrnaとシード相補性を持っていたので、不可能であることが証明 そこで、我々は、sirnaがシード依存的なオフターゲット効果を誘導する能力を支配する規則を探し、オフターゲット効果の効率は、siRNAガイド鎖のシード領域とその標的mRNAとの間に形成される二重鎖の熱力学的安定性に非常に相関していることを明らかにした(Ui-Tei et al., 2008). RNA二重鎖の形成のための熱力学的パラメータの一つである融解温度(T m)は,種子依存性オフターゲット効果の誘導と強い正の相関を示した。 したがって、シード-標的二重鎖の低Tmを有するsiRNAを選択することは、シード依存性のオフターゲットサイレンシングを最小限に抑えるべきである(図1)。 21.5℃のTmは、ほぼオフターゲットなしのシード配列をオフターゲット陽性のものから区別するベンチマークとして役立つ可能性があります。 さらに、オフターゲット効果はガイド鎖だけでなくパッセンジャー鎖によっても引き起こされる可能性があるため、両方の鎖に対してシード標的T mが十分に低いsiRNAが有利である。
ステップ3: 完全に一致したオフターゲット遺伝子の排除
シード-ターゲット二重鎖のTm値が十分に低い場合でも、非シード領域が完全に相補的である場合、標的遺伝子サイレンシングは依然として起こる可能性がある。 したがって、第3のステップでは、他の非標的転写物とほぼ完全に一致するsiRNAが排除された(図1)。
siRNA設計ソフトウェア
siRNA設計ソフトウェア、siDirect2.0(http://siDirect2.RNAi.jp/)を発表しました; 上記の手順に従って、機能的な標的特異的siRNA設計ソフトウェアを提供する(Naito e t a l.,2 0 0 2)。, 2009). デフォルトパラメータでは、Ui-Teiルールを満たすsiRNAを選択することができます。 候補機能sirnaは、21.5℃以下のTm値を持つシードターゲット二重鎖を形成することができ、両方の鎖の位置2-20にまたがるそれらの19nt領域は、他の非標的転写物

図2. SiDirect2.0siRNAデザインソフトウェアの画面ビュー。 (ア)トップページ(http://siDirect2.RNAi.jp/) (B)siRNA設計のための任意のパラメータ。 (C)結果ページ。 (D)完璧に近い一致を持つオフターゲット候補者の詳細なリスト。 各オフターゲット転写物とsiRNA配列との間の整列は、不一致の位置を視覚化する。
機能性siRNAを選択するための他のソフトウェアは、表1に示すように公開されていた。 それらの多くでは、Ui−Tei規則(Ui−Tei e t a l. ら、2 0 0 4)、Reynolds rule(Reynolds e t a l. ら、2 0 0 4)、Amarzguioui規則(AmarzguiouiおよびPrydz、2 0 0 4)、Tuschl規則(Elbashir e t a l.,2002)、およびそれらの組合せは頻繁にそして広く利用されていました。 ほぼ完全に一致した非標的遺伝子を排除するために、BLAST検索をいくつかのソフトウェアで相同性検索のために使用した。 しかし、BLAST検索は、siRNA、SIDIRECT、WU−BLAST、およびBowtieのような短い配列に対してはそれほど正確ではないので、短い配列に対する高精度な相同性検索エンジンがしばしば使 その中でも、siDirect2.0は最も正確な結果をもたらす可能性があります。 さらに、ソフトウェアのいくつかは、mRNA二次構造(Ladunga,2 0 0 7;Lu and Mathews,2 0 0 8)、代替スプライシング(Park e t a l. ら,2 0 0 8)、またはRNAウイルスによる免疫応答が起こり得るモチーフ配列(Gong e t a l.,2 0 0 8)、またはRNAウイルスによる免疫応答が起こり得るモチーフ配列(Gong e t a l., 2008). これらの機能はsiDirect2.0では考慮されていません。 したがって、これらの特徴を考慮に入れるために、siDirect2.0および他の適切なソフトウェアプログラムによって一般的に選択されたsiRNAは、最適な結果を
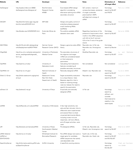
表1. 低分子干渉RNA設計ソフトウェアプログラム。
さらに、意図された標的遺伝子のノックダウン効果は一般的であると考えられているが、オフターゲット効果はsirna間で異なる可能性が高いため、意図された標的遺伝子の異なる部位を標的とする二つ以上のsirnaを使用することは事実上重要な考慮事項である。
結論
各siRNAの有効性は、哺乳動物細胞におけるその配列によって大きく異なることが知られており、ランダムに設計されたsirnaの限られた画分 さらに、オフターゲットサイレンシング効果は、siRNAが意図しない遺伝子とシード領域で部分的な相補性を有する場合に生じる。 ここでは、RNAi機械に基づいて、我々は、標的遺伝子特異的にノックダウンすることが期待されている機能的、オフターゲット効果減少sirnaの合理的な設計を説
利益相反声明
著者らは、この研究は利益相反の可能性があると解釈される可能性のある商業的または財務的関係がない場合に行われたと宣言
謝辞
本研究は、文部科学省およびセルイノベーションプロジェクト(文部科学省)からの助成、私立大学コア研究プロジェクト、Ui邸久美子へのマッチングファンド補助金によって一部支援されたものである。
Amarzguioui,M.,Prydz,H.(2004). 機能的siRNA配列の選択のためのアルゴリズム。 バイオケム バイオフィス・バイフィス・バイフィス コミュ… 316, 1050–1058.
Pubmed要約/Pubmed全文|CrossRef全文
バーミンガム,A.,アンダーソン,E.M. 洋,A.,Ilsley-Tyree、Leake、Fedorov,Y.,Baskerville、Maksimovaり、ロビンソン、Karpilow,J.マーシャルW.バイオインフォマティクスをKhvorova,A.(2006). 全体的な同一性ではなく、3’UTRシード一致は、Rnaiオフ標的と関連している。 ナット 方法3、199-204。
Pubmed要約/Pubmed全文|CrossRef全文
Castanotto,D.,And Rossi,J.J.(2009). RNA干渉ベースの治療法の約束と落とし穴。 自然457,426-433.
Pubmed要約/Pubmed全文|CrossRef全文
Chalk,A.M.,And Sonnhammer,E.L.L.(2008). ミスマッチ耐性データを組み込んだsiRNA特異性検索。 バイオインフォマティクス24,1316-1317.
Pubmed要約/Pubmed全文|CrossRef全文
Cui,W.,Ning,J.,Naik,U.P.,And Duncan,M.K.(2004). OptiRNAiおよびRNAiの設計用具。 Comput。 メソッドプログラムBiomed。 75, 67–73.
Pubmed要約/Pubmed全文|CrossRef全文
ディン、Y、チャン、C.Y. およびLawrence,C. サイト構築のためのウェブサーバ。 核酸Res.32,W135–W141.
Pubmed要約/Pubmed全文|CrossRef全文
ることができると考えられている。 21ヌクレオチドRnaの二重鎖は、培養哺乳動物細胞におけるRNA干渉を媒介する。 自然411,494-498.
Pubmed要約/Pubmed全文|CrossRef全文
とができるようになりました。 低分子干渉Rnaを用いた体細胞哺乳動物細胞における遺伝子機能の解析。 方法26、199-213。
Pubmed要約/Pubmed全文|CrossRef全文
ることができます。 ヒトAGO2によるガイドRNAの5′-ヌクレオチド塩基特異的認識のための構造的基礎。 自然465、818-822。
Pubmed要約/Pubmed全文|CrossRef全文
Gong,W.,Ren,Y.,Zhou,H.,Wang,Y.,Kang,S.,And Li,Tongbin. (2008). siDRM: そして有効で、一般に適当なオンラインsiRNAの設計用具。 バイオインフォマティクス24,2405-2406.
Pubmed要約/Pubmed全文|CrossRef全文
Grimson,A.,Farh,K.K.,Johnston,W.K.,Garrett-Engele,P.,Lim,L.P.,And Bartel,D.P.(2007). Mammals乳類のmicrornaの目標とする特定性:種の組合わせることを越える決定基。 モル セル27、91-105。
Pubmed要約/Pubmed全文|CrossRef全文
とができるようになることを期待しています。 Argonaute2RNAiの遺伝的および生化学的分析の間のリンク。 科学293,1146-1150.
Pubmed要約/Pubmed全文|CrossRef全文
Henschel,A.,Buchholz,F.,And Habermann,B.(2004). DEQOR:siRNAの設計と品質管理のためのwebベースのツール。 核酸Res.32,W113–W120.
Pubmed要約/Pubmed全文|CrossRef全文
Horn,T.,Sandmann,T.,And Boutros,M.(2010). RNA干渉スクリーンのためのゲノムワイドライブラリの設計と評価。 ゲノムバイオール 11R61
Pubmed要約/Pubmed全文|CrossRef全文
Jackson,A.L.,Bartz,S.R.,Shelter,J.,Kobayashi,S.V.,Burchard,J.,Mao,M.,Li,B.,Cavet,G.,And Linsley,P.S.(2003). 発現プロファイリングは、RNAiによるオフターゲット遺伝子調節を明らかにする。 ナット バイオテクノール 21, 635–637.
Pubmed要約/Pubmed全文|CrossRef全文
Jackson,A.L.,Burchard,J.,Schelter,J.,Chau,B.M.,Cleary,M.,Lim,L.,And Linsley,P.S.(2006). シード領域配列相補性によって媒介される広範なsiRNA”オフターゲット”転写物サイレンシング。 12,1179-1187.
Pubmed要約/Pubmed全文|CrossRef全文
ケティング,R.F.(2011). RNAiの多くの顔。 デヴ セル15、148-161。
クロスリファレンス全文
Khvorova,A.,Reynolds,A.,And Jayasena,S.D.(2003). 機能的siRNAおよびmiRNAは鎖バイアスを示す。 セル115、209-216。
Pubmed要約/Pubmed全文|CrossRef全文
Ladunga,I.(2007). より少ないsirnaによるより完全な遺伝子サイレンシング:透明な最適化されたデザインと生物物理学的署名。 核酸Res.35,433-440.
Pubmed要約/Pubmed全文|CrossRef全文
ることができると考えられています。 ヒト細胞におけるRISC組立中のsiRNA passgenge鎖の切断。 EMBO Rep.7,314-320.
Pubmed要約/Pubmed全文|CrossRef全文
Lewis,B.P.,Burge,C.B.,And Bartel,D.P.(2005). 多くの場合、アデノシンに隣接した保存された種子のペアリングは、ヒト遺伝子の何千ものマイクロrna標的であることを示しています。 セル120、15-20。
Pubmed要約/Pubmed全文|CrossRef全文
リム、L.P.、Lau、N.C.、Garrett-Engele、P.、Grimson、A.、Schelter、J.M.、城、J.、Bartel、D.P.、Linsley、P.S.、およびジョンソン、J.M.(2005年)。 マイクロアレイ解析は、いくつかのマイクロrnaは、ターゲットmrnaの多数をダウンレギュレートすることを示しています。 433,769-773.
Pubmed要約/Pubmed全文|CrossRef全文
Lu,Z.J. およびMathews,D. ハイブリダイゼーション熱力学を用いた効率的なsiRNA選択。 核酸Res.36,640-647.
クロスリファレンス全文
Ma,J.-B.,Yuan,Y.R.,Meister,G.,Pei,Y.,Tuschl,T.,And Patel,D.J.(2005). A.fulgidus piwiタンパク質によるガイドRNAの5’末端特異的認識のための構造的基礎。 自然434、666-670。
Pubmed要約/Pubmed全文|CrossRef全文
ることを可能にすることを目的としています。 一本鎖アンチセンスsiRNAは、RNAiにおける標的RNA切断をガイドする。 セル110、563-574。
Pubmed要約/Pubmed全文|CrossRef全文
Matranga,C.,Tomari,Y.,Shin,C.,Bartel,D.P.,And Zamore,P.D.(2005). 乗客鎖切断は、Ago2含有RNAi酵素複合体へのsiRNAのアセンブリを容易にします。 セル123、607-620。
Pubmed要約/Pubmed全文|CrossRef全文
ることができると考えられている(2009年)。 siDirect2.0: 種子依存性のオフターゲット効果を低減した機能的siRNAを設計するための更新されたソフトウェア。 BMCバイオインフォマティクス10,392.
クロスリファレンス全文
Park,Y.-K.,Park,S.-M.,Choi,Y.-C.,Lee,D.,Won,M.,And Kim,Y.J.(2008). AsiDesigner:代替スプライシングを考慮したエクソンベースのsiRNA設計サーバー。 核酸Res.36,W97-W103.
クロスリファレンス全文
Rand,T.A.,Petersen,S.,Du,F.,And Wang,X.(2005). Argonaute2は、RISC活性化中にsiRNAの抗ガイド鎖を切断する。 セル123、621-629。
Pubmed要約/Pubmed全文|CrossRef全文
とができるようにすることを目的としています。 RNA干渉のための合理的なsiRNA設計。 ナット バイオテクノール 22, 326–330.
Pubmed要約/Pubmed全文|CrossRef全文
シュワルツ,D.S.,Hutvangner,G.,Du,T.,Xu,Z.,Aronin,N.,And Zamore,P.D.(2003). RNAi酵素複合体の集合における非対称性。 セル115、199-208。
Pubmed要約/Pubmed全文|CrossRef全文
Shah,J.K.,Garner,H.R.,White,M.A.,Shames,D.S.,And Minna,J.D.(2007). sIR:siRNA information resource、siRNA配列設計および解析のためのwebベースのツール、およびオープンアクセスsiRNAデータベース。 BMCバイオインフォマティクス8、178。 土井:10.1186/1471-2105-8-178
CrossRef全文
とができていることを明らかにしました。 シード二重鎖における熱力学的安定性とWatoson-Crick塩基対形成は,srnaベースのオフターゲット効果の効率の主要な決定因子である。 核酸Res.36、7100-7109。
Pubmed要約/Pubmed全文|CrossRef全文
(2004年)……………………………………………….2014年………………………….. 哺乳類およびニワトリRNA干渉のための非常に効果的なsiRNA配列の選択のためのガイドライン。 Nucleic Acids Res.32,936-948.
Pubmed要約/Pubmed全文|CrossRef全文
ることができると考えられている。 SiRNAの有効性予測のための正確で解釈可能なモデル。 BMCバイオインフォマティクス7,520. 土井:10.1186/1471-2105-7-520
CrossRef全文
ることができると考えられています。 siRAN selection server:自動siRNAオリゴヌクレオチド予測サーバー。 核酸Res.32,W130–W134.
Pubmed要約/Pubmed全文|CrossRef全文
Yuan,Y.-R.,Pei,Y.,Ma,J.B.,Kuryavyi,V.,Zhandina,M.,Meister,G.,Chen,H.Y.,Dauter,Z.,Tuschl,T.,And Patel,D.J.(2005). A.aeolicus argonaute、サイト固有のDNAガイド付きエンドリボヌクレアーゼの結晶構造は、RISCを介したmRNA切断への洞察を提供します。 モル セル19、405-419。
Pubmed要約|Pubmed全文|CrossRef全文