- Bevezetés
- optimalizált tervezése siRNS
- 1. lépés: a funkcionális siRNS-szekvencia kiválasztása
- 2. lépés: Az siRNS szekvencia kiválasztása csökkentett célon kívüli hatásokkal
- 3. lépés: A majdnem tökéletesen illeszkedő, célon kívüli gének eliminációja
- siRNA Tervező szoftver
- következtetés
- összeférhetetlenségi nyilatkozat
- Köszönetnyilvánítás
Bevezetés
az RNS interferencia (RNAi) egy széles körben alkalmazott technika, amellyel a kis interferáló RNS (siRNS) egy specifikus célgént szabályoz tökéletes komplementer szekvenciával, és megígérte, hogy az emberi betegségek terápiás alkalmazásában (Castanotto and Rossi, 2009; Ketting, 2011). Bár az embernek több mint 20 000 génje van, kívánatos olyan siRNS-t használni, amely rendkívül funkcionális, és a specifikus célponton kívül semmilyen más génre nincs hatással. Ebben a cikkben áttekintünk egy optimalizált módszert az siRNS tervezésére az rnai mechanizmusa alapján. Ezenkívül bemutatjuk a nyilvánosság számára nyitott weboldalakat az siRNS szekvenciák kiválasztására.
optimalizált tervezése siRNS
duplexek 21-nukleotid (nt) RNS 2 nt 3′ túlnyúlás (siRNS) általában használt RNS kísérletek. A sejtekbe történő szállításkor az siRNS-ek kettős szálú RNS-ként beépülnek az RNS-indukált hangtompító komplexbe (RISC). A RISC az argonaute fehérjét (Ago) tartalmazó effektor komplex szeletelő aktivitással (Hammond et al., 2001; Martinez et al., 2002). A termodinamikailag kevésbé stabil 5′-végű siRNS vezető szálat előnyösen a RISC tartja meg (Khvorova et al., 2003; Schwarz et al., 2003; Ui-Tei et al., 2004). A RISC-re betöltött kettős szálú siRNS-ek többségének utasszálait az Ago2 fehérje hasítja és lebomlik (Matranga et al., 2005; Rand et al., 2005; Leuschner et al., 2006). A megtartott vezetőszálpárok tökéletesen komplementer szekvenciával célozzák meg az mRNS-t, és az Ago2 fehérje általi hasítással elnyomják az siRNS vezetőszál 10.nukleotidpozíciójában (Elbashir et al., 2001; Hammond et al., 2001; Martinez et al., 2002). A genom egészére kiterjedő kísérletekből származó felhalmozott bizonyítékok azonban azt mutatják, hogy a vezető szál részleges komplementaritásával rendelkező mRNS-ek nagy száma szintén csökken (Jackson et al., 2003, 2006; Lim et al., 2005; Birmingham et al., 2006; Ui-Tei et al., 2008). Ezt a jelenséget magfüggő off-target hatásnak nevezik, és előnyösen megfigyelhető az mRNS 3′ UTR-ekben. Ennek a célon kívüli hatásnak a célfelismerési mechanizmusa ismert, hogy hasonló a miRNS által közvetített géncsendesítéshez (Lewis et al., 2005; Lim et al., 2005; Grimson et al., 2007). A 2-8 magtartományt kiegészítő szekvenciákkal rendelkező átiratok az 5′ termináltól főleg redukálódnak. A magrégióról ismert, hogy az Ago felszínén kvázi spirális formában helyezkedik el, hogy a kis RNS-ek belépési vagy nukleációs helyeként szolgáljon a RISCs-ben (Ma et al., 2005; Yuan et al., 2005). Így a magrégió először azonosítja a cél mRNS-eket, majd tökéletes bázispárosítást képez a tervezett cél mRNS-sel, és ago2-vel indukálja az RNS-t.
az RNSi mechanizmusa alapján a célgén-specifikus siRNS-t a következő három lépés szerint szelektívnek tekintjük.
1. lépés: a funkcionális siRNS-szekvencia kiválasztása
az siRNS-ek leütési hatékonysága nagymértékben függ a szekvenciáiktól. Támogattuk az empirikusan alapuló szabályt, amely előírta a rendkívül funkcionális siRNS jellemzőit (Ui-Tei et al., 2004), az ilyen szabályt Ui-Tei szabálynak hívják (1.ábra). Az Ui-Tei szabály által kiválasztott siRNS egyidejűleg teljesíti a következő négy feltételt: (1) A vagy U az 1.pozícióban az siRNS vezető szálának 5′ végpontjától, (2) G vagy C a 19. pozícióban, (3) AU gazdagság (AU kb 4) az 1-7. pozícióban, és (4) nincs hosszú GC szakasz 60. A (4) kivételével a szabályunk azt jelezte, hogy a funkcionális siRNS aszimmetrikus stabilitással rendelkezik az 5′ és 3′ terminálokon. Kísérleti validációnk luciferase reporter assay alkalmazásával azt mutatta, hogy a fenti feltételeknek megfelelő siRNS-ek 98% – a csökkentette a luciferase reporter expresszióját 33% alá (Ui-Tei et al., 2004). Más csoportok bemutatták a Reynolds-szabálynak nevezett rendkívül funkcionális siRNS-ek szabályait is (Reynolds et al., 2004) és Amarzguioui rule (Amarzguioui and Prydz, 2004), az 1.ábra összefoglalása szerint. Ezek a szabályok azt is egyértelműen megmutatták, hogy a funkcionális siRNS-ek aszimmetrikusak: az instabil 5′ terminállal rendelkező RNS-szál hatékony volt vezető szálként. Továbbá, közös ezekben a szabályokban, 5 ‘ terminus funkcionális siRNS vezető szál előnyösebb volt, hogy A vagy U. később kiderült, hogy az eredmények tükrözik a szerkezeti jellemzői az emberi Ago2 (Frank et al., 2010). A humán AGO2 és NMR titrálási kísérletekből származó középső (középső) domén kristályszerkezete azt mutatta, hogy a nukleotid-monofoszfátok, az AMP és az UMP akár 30-szor nagyobb affinitással kötődnek, mint a CMP vagy a GMP, strukturális bizonyítékot szolgáltatva a nukleotid-specifikus kölcsönhatásokra az eukarióta AGO fehérjék középső doménjében.
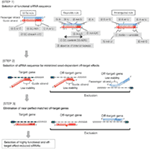
1. ábra. Sematikus ábrázolás funkcionális és off-target hatás-Csökkentett siRNS-ek kiválasztásához. Rendkívül funkcionális siRNS kiválasztása Ui-Tei, Reynolds, Amarzguioui szabályok vagy ezek kombinációja alapján (1.lépés). Alacsony stabilitású siRNS-ek kiválasztása a vetőmag – cél duplexekben (2.lépés). Az siRNS-ek eliminációja közel tökéletesen illeszkedő szekvenciákkal a nem célgénekhez (3.lépés). Minden szabályban a nukleotid pozíció jelzi a vezető szál 5′ terminálisától számított nukleotid számát.  :
:  A/U az 1.pozícióban.
A/U az 1.pozícióban.  G / C a 19. pozícióban.
G / C a 19. pozícióban.  4-7 A/Us az 1-7.pozícióban.
4-7 A/Us az 1-7.pozícióban. 
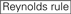 :
:  GC-tartalom (30% -52%).
GC-tartalom (30% -52%). 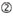 a / U 3 az 1-5. pozícióban.
a / U 3 az 1-5. pozícióban. 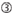 belső ismétlések hiánya.
belső ismétlések hiánya. 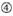 A az 1.pozícióban.
A az 1.pozícióban. 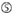 A A 17.pozícióban.
A A 17.pozícióban. 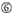 U a 10. pozícióban.
U a 10. pozícióban. 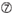 nem G / C az 1. pozícióban.
nem G / C az 1. pozícióban. 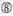 nem G a 7. pozícióban.
nem G a 7. pozícióban. 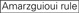 :
:  a duplex végek stabilitásának aszimmetriája (a duplex két végén lévő három terminális alappár A/U differenciájaként mérve).
a duplex végek stabilitásának aszimmetriája (a duplex két végén lévő három terminális alappár A/U differenciájaként mérve).  G vagy C a 19. pozícióban.
G vagy C a 19. pozícióban.  A vagy U az 1. pozícióban.
A vagy U az 1. pozícióban.  A vagy U a 14.pozícióban.
A vagy U a 14.pozícióban.  nem U a 19. pozícióban.
nem U a 19. pozícióban.  nem G az 1. pozícióban.
nem G az 1. pozícióban.
2. lépés: Az siRNS szekvencia kiválasztása csökkentett célon kívüli hatásokkal
a magfüggő célon kívüli hatások elkerülése érdekében az egyik megközelítés lehet az siRNS vezető szál kiválasztása, amelynek magszekvenciája nem komplementer az összes nem célzott gén 3′ UTR-jének egyetlen szekvenciájával sem. Ez a megközelítés azonban lehetetlennek bizonyult, mivel a legritkább hét nt magszekvenciával rendelkező emberi siRNS-ek még mindig vetőmag-komplementaritással rendelkeztek több nem célzott mRNS-sel. Tehát kerestük azokat a szabályokat, amelyek szabályozzák az siRNS-ek azon képességét, hogy magfüggő off-target hatást indukáljanak, és kiderült, hogy az off-target hatás hatékonysága nagymértékben korrelál az siRNS vezető szál magterülete és a cél mRNS között kialakult duplex termodinamikai stabilitásával (Ui-Tei et al., 2008). Az olvadási hőmérséklet (TM), az RNS duplex képződésének egyik termodinamikai paramétere, erős pozitív korrelációt mutatott a magfüggő off-target hatások indukciójával. Így a mag-cél duplex alacsony Tm-Mel rendelkező siRNS-ek kiválasztása minimalizálja a magfüggő célon kívüli hangtompítást (1.ábra). A TM 21,5cc lehet a viszonyítási alap, amely megkülönbözteti a szinte off-target-mentes mag szekvenciák a off-target-pozitív is. Továbbá, mivel a céltól eltérő hatást nemcsak a vezetőszál, hanem az utasszál is okozhatja, kedvezőek azok a siRNS-ek, amelyek mag-cél Tm mindkét szál számára kellően alacsony.
3. lépés: A majdnem tökéletesen illeszkedő, célon kívüli gének eliminációja
még akkor is, ha a vetőmag-cél duplex Tm értéke kellően alacsony, a célgén-elnémítás akkor is megtörténhet, ha a nem vetőmag régió teljesen komplementer. Ezért a harmadik lépésben megszüntettük azokat a siRNS-eket, amelyek majdnem tökéletesen megfelelnek bármely más nem célzott átiratnak (1.ábra).
siRNA Tervező szoftver
bemutattuk siRNA tervező szoftver, siDirect 2.0 (http://siDirect2.RNAi.jp/; 2. ábra), amely funkcionális, célspecifikus siRNS tervező szoftvert biztosít a fent említett eljárások szerint (Naito et al., 2009). Az alapértelmezett paraméterben az Ui-Tei szabályt kielégítő siRNS-ek választhatók ki. Amikor a jelölt funkcionális siRNS-ek mag-cél duplexeket képezhetnek, amelyek Tm-értéke 21,5 kb, és mindkét szál 2-20 helyzetét átívelő 19-nt régióik legalább két eltérést mutatnak bármely más nem célzott átirattal, a siDirect 2.0 legalább egy minősített siRNS-t tervezhet a refseq-ben lévő humán mRNS-szekvenciák >94% – ára.

2. ábra. Képernyő nézetek siDirect 2.0 siRNA tervező szoftver. A) felső oldal (http://siDirect2.RNAi.jp/). (B) választható paraméterek siRNS tervezés. C) eredményoldal. (D) az off-target jelöltek részletes listája, közel tökéletes mérkőzésekkel. Az egyes off-target átiratok és az siRNS szekvenciák közötti összehangolás megjeleníti az eltérések helyzetét.
a funkcionális siRNS-ek kiválasztására szolgáló egyéb szoftverek az 1.táblázat szerint nyilvánosak voltak. Sok ilyenben Ui-Tei szabály (Ui-Tei et al., 2004), Reynolds szabály (Reynolds et al., 2004), Amarzguioui-szabály (Amarzguioui and Prydz, 2004), Tuschl-szabály (Elbashir et al., 2002), és ezek kombinációját gyakran és széles körben használták. A majdnem tökéletesen illeszkedő, nem célgének kiküszöbölése érdekében a BLAST search-et homológiai kereséshez használták több szoftverben. Mivel azonban a BLAST search nem olyan pontos a rövid szekvenciákhoz, mint a siRNS, a siDirect,a WU-BLAST és a Bowtie, amelyek nagyon pontos homológiai keresőmotorok a rövid szekvenciákhoz. Ezek közül a siDirect 2.0 hozhatja a legpontosabb eredményeket. Ezenkívül néhány szoftver figyelembe veszi a további funkciókat, mint például az mRNS másodlagos szerkezete (Ladunga, 2007; Lu and Mathews, 2008), alternatív splicing (Park et al., 2008), vagy az a motívumszekvencia, amellyel az RNS vírus immunválasza bekövetkezhet (Gong et al., 2008). Ezeket a funkciókat a siDirect 2.0 nem veszi figyelembe. Tehát, figyelembe véve ezeket a funkciókat, a siDirect 2.0 és a többi megfelelő szoftver által általában kiválasztott siRNS-ek optimális eredményt hozhatnak.
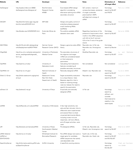
táblázat 1. Kis interferáló RNS tervező szoftverek.
ezenkívül gyakorlatilag fontos szempont, hogy két vagy több siRNS-t használjunk, amelyek a tervezett célgén különböző helyeit célozzák meg, mivel a tervezett célgén leütési hatásai feltételezhetően gyakoriak, de a célon kívüli hatások valószínűleg különböznek az siRNS-ek között.
következtetés
az egyes siRNS-ek hatékonysága az emlős sejtekben való szekvenciájától függően nagymértékben változik, és a véletlenszerűen megtervezett siRNS-eknek csak korlátozott része működik. Sőt, a célon kívüli hangtompító hatások akkor jelentkeznek, amikor az siRNS részleges komplementaritással rendelkezik a magrégióban nem szándékos génekkel. Itt, az RNSi gépezet alapján, leírtuk a funkcionális racionális tervezését, célon kívüli hatás-Csökkentett siRNS-ek, amelyek várhatóan leütik a célgént-specifikusan.
összeférhetetlenségi nyilatkozat
a szerzők kijelentik, hogy a kutatást olyan kereskedelmi vagy pénzügyi kapcsolatok hiányában végezték, amelyek potenciális összeférhetetlenségnek tekinthetők.
Köszönetnyilvánítás
ezt a munkát részben a japán Oktatási, Kulturális, Sport -, Tudományos és Technológiai Minisztérium (MEXT), valamint a cell Innovation Project (MEXT), valamint a magánegyetemek alapvető kutatási projektje támogatta.
Amarzguioui, M. és Prydz, H. (2004). Algoritmus a funkcionális siRNS szekvenciák kiválasztására. Biochem. Biophys. Res. Commun. 316, 1050–1058.
Pubmed Absztrakt / Pubmed Teljes Szöveg / CrossRef Teljes Szöveg
Birmingham, A., Anderson, E. M., Reynolds, A., Ilsley-Tyree, D., Leake, D., Fedorov, Y., Baskerville, S., Maksimova, E., Robinson, K., Karpilow, J., Marshall, W. S. és Khvorova, A. (2006). 3 ‘ az UTR vetőmag-egyezések, de nem az Általános identitás, az RNAi off-célokhoz kapcsolódnak. Nat. 3. módszer, 199-204.
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Castanotto, D. és Rossi, J. J. (2009). Az RNS-interferencia-alapú terápiák ígéretei és buktatói. Természet 457, 426-433.
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Chalk, A. M. és Sonnhammer, E. L. L. (2008). siRNS specificitás keresés, amely eltérési toleranciaadatokat tartalmaz. Bioinformatika 24, 1316-1317.
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
2004-ben Hui, W., Ning, J., Naik, U. P. és Duncan, M. K. OptiRNAi és RNAi tervező eszköz. Comput. Módszerek Programok Biomed. 75, 67–73.
Pubmed Absztrakt / Pubmed Teljes Szöveg / CrossRef Teljes Szöveg
Ding, Y., Chan, C. Y. és Lawrence, C. E. (2004). Sfold webszerver a nukleinsavak statisztikai hajtogatására és racionális tervezésére. Nukleinsavak Res. 32, W135-W141.
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Elbashir, S. M., Harborth, J., Lendeckel, W., Yalcin, A., Weber, K. és Tuschl, T. (2001). A 21-nukleotid RNS-ek duplexei közvetítik az RNS interferenciát a tenyésztett emlőssejtekben. Természet 411, 494-498.
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Elbashir, W. M., Harborth, J., Weber, K. és Tuschl, T. (2002). A szomatikus emlőssejtek génfunkciójának elemzése kis interferáló RNS-ek alkalmazásával. 26. módszer, 199-213.
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Frank, F., Sonenberg, N. és Nagar, B. (2010). A vezető RNS 5′-nukleotid bázis-specifikus felismerésének szerkezeti alapja humán AGO2. Természet 465, 818-822.
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Gong, W., Ren, Y., Zhou, H., Wang, Y., Kang, S. és Li, Tongbin. (2008). siDRM: és hatékony és általánosan alkalmazható online siRNA tervező eszköz. Bioinformatika 24, 2405-2406.
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Grimson, A., Farh, K. K., Johnston, W. K., Garrett-Engele, P., Lim, L. P. és Bartel, D. P. (2007). MikroRNS célzott specifitás emlősökben: meghatározó tényezők a magpárosításon túl. Mol. 27-es cella, 91-105.
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Hammond, S. M., Boettcher, S., Caudy, A. A., Kobayashi, R. és Hannon, G. J. (2001). Argonaute 2 Kapcsolat az RNSi genetikai és biokémiai analízise között. Tudomány 293, 1146-1150.
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Henschel, A., Buchholz, F. és Habermann, B. (2004). DEQOR: web alapú eszköz a siRNS-ek tervezéséhez és minőségellenőrzéséhez. Nukleinsavak Res. 32, W113-W120.
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Horn, T., Sandmann, T. és Boutros, M. (2010). Az RNS interferencia képernyők genomszintű könyvtárainak tervezése és értékelése. Genome Biol. 11, R61.
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Jackson, A. L., Bartz, S. R., Shelter, J., Kobayashi, S. V., Burchard, J., Mao, M., Li, B., Cavet, G. és Linsley, P. S. (2003). Az expressziós profilozás feltárja a célon kívüli génszabályozást az RNAi által. Nat. Biotechnol. 21, 635–637.
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Jackson, A. L., Burchard, J., Schelter, J., Chau, B. M., Cleary, M., Lim, L. és Linsley, P. S. (2006). Széles körben elterjedt siRNS “off-target” átirat hangtompítás, amelyet a vetőmag régió szekvenciájának komplementaritása közvetít. RNS 12, 1179-1187.
Pubmed Absztrakt / Pubmed Teljes Szöveg / CrossRef Teljes Szöveg
Ketting, R. F. (2011). A RNAi sok arca. Dev. 15-ös cella, 148-161.
CrossRef teljes szöveg
Khvorova, A., Reynolds, A. és Jayasena, S. D. (2003). A funkcionális siRNS-ek és a miRNS-ek szálas torzítást mutatnak. 115-ös cella, 209-216.
Pubmed Absztrakt / Pubmed Teljes Szöveg / CrossRef Teljes Szöveg
Ladunga, I. (2007). Teljesebb géncsendesítés kevesebb siRNS-sel: átlátszó optimalizált tervezés és biofizikai aláírás. Nukleinsavak Res. 35, 433-440.
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Leuschner, P. J., Ameres, S. L., Kueng, S. és Martinez, J. (2006). Az siRNS utasszál hasítása a RISC összeszerelése során emberi sejtekben. EMBO Rep. 7, 314-320.
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Lewis, B. P., Burge, C. B. és Bartel, D. P. (2005). A konzervált magpárosítás, amelyet gyakran adenozinok szegélyeznek, azt jelzi, hogy több ezer emberi gén mikroRNS célpont. 120-as cella, 15-20.
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Lim, L. P., Lau, N. C., Garrett-Engele, P., Grimson, A., Schelter, J. M., Castle, J., Bartel, D. P., Linsley, P. S. és Johnson, J. M. (2005). A mikroarray elemzés azt mutatja, hogy egyes mikroRNS-ek nagyszámú cél mRNS-t szabályoznak le. Természet 433, 769-773.
Pubmed Absztrakt / Pubmed Teljes Szöveg / CrossRef Teljes Szöveg
Lu, Z. J. és Mathews, D. H. (2008). Hatékony siRNS szelekció hibridizációs termodinamikával. Nukleinsav Res. 36, 640-647.
CrossRef teljes szöveg
Ma, J.-B., Yuan, Y. R., Meister, G., Pei, Y., Tuschl, T. és Patel, D. J. (2005). A vezető RNS 5′-végspecifikus felismerésének szerkezeti alapja az A. fulgidus piwi fehérje. Természet 434, 666-670.
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Martinez, J., Patkaniowska, A., Urlaub, H., Luhrmann, R. és Tuschl, T. (2002). Egyszálú antiszensz siRNS-ek irányítják a cél RNS hasítását az RNS-ben. 110-es cella, 563-574.
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Matranga, C., Tomari, Y., Shin, C., Bartel, D. P. és Zamore, P. D. (2005). Az utasszál hasítása megkönnyíti az siRNS ago2-tartalmú rnai enzimkomplexekké történő összeszerelését. 123-as cella, 607-620.
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Naito, Y., Yoshimura, J., Morishita, S. és Ui-Tei, K. (2009). siDirect 2.0: frissített szoftver tervezése funkcionális siRNS csökkentett vetőmag-függő off-target hatást. BMC bioinformatika 10, 392.
CrossRef teljes szöveg
Park, Y.-K., Park, S.-M., Choi, Y.-C., Lee, D., Won, M. és Kim, Y. J. (2008). AsiDesigner: exon-alapú siRNA design server figyelembe véve az alternatív splicing. Nukleinsav Res. 36, W97-W103.
CrossRef teljes szöveg
Rand, T. A., Petersen, S., Du, F. és Wang, X. (2005). Az Argonaute2 hasítja az siRNS vezetőellenes szálát a RISC aktiválás során. 123-as cella, 621-629.
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Reynolds, A., Leake, D., Boese, Q., Scaringe, S., Marshall, W. S. és Khvorova, A. (2004). Racionális siRNS tervezés az RNS interferenciához. Nat. Biotechnol. 22, 326–330.
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Schwarz, D. S., Hutvangner, G., Du, T., Xu, Z., Aronin, N. és Zamore, P. D. (2003). Aszimmetria az rnai enzim komplex összeállításában. 115-ös cella, 199-208.
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Shah, J. K., Garner, H. R., White, M. A., Shames, D. S. és Minna, J. D. (2007). sIR: siRNA information resource, egy web-alapú eszköz siRNS szekvenciák tervezéséhez és elemzéséhez, valamint nyílt hozzáférésű siRNS adatbázis. BMC bioinformatika 8, 178. doi:10.1186/1471-2105-8-178
CrossRef teljes szöveg
Ui-Tei, K., Naito, Y., Nishi, K., Juni, A. és Saigo, K. (2008). A termodinamikai stabilitás és a Watoson-Crick bázis párosítás a mag duplexben az srns-alapú off-target hatás hatékonyságának fő meghatározói. Nukleinsavak Res. 36, 7100-7109.
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Ui-Tei, K., Naito, Y., Takahashi, F., Harcuchi, T., Ohki-Hamazaki, H., Juni, A., Ueda, R. és Saigo, K. (2004). Útmutató az emlősök és csirkék RNS-interferenciájának rendkívül hatékony siRNS-szekvenciáinak kiválasztásához. Nukleinsavak Res. 32, 936-948.
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Vert, J.-P., Foveau, N., Lajaunie, C. és Vandenbrouck, Y. (2006). Pontos és értelmezhető modell az siRNS hatékonyság előrejelzéséhez. BMC bioinformatika 7, 520. doi:10.1186/1471-2105-7-520
CrossRef teljes szöveg
Yuan, B., Latek, R., Rossbach, M., Tuschl, T. és Lewitter, F. (2004). siRAN selection server: automatizált siRNS oligonukleotid előrejelző szerver. Nukleinsavak Res. 32, W130-W134.
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Yuan, Y.-R., Pei, Y., Ma, J. B., Kuryavyi, V., Zhandina, M., Meister, G., Chen, H. Y., Dauter, Z., Tuschl, T. és Patel, D. J. (2005). Kristályszerkezete A. aeolicus argonaute, egy helyspecifikus DNS-vezérelt endoribonukleáz, betekintést nyújt a RISC által közvetített mRNS hasításba. Mol. 19-es cella, 405-419.
Pubmed Absztrakt / Pubmed Teljes Szöveg / CrossRef Teljes Szöveg