- Innledning
- Materialer Og Metoder
- Vevspreparat
- Dobbelt Etikett Fluorescens Immunhistokjemi
- Antistoffkarakterisering
- Konfokal Analyse
- Antistoffkontroller
- Resultater
- NGF Immunmerking
- NGF Og Gabaergisk Ko-Lokalisering
- NGF Og Glutamaterg Ko-Lokalisering
- Diskusjon
- Interessekonflikt
- Anerkjennelser
- Supplerende Materiale
Innledning
DEN neurotrophin nerve vekstfaktor (NGF) er involvert i flere kritiske prosesser i utvikling og modne pattedyr nervesystemet, inkludert målet innervasjon, celledifferensiering og neuronal overlevelse (Large et al., 1986; Li et al., 1995; Sofroniew et al., 2001; Lad et al., 2003). I den voksne hjernen SPILLER NGF en nøkkelrolle i vedlikehold og funksjon av det basale forebrain kolinerge systemet (Lad et al., 2003). NIVÅENE AV NGF er høyest i områder som mottar størst antall basale forebrain kolinerge projeksjoner, nemlig hippocampus og cortex (Korsching et al., 1985; Shelton Og Reichardt, 1986), og reseptorer FOR NGF i cortex er i stor grad begrenset til basal forebrain corticopetal projeksjoner (Kordower et al., 1988; Sofroniew et al., 2001; Rossi et al., 2002). Nervevekstfaktorsignal opprettholder kolinerge kortikopetale fremspring under voksen alder (Chen et al., 1997; Debeir et al., 1999) og kan forhindre degenerasjon av disse nevronene etter transeksjon av deres axoner (Hefti, 1986; Tuszynski et al., 1990; Kordower et al., 1994). VIDERE forbedrer NGF frigjøring av acetylkolin fra basale forebrain kulturer (Auld et al., 2001) og kan modulere kolinerg funksjon gjennom fenotypisk kontroll av det kolinerge genet locus (Rylett et al., 1993; Hu et al., 1997).
det basale forebrain kolinerge systemet påvirker læring og erfaringsavhengig plastisitet i cortex (Bakin Og Weinberger, 1996; Kilgard og Merzenich, 1998; Conner et al., 2003, 2005), OG NGF-signalering har blitt hypotesert for å støtte, og muligens forbedre, basal forebrain-mediert læring og plastisitet. For eksempel reduserer blokkering AV NGF-signalering via gjentatte injeksjoner AV NGF-antistoffer i insulær cortex lokal kolinerg innervering og forstyrrer oppkjøpet av to prosesser som avhenger av integriteten til kolinerge innganger, betinget smakaversjon og hemmende unngåelseslæring (Gutierrez et al ., 1997). En fersk studie Av Conner et al. (2009) viste at både romlig læring og hippocampal langsiktig potensiering (LTP) forbedres etter infusjoner AV NGF i septal kjernen, den primære kilden til kolinerg innervering til hippocampus.
Fokal applikasjon AV NGF kan også indusere rask utvidelse av den lokale whiskerrepresentasjonen i tønnebarken hos rotter. Denne prosessen er avhengig av kolinerge projeksjoner fra basal forebrain (Prakash et al., 1996, 2004), noe som tyder på at kortikal NGF-signalering kan stimulere rask kolinergavhengig funksjonell omorganisering. SÅLEDES, I tillegg til sine langsiktige trofiske effekter på basale forebrain kolinerge celler, KAN NGF også delta i kortsiktig kretsmodellering. Denne» dual-action » hypotesen støttes av EKSISTENSEN AV konstitutive og aktivitetsavhengige frigjøringsmekanismer AV NGF (Blochl Og Thoenen, 1995; Lessmann et al., 2003), potensielt underliggende langsiktige trofiske og kortsiktige modulerende effekter AV NGF, henholdsvis. VIDERE har BÅDE retrograde (langsiktige) og lokale (kortsiktige) signalveier blitt observert FOR NGF (Huang Og Reichardt, 2003).
CELLER som uttrykker NGF har blitt påvist i cortex, cerebellum, hippocampus, thalamus, striatum, basal forebrain og hjernestamme (Gall og Isackson, 1989; Maisonpierre et al., 1990; Isackson et al., 1991; Conner og Varon, 1992; Hayashi et al., 1993; Mufson et al., 1994; Zhang et al., 2007). SELV OM NGF mRNA har blitt observert i astrocytter og andre glia, er det store flertallet AV kortikale NGF produsert av nevroner (Sofroniew et al., 2001). De spesifikke typer nevroner som produserer NGF i cortex er imidlertid ikke kjent, og kolinerge kortikopetale fremspring har vist seg å innerverer både eksitatoriske og hemmende nevroner i cortex (Zaborszky et al., 1999). I ekstrakortiske regioner som hippocampus, striatum og basal forebrain, ER NGF-produksjonen hovedsakelig lokalisert Til Gabaergiske hemmende nevroner (Lauterborn et al., 1993, 1995; Pascual et al., 1998; Bizon et al., 1999). Identifisering AV NGF-produserende celler i cortex er viktig for å identifisere potensielle mekanismer som ligger til grunn for modulering av kolinerge kortikale innganger og mekanismer for kortikal plastisitet. I den nåværende studien identifiserer vi en delmengde av kortikale Gabaergiske celler som den primære kilden TIL NGF-produksjon i voksen cortex, med relativt sjelden produksjon av glutamatergiske nevroner.
Materialer Og Metoder
alle forsøkspersoner ble behandlet i henhold til institusjonelle retningslinjer for dyrepleie. På grunn av lave endogene NIVÅER av kortikal NGF-uttrykk som forbød identifisering av spesifikke CELLETYPEKILDER TIL NGF i tidligere studier, utførte vi lokale kolchicin-infusjoner for å hemme mikrotubulepolymerisering, og blokkerte DERMED NGF-transport vekk fra cellekroppen og resulterte i akkumulering AV detekterbart NGF-antigen i soma av produserende celler (Schubert et al ., 1972; Hokfelt et al., 1975; Hanson Og Edströ, 1978; Conner og Varon, 1992). Tidligere rapporter har vist at kolkisinbehandling øker deteksjon AV NGF ved hjelp av immunhistokjemiske teknikker (Conner Og Varon, 1992). Videre kolkisinnivåer lik den som brukes i den aktuelle studien ikke å indusere brutto unormalt i nevronfordeling av nevrotrofin familiemedlem BDNF(Conner et al ., 1997).
Vevspreparat
Åtte voksne fischer 344 rotter (4 hann, 4 hunn; Harlan Sprague Dawley) ble bedøvet med 2 ml / kg av en 25 mg/ml ketamin, 1,3 mg/ml xylazin og 0,25 mg / ml acepromazincocktail, og injisert med 5.0 µ kolkisin (10 µ/µ i aCSF) ved de kortikale stedene listet nedenfor til en rate på 0.5 µ/min ved bruk av en 10 µ Hamilton-sprøyte. Etter infusjon forble nålen på plass i fire minutter for å tillate tilstrekkelig diffusjon til det omkringliggende vevet. Fire dyr fikk bilaterale injeksjoner i den primære motoriske cortexen (M1) ved + 1,2 mm anterior (A / P) og ±2,5 mm lateral (M/L) til bregma. Halvparten av oppløsningen ble injisert ved 1,6 mm under overflaten av hjernen (D / V), og resten ved 1,0
Dobbelt Etikett Fluorescens Immunhistokjemi
Sekvensiell dobbelt etikett immunhistokjemi ble brukt til å visualisere nevroner som uttrykker NGF og Enten Gabaergiske eller glutamaterge cellemarkører. Frittflytende seksjoner ble vasket I Tris Buffered Saline (TBS), permeabilisert med 0.25% Triton X-100, og ikke-spesifikk merking ble deretter blokkert med 5% eselserum. Seksjonene ble inkubert i 72 timer ved 4°C i anti-NGF-antistoff hos kanin (Conner og Varon, 1992) fortynnet 1: 1000 i TBS, 0,25% Triton X-100 og 5% eselserum. Etter primær antistoff inkubasjon ble seksjoner inkubert i esel anti-kanin biotin-konjugert IgG (1:200; Vector Laboratories, Burlingame, CA, USA). Tyramidsignalforsterkning (Tsa; PerkinElmer, Waltham, MA, USA) ble brukt for å forsterke NGF-signalet, hvoretter seksjoner ble vasket I TBS og inkubert I Alexa Fluor 488 eller 594-konjugert streptavidin (Invitrogen, Carlsbad, CA, USA) fortynnet 1:200 for 3 timer ved 4°C. Etter en kort vask ble seksjoner inkubert i både mus anti-glutamat dekarboksylase (GAD) 65 (GAD-6, AntibodyRegistry:AB_528264, 1:2000; Utviklingsstudier Hybridoma Bank,Iowa City, IA, USA) og mus anti-GAD67 (ANITBODYREGISTRY: AB_2278725, 1:1500; Millipore, Temecula, CA, USA), eller i mus anti-GAD67 parvalbumin (antibodyregistry: ab_2174013, 1:30000; MILLIPORE, temecula, Ca, Usa), MUS ANTI-CALBINDIN-d-28k (antibodyregistry: Ab_476894, 1:1500; Sigma-Aldrich, st. LOUIS, MO, USA), eller mus anti-ca2+/calmodulinavhengig Proteinkinase IIA (CAMKIIA, antibodyregistry: ab_2067919, 1:1500; Millipore) i 72 timer ved 4°C. til Slutt ble seksjoner vasket, inkubert I Alexa Fluor 594 eller 488-konjugert esel anti-mus (Invitrogen) i 3 timer ved romtemperatur, vasket igjen, montert på glassglass og dekket i Fluoromount-G (Southern Biotech, Birminghan, AL, USA). FOR å maksimere identifikasjonen Av Gabaergiske celler ble gad65 og GAD67 antistoffer koinkubert. En delmengde av seksjoner ble dekket I ProLong Gold med Dapi (Invitrogen) for visualisering av cellekjerner.
Antistoffkarakterisering
NGF-antistoffet som brukes i denne studien er en affinitetsrenset polyklonal som er oppdratt hos kanin mot RENSET NGF-MUS (Conner Og Varon, 1992). Antistoffet gjenkjenner renset MUS OG rekombinant HUMAN NGF, men kryssreagerer ikke med rekombinant BDNF eller NT – 3 (Conner Og Varon, 1996). Videre samsvarer det immunoreaktive mønsteret AV NGF-uttrykk i rottehjernen tett med det som er oppnådd fra in situ-analyse i rottehjernen (Conner Og Varon, 1997).
det monoklonale antistoffet GAD-65 (Utviklingsstudier Hybridoma Bank, gad-6) ble produsert ved å immunisere mus MED GAD proteinimmunoaffinity-renset fra rottehjernen. Western blot-analyse av rottehjernehomogenater viste at antistoffet selektivt gjenkjenner GAD-65, men IKKE GAD-67 (Chang og Gottlieb, 1988). Ytterligere studier har vist AT GAD – 6-antistoffet gjenkjenner en epitop som ligger mellom aminosyrer 475-571 Av C-terminus AV GAD-65 (Butler et al., 1993).
DEN monoklonale gad-67-musen (Millipore, MAB 5406, lot: 25010139) ble hevet mot aminosyrerester 4-101 av human GAD-67, og gjenkjenner et enkelt 67-kDa-bånd på Western blot-analyse av rottehjernen (produsentens tekniske informasjon). Preinkubering av antistoffet med et gst-gad-67 fusjonsprotein resulterte ikke i noe immunopositivt signal i hjernen (Ito et al., 2007).
musens monoklonale Anti-CaMKIIa (Millipore, MAB 8699, lot: LV1366080) gjenkjenner spesifikt alfa-underenheten av kalsium / kalmodulinavhengig proteinkinase II. Western blot analyse viser at antistoffet identifiserer et enkelt bånd av 50 kDa og gjenkjenner både fosforylerte og ikke-fosforylerte former (Erondu Og Kennedy, 1985).
Monoklonal anti-calbindin-d-28k (Sigma–Aldrich, C9848, lot: 088K4799) er avledet FRA BALB/c-mus immunisert med renset bovin nyre calbindin-d-28k. Immunoblotting viste at antistoffet gjenkjenner et 28-kDa-bånd, og reagerer ikke med lignende molekyler, som calbindin-D-9K, calretinin, myosin light chain, og parvalbumin (produsentens tekniske informasjon). Preabsorpsjon med et calbindin-d-27 kda-protein renset fra kylling-og rotthjerner ble vist å eliminere calbindin immunostholdende i hjernen (Pasteels et al., 1987).
Anti-parvalbumin (Millipore, MAB 1572, lot: LV1378387) ble samlet fra mus immunisert mot parvalbumin renset fra froskemuskel. Det monoklonale antistoffet er rettet mot en epitop ved det første Ca2+ – bindingsstedet, og immunoblotanalysen viser at det gjenkjenner et hjerneprotein på 12 kDa (produsentens tekniske informasjon).
Konfokal Analyse
Bilder ble tatt med En Olympus AX70 Med Magnafire software (versjon 2.0; Karl Storz Imaging, Goleta, CA, USA). 2 mm anterior / posterior til kolkisin injeksjonssteder, antagelig på grunn av mangel på kolkisin diffusjon og den resulterende fravær av somatisk NGF akkumulering, ble bare seksjoner innenfor 1,5 mm av hvert kolkisin injeksjonssted analysert. Hver 10. seksjon (400 µ) ble undersøkt innenfor et kortikalt område. Celler ble manuelt talt, og minst tre seksjoner ble analysert i hver kortikale region og antistoffkombinasjon per individ. Bare tre dyr ble evaluert i den tidlige regionen på grunn av uoppdagelig NGF-merking i fjerde. Enkelt-og dobbeltmerkede celler ble kvantifisert ved bruk av både enkelt – og dobbeltkanalbilder. Flere kriterier ble brukt til å identifisere merkede celler, inkludert størrelse, morfologi, signal vs bakgrunn og sammenfallende dapi-merking ved vurdering AV dapi-farget vev. I en undergruppe av seksjoner ble det samlet inn 5 µ z-stabler ved Hjelp Av En Olympus Fluoview FV1000 for å sikre neuronal lokalisering av det merkede objektet. På grunn av vår interesse for andelen, og ikke det absolutte antallet, av dobbeltmerkede celler, ble ikke stereologiske metoder brukt.
prosentandelen av dobbeltmerkede celler per immunoreaktiv (IR) cellegruppe ble bestemt for hvert bildefelt. Gjennomsnittlig ± standardfeil ble beregnet for hver undersøkte kortikale region. Enveisanalyse av varians (ANOVA) ble brukt til å evaluere forskjeller mellom kortikale regioner. Fishers HSD ble brukt til post-hoc analyse. Alle statistiske analyser ble utført MED SPSS 15.0 For Windows.
Antistoffkontroller
Kontroller inkluderte utelatelse av primære antistoffer, utelatelse av sekundære antistoffer og erstatning av primære antistoff med ikke-spesifikt antistoff (kanin IgG). Alle manipulasjoner hadde de forventede effektene og støttet påstanden om at merkede celler representerer ekte antigenmerking av deres tilsvarende antistoffer.
Resultater
NGF Immunmerking
Distinkt NGF-merking var synlig innenfor en radius på 1.5 mm fra kolkisin kortikale injeksjonssteder. INNENFOR disse områdene var NGF-merking hovedsakelig begrenset til celle somata (Figur 1). Sjelden kan en eller flere cellulære prosesser også skille seg fra. Utenfor denne 1, 5 mm-radiusen var NGF-merking nesten uoppdagelig i cortex. Da kortikal ekspresjon Av NGF-reseptorene TrkA og p75 er begrenset til kolinerge kortikopetale fibre, er den observerte merkingen av NGF usannsynlig å reflektere ENDOCYTOSED NGF, men i stedet er indikativ FOR NGF-produserende celler (Holtzman et al., 1995; Rossi et al., 2002; Stephens et al., 2005). Som rapportert tidligere (Ribak et al., 1978) intensiverte kolkisinbehandling gad-merking i cellekropper samt nevronprosesser. Kolkisin hadde ingen påviselig effekt på merking for parvalbumin, calbindin eller CaMKIIa.
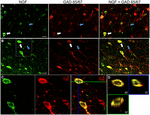
FIGUR 1. Nerve vekstfaktor colocalizes omfattende med hemmende celle markører. Immunoreaktive celler i (a) primær motor cortex og (b) prefrontal cortex. Bilder viser AT NGF-merkede celler (grønn) kolokaliserer mye MED gad 65/67-merkede celler (rød). Hvite piler viser et eksempel på celleimmunoreaktiv for BÅDE NGF og gad 65/67 i hver kortikale region. Blå piler viser celler immunoreaktive for GAD 65/67 bare. (C) Forstørret bilde av området inne hvit boks i (B). (D) X–Y–Z rekonstruksjon av den dobbeltmerkede cellen angitt i (C). Grønne og Blå linjer indikerer disseksjonsnivåer i HENHOLDSVIS XZ og YZ-plan. Målestenger = 25@m.
NGF Og Gabaergisk Ko-Lokalisering
Nervevekstfaktor ko-lokalisert i stor grad med De Gabaergiske cellemarkørene GAD65 og GAD67, uavhengig av det undersøkte kortikale området (Figur 1; Tabell 1). Totalt sett er 91 ± 0,9% AV NGF-merkede kortikale celler også merket FOR GAD65/67. Prosentandelen AV NGF-merkede CELLER som samtidig uttrykker GAD65/67 viste liten forskjell mellom prefrontale (90.0 ± 1.5%), motor (91.7 ± 1.5%), parietal (89.6 ± 3.5%) og tidsmessige (93.4 ± 8.1%) cortices (enveis ANOVA; p = 0.78). OMVENDT er NGF co-lokalisert med bare 55 ± 2.3% AV ALLE GAD65 / 67-merkede celler. For å avgjøre OM NGF-produksjonen var begrenset til en bestemt subtype Av Gabaergisk nevron, merket vi vev FOR NGF og enten parvalbumin eller calbindin (Figur 2). NGF-merkede celler ble observert å kolokalisere med begge markører. NGF-kolokalisering med parvalbumin (67.8 ± 3.6%) var imidlertid over 2× større enn hos calbindin (29.1 ± 3.9%). I tillegg utgjorde NGF-IR-celler mindre enn halvparten av alle parvalbumin (47,7 ± 4,6%) og calbindin (25,7 ± 4,9%) immunoreaktive celler.

FIGUR 2. NGF kolabelert med hemmende nevron subklasse markører. Skiver av motor cortex ble merket FOR NGF og enten parvalbumin eller calbindin. (A) Celler viste omfattende overlapping AV NGF og parvalbumin merking (hvite piler). (B) Omvendt var kolabeling AV NGF og calbindin mindre vanlig. Målestenger = 25@m.

TABELL 1. NGF-OG GAD65/67-immunoreaktive celler etter kortikal region.
Nervevekstfaktor-uttrykkende nevroner ble observert gjennom alle kortikale lag. Tidligere studier har rapportert ujevn fordeling AV NGF-merkede nevroner i kortikale laminae (Pitts og Miller, 2000; Patz og Wahle, 2006). Kvantitativ analyse etter lag ble imidlertid ikke utført i den nåværende studien, da NGF-merkingsintensiteten ble redusert med økende avstand fra kolchicin injeksjonssted.
NGF Og Glutamaterg Ko-Lokalisering
Merking For CaMKIIa ble primært observert innenfor cellesomata og proksimale prosesser (Figur 3). I motsetning til den omfattende ko-lokaliseringen sett MED NGF og Gabaergiske markører, er NGF-merkede celler sjelden ko-lokalisert med CaMKIIa-merkede celler (Figur 3; Tabell 2). Totalt var 4,9 ± 1,1% AV NGF-immunoreaktive celler merket samtidig med camkiia-antistoffer. Ko-lokalisering varierte signifikant med kortikal region (enveis ANOVA; p = 0,03); Fishers post hoc viste at prefrontal cortex hadde en større andel dobbeltmerkede NGF-celler (7,6 ± 2,1%) sammenlignet med primær motorisk cortex (2,4 ± 1,0%; p = 0,02) og parietal cortex (2,9% ± 1,5; p = 0,01).

FIGUR 3. Nerve vekstfaktor colocalizes minimalt med excitatory celle markør CaMKIIa. Immunoreaktive celler i prefrontal cortex. Celler ble sjelden kolabelert FOR NGF (grønn) og CaMKIIa (rød), uavhengig av kortikal region undersøkt. Gullpiler viser et eksempel på en celleimmunoreaktiv for NGF bare. Målestenger = 25@m.

TABELL 2. NGF-Og CaMKIIa-immunoreaktive celler etter kortikal region.
celler immunoreaktive For CaMKIIa sterkt mindretall de merket AV NGF antistoffer. Den totale andelen CaMKIIa-merkede celler som samtidig uttrykte NGF-signal var 2 ± 0,6%. Denne prosentandelen varierte signifikant etter region (enveis ANOVA p = 0,003), med prefrontal cortex som hadde en større andel dobbeltmerkede NGF/CaMKIIa-celler (3,7 ± 1,1%) enn den primære motoriske cortex (0,8% ± 0,3; p = 0,001), parietal cortex (1,4% ± 0,6; p = 0,01) og temporal cortex (1,5 ± 0,6%; p = 0,01).
Diskusjon
den nåværende studien viser at det store flertallet (> 90%) AV NGF-produserende nevroner i cortex er Gabaergiske, mens halvparten av Alle Gabaergiske nevroner kolokaliserer MED NGF. I motsetning til dette viser markører av eksitatoriske nevroner bare sjeldne ko-lokaliseringer med NGF. Disse resultatene var konsistente gjennom flere kortikale regioner analysert i denne studien, noe som indikerer at NGF primært produseres av hemmende interneuroner i rotten neocortex.
SELV OM NGF immunoreaktivitet sjelden sammenfalt med eksitatoriske cellemarkører (CAMKIIa), var en liten prosentandel (~5%) positiv for CaMKIIa i alle undersøkte kortikale regioner. Confocal analyse bekreftet at denne doble merking stammer fra samme fokalplan, og var ikke på grunn av diskret signal som oppstår fra overlappende celler. Den funksjonelle betydningen AV NGF-uttrykk i en så liten brøkdel av eksitatoriske celler i ikke kjent, men det er mulig at DISSE NGF-produserende nevronene representerer en tidligere uidentifisert underklasse av eksitatoriske nevroner i neocortex.
våre resultater er i samsvar med funn fra tidligere studier i andre hjernegrupper som viser AT NGF ko-lokaliserer nesten utelukkende Med Gabaergiske celler i striatum, basal forebrain og hippocampus (Lauterborn et al., 1993, 1995; Pascual et al., 1998; Bizon et al., 1999). DERMED KAN NGF-produksjon Av Gabaergiske celler være en generell egenskap for alle mål som mottar basal forebrain cholinerg innervering(inkludert basal forebrain selv). Disse kolinerge nevronpopulasjonene krever NGF for vedlikehold av deres fenotype og fremspring (Rylett et al., 1993; Chen et al., 1997; Hu et al., 1997; Debeir et al., 1999). På tvers av studier fremstår hemmende interneuroner nå som den primære kilden TIL NGF-trofisme for basale forebrain-kolinerge nevroner.
selv om basale forebrain kolinerge nevroner innerverer både eksitatoriske og hemmende kortikale nettverk (Zaborszky et al., 1999), er kilden til trofisk støtte overveldende fra den hemmende befolkningen, som er kjent for å spille en kritisk rolle i å formidle plastisitet i kortikale kretser (Hensch og Stryker, 2004; Yazaki-Sugiyama et al., 2009; Donato et al., 2013). Kolinerg signalering ser ut til å bidra til differensial aktivering av ulike hemmende subpopulasjoner, og dermed modulere eksitatorisk-hemmende balanse (Xiang et al., 1998; Froemke et al., 2007). NGF kan dermed fungere som et tilbakemeldingssignal mellom svært plasthemmende nettverk og de kolinerge inngangene som aktiverer dem. FAKTISK øker NGF plastisitet og atferdslæring gjennom kolinerge avhengige mekanismer (Prakash et al., 1996, 2004; Gutierrez et al., 1997; Conner et al., 2009). Aktivitetsavhengig frigjøring AV NGF (Blochl og Thoenen, 1995; Lessmann et al., 2003), sammen med NGFS evne til å øke kolinerg aktivitet (Rylett et al., 1993; Hu et al., 1997; Auld et al., 2001), antyder AT NGF kan fremme omorganisering av aktive kretser via forbedret kolinerg funksjon.
Fremtidige studier vil forsøke å identifisere hvilke underklasser av hemmende nevroner som uttrykker NGF og hvordan dette uttrykket nettopp påvirker kortikale kretser. FOR dette formål tok vi foreløpige skritt for å avgjøre OM NGF co-lokalisert med to vanlige markører av hemmende nevroner, parvalbumin (primært assosiert med kurv og lysekrone celler), og calbindin (assosiert med mange hemmende celletyper; McBain Og Fisahn, 2001; Markram et al., 2004). Våre resultater viser at NGF først og fremst ble påvist i parvalbumin-immunoreaktive celler, selv om mange celler merket med parvalbumin ikke co-express NGF. Det er viktig AT NGF-IR-celler også kolokaliseres med calbindin-merkede celler, noe som tyder på at MER enn en underklasse av hemmende nevron produserer NGF.
i sammendraget uttrykkes NEOCORTEX NGF primært av hemmende nevroner, en egenskap som ser ut til å være bevart fra fylogenetisk eldre hjerneområder og som kan generalisere til hjernen som helhet. Våre resultater tyder på kortikale hemmende interneuroner spiller en viktig rolle i vedlikehold av kolinerge projeksjonsneuroner av basal forebrain. Gabaergiske interneuroner kan dermed fremme kortikal omorganisering via regulert NGF-signalering.
Interessekonflikt
forfatterne erklærer at forskningen ble utført i fravær av kommersielle eller økonomiske forhold som kan tolkes som en potensiell interessekonflikt.
Anerkjennelser
Finansiert AV NIH (AG10435), Veterans Administration, Alzheimers Association og Dr. Miriam Og Sheldon G. Adelson Medical Research Foundation.
Supplerende Materiale
Supplerende Materiale for denne artikkelen kan bli funnet online på: http://www.frontiersin.org/journal/10.3389/fncel.2014.00220/abstract
Auld, D. S., Mennicken, F., Og Quirion, R. (2001). Nervevekstfaktor induserer raskt langvarig acetylkolinfrigivelse fra kultiverte basale forebrain-nevroner: differensiering mellom nevromodulatoriske og nevrotrofiske påvirkninger. J. Neurosci. 21, 3375–3382.
Pubmed Abstrakt | Pubmed Fulltekst
Bakin, J. S., Og Weinberger, N. M. (1996). Induksjon av et fysiologisk minne i hjernebarken ved stimulering av kjernen basalis. Proc. Natl. Acad. Sci. Usa 93, 11219-11224. doi: 10.1073 / pnas.93.20.11219
CrossRef Full Tekst
Bizon, J. L., Lauterborn, J. C., Og Gall, C. M. (1999). Subpopulasjoner av striatale interneuroner kan skille seg ut på grunnlag av nevrotrofisk faktoruttrykk. J. Comp. Neurol. 408, 283–298. doi: 10.1002 / (SICI)1096-9861(19990531)408:2<283::HJELP-CNE9 > 3.0.CO;2-2
Pubmed Abstrakt / Pubmed Fulltekst / CrossRef Fulltekst
Blochl, A., Og Thoenen, H. (1995). Karakterisering av nervevekstfaktor (NGF) frigjøring fra hippocampale nevroner: bevis for en konstitutiv og en ukonvensjonell natriumavhengig regulert vei. Eur. J. Neurosci. 7, 1220–1228. doi: 10.1111/j.1460-9568.1995.tb01112.x
Pubmed Abstrakt / Pubmed Fulltekst / CrossRef Fulltekst
Butler, M. H., Solimena, M., Dirkx, R. Jr., Hayday, A., Og De Camilli, P. (1993). Identifikasjon av en dominerende epitop av glutaminsyre-dekarboksylase (gad-65) anerkjent av autoantistoffer i stiff-man syndrom. J. Exp. Med. 178, 2097–2106. doi: 10.1084 / jem.178.6.2097
Pubmed Abstrakt | Pubmed Fulltekst | CrossRef Fulltekst
Chang, Y. C. og Gottlieb, D. I. (1988). Karakterisering av proteiner renset med monoklonale antistoffer mot glutaminsyre dekarboksylase. J. Neurosci. 8, 2123–2130.
Chen, K. S., Nishimura, M. C., Armanini, M. P., Crowley, C., Spencer, S. D., Og Phillips, H. S. (1997). Forstyrrelse av en enkelt allel av nervevekstfaktorgenet resulterer i atrofi av basale forebrain kolinerge nevroner og minneunderskudd. J. Neurosci. 17, 7288–7296.
Pubmed Abstrakt | Pubmed Fulltekst
Conner, J. M., Chiba, A. a., Og Tuszynski, M. H. (2005). Basal forebrain cholinergic system er avgjørende for kortikal plastisitet og funksjonell utvinning etter hjerneskade. Neuron 46, 173-179. doi: 10.1016 / j.neuron.2005.03.003
Pubmed Abstrakt / Pubmed Fulltekst / CrossRef Fulltekst
Conner, J. M.^ A b Culberson , A., Packowski, C., Chiba, A. A., Og Tuszynski, M. H. (2003). Lesjoner Av Det Basale forebrain kolinerge systemet svekker oppgaveoppkjøp og avskaffer kortikal plastisitet forbundet med motorisk ferdighetslæring. Neuron 38, 819-829. doi: 10.1016 / S0896-6273(03)00288-5
Pubmed Abstrakt / Pubmed Fulltekst / CrossRef Fulltekst
J. M., Franks, K. M., Titterness, A. K., Russell, K., Merrill, D. A., Christie,B. R., et al. (2009). NGF er viktig for hippocampal plastisitet og læring. J. Neurosci. 29, 10883–10889. doi: 10.1523 / JNEUROSCI.2594-09.2009
Pubmed Abstrakt / Pubmed Fulltekst / CrossRef Fulltekst
Conner, J. M., Lauterborn, J. C., Yan, Q., Gall, C. M., Og Varon, S. (1997). Fordeling av hjernederivert nevrotrofisk faktor (bdnf) protein og mRNA i normal voksen rotte CNS: bevis for anterograd aksonal transport. J. Neurosci. 17, 2295–2313.
Pubmed Abstrakt | Pubmed Fulltekst
Conner, J. M., Og Varon, S. (1992). Fordeling av nervevekstfaktorlignende immunoreaktive nevroner i den voksne rottehjernen etter kolkisinbehandling. J. Comp. Neurol. 326, 347–362. doi: 10.1002 / cne.903260304
Pubmed Abstrakt / Pubmed Fulltekst / CrossRef Fulltekst
Conner, J. M., Og Varon, S. (1996). Karakterisering av antistoffer mot nervevekstfaktor: analyseavhengig variabilitet i kryssreaktiviteten med andre nevrotrofiner. J. Neurosci. Metoder 65, 93-99. doi: 10.1016/0165-0270(95)00151-4
Pubmed Abstrakt / Pubmed Fulltekst / CrossRef Fulltekst
Conner, J. M., Og Varon, S. (1997). Utviklingsprofil AV NGF immunoreaktivitet i rottehjernen: EN MULIG ROLLE AV NGF i etableringen av kolinerge terminalfelt i hippocampus og cortex. Hjernen Res. Dev. Hjerne Res. 101, 67-79. doi: 10.1016 / S0165-3806(97)00051-5
Pubmed Abstrakt / Pubmed Fulltekst / CrossRef Fulltekst
Debeir, T., Saragovi, H. U., Og Cuello, A. C. (1999). En nervevekstfaktor mimetisk TrkA-antagonist forårsaker seponering av kortikale kolinerge boutoner hos voksne rotter. Proc. Natl. Acad. Sci. Usa 96, 4067-4072. doi: 10.1073 / pnas.96.7.4067
Pubmed Abstrakt / Pubmed Fulltekst / CrossRef Fulltekst
Donato, F., Rompani, S. B., Og Caroni, P. (2013). Parvalbumin-uttrykker kurv-celle nettverk plastisitet indusert av erfaring regulerer voksnes læring. Natur 504, 272-276. doi: 10.1038 / nature12866
Pubmed Abstrakt / Pubmed Fulltekst / CrossRef Fulltekst
Erondu, N. E. Og Kennedy, M. B. (1985). Regional distribusjon av Type II Ca2 + / calmodulin-avhengig proteinkinase i rottehjerne. J. Neurosci. 5, 3270–3277.
Froemke, R. C., Merzenich, M. M., Og Schreiner, C. E. (2007). Et synaptisk minnespor for kortikal mottakelig feltplastisitet. Natur 450, 425-429. doi: 10.1038 / nature06289
Pubmed Abstrakt / Pubmed Fulltekst / CrossRef Fulltekst
Gall, C. M. og Isackson, P. J. (1989). Limbiske anfall øker nevronproduksjonen av messenger RNA for nervevekstfaktor. Vitenskap 245, 758-761. doi: 10.1126 / vitenskap.2549634
Kryssref Full Tekst
Gutierrez, H., Miranda, M. I., Og Bermudez-Rattoni, F. (1997). Læringshemming og kolinerg deafferentasjon etter mangel på kortikal nervevekstfaktor. J. Neurosci. 17, 3796–3803.
Pubmed Abstrakt | Pubmed Fulltekst
Hanson, M., Og Edströ, A. (1978). Mitosehemmere og aksonal transport. Int. Rev. Cytol. Suppl. 373–402.
Hayashi, M., Yamashita, A., Shimizu, K., Sogawa, K., Og Fujii, Y. (1993). Ekspresjon av genet for nervevekstfaktor (NGF) i apens sentrale nervesystem. Hjernereses 618, 142-148. doi: 10.1016/0006-8993 (93)90437-R
Kryssref Full Tekst
Hefti, F. (1986). Nervevekstfaktor fremmer overlevelse av septal kolinerge nevroner etter fimbriale transeksjoner. J. Neurosci. 6, 2155–2162.
Hensch, T. K., Og Stryker, M. P. (2004). Columnar arkitektur skulpturert AV GABA kretser i å utvikle katt visuell cortex. Vitenskap 303, 1678-1681. doi: 10.1126 / vitenskap.1091031
Pubmed Abstrakt / Pubmed Fulltekst / CrossRef Fulltekst
Hokfelt, T., Kellerth, J. O., Nilsson, G., Og Pernow, B. (1975). Eksperimentelle immunhistokjemiske studier på lokalisering Og distribusjon Av substans P i cat primære sensoriske nevroner. Hjerne Res. 100, 235-252. doi: 10.1016/0006-8993(75)90481-3
Pubmed Abstrakt / Pubmed Fulltekst / CrossRef Fulltekst
Holtzman, D. M., Kilbridge, J., Li, Y., Cunningham, E. T. Jr., Lenn, N. J., Clary,D. O., et al. (1995). TrkA-uttrykk i CNS: bevis for eksistensen av flere nye NGF-responsive cns-nevroner. J. Neurosci. 15, 1567–1576.
Pubmed Abstrakt | Pubmed Fulltekst
Hu, L. Cote, S. L. Og Cuello, A. C. (1997). Differensialmodulasjon av den kolinerge fenotypen av kjernen basalis magnocellularis nevroner ved å påføre NGF på cellekroppen eller kortikale terminale felt. Exp. Neurol. 143, 162–171. doi: 10.1006 / exnr.1996.6357
Pubmed Abstrakt / Pubmed Fulltekst / CrossRef Fulltekst
Huang, E. J., Og Reichardt, L. F. (2003). Trk-reseptorer: roller i neuronal signaltransduksjon. Annu. Rev. Biochem. 72, 609–642. doi: 10.1146 / annurev.biochem.72.121801.161629
Fulltekst
Isackson, P. J., Huntsman, M. M., Murray, K. D., Og Gall, C. M. (1991). Bdnf mRNA-ekspresjon er økt hos voksne rotter i forebrain etter limbiske anfall: temporale induksjonsmønstre forskjellig FRA NGF. Neuron 6, 937-948. doi: 10.1016 / 0896-6273 (91)90234-Q
Pubmed Abstrakt / Pubmed Full Tekst / CrossRef Full Tekst
Ito, T., Hioki, H., Nakamura, K., Tanaka, Y., Nakade, H., Kaneko, T., et al. (2007). Gamma-aminosmørsyre-inneholdende sympatiske preganglioniske nevroner i rottebryst ryggmargen sender sine aksoner til overlegen cervikal ganglion. J. Comp. Neurol. 502, 113–125. doi: 10.1002 / cne.21309
Pubmed Abstrakt / Pubmed Fulltekst / CrossRef Fulltekst
Kilgard, M. P., Og Merzenich, M. M. (1998). Cortical kart omorganisering aktivert av nucleus basalis aktivitet. Vitenskap 279, 1714-1718. doi: 10.1126 / vitenskap.279.5357.1714
Pubmed Abstrakt / Pubmed Fulltekst / CrossRef Fulltekst
Kordower, J. H., Bartus, R. T. Bothwell, M., Schatteman, G., Og Gash, D. M. (1988). Nervevekstfaktorreseptorimmunor aktivitet i det ikke-humane primatet (Cebus apella): distribusjon, morfologi og kolokalisering med kolinerge enzymer. J. Comp. Neurol. 277, 465–486. doi: 10.1002 / cne.902770402
Pubmed Abstrakt / Pubmed Fulltekst / CrossRef Fulltekst
Kordower, J. H., Winn, S. R., Liu, Y. T., Mufson, E. J., Sladek, J. R. Jr., Hammang,J. P., Et al. (1994). Den gamle apen basal forebrain: redning og spirende av axotomized basal forebrain nevroner etter grafts av innkapslede celler utskiller menneskelig nerve vekstfaktor. Proc. Natl. Acad. Sci. Usa 91, 10898-10902. doi: 10.1073 / pnas.91.23.10898
Pubmed Abstrakt / Pubmed Fulltekst / CrossRef Fulltekst
Korsching, S., Auburger, G., Heumann, R., Scott, J. ,Og Thoenen, H. (1985). Nivåer av nervevekstfaktor og dens mRNA i rottens sentralnervesystem korrelerer med kolinerg innervering. EMBO j. 4, 1389-1393.
Pubmed Abstrakt | Pubmed Fulltekst
Lad, S. P., Neet, K. E., Og Mufson, E. J. (2003). Nervevekstfaktor: struktur, funksjon og terapeutiske implikasjoner for Alzheimers sykdom. Curr. Narkotika Mål CNS Neurol. Disord. 2, 315–334. doi: 10.2174/1568007033482724
Pubmed Abstrakt / Pubmed Fulltekst / CrossRef Fulltekst
Stor, T. H., Bodary, S. C., Clegg, D. O., Weskamp, G., Otten, U., Og Reichardt, L. F. (1986). Nerve vekstfaktor genuttrykk i utvikling rotte hjernen. Vitenskap 234, 352-355. doi: 10.1126 / vitenskap.3764415
Kryssref Full Tekst
Lauterborn, J. C., Bizon, J. L., Tran, T. M., Og Gall, C. M. (1995). NGF mRNA uttrykkes Av Gabaergiske, men ikke kolinerge nevroner i rottebasal forebrain. J. Comp. Neurol. 360, 454–462. doi: 10.1002 / cne.903600307
Pubmed Abstrakt / Pubmed Fulltekst / CrossRef Fulltekst
Lauterborn, J. C., Tran, T. M., Isackson, P. J., Og Gall, C. M. (1993). Nervevekstfaktor mRNA uttrykkes Av Gabaergiske nevroner i rotthippocampus. Neuroreport 5, 273-276. doi: 10.1097/00001756-199312000-00023
CrossRef Full Text
Lessmann, V., Gottmann, K., Og Malcangio, M. (2003). Neurotrofin sekresjon: nåværende fakta og fremtidsutsikter. Prog. Neurobiol. 69, 341–374. doi: 10.1016 / S0301-0082(03)00019-4
Pubmed Abstrakt / Pubmed Fulltekst / CrossRef Fulltekst
Li, Y., Holtzman, D. M., Kromer, L. F., Kaplan, D. R., Chua-Couzens, J., Clary,D. O., et al. (1995). Regulering Av TrkA og ChAT uttrykk i utvikling rotte basal forebrain: bevis på at både eksogen OG endogen NGF regulerer differensiering av kolinerge nevroner. J. Neurosci. 15, 2888–2905.
Pubmed Abstrakt | Pubmed Fulltekst
A. V., A. V., A. V., A. V., A. v., a. v., a. v., a. v., a. v.,a. v., a. v., a. v., a. v., et al. (1990). NT-3, BDNF og NGF i det utviklende rottenervesystemet: parallelle så vel som gjensidige uttrykksmønstre. Neuron 5, 501-509. doi: 10.1016 / 0896-6273 (90)90089-X
Pubmed Abstrakt / Pubmed Fulltekst / CrossRef Fulltekst
Markram, H., Toledo-Rodriguez, M., Wang, Y., Gupta, A., Silberberg, G. ,Og Wu, C. (2004). Interneuroner av det neokortiske hemmende systemet. Nat. Pastor Neurosci. 5, 793–807. doi: 10.1038 / nrn1519
Pubmed Abstrakt / Pubmed Fulltekst / CrossRef Fulltekst
McBain, C. J., Og Fisahn, A. (2001). Interneurons ubundet. Nat. Pastor Neurosci. 2, 11–23. doi: 10.1038/35049047
Pubmed Abstrakt / Pubmed Fulltekst / CrossRef Fulltekst
Mufson, E. J., Conner, J. M., Varon, S., Og Kordower, J. H. (1994). Nervevekstfaktorlignende immunoreaktive profiler i primatbasal forebrain og hippocampal dannelse. J. Comp. Neurol. 341, 507–519. doi: 10.1002 / cne.903410407
Pubmed Abstrakt / Pubmed Fulltekst / CrossRef Fulltekst
Pascual, M., Rocamora, N., Acsady, L., Freund, Tf, Og Soriano, E. (1998). Ekspresjon av nervevekstfaktor og nevrotrofin-3 mrna i hippocampale interneuroner: morfologisk karakterisering, uttrykksnivåer og kolokalisering av nervevekstfaktor og nevrotrofin-3. J. Comp. Neurol. 395, 73–90. doi: 10.1002 / (SICI)1096-9861(19980525)395:1<73::HJELP-CNE6>3.0.CO; 2-E
Pubmed Abstrakt / Pubmed Fulltekst / CrossRef Fulltekst
Pasteels, B., Miki, N., Hatakenaka, S., Og Pochet, R. (1987). Immunhistokjemisk kryssreaktivitet og elektroforetisk comigrasjon mellom calbindin d-27 kDa og visinin. Hjernereses. 412, 107-113. doi: 10.1016/0006-8993(87)91444-2
Pubmed Abstrakt / Pubmed Fulltekst / CrossRef Fulltekst
Patz, S., Og Wahle, P. (2006). Utviklingsmessige endringer av nevrotrofin mRNA uttrykk i lagene av rotte visuell cortex. Eur. J. Neurosci. 24, 2453–2460. doi: 10.1111/j.1460-9568. 2006. 05126.x
Pubmed Abstrakt / Pubmed Fulltekst / CrossRef Fulltekst
Pitts, A. F. Og Miller, M. W. (2000). Ekspresjon av nervevekstfaktor, hjerneavledet nevrotrofisk faktor og nevrotrofin-3 i den somatosensoriske cortex av den modne rotte: coexpression med høyaffinitets nevrotrofinreseptorer. J. Comp. Neurol. 418, 241–254. doi: 10.1002 / (SICI)1096-9861(20000313)418:3<241::HJELP-CNE1 > 3.0.CO;2-M
Pubmed Abstrakt / Pubmed Fulltekst / CrossRef Fulltekst
Prakash, N., Cohen-Cory, S., Og Frostig, R. D. (1996). RASK og motsatt effekt AV BDNF og NGF på funksjonell organisering av den voksne cortex in vivo. Natur 381, 702-706. doi: 10.1038/381702a0
Pubmed Abstrakt / Pubmed Fulltekst / CrossRef Fulltekst
Prakash, N., Cohen-Cory, S., Penschuck, S., Og Frostig, R. D. (2004). Basal forebrain cholinergic system er involvert i rapid nerve growth factor (NGF)-indusert plastisitet i barrel cortex av voksne rotter. J. Nevrofysiol. 91, 424–437. doi: 10.1152 / jn.00489.2003
Pubmed Abstrakt / Pubmed Fulltekst / CrossRef Fulltekst
Ribak, C. E., Vaughn, J. E. og Saito, K. (1978). Immunocytokjemisk lokalisering av glutaminsyre dekarboksylase i neuronal somata etter kolkisin hemming av aksonal transport. Hjerne Res. 140, 315-332. doi: 10.1016/0006-8993(78)90463-8
Pubmed Abstrakt / Pubmed Fulltekst / CrossRef Fulltekst
Rossi, Fm, Sala, R., Og Maffei, L. (2002). Ekspresjon av nervevekstfaktorreseptorene TrkA og p75NTR i rottens visuelle cortex: utvikling og regulering ved kolinerg inngang. J. Neurosci. 22, 912–919.
Pubmed Abstrakt | Pubmed Fulltekst
Rylett, R. J., Goddard, S., Schmidt, B. M., Og Williams, L. R. (1993). Acetylkolinsyntese og frisetting etter kontinuerlig intracerebral administrasjon AV NGF hos Voksne og eldre fischer-344 rotter. J. Neurosci. 13, 3956–3963.
Pubmed Abstrakt | Pubmed Fulltekst
Schubert, P., Kreutzberg, G. W., Og Lux, H. D. (1972). Neuroplasmisk transport i dendriter: effekt av kolchicin på morfologi og fysiologi av motoneuroner i katten. Hjernereses47, 331-343. doi: 10.1016/0006-8993(72)90643-9
Pubmed Abstrakt / Pubmed Fulltekst / CrossRef Fulltekst
Shelton, D. L., Og Reichardt, L. F. (1986). Studier på ekspresjon av beta nerve vekstfaktor (NGF) genet i sentralnervesystemet: nivå og regional fordeling AV NGF mRNA tyder PÅ AT NGF fungerer som en trofisk faktor for flere forskjellige populasjoner av nevroner. Proc. Natl. Acad. Sci. Usa 83, 2714-2718. doi: 10.1073 / pnas.83.8.2714
Pubmed Abstrakt | Pubmed Fulltekst | CrossRef Fulltekst
Sofroniew, M. V., Howe, C. L. og Mobley, W. C. (2001). Nervevekstfaktorsignalering, nevrobeskyttelse og nevrale reparasjoner. Annu. Pastor Neurosci. 24, 1217–1281. doi: 10.1146 / annurev.nevro.24.1.1217
CrossRef Fulltekst
Stephens, H. E., Belliveau, A. c., Gupta, J. S., Mirkovic, S., Og Kablar, B. (2005). Rollen av nevrotrofiner i vedlikehold av ryggmargens motorneuroner og dorsale rotganglia proprioceptive sensoriske nevroner. Int. J. Dev. Neurosci. 23, 613–620. doi: 10.1016 / j. ijdevneu.2005.07.002
Pubmed Abstrakt | Pubmed Fulltekst | CrossRef Fulltekst
Tuszynski, M. H., Armstrong, D. M. og Gage, F. H. (1990). Basal hjernecelletap etter fimbria / fornix-transeksjon. Hjernen Res. 508, 241–248. doi: 10.1016 / 0006-8993 (90)90402-W
Kryssref Full Tekst
Xiang, Z., Huguenard, J. R., Og Prince, D. A. (1998). Kolinerg veksling i neokortikale hemmende nettverk. Vitenskap 281, 985-988. doi: 10.1126 / vitenskap.281.5379.985
Pubmed Abstrakt / Pubmed Fulltekst / CrossRef Fulltekst
Yazaki-Sugiyama, Y., Kang, S., Cateau, H., Fukai, T. ,Og Hensch, T. K. (2009). Toveis plastisitet i rask spiking GABA kretser av visuell opplevelse. Natur 462, 218-221. doi: 10.1038 / nature08485
Pubmed Abstrakt / Pubmed Fulltekst / CrossRef Fulltekst
Zaborszky, L., Pang, K., Somogyi, J., Nadasdy, Z., Og Kallo, I. (1999). Basal forebrain corticopetal system revisited. Anne. N. Y. Acad. Sci. 877, 339–367. doi: 10.1111/j.1749-6632.1999.tb09276.x
Pubmed Abstrakt / Pubmed Fulltekst / CrossRef Fulltekst
Zhang, H. T., Li, L. Y., Zou, X. L., Song, X. B., Hu, Y. L., Feng,Z. T., Et al. (2007). Immunhistokjemisk fordeling AV NGF, BDNF, nt-3 og NT-4 hos voksne rhesusabehjerner. J. Histochem. Cytochem. 55, 1–19. doi: 10.1369/jhc.6A6952.2006
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text