- Einleitung
- Materialien und Methoden
- Gewebepräparation
- Doppelmarkierte Fluoreszenz-Immunhistochemie
- Antikörpercharakterisierung
- Konfokale Analyse
- Antikörperkontrollen
- Ergebnisse
- NGF-Immunmarkierung
- NGF und gabaerge Co-Lokalisation
- NGF und glutamaterge Kolokalisierung
- Interessenkonflikterklärung
- Danksagungen
- Ergänzungsmaterial
Einleitung
Der Neurotrophin-Nervenwachstumsfaktor (NGF) ist an mehreren kritischen Prozessen im sich entwickelnden und reifen Nervensystem von Säugetieren beteiligt, einschließlich Zielinnervation, Zelldifferenzierung und neuronalem Überleben (Large et al., 1986; Li et al., 1995; Sofroniew et al., 2001; Lad et al., 2003). Im erwachsenen Gehirn spielt NGF eine Schlüsselrolle bei der Aufrechterhaltung und Funktion des cholinergen Systems des basalen Vorderhirns (Lad et al., 2003). Die NGF-Spiegel sind in Bereichen am höchsten, in denen die meisten cholinergen Projektionen des basalen Vorderhirns auftreten, nämlich Hippocampus und Kortex (Korsching et al., 1985; Shelton und Reichardt, 1986), und Rezeptoren für NGF im Kortex sind weitgehend auf basale kortikopetale Projektionen des Vorderhirns beschränkt (Kordower et al., 1988; Sofroniew et al., 2001; Rossi et al., 2002). Die Signalisierung des Nervenwachstumsfaktors hält die cholinergen kortikopetalen Projektionen im Erwachsenenalter aufrecht (Chen et al., 1997; Debeir et al., 1999) und kann die Degeneration dieser Neuronen nach Durchtrennung ihrer Axone verhindern (Hefti, 1986; Tuszynski et al., 1990; Kordower et al., 1994). Darüber hinaus verstärkt NGF die Freisetzung von Acetylcholin aus basalen Vorderhirnkulturen (Auld et al., 2001) und kann die cholinerge Funktion durch phänotypische Kontrolle des cholinergen Genlocus modulieren (Rylett et al., 1993; Hu et al., 1997).
Das cholinerge System des basalen Vorderhirns beeinflusst die lern- und erfahrungsabhängige Plastizität im Cortex (Bakin und Weinberger, 1996; Kilgard und Merzenich, 1998; Conner et al., 2003, 2005), und es wurde die Hypothese aufgestellt, dass die NGF-Signalisierung das basale Lernen und die Plastizität des Vorderhirns unterstützt und möglicherweise verbessert. Zum Beispiel reduziert die Blockade der NGF-Signalisierung durch wiederholte Injektionen von NGF-Antikörpern im Inselkortex die lokale cholinerge Innervation und stört den Erwerb von zwei Prozessen, die von der Integrität der cholinergen Inputs abhängen, konditionierte Geschmacksaversion und inhibitorisches Vermeidungslernen (Gutierrez et al., 1997). Eine aktuelle Studie von Conner et al. (2009) zeigten, dass sowohl das räumliche Lernen als auch die Hippocampus-Langzeitpotenzierung (LTP) nach Infusionen von NGF in den Septumkern, die primäre Quelle der cholinergen Innervation des Hippocampus, verstärkt werden.
Die fokale Anwendung von NGF kann auch eine schnelle Ausdehnung der lokalen Whisker-Repräsentation im Barrel-Cortex von Ratten induzieren. Dieser Prozess ist abhängig von cholinergen Projektionen aus dem basalen Vorderhirn (Prakash et al., 1996, 2004), was darauf hindeutet, dass die kortikale NGF-Signalisierung eine schnelle cholinerge abhängige funktionelle Reorganisation stimulieren kann. Daher kann NGF zusätzlich zu seinen langfristigen trophischen Wirkungen auf cholinerge Zellen des basalen Vorderhirns auch an einer kurzfristigen Umgestaltung des Schaltkreises teilnehmen. Diese „Dual-Action“ -Hypothese wird durch die Existenz konstitutiver und aktivitätsabhängiger Freisetzungsmechanismen von NGF gestützt (Blochl und Thoenen, 1995; Lessmann et al., 2003), die möglicherweise den langfristigen trophischen bzw. kurzfristigen modulatorischen Effekten von NGF zugrunde liegen. Darüber hinaus wurden sowohl retrograde (langfristige) als auch lokale (kurzfristige) Signalwege für NGF beobachtet (Huang und Reichardt, 2003).
NGF exprimierende Zellen wurden im Cortex, Cerebellum, Hippocampus, Thalamus, Striatum, basalen Vorderhirn und Hirnstamm nachgewiesen (Gall und Isackson, 1989; Maisonpierre et al., 1990; Isackson et al., 1991; Conner und Varon, 1992; Hayashi et al., 1993; Mufson et al., 1994; Zhang et al., 2007). Obwohl NGF-mRNA Berichten zufolge in Astrozyten und anderen Glia beobachtet wurde, wird die überwiegende Mehrheit des kortikalen NGF von Neuronen produziert (Sofroniew et al., 2001). Die spezifischen Arten von Neuronen, die NGF im Kortex produzieren, sind jedoch nicht bekannt, und es wurde gezeigt, dass cholinerge kortikopetale Projektionen sowohl exzitatorische als auch inhibitorische Neuronen im Kortex innervieren (Zaborszky et al., 1999). In extrakortikalen Regionen wie Hippocampus, Striatum und basalem Vorderhirn ist die NGF-Produktion überwiegend auf gabaerge inhibitorische Neuronen lokalisiert (Lauterborn et al., 1993, 1995; Pascual et al., 1998; Bizon et al., 1999). Die Identifizierung von NGF-produzierenden Zellen im Kortex ist wichtig, um mögliche Mechanismen zu identifizieren, die der Modulation cholinerger kortikaler Inputs und Mechanismen der kortikalen Plastizität zugrunde liegen. In der aktuellen Studie identifizieren wir eine Untergruppe von kortikalen GABAergen Zellen als primäre Quelle der NGF-Produktion im adulten Kortex, mit relativ seltener Produktion durch glutamaterge Neuronen.
Materialien und Methoden
Alle Probanden wurden gemäß den institutionellen Richtlinien für die Tierpflege behandelt. Aufgrund der geringen endogenen kortikalen NGF-Expression, die in früheren Studien die Identifizierung spezifischer NGF–Quellen vom Zelltyp verbot, führten wir lokale Colchicin-Infusionen durch, um die Mikrotubuli-Polymerisation zu hemmen, wodurch der NGF-Transport vom Zellkörper weg blockiert und eine Akkumulation von nachweisbarem NGF-Antigen im Soma produzierender Zellen (Schubert et al., 1972; Hokfelt et al., 1975; Hanson und Edström, 1978; Conner und Varon, 1992). Frühere Berichte haben gezeigt, dass die Behandlung mit Colchicin den Nachweis von NGF unter Verwendung immunhistochemischer Techniken erhöht (Conner und Varon, 1992). Darüber hinaus induzieren ähnliche Colchicinspiegel wie in der aktuellen Studie keine schwerwiegenden Anomalien in der neuronalen Verteilung des Neurotrophin-Familienmitglieds BDNF (Conner et al., 1997).
Gewebepräparation
Acht erwachsene Fischer 344 Ratten (4 männlich, 4 weiblich; Harlan Sprague Dawley) wurden mit 2 ml/kg eines 25 mg/ ml Ketamins, 1,3 mg / ml Xylazin und 0,25 mg/ml Acepromazin-Cocktails betäubt und mit 5 injiziert.0 µl Colchicin (10 µg / µl in aCSF) an den unten aufgeführten kortikalen Stellen mit einer Geschwindigkeit von 0,5 µl / min unter Verwendung einer 10 µl Hamilton-Spritze. Nach der Infusion blieb die Nadel vier Minuten lang an Ort und Stelle, um eine ausreichende Diffusion in das umgebende Gewebe zu ermöglichen. Vier Tiere erhielten bilaterale Injektionen in den primären motorischen Kortex (M1) bei +1,2 mm anterior (A / P) und ±2,5 mm lateral (M / L) zu Bregma. Die Hälfte der Lösung wurde 1,6 mm unter der Oberfläche des Gehirns (D / V) und der Rest 1,0 mm injiziert. Die verbleibenden vier Tiere erhielten alle einseitige Injektionen in den präfrontalen Kortex (A / P: +3.0, M / L: + 0,5, D / V: -2,3 und -1,8), temporaler Kortex (A / P: -6,5, M / L: + 5,0, D / V: -7,5 und -7,0) und parietaler Kortex (A / P: -3,0, M / L: + 5,0, D / V: -1,8 und -1,3). Nach 48 h wurden die Tiere tief betäubt und mit 250 ml kalter phosphatgepufferter Kochsalzlösung (pH 7,4) transkardial perfundiert, gefolgt von 250 ml kaltem 2% Paraformaldehyd + 0,2% Parabenzochinon in 0,1 M Phosphatpuffer. Gehirne wurden extrahiert, 2 h im gleichen Fixiermittel nachfixiert und in 0,1 M Phosphatpuffer mit 30% Saccharose für mindestens 72 h bei 4 ° C kryoprotektiert. Koronale Schnitte (40 µm) wurden auf einem Gefrierschiebemikrotom geschnitten und in Kryoprotektor (TCS) bei 4 ° C gelagert, bis sie für die Immunhistochemie weiterverarbeitet wurden.
Doppelmarkierte Fluoreszenz-Immunhistochemie
Sequentielle doppelmarkierte Immunhistochemie wurde verwendet, um Neuronen zu visualisieren, die NGF und entweder gabaerge oder glutamaterge Zellmarker exprimieren. Frei schwebende Abschnitte wurden in Tris gepufferter Kochsalzlösung (TBS) gewaschen, mit 0,25% Triton X-100 permeabilisiert und die unspezifische Markierung wurde dann mit 5% Eselsserum blockiert. Die Schnitte wurden 72 h bei 4 ° C in Kaninchen-Anti-NGF-Antikörper (Conner und Varon, 1992) verdünnt 1: 1000 in TBS, 0,25% Triton X-100 und 5% Eselsserum inkubiert. Nach der primären Antikörperinkubation wurden Abschnitte in Esel-Anti-Kaninchen-Biotin-konjugiertem IgG (1:200; Vector Laboratories, Burlingame, CA, USA) inkubiert. Tyramid-Signalverstärkung (TSA; PerkinElmer, Waltham, MA, USA) wurde zur Verstärkung des NGF-Signals angewendet, wonach Abschnitte in TBS gewaschen und in Alexa Fluor 488 oder 594-konjugiertem Streptavidin (Invitrogen, Carlsbad, CA, USA) verdünnt 1: 200 für 3 h bei 4 ° C inkubiert wurden. Nach kurzem Waschen wurden Schnitte sowohl in Maus-Anti-Glutamat-Decarboxylase (GAD) 65 (GAD-6, AntibodyRegistry:AB_528264,1:2000; Developmental Studies Hybridoma Bank, Iowa City, IA, USA) als auch in Maus-Anti-GAD67 (AnitbodyRegistry: AB_2278725, 1:1500; Millipore, Temecula, CA, USA) oder in Maus-Anti-Parvalbumin ( AntibodyRegistry: AB_2174013, 1:30000; Millipore, Temecula, CA, USA), Maus-Anti-Calbindin-D-28K (AntibodyRegistry: AB_476894, 1:1500; Sigma-Aldrich, St. Louis, MO, USA) oder Maus-Anti-Ca2+/Calmodulin-abhängige Proteinkinase IIa (CaMKIIa, AntibodyRegistry: MODELL: AB_2067919, 1:1500; Millipore) für 72 h bei 4°C. Schliesslich wurden Schnitte gewaschen, in Alexa Fluor 594 oder 488-conjugated donkey anti-mouse (Invitrogen) für 3 h bei Raumtemperatur inkubiert, erneut gewaschen, auf Objektträger montiert und in Fluoromount-G (Southern Biotech, Birminghan, AL, USA) überschichtet. Um die Identifizierung von gabaergen Zellen zu maximieren, wurden GAD65- und GAD67-Antikörper co-inkubiert. Eine Teilmenge von Abschnitten wurde mit DAPI (Invitrogen) zur Visualisierung von Zellkernen in Gelbgold eingedeckt.
Antikörpercharakterisierung
Der in dieser Studie verwendete NGF-Antikörper ist ein affinitätsgereinigtes Polyklon, das in Kaninchen gegen gereinigtes Maus-NGF gezüchtet wurde (Conner und Varon, 1992). Der Antikörper erkennt gereinigtes Maus- und rekombinantes humanes NGF, reagiert jedoch nicht mit rekombinantem BDNF oder NT-3 (Conner und Varon, 1996). Darüber hinaus stimmt das immunreaktive Muster der NGF-Expression im Rattenhirn eng mit dem überein, das aus der In-situ-Analyse im Rattenhirn gewonnen wurde (Conner und Varon, 1997).
Der monoklonale Antikörper GAD-65 (Developmental Studies Hybridoma Bank, Gad-6) wurde durch Immunisierung von Mäusen mit aus Rattenhirn immunaffinitätsgereinigtem GAD-Protein hergestellt. Die Western-Blot-Analyse von Rattenhirnhomogenaten ergab, dass der Antikörper selektiv GAD-65, aber nicht GAD-67 erkennt (Chang und Gottlieb, 1988). Zusätzliche Studien haben gezeigt, dass der GAD-6-Antikörper ein Epitop erkennt, das sich zwischen den Aminosäuren 475-571 des C-Terminus von GAD-65 befindet (Butler et al., 1993).
Die GAD-67 Maus monoklonal (Millipore, MAB 5406, lot: 25010139) wurde gegen die Aminosäurereste 4-101 von humanem GAD-67 angehoben und erkennt eine einzelne 67-kDa-Bande bei der Western-Blot-Analyse des Rattenhirns (technische Informationen des Herstellers). Die Präinkubation des Antikörpers mit einem GST-GAD-67-Fusionsprotein führte zu keinem immunopositiven Signal im Gehirn (Ito et al., 2007).
Die Maus-monoklonale Anti-CaMKIIa (Millipore, MAB 8699, lot: LV1366080) erkennt spezifisch die Alpha-Untereinheit der Calcium/Calmodulin-abhängigen Proteinkinase II. Die Western-Blot-Analyse zeigt, dass der Antikörper eine einzelne Bande von 50 kDa identifiziert und sowohl phosphorylierte als auch unphosphorylierte Formen erkennt (Erondu und Kennedy, 1985).
Monoklonales Anti-Calbindin-D-28k (Sigma–Aldrich, C9848, Lot: 088k4799) stammt von BALB / c-Mäusen, die mit gereinigtem Rindernieren-Calbindin-D-28k immunisiert wurden. Immunoblotting zeigte, dass der Antikörper eine 28-kDa-Bande erkennt und nicht mit ähnlichen Molekülen wie Calbindin-D-9K, Calretinin, Myosin Light Chain und parvalbumin (technische Informationen des Herstellers). Es wurde gezeigt, dass die Präabsorption mit einem aus Küken- und Rattengehirnen gereinigten Calbindin-D-27-kDa-Protein die Calbindin-Immunfärbung im Gehirn eliminiert (Pasteels et al., 1987).
Anti-Parvalbumin (Millipore, MAB 1572, Lot: LV1378387) wurde von Mäusen gesammelt, die gegen aus Froschmuskel gereinigtes Parvalbumin immunisiert waren. Der monoklonale Antikörper ist gegen ein Epitop an der ersten Ca2 + -Bindungsstelle gerichtet und die Immunoblot-Analyse zeigt, dass er ein Gehirnprotein von 12 kDa erkennt (technische Informationen des Herstellers).
Konfokale Analyse
Die Bilder wurden mit einer Olympus AX70 mit Magnafire Software (Version 2.0; Karl Storz Imaging, Goleta, CA, USA) aufgenommen. Da die NGF-Markierung etwa 2 mm anterior / posterior der Colchicin-Injektionsstellen erheblich reduziert war, vermutlich aufgrund eines Mangels an Colchicindiffusion und des daraus resultierenden Fehlens einer somatischen NGF-Akkumulation, wurden nur Abschnitte innerhalb von 1,5 mm jeder Colchicin-Injektionsstelle analysiert. Jeder 10. Schnitt (400 µm) wurde innerhalb einer kortikalen Region untersucht. Die Zellen wurden manuell gezählt, und mindestens drei Abschnitte wurden in jeder kortikalen Region und Antikörperkombination pro Subjekt analysiert. Nur drei Tiere wurden in der temporalen Region aufgrund nicht nachweisbarer NGF-Markierung im vierten untersucht. Einzel- und doppelmarkierte Zellen wurden unter Verwendung von Einzel- und Doppelkanalbildern quantifiziert. Mehrere Kriterien wurden verwendet, um markierte Zellen zu identifizieren, einschließlich Größe, Morphologie, Signal vs. Hintergrund und übereinstimmende DAPI-Markierung bei der Beurteilung von DAPI-gefärbtem Gewebe. In einer Teilmenge von Abschnitten wurden 5 µm Z-Stapel mit einem Olympus Fluoview FV1000 gesammelt, um die neuronale Lokalisierung des markierten Objekts sicherzustellen. Aufgrund unseres Interesses am Anteil und nicht an der absoluten Anzahl doppelt markierter Zellen wurden keine stereologischen Methoden verwendet.
Für jedes Bildfeld wurde der prozentuale Anteil an doppelt markierten Zellen pro immunreaktiver (IR) Zellgruppe bestimmt. Der mittlere ± Standardfehler wurde für jede untersuchte kortikale Region berechnet. Eine Einweganalyse der Varianz (ANOVA) wurde verwendet, um Unterschiede zwischen kortikalen Regionen zu bewerten. Fisher’s HSD wurde für die Post-hoc-Analyse verwendet. Alle statistischen Analysen wurden mit SPSS 15.0 für Windows durchgeführt.
Antikörperkontrollen
Kontrollen umfassten das Weglassen von Primärantikörpern, das Weglassen von Sekundärantikörpern und das Ersetzen von Primärantikörpern durch unspezifische Antikörper (Kaninchen-IgG). Alle Manipulationen hatten die erwarteten Auswirkungen und stützten die Behauptung, dass markierte Zellen eine echte Antigenmarkierung durch ihre entsprechenden Antikörper darstellen.
Ergebnisse
NGF-Immunmarkierung
Innerhalb eines Radius von 1 war eine deutliche NGF-Markierung sichtbar.5 mm von den kortikalen Injektionsstellen von Colchicin entfernt. Innerhalb dieser Bereiche war die NGF-Markierung überwiegend auf Zellsomata beschränkt (Abbildung 1). Selten konnten auch ein oder mehrere zelluläre Prozesse unterschieden werden. Außerhalb dieses Radius von 1,5 mm war die NGF-Markierung im Cortex praktisch nicht nachweisbar. Da die kortikale Expression der NGF-Rezeptoren TrkA und p75 auf cholinerge kortikopetale Fasern beschränkt ist, spiegelt die beobachtete Markierung von NGF wahrscheinlich nicht endozytiertes NGF wider, sondern weist auf NGF-produzierende Zellen hin (Holtzman et al., 1995; Rossi et al., 2002; Stephens et al., 2005). Wie bereits berichtet (Ribak et al., 1978) intensivierte die Behandlung mit Colchicin die GAD-Markierung in Zellkörpern sowie neuronale Prozesse. Colchicin hatte keinen nachweisbaren Effekt auf die Markierung von Parvalbumin, Calbindin oder CaMKIIa.
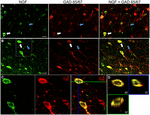
ABBILDUNG 1. Nervenwachstumsfaktor kolokalisiert weitgehend mit inhibitorischen Zellmarkern. Immunreaktive Zellen im (A) primären motorischen Kortex und (B) präfrontalen Kortex. Bilder zeigen, dass NGF-markierte Zellen (grün) weitgehend mit GAD 65/67-markierten Zellen (rot) kolokalisieren. Weiße Pfeile zeigen eine Beispielzelle, die sowohl für NGF als auch für GAD 65/67 in jeder kortikalen Region immunoreaktiv ist. Blaue Pfeile zeigen Zellen, die nur für GAD 65/67 immunreaktiv sind. (C) Vergrößertes Bild des Bereichs innerhalb des weißen Kastens in (B). (D) X–Y–Z-Rekonstruktion der in (C) angegebenen doppelmarkierten Zelle. Grüne und blaue Linien zeigen Dissektionsniveaus in XZ- und YZ-Ebenen an. Maßstabsbalken = 25 µm.
NGF und gabaerge Co-Lokalisation
Nervenwachstumsfaktor co-lokalisiert extensiv mit den gabaergen Zellmarkern GAD65 und GAD67, unabhängig von der untersuchten kortikalen Fläche (Abbildung 1; Tabelle 1). Insgesamt waren 91 ± 0,9% der NGF-markierten kortikalen Zellen auch für GAD65 / 67 markiert. Der Prozentsatz der NGF-markierten Zellen, die GAD65 / 67 koexprimieren, zeigte einen geringen Unterschied zwischen den präfrontalen (90,0 ± 1,5%), motorischen (91,7 ± 1,5%), parietalen (89,6 ± 3,5%) und temporalen (93,4 ± 8,1%) Kortex (EINWEGANOVA; p = 0,78). Umgekehrt ist NGF mit nur 55 ± 2 co-lokalisiert.3% aller GAD65/67-markierten Zellen. Um festzustellen, ob die NGF-Produktion auf einen bestimmten Subtyp des gabaergen Neurons beschränkt war, markierten wir Gewebe für NGF und entweder Parvalbumin oder Calbindin (Abbildung 2). Es wurde beobachtet, dass NGF-markierte Zellen mit beiden Markern kolokalisieren. Die NGF-Kolokalisierung mit Parvalbumin (67,8 ± 3,6%) war jedoch über 2 × größer als mit Calbindin (29,1 ± 3,9%). Darüber hinaus machten NGF-IR-Zellen weniger als die Hälfte aller immunreaktiven Parvalbumin- (47,7 ± 4,6%) und Calbindin- (25,7 ± 4,9%) Zellen aus.

ABBILDUNG 2. NGF colabeled mit inhibitorischen Neuron subclass Marker. Scheiben des motorischen Kortex wurden für NGF und entweder Parvalbumin oder Calbindin markiert. (A) Die Zellen zeigten eine starke Überlappung der NGF- und Parvalbumin-Markierung (weiße Pfeile). (B) Umgekehrt war die gemeinsame Markierung von NGF und Calbindin seltener. Maßstabsbalken = 25 µm.

TABELLE 1. NGF- und GAD65 / 67-immunreaktive Zellen nach kortikaler Region.
Nervenwachstumsfaktor-exprimierende Neuronen wurden in allen kortikalen Schichten beobachtet. Frühere Studien haben eine ungleichmäßige Verteilung von NGF-markierten Neuronen in den kortikalen Lamellen berichtet (Pitts und Miller, 2000; Patz und Wahle, 2006). Eine quantitative Analyse nach Schichten wurde in der aktuellen Studie jedoch nicht durchgeführt, da die NGF-Markierungsintensität mit zunehmendem Abstand von der Colchicin-Injektionsstelle abnahm.
NGF und glutamaterge Kolokalisierung
Die Markierung für CaMKIIa wurde hauptsächlich in Zellsomata und proximalen Prozessen beobachtet (Abbildung 3). Im Gegensatz zu der ausgedehnten Kolokalisierung, die mit NGF- und GABAergen Markern beobachtet wurde, sind NGF-markierte Zellen selten mit CaMKIIa-markierten Zellen kolokalisiert (Abbildung 3; Tabelle 2). Insgesamt wurden 4,9 ± 1,1% der NGF-immunreaktiven Zellen mit CaMKIIa-Antikörpern co-markiert. Die Kolokalisierung unterschied sich signifikant nach kortikaler Region (Einweg-ANOVA; p = 0,03); Fishers Post hoc ergab, dass der präfrontale Kortex einen größeren Anteil an doppelt markierten NGF-Zellen (7,6 ± 2,1%) aufwies als der primäre motorische Kortex (2,4 ± 1,0%; p = 0,02) und der parietale Kortex (2,9% ± 1,5; p = 0,01).

ABBILDUNG 3. Der Nervenwachstumsfaktor kolokalisiert minimal mit dem exzitatorischen Zellmarker CaMKIIa. Immunreaktive Zellen im präfrontalen Kortex. Zellen wurden selten für NGF (grün) und CaMKIIa (rot) kolabeliert, unabhängig von der untersuchten kortikalen Region. Goldpfeile zeigen ein Beispiel einer Zelle, die nur für NGF immunoreaktiv ist. Maßstabsbalken = 25 µm.

TABELLE 2. NGF- und CaMKIIa-immunreaktive Zellen nach kortikaler Region.
Zellen, die für CaMKIIa immunreaktiv sind, waren denen, die mit NGF-Antikörpern markiert wurden, weit überlegen. Der Gesamtanteil der CaMKIIa-markierten Zellen, die gleichzeitig NGF-Signal exprimierten, betrug 2 ± 0,6%. Dieser Prozentsatz unterschied sich signifikant nach Region (Einweg-ANOVA p = 0,003), wobei der präfrontale Kortex einen größeren Anteil an doppelt markierten NGF / CaMKIIa-Zellen (3,7 ± 1,1%) aufwies als der primäre motorische Kortex (0,8% ± 0,3; p = 0,001), der parietale Kortex (1,4% ± 0,6; p = 0,01) und der temporale Kortex (1,5 ± 0,6%; p = 0,01).
Die aktuelle Studie zeigt, dass die überwiegende Mehrheit (> 90%) der NGF-produzierenden Neuronen des Kortex gabaerg sind, während die Hälfte aller GABAergen Neuronen mit NGF kolokalisiert ist. Im Gegensatz dazu weisen Marker exzitatorischer Neuronen nur eine seltene Kolokalisierung mit NGF auf. Diese Ergebnisse waren in mehreren in dieser Studie analysierten kortikalen Regionen konsistent, was darauf hindeutet, dass NGF hauptsächlich von inhibitorischen Interneuronen im Neokortex der Ratte produziert wird.
Obwohl die NGF-Immunreaktivität selten mit exzitatorischen Zellmarkern (CAMKIIa) zusammenfiel, war ein kleiner Prozentsatz (~ 5%) in allen untersuchten kortikalen Regionen positiv für CaMKIIa. Die konfokale Analyse bestätigte, dass diese Doppelmarkierung aus derselben Fokusebene stammte und nicht auf ein diskretes Signal zurückzuführen war, das von überlappenden Zellen ausging. Die funktionelle Bedeutung der NGF-Expression in einer so kleinen Fraktion exzitatorischer Zellen ist nicht bekannt, aber es ist möglich, dass diese NGF-produzierenden Neuronen eine bisher nicht identifizierte Unterklasse exzitatorischer Neuronen im Neokortex darstellen.
Unsere Ergebnisse stimmen mit den Ergebnissen früherer Studien in anderen Hirnregionen überein, die zeigen, dass NGF fast ausschließlich mit gabaergen Zellen im Striatum, im basalen Vorderhirn und im Hippocampus kolokalisiert ist (Lauterborn et al., 1993, 1995; Pascual et al., 1998; Bizon et al., 1999). Daher kann die NGF-Produktion durch GABAerge Zellen eine allgemeine Eigenschaft aller Ziele sein, die eine cholinerge Innervation des basalen Vorderhirns erhalten (einschließlich des basalen Vorderhirns selbst). Diese cholinergen neuronalen Populationen benötigen NGF zur Aufrechterhaltung ihres Phänotyps und ihrer Projektionen (Rylett et al., 1993; In: Chen et al., 1997; Hu et al., 1997; Debeir et al., 1999). Über Studien, inhibitorische Interneurone treten nun als primäre Quelle des NGF-Trophismus für cholinerge Neuronen des basalen Vorderhirns auf.
Obwohl cholinerge Neuronen im basalen Vorderhirn sowohl exzitatorische als auch inhibitorische kortikale Netzwerke innervieren (Zaborszky et al., 1999) stammt die Quelle der trophischen Unterstützung überwiegend aus der inhibitorischen Population, von der bekannt ist, dass sie eine entscheidende Rolle bei der Vermittlung von Plastizität in kortikalen Schaltkreisen spielt (Hensch und Stryker, 2004; Yazaki-Sugiyama et al., 2009; Donato et al., 2013). Die cholinerge Signalübertragung scheint zur differentiellen Aktivierung verschiedener inhibitorischer Subpopulationen beizutragen, wodurch das exzitatorisch-inhibitorische Gleichgewicht moduliert wird (Xiang et al., 1998; Froemke et al., 2007). NGF kann dabei als Rückkopplungssignal zwischen hochplastischen inhibitorischen Netzwerken und den cholinergen Inputs dienen, die diese aktivieren. In der Tat erhöht NGF die Plastizität und das Verhaltenslernen durch cholinerge Mechanismen (Prakash et al., 1996, 2004; Gutierrez et al., 1997; Conner et al., 2009). Aktivitätsabhängige Freisetzung von NGF (Blochl und Thoenen, 1995; Lessmann et al., 2003), gepaart mit der Fähigkeit von NGF, die cholinerge Aktivität zu erhöhen (Rylett et al., 1993; Hu et al., 1997; Auld et al., 2001), legt nahe, dass NGF die Reorganisation aktiver Schaltkreise durch eine verbesserte cholinerge Funktion fördern kann.
Zukünftige Studien werden versuchen zu identifizieren, welche Unterklassen hemmender Neuronen NGF exprimieren und wie diese Expression die kortikale Schaltung genau beeinflusst. Zu diesem Zweck haben wir vorläufige Schritte unternommen, um festzustellen, ob NGF mit zwei gemeinsamen Markern von inhibitorischen Neuronen, Parvalbumin (hauptsächlich assoziiert mit Korb- und Kronleuchterzellen) und Calbindin (assoziiert mit zahlreichen inhibitorischen Zelltypen; McBain und Fisahn, 2001; Markram et al., 2004). Unsere Ergebnisse zeigen, dass NGF hauptsächlich in Parvalbumin-immunreaktiven Zellen nachgewiesen wurde, obwohl viele von Parvalbumin markierte Zellen NGF nicht coexprimierten. Wichtig ist, dass NGF-IR-Zellen auch mit Calbindin-markierten Zellen kolokalisiert sind, was darauf hindeutet, dass mehr als eine Unterklasse von inhibitorischen Neuronen NGF produziert.
Zusammenfassend wird NGF innerhalb des Ratten-Neokortex hauptsächlich durch inhibitorische Neuronen exprimiert, eine Eigenschaft, die aus phylogenetisch älteren Gehirnarealen erhalten zu sein scheint und die sich auf das Gehirn als Ganzes verallgemeinern kann. Unsere Ergebnisse legen nahe, dass kortikale inhibitorische Interneurone eine wichtige Rolle bei der Aufrechterhaltung cholinerger Projektionsneuronen des basalen Vorderhirns spielen. GABAerge Interneurone können somit die kortikale Reorganisation über regulierte NGF-Signalisierung fördern.
Interessenkonflikterklärung
Die Autoren erklären, dass die Forschung in Abwesenheit von kommerziellen oder finanziellen Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
Danksagungen
Finanziert von der NIH (AG10435), der Veterans Administration, der Alzheimer’s Association und der Dr. Miriam und Sheldon G. Adelson Medical Research Foundation.
Ergänzungsmaterial
Das Ergänzungsmaterial zu diesem Artikel finden Sie online unter: http://www.frontiersin.org/journal/10.3389/fncel.2014.00220/abstract
Auld, DS, Mennicken, F. und Quirion, R. (2001). Der Nervenwachstumsfaktor induziert schnell eine verlängerte Acetylcholinfreisetzung aus kultivierten basalen Vorderhirnneuronen: Differenzierung zwischen neuromodulatorischen und neurotrophen Einflüssen. In: J. Neurosci. 21, 3375–3382.
Pubmed Zusammenfassung / Pubmed Volltext
Bakin, J. S. und Weinberger, N. M. (1996). Induktion eines physiologischen Gedächtnisses in der Großhirnrinde durch Stimulation des Nucleus basalis. Prok. Natl. Acad. Sci. USA 93, 11219-11224. doi: 10.1073/pnas.93.20.11219
Querverweis Volltext
Bizon, JL, Lauterborn, JC und Gall, CM (1999). Subpopulationen striataler Interneurone können anhand der Expression neurotropher Faktoren unterschieden werden. In: J. Comp. Neurol. 408, 283–298. doi: 10.1002/(SICI)1096-9861(19990531)408:2<283:: BEIHILFE-CNE9>3.0.CO;2-2
Pubmed Zusammenfassung / Pubmed Volltext / CrossRef Volltext
Blochl, A. und Thoenen, H. (1995). Charakterisierung der Freisetzung des Nervenwachstumsfaktors (NGF) aus Hippocampusneuronen: Hinweise auf einen konstitutiven und unkonventionellen natriumabhängigen regulierten Weg. EUR. In: J. Neurosci. 7, 1220–1228. doi: 10.1111/j.1460-9568.1995.tb01112.x
Pubmed Zusammenfassung / Pubmed Volltext / CrossRef Volltext
Butler, M. H., Solimena, M., Dirkx, R. Jr., Hayday, A. und De Camilli, P. (1993). Identifizierung eines dominanten Epitops der Glutaminsäuredecarboxylase (GAD-65), das von Autoantikörpern beim Stiff-Man-Syndrom erkannt wird. In: J. Exp. Med. 178, 2097–2106. doi: 10.1084/jem.178.6.2097
Pubmed Zusammenfassung / Pubmed Volltext / CrossRef Volltext
Chang, YC und Gottlieb, DI (1988). Charakterisierung der mit monoklonalen Antikörpern gegen Glutaminsäuredecarboxylase gereinigten Proteine. In: J. Neurosci. 8, 2123–2130.
Chen, K. S., Nishimura, M. C., Armanini, M. P., Crowley, C., Spencer, S. D. und Phillips, H. S. (1997). Die Störung eines einzelnen Allels des Nervenwachstumsfaktor-Gens führt zu einer Atrophie der cholinergen Neuronen des basalen Vorderhirns und zu Gedächtnisdefiziten. In: J. Neurosci. 17, 7288–7296.
Pubmed Zusammenfassung / Pubmed Volltext
Conner, J. M., Chiba, A. A. und Tuszynski, M. H. (2005). Das cholinerge System des basalen Vorderhirns ist essentiell für die kortikale Plastizität und funktionelle Erholung nach Hirnverletzungen. Neuron 46, 173-179. doi: 10.1016/j.neuron.2005.03.003
Pubmed Zusammenfassung / Pubmed Volltext / CrossRef Volltext
Conner, J. M., Culberson, A., Packowski, C., Chiba, A. A. und Tuszynski, M. H. (2003). Läsionen des cholinergen Systems des basalen Vorderhirns beeinträchtigen den Aufgabenerwerb und beseitigen die mit dem motorischen Lernen verbundene kortikale Plastizität. Neuron 38, 819-829. ust-IDNR.: 10.1016/S0896-6273(03)00288-5
Pubmed Zusammenfassung / Pubmed Volltext / CrossRef Volltext
Conner, J. M., Franks, K. M., Titterness, A. K., Russell, K., Merrill, DA, Christie, BR,et al. (2009). NGF ist essentiell für die Plastizität und das Lernen des Hippocampus. In: J. Neurosci. 29, 10883–10889. doi: 10.1523/JNEUROSCI.2594-09.2009
Pubmed Zusammenfassung / Pubmed Volltext / CrossRef Volltext
Conner, JM, Lauterborn, JC, Yan, Q., Galle, CM und Varon, S. (1997). Verteilung des vom Gehirn abgeleiteten neurotrophen Faktors (BDNF) -Proteins und der mRNA im normalen adulten Ratten-ZNS: Evidenz für anterograden axonalen Transport. In: J. Neurosci. 17, 2295–2313.
Pubmed Zusammenfassung / Pubmed Volltext
Conner, JM und Varon, S. (1992). Verteilung von Nervenwachstumsfaktor-ähnlichen immunreaktiven Neuronen im adulten Rattenhirn nach Colchicin-Behandlung. In: J. Comp. Neurol. 326, 347–362. doi: 10.1002/cne.903260304
Pubmed Zusammenfassung / Pubmed Volltext / CrossRef Volltext
Conner, JM und Varon, S. (1996). Charakterisierung von Antikörpern gegen den Nervenwachstumsfaktor: Assay-abhängige Variabilität der Kreuzreaktivität mit anderen Neurotrophinen. In: J. Neurosci. Methoden 65, 93-99. doi: 10.1016/0165-0270(95)00151-4
Pubmed Zusammenfassung / Pubmed Volltext / CrossRef Volltext
Conner, JM und Varon, S. (1997). Entwicklungsprofil der NGF-Immunreaktivität im Rattenhirn: eine mögliche Rolle von NGF bei der Etablierung cholinerger terminaler Felder im Hippocampus und Cortex. Brain Res. Dev. Brain Res. 101, 67-79. ust-IDNR.: 10.1016/S0165-3806(97)00051-5
Pubmed Zusammenfassung / Pubmed Volltext / CrossRef Volltext
Debeir, T., Saragovi, H. U. und Cuello, A. C. (1999). Ein Nervenwachstumsfaktor-mimetischer TrkA-Antagonist bewirkt den Entzug von kortikalen cholinergen Boutons in der erwachsenen Ratte. Prok. Natl. Acad. Sci. USA 96, 4067-4072. doi: 10.1073/pnas.96.7.4067
Pubmed Zusammenfassung / Pubmed Volltext / CrossRef Volltext
Donato, F., Rompani, S. B. und Caroni, P. (2013). Die durch Erfahrung induzierte Parvalbumin-exprimierende Basket-Cell-Netzwerkplastizität reguliert die Erwachsenenbildung. Natur 504, 272-276. doi: 10.1038/nature12866
Pubmed Zusammenfassung / Pubmed Volltext / CrossRef Volltext
Erondu, N. E. und Kennedy, MB (1985). Regionale Verteilung der Typ II Ca2 + / Calmodulin-abhängigen Proteinkinase im Rattenhirn. In: J. Neurosci. 5, 3270–3277.
Froemke, R. C., Merzenich, M. M., und Schreiner, C. E. (2007). Eine synaptische Gedächtnisspur für kortikale rezeptive Feldplastizität. Natur 450, 425-429. doi: 10.1038/nature06289
Pubmed Zusammenfassung / Pubmed Volltext / CrossRef Volltext
Gall, CM und Isackson, PJ (1989). Limbische Anfälle erhöhen die neuronale Produktion von Boten-RNA für den Nervenwachstumsfaktor. Wissenschaft 245, 758-761. doi: 10.1126/Wissenschaft.2549634
Querverweis Volltext
Gutierrez, H., Miranda, M. I. und Bermudez-Rattoni, F. (1997). Lernbehinderung und cholinerge Deafferenzierung nach Deprivation des kortikalen Nervenwachstumsfaktors. In: J. Neurosci. 17, 3796–3803.
Pubmed Zusammenfassung / Pubmed Volltext
Hanson, M. und Edström, A. (1978). Mitosehemmer und axonaler Transport. Int. In: Rev. Cytol. Suppl. 373–402.
Hayashi, M., Yamashita, A., Shimizu, K., Sogawa, K. und Fujii, Y. (1993). Expression des Gens für den Nervenwachstumsfaktor (NGF) im zentralen Nervensystem des Affen. Brain Res. 618, 142-148. doi: 10.1016/0006-8993(93)90437-R
Querverweis Volltext
Hefti, F. (1986). Nervenwachstumsfaktor fördert das Überleben von septalen cholinergen Neuronen nach fimbrialen Transektionen. In: J. Neurosci. 6, 2155–2162.
Hensch, T. K. und Stryker, M. P. (2004). Säulenarchitektur, die von GABA-Schaltkreisen bei der Entwicklung des visuellen Kortex der Katze geformt wurde. Wissenschaft 303, 1678-1681. doi: 10.1126/Wissenschaft.1091031
Pubmed Zusammenfassung / Pubmed Volltext / CrossRef Volltext
Hokfelt, T., Kellerth, J. O., Nilsson, G. und Pernow, B. (1975). Experimentelle immunhistochemische Untersuchungen zur Lokalisation und Verteilung der Substanz P in primären sensorischen Neuronen der Katze. Brain Res. 100, 235-252. doi: 10.1016/0006-8993(75)90481-3
Pubmed Zusammenfassung / Pubmed Volltext / CrossRef Volltext
In diesem Zusammenhang wird auch auf die Verwendung von Cookies hingewiesen. (1995). TrkA-Expression im ZNS: Beweise für die Existenz mehrerer neuartiger NGF-responsiver ZNS-Neuronen. In: J. Neurosci. 15, 1567–1576.
Pubmed Zusammenfassung / Pubmed Volltext
Hu, L., Cote, SL und Cuello, AC (1997). Differentielle Modulation des cholinergen Phänotyps der Nucleus basalis magnocellularis Neuronen durch Anwendung von NGF am Zellkörper oder kortikalen terminalen Feldern. Verwendbar bis. Neurol. 143, 162–171. doi: 10.1006/Exkl.1996.6357
Pubmed Zusammenfassung / Pubmed Volltext / CrossRef Volltext
Huang, EJ und Reichardt, LF (2003). Trk-Rezeptoren: Rolle bei der neuronalen Signaltransduktion. Jahr. Rev. Biochem. 72, 609–642. doi: 10.1146/Jahrbuch.biochem.72.121801.161629
Querverweis Volltext
Isackson, PJ, Huntsman, MM, Murray, KD und Gall, CM (1991). Die BDNF-mRNA-Expression ist im adulten Rattenvorhirn nach limbischen Anfällen erhöht: zeitliche Induktionsmuster, die sich von NGF unterscheiden. Neuron 6, 937-948. doi: 10.1016/0896-6273(91)90234-Q
Pubmed Zusammenfassung / Pubmed Volltext / CrossRef Volltext
Ito, T., Hioki, H., Nakamura, K., Tanaka, Y., Nakade, H., Kaneko, T.,et al. (2007). Gamma-Aminobuttersäure-haltige sympathische präganglionäre Neuronen im thorakalen Rückenmark der Ratte senden ihre Axone zum oberen zervikalen Ganglion. In: J. Comp. Neurol. 502, 113–125. doi: 10.1002/cne.21309
Pubmed Zusammenfassung / Pubmed Volltext / CrossRef Volltext
Kilgard, M. P. und Merzenich, M. M. (1998). Reorganisation der kortikalen Karte durch Nucleus Basalis-Aktivität. Wissenschaft 279, 1714-1718. doi: 10.1126/Wissenschaft.279.5357.1714
Pubmed Zusammenfassung / Pubmed Volltext / CrossRef Volltext
Cordower, J. H., Bartus, R. T., Bothwell, M., Schatteman, G. und Gash, DM (1988). Nervenwachstumsfaktor-Rezeptor-Immunaktivität im nichtmenschlichen Primaten (Cebus apella): Verteilung, Morphologie und Kolokalisierung mit cholinergen Enzymen. In: J. Comp. Neurol. 277, 465–486. doi: 10.1002/cne.902770402
Pubmed Zusammenfassung / Pubmed Volltext / CrossRef Volltext
Kordower, J. H., Winn, S. R., Liu, Y. T., Mufson, E. J., Sladek, J. R. Jr., Hammang, J. P.,et al. (1994). Das basale Vorderhirn des alten Affen: rettung und Keimung von axotomierten basalen Vorderhirnneuronen nach Transplantaten eingekapselter Zellen, die den menschlichen Nervenwachstumsfaktor sezernieren. Prok. Natl. Acad. Sci. USA 91, 10898-10902. doi: 10.1073/pnas.91.23.10898
Pubmed Zusammenfassung / Pubmed Volltext / CrossRef Volltext
Korsching, S., Auburger, G., Heumann, R., Scott, J. und Thoenen, H. (1985). Die Spiegel des Nervenwachstumsfaktors und seiner mRNA im Zentralnervensystem der Ratte korrelieren mit der cholinergen Innervation. EMBO J. 4, 1389-1393.
Pubmed Zusammenfassung / Pubmed Volltext
Lad, S. P., Neet, K. E. und Mufson, E. J. (2003). Nervenwachstumsfaktor: Struktur, Funktion und therapeutische Implikationen für die Alzheimer-Krankheit. Curr. Medikament zielt auf ZNS Neurol. Unordnung. 2, 315–334. doi: 10.2174/1568007033482724
Pubmed Zusammenfassung / Pubmed Volltext / CrossRef Volltext
Groß, T. H., Bodary, S. C., Clegg, D. O., Weskamp, G., Otten, U., und Reichardt, L. F. (1986). Genexpression des Nervenwachstumsfaktors im sich entwickelnden Rattenhirn. Wissenschaft 234, 352-355. doi: 10.1126/wissenschaft.3764415
Querverweis Volltext
Lauterborn, JC, Bizon, JL, Tran, TM und Gall, CM (1995). NGF-mRNA wird von gabaergen, aber nicht cholinergen Neuronen im basalen Vorderhirn der Ratte exprimiert. In: J. Comp. Neurol. 360, 454–462. doi: 10.1002/cne.903600307
Pubmed Zusammenfassung / Pubmed Volltext / CrossRef Volltext
Lauterborn, JC, Tran, TM, Isackson, PJ und Gall, CM (1993). Nervenwachstumsfaktor-mRNA wird von gabaergen Neuronen im Hippocampus der Ratte exprimiert. Neuroreport 5, 273-276. doi: 10.1097/00001756-199312000-00023
CrossRef Volltext
Lessmann, V., Gottmann, K. und Malcangio, M. (2003). Neurotrophinsekretion: aktuelle Fakten und Zukunftsaussichten. Progrock. Neurobiol. 69, 341–374. modell: 10.1016/S0301-0082(03)00019-4
Pubmed Zusammenfassung / Pubmed Volltext / CrossRef Volltext
Es sind keine frei zugänglichen ergänzenden Materialien verfügbar Zitation Li, Y., Holtzman, D. M., Kromer, L. F., Kaplan, D. R., Chua-Couzens, J., Clary, D. O.,et al. (1995). Regulation der TrkA- und ChAT-Expression im sich entwickelnden basalen Vorderhirn der Ratte: hinweise darauf, dass sowohl exogener als auch endogener NGF die Differenzierung cholinerger Neuronen regulieren. In: J. Neurosci. 15, 2888–2905.
Pubmed Zusammenfassung / Pubmed Volltext
Es sind keine frei zugänglichen ergänzenden Materialien verfügbar Zitation Maisonpierre, P. C., Friedman, B., Wiegand, S. J., Furth, M. E.,et al. (1990). NT-3, BDNF und NGF im sich entwickelnden Rattennervensystem: parallele sowie reziproke Expressionsmuster. Neuron 5, 501-509. doi: 10.1016/0896-6273(90)90089-X
Pubmed Zusammenfassung / Pubmed Volltext / CrossRef Volltext
Markrams, H., Toledo-Rodriguez, M., Wang, Y., Gupta, A., Silberberg, G. und Wu, C. (2004). Interneurone des neokortikalen Hemmsystems. Nat. Rev. Neurosci. 5, 793–807. doi: 10.1038/nrn1519
Pubmed Zusammenfassung / Pubmed Volltext / CrossRef Volltext
McBain, CJ, und Fisahn, A. (2001). Interneuronen ungebunden. Nat. Rev. Neurosci. 2, 11–23. doi: 10.1038/35049047
Pubmed Zusammenfassung / Pubmed Volltext / CrossRef Volltext
Mufson, EJ, Conner, JM, Varon, S. und Kordower, JH (1994). Nervenwachstumsfaktor-ähnliche immunreaktive Profile im basalen Vorderhirn und in der Hippocampusbildung von Primaten. In: J. Comp. Neurol. 341, 507–519. doi: 10.1002/cne.903410407
Pubmed Zusammenfassung / Pubmed Volltext / CrossRef Volltext
Pascual, M., Rocamora, N., Acsady, L., Freund, T. F. und Soriano, E. (1998). Expression von Nervenwachstumsfaktor- und Neurotrophin-3-mRNAs in Hippocampus-Interneuronen: morphologische Charakterisierung, Expressionsniveaus und Kolokalisierung von Nervenwachstumsfaktor und Neurotrophin-3. In: J. Comp. Neurol. 395, 73–90. doi: 10.1002/(SICI)1096-9861(19980525)395:1<73:: BEIHILFE-CNE6>3.0.CO ;2-E
Pubmed Zusammenfassung / Pubmed Volltext / CrossRef Volltext
Pasteels, B., Miki, N., Hatakenaka, S. und Pochet, R. (1987). Immunhistochemische Kreuzreaktivität und elektrophoretische Wanderung zwischen Calbindin D-27 kDa und Visinin. Brain Res. 412, 107-113. doi: 10.1016/0006-8993(87)91444-2
Pubmed Zusammenfassung / Pubmed Volltext / CrossRef Volltext
Patz, S. und Wahle, P. (2006). Entwicklungsänderungen der Neurotrophin-mRNA-Expression in den Schichten des visuellen Kortex der Ratte. EUR. In: J. Neurosci. 24, 2453–2460. doi: 10.1111/j.1460-9568.2006.05126.x
Pubmed Zusammenfassung / Pubmed Volltext / CrossRef Volltext
Pitts, A. F. und Miller, M. W. (2000). Expression des Nervenwachstumsfaktors, des vom Gehirn abgeleiteten neurotrophen Faktors und des Neurotrophin-3 im somatosensorischen Kortex der reifen Ratte: Koexpression mit hochaffinen Neurotrophinrezeptoren. In: J. Comp. Neurol. 418, 241–254. doi: 10.1002/(SICI)1096-9861(20000313)418:3<241:: BEIHILFE-CNE1>3.0.CO;2-M
Pubmed Zusammenfassung / Pubmed Volltext / CrossRef Volltext
Prakash, N., Cohen-Cory, S. und Frostig, RD (1996). SCHNELLE und entgegengesetzte Wirkungen von BDNF und NGF auf die funktionelle Organisation des adulten Kortex in vivo. Natur 381, 702-706. doi: 10.1038/381702a0
Pubmed Zusammenfassung / Pubmed Volltext / CrossRef Volltext
Prakash, N., Cohen-Cory, S., Penschuck, S. und Frostig, RD (2004). Das cholinerge System des basalen Vorderhirns ist an der durch den schnellen Nervenwachstumsfaktor (NGF) induzierten Plastizität in der Großhirnrinde adulter Ratten beteiligt. In: J. Neurophysiol. 91, 424–437. doi: 10.1152/jn.00489.2003
Pubmed Zusammenfassung / Pubmed Volltext / CrossRef Volltext
Ribak, CE, Vaughn, JE und Saito, K. (1978). Immunzytochemische Lokalisierung von Glutaminsäuredecarboxylase in neuronalen Somata nach Colchicinhemmung des axonalen Transports. Gehirn Res. 140, 315-332. doi: 10.1016/0006-8993(78)90463-8
Pubmed Zusammenfassung / Pubmed Volltext / CrossRef Volltext
Rossi, FM, Sala, R. und Maffei, L. (2002). Expression der Nervenwachstumsfaktorrezeptoren TrkA und p75NTR im visuellen Kortex der Ratte: Entwicklung und Regulation durch den cholinergen Input. In: J. Neurosci. 22, 912–919.
Pubmed Zusammenfassung / Pubmed Volltext
Rylett, RJ, Goddard, S., Schmidt, BM und Williams, LR (1993). Acetylcholinsynthese und -freisetzung nach kontinuierlicher intrazerebraler Verabreichung von NGF bei erwachsenen und gealterten Fischer-344-Ratten. In: J. Neurosci. 13, 3956–3963.
Pubmed Zusammenfassung / Pubmed Volltext
Schubert, P., Kreutzberg, G. W. und Lux, H. D. (1972). Neuroplasmatischer Transport in Dendriten: Wirkung von Colchicin auf die Morphologie und Physiologie von Motoneuronen bei der Katze. Brain Res. 47, 331-343. doi: 10.1016/0006-8993(72)90643-9
Pubmed Zusammenfassung / Pubmed Volltext / CrossRef Volltext
Shelton, D. L., und Reichardt, L. F. (1986). Studien zur Expression des Beta-Nervenwachstumsfaktor (NGF) -Gens im Zentralnervensystem: Niveau und regionale Verteilung von NGF-mRNA legen nahe, dass NGF als trophischer Faktor für mehrere verschiedene Populationen von Neuronen fungiert. Prok. Natl. Acad. Sci. U.S.A. 83, 2714-2718. doi: 10.1073/pnas.83.8.2714
Pubmed Zusammenfassung / Pubmed Volltext / CrossRef Volltext
Sofroniew, M. V., Howe, C. L. und Mobley, W. C. (2001). Nervenwachstumsfaktor-Signalisierung, Neuroprotektion und neuronale Reparatur. Jahr. Rev. Neurosci. 24, 1217–1281. doi: 10.1146/Jahrbuch.neuro.24.1.1217
Querverweis Volltext
Stephens, H. E., Belliveau, A. C., Gupta, J. S., Mirkovic, S. und Kablar, B. (2005). Die Rolle von Neurotrophinen bei der Aufrechterhaltung der Motoneuronen des Rückenmarks und der propriozeptiven sensorischen Neuronen der Dorsalwurzelganglien. Int. J. Dev. Neurowissenschaften. 23, 613–620. doi: 10.1016/j.ijdevneu.2005.07.002
Pubmed Zusammenfassung / Pubmed Volltext / CrossRef Volltext
Tuszynski, M. H., Armstrong, D. M. und Gage, F. H. (1990). Basaler Vorderhirnzellverlust nach Fimbrien / Fornix-Transsektion. Brain Res. 508, 241–248. doi: 10.1016/0006-8993(90)90402-W
Querverweis Volltext
Xiang, Z., Huguenard, JR und Prince, DA (1998). Cholinerge Umschaltung innerhalb neokortikaler inhibitorischer Netzwerke. Wissenschaft 281, 985-988. doi: 10.1126/Wissenschaft.281.5379.985
Pubmed Zusammenfassung / Pubmed Volltext / CrossRef Volltext
Yazaki-Sugiyama, Y., Kang, S., Cateau, H., Fukai, T. und Hensch, T. K. (2009). Bidirektionale Plastizität in GABA-Schaltkreisen mit schnellem Spiking durch visuelle Erfahrung. Natur 462, 218-221. doi: 10.1038/nature08485
Pubmed Zusammenfassung / Pubmed Volltext / CrossRef Volltext
Zaborszky, L., Pang, K., Somogyi, J., Nadasdy, Z. und Kallo, I. (1999). Das basale Vorderhirn corticopetal System revisited. Ann. In: N. Y. Acad. Sci. 877, 339–367. doi: 10.1111/j.1749-6632.1999.tb09276.x
Pubmed Zusammenfassung / Pubmed Volltext / CrossRef Volltext
Zhang, H. T., Li, L. Y., Zou, X. L., Lied, X. B., Hu, Y. L., Feng, Z. T.,et al. (2007). Immunhistochemische Verteilung von NGF, BDNF, NT-3 und NT-4 in adulten Rhesusaffengehirnen. J. Histochem. Cytochem. 55, 1–19. doi: 10.1369/jhc.6A6952.2006
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text