In diesem Lernprogramm werden grundlegende Aspekte der Massenspektrometrie erläutert, die Ihnen bei der Entscheidung über die richtigen Techniken und Messungen für Ihre Forschungsproben hilfreich sind.
- Was ist Massenspektrometrie?
- Das Massenspektrometer
- Ionisationsmethoden
- Elektronenstoß-Ionisation
- Chemische Ionisation
- Matrixunterstützte Laserdesorption
- Chemische Ionisation des Atmosphärendrucks
- Elektrospray-Ionisation
- Analyse von Ionen
- Tandem-Massenspektrometrie
- Trennverfahren zur Kopplung mit Massenspektrometrie
Was ist Massenspektrometrie?
Die Massenspektrometrie ist eine Analysetechnik, bei der ionisierte Moleküle in der Gasphase untersucht werden, um eines oder mehrere der folgenden Ziele zu erreichen:
- Molekulargewichtsbestimmung
- Strukturcharakterisierung
- Gasphasenreaktivitätsstudie
- Qualitative und quantitative Analyse von Komponenten in einem Gemisch.
Die Massenspektrometrie besteht im Wesentlichen aus dem Wiegen von Ionen in der Gasphase. Das verwendete Instrument könnte als ausgeklügelte Waage betrachtet werden, die mit hoher Präzision die Massen einzelner Atome und Moleküle bestimmt. Abhängig von den chemischen und physikalischen Eigenschaften der Proben können verschiedene Ionisationstechniken verwendet werden. Einer der Hauptfaktoren bei der Auswahl der zu verwendenden Ionisationstechnik ist die Thermolabilität. Für Proben, die nicht thermolabil und relativ flüchtig sind, kann Ionisation wie Elektroneneinschlag und / oder chemische Ionisation effektiv verwendet werden. Für Proben, die thermolabil sind, wie Peptide, Proteine und andere Proben von biologischem Interesse, sind weiche Ionisationstechniken in Betracht zu ziehen. Zu den am häufigsten verwendeten weichen Ionisationstechniken gehören Elektrospray (ESI) und Matrix Assisted Laser Desorption (MALDI). Der Name, der einer bestimmten massenspektrometrischen Technik gegeben wird, zeigt normalerweise auf die verwendete Ionisationsmethode.
Atom- und Molekülmassen werden relativ zur Masse des Kohlenstoffisotops 12C zugeordnet, dessen Atomgewicht als genau 12 definiert ist. Die tatsächliche Masse von 12C beträgt 12 Dalton, wobei ein Dalton gleich 1 ist.661 10-24 g. Die Masse eines Moleküls oder eines Ions kann in Dalton (Da) oder Kilodalton (kDa) angegeben werden.
Das Massenspektrometer
Die Massenspektrometrie verwendet ein Instrument, das als Massenspektrometer bezeichnet wird. Die Hauptkomponenten eines Massenspektrometers sind:
- Einlasssystem (LC, GC, direkte Sonde etc…)
- Ionen quelle (EI, CI, ESI, APCI, MALDI, etc…)
- Massenanalysator (Quadrupol, TOF, Ionenfalle, magnetischer Sektor)
- Detektor (Elektronenvervielfacher, Mikrokanal, MCPs)
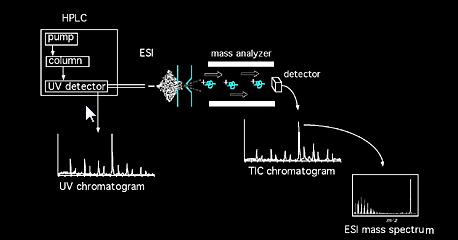
Proben können dem Massenspektrometer direkt über Feststoffsonde oder bei Gemischen über Chromatographiegeräte (z.B. Gaschromatographie, Flüssigkeitschromatographie, Kapillarelektrophorese, etc.) zugeführt werden…). In der Quelle werden die Probenmoleküle ionisiert. In der Quelle gebildete Ionen (Molekül- und Fragmentionen) gewinnen etwas kinetische Energie und verlassen die Quelle. Ein kalibrierter Analysator analysiert dann die passierenden Ionen als Funktion ihrer Masse-Ladungs-Verhältnisse. Verschiedene Arten von Analysatoren können verwendet werden, magnetisch, vierpolig, Ionenfalle, Fourier-Transformation, Flugzeit usw…Der aus der Analysatoranordnung austretende Ionenstrahl wird dann detektiert und das Signal registriert. Gemeinsame Ionisationsmethode Akronyme umfassen:
- EI = Elektronen Auswirkungen;
- CI = Chemische Ionisation;
- SIMS = Sekundäre Ionen Masse Spec;
- FAB = Schnelle Atom Beschuss;
- LDMS = Laser Desorption Masse Spec;
- PDMS = Plasma Desorption Masse Spec;
- TS=Thermospray;
- AS=Aerospray;
- ESMS=Elektrospray Masse Spez.
Gemeinsame masse analyzer akronyme umfassen:
- EB=Elektrostatisch-magnetisch;
- IT=Ionenfalle;
- Q=Quadrupol;
- TOF=Flugzeit.
Ionisationsmethoden
Die Auswahl der richtigen Ionisationsmethode für die Analyse Ihrer Probe ist äußerst wichtig. Obwohl wir Vorschläge machen können, liegt es in Ihrer Verantwortung, die für Ihre Forschungsergebnisse geeignete (n) Methode (n) zu verstehen und auszuwählen.
- Electron Impact EI Ionisation
- Chemische Ionisation CI
- Negative Ionen Chemische Ionisation
- Elektrospray Ionisation Techniken
- Matrix Unterstützt Lazer Desorption (nicht angeboten in unsere anlage, aber verfügbar elswhere auf campus)
- Atmosphärendruck Chemische Ionisation APCI
Elektron Auswirkungen Ionisation
M + e-(70eV) —– > M +. + 2e-
EI ionisation methode ist geeignet für nicht thermolabile verbindungen. Die Flüchtigkeit der Probe ist erforderlich. Probenmoleküle im Dampfzustand werden von sich schnell bewegenden Elektronen bombardiert, üblicherweise 70 eV Energie. Dies führt zur Ionenbildung. Ein Elektron aus der höchsten Orbitalenergie wird verdrängt, und infolgedessen werden Molekülionen gebildet. Einige dieser Molekülionen zersetzen sich und Fragmentionen werden gebildet. Die Fragmentierung eines gegebenen Ions ist auf den Energieüberschuss zurückzuführen, den es innerhalb der Ionisation benötigt. Fragmentionen können ungerade Elektronen oder sogar Elektronen sein. Bei der Elektronenstoßionisation gebildete Molekülionen sind ungerade Elektronenionen. Ungerade Elektronenfragmentionen entstehen durch direkte Spaltung (z.B. direkte Spaltung einer C-C-Bindung). Auch Elektronenfragmentionen werden oft durch Umlagerung (z.B. Protonentransfer) gebildet. Die Probe kann der EI-Quelle über eine Gaschromatographievorrichtung, beispielsweise bei Gemischen, oder direkt über eine Feststoffsondenvorrichtung zugeführt werden. Die für ein Experiment benötigten Mengen betragen normalerweise weniger als ein Mikrogramm Material.
EI-Massenspektren enthalten in den meisten Fällen intensive Fragmentionenpeaks und viel weniger intensive Molekülionenpeaks. Wenn der molekulare Ionenpeak im Massenspektrum nicht beobachtet wird, kann chemische Ionisation verwendet werden, um molekulare Ioneninformationen zu erhalten. Eine hilfreiche Regel zur Bestimmung, ob ein Ion ein molekulares Ion ist, ist die Stickstoffregel.
Stickstoffregel: Wie oben angegeben, sind Molekülionen, die bei der EI-Ionisation gebildet werden, ungerade Elektronenionen. Wenn ihr beobachtetes Masse-Ladungs-Verhältnis ungerade ist, enthält das zu untersuchende Molekül eine ungerade Anzahl von Stickstoffatomen. Wenn dieses Verhältnis von Masse zu Ladung eine gerade Zahl ist, enthält dieses Molekül keine oder sogar Stickstoffatome.
Chemische Ionisation
Für organische Chemiker ist die chemische Ionisation (CI) eine besonders nützliche Technik, wenn im EI-Massenspektrum kein molekulares Ion beobachtet wird, und auch im Fall der Bestätigung des Masse-Ladungs-Verhältnisses des molekularen Ions. Die chemische Ionisationstechnik verwendet praktisch die gleiche Ionenquellenvorrichtung wie beim Elektronenaufprall, außer CI verwendet eine enge Ionenquelle und Reagenzgas. Reagenzgas (z.B. Ammoniak) wird zunächst einem Elektroneneinschlag ausgesetzt. Probenionen werden durch die Wechselwirkung von Reagenzgasionen und Probenmolekülen gebildet. Dieses Phänomen nennt man Ionen-Molekül-Reaktionen. Reagenzgasmoleküle liegen im Verhältnis von etwa 100:1 zu Probenmolekülen vor. Positive Ionen und negative Ionen werden im CI-Prozess gebildet. Abhängig von der Konfiguration des Instruments (Quellspannungen, Detektor, etc…) werden nur positive Ionen oder nur negative Ionen aufgezeichnet.
Im CI treten Ionenmolekülreaktionen zwischen ionisierten Reagenzgasmolekülen (G) und flüchtigen analytneutralen Molekülen (M) auf, um Analyt-Ionen zu erzeugen. Pseudomolekulare Ionen MH+ (positiver Ionenmodus) oder – (negativer Ionenmodus) werden häufig beobachtet. Im Gegensatz zu Molekülionen, die bei der EI-Methode erhalten werden, erfolgt der MH + – und – -Nachweis in hoher Ausbeute und es werden weniger Fragmentionen beobachtet.
Positive ionen modus:
GH + + M —— > MH + + G
Negative ionen modus:
-+ M ——> – + G
Diese einfachen Protonentransferreaktionen sind echte Gasphasen-Säure-Base-Prozesse im Bronsted-Lowrey-Sinne. Eine „enge“ Ionenquelle (Druck = 0,1-2 Torr) wird verwendet, um Kollisionen zu maximieren, was zu einer Erhöhung der Empfindlichkeit führt. Um stattfinden zu können, müssen diese Ionenmolekülreaktionen exotherm sein. Der Protonentransfer ist einer der einfachen Prozesse, die bei positivem CI beobachtet werden:
RH+ + M —– > MH+ + R
Einer der entscheidenden Parameter bei dieser Reaktion ist die Protonenaffinität. Damit die Reaktion abläuft, muss die Protonenaffinität des Moleküls M höher sein als die des Gasmoleküls. Die wichtigsten in CI verwendeten Reagenzgase sind: Ammoniak, Methan und Isobutan. Die vorherrschenden gebildeten Reaktanden-Ionen sind in den unten gezeigten Mechanismen angegeben. Die Wahl des Reagenzgases beeinflusst das Ausmaß der Fragmentierung des quasi-molekularen Ions.
Methan (positive ionen chemische ionisation):
- CH4 + e —–> CH4+. + 2e ——> CH3+ + H.
- CH4+. + CH4 —–> CH5+ +CH3.
- CH4+. + CH4 —–> C2H5+ + H2 + H.
Isobutane (positive ion chemical ionization):
- i-C4H10 + e —–> i-C4H10+. + 2e
- i-C4H10+. + i-C4H10 ——> i-C4H9+ + C4H9 +H2
Ammonia (positive ion chemical ionization):
- NH3 + e —–> NH3+. + 2e
- NH3+. + NH3 ——> NH4+ + NH2.
- NH4+ + NH3 ———> N2H7+
Bei der chemischen Ionisierung im Methan-Positiv-Ionen-Modus werden die relevanten Probenpeaks MH +, + und + beobachtet; aber hauptsächlich MH +. Dies entspricht den Massen M+1, M+29 und M+41.
In isobutan positive ionen modus chemische ionisation die wichtigsten peak beobachtet ist MH +.
In ammoniak positive ionen modus chemische ionisation die wichtigsten peaks beobachtet sind MH +, und +. Wenn mehr als eine Protonierungsstelle vorhanden ist, können zusätzliche NH3-Addukte entsprechend + gesehen werden. Dies entspricht den Massen M+1, M+18 und M+35.
In einigen Fällen können protonierte Dimere oder andere Addukte beobachtet werden; Verlust von H2O gefolgt von Protonierung oder Adduktionenbildung ist für einige Klassen von Verbindungen zu sehen. Wenn das Spektrum, das Sie beobachten, nicht die richtigen Adduktionen zu zeigen scheint oder eine starke Fragmentierung aufweist, seien Sie vorsichtig, wenn Sie versuchen, die Ergebnisse zu interpretieren. In der Literatur gibt es eine Fülle von Daten, die chemische Ionisationsmechanismen für bestimmte Verbindungsklassen diskutieren.
Zwei Faktoren bestimmen die Wahl des zu verwendenden Reagenzgases:
- Protonenaffinität PA
- Energieübertragung
NH3 (Ammoniak) ist das am häufigsten verwendete Reagenzgas in CI aufgrund der geringen Energieübertragung von NH4 + im Vergleich zu CH5 + zum Beispiel. Mit NH3 als Reagenzgas werden üblicherweise MH+ und MNH4+ (17 Masseneinheiten Unterschied) beobachtet.
Negative Ionen Chemische Ionisation
Drei mechanismen können unterstrichen werden:
- Elektroneneinfangreaktion aufgrund des Erreichens von sich langsam bewegenden, niederenergetischen „thermalisierten“ Elektronen, die effizienter auf Probenmoleküle übertragen werden können.
- Elektronentransfer aus ionisiertem Reagenzgas (z. B. NH2 – kann ein Elektron auf ein Molekül übertragen, das eine größere Elektronenaffinität als NH2 aufweist).
- Reagenzgasionen nehmen an echten CI-Reaktionen teil (z. B. Protonenabstraktion nach relativen Aziditäten).
Molekulare ionen beobachtet in negative ionen chemische ionisation masse spektren sind in der regel M-oder-.
Elektrospray-Ionisationsmethode
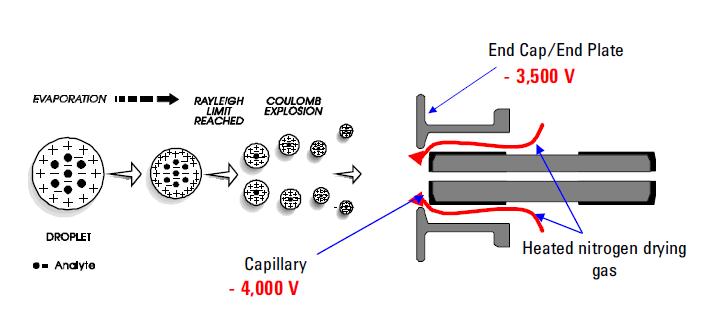
Zu den am häufigsten verwendeten Sprühionisationstechniken gehört die Elektrospray-Ionisation (ESI). Diese Technik ist weiterhin die Methode der Wahl für die Analyse thermolabiler Chemikalien. Seine Fähigkeiten sind gut dokumentiert. Es nutzt eine elektrische Spannung zwischen dem ESI-Sondenausgang (z. B. Kapillare) und der Gegenelektrode, die sich wenige Millimeter von der Sonde entfernt befindet. Der Prozess führt zur Erzeugung hochgeladener Tröpfchen direkt aus der infundierten Lösung. Mehrfach und/oder einfach geladene Analytmoleküle desorbieren aus den versprühten Tröpfchen und werden durch den Rest des Massenspektrometers abgetastet. ESI zeichnet sich durch seine Fähigkeit aus, mehrfach geladene Molekülionen aus einer Vielzahl von Polymeren wie Protein- und DNA-Fragmenten herzustellen; Es ermöglicht auch den empfindlichen Nachweis von einfach geladenen polaren Spezies mit niedrigem Molekulargewicht wie Arzneimitteln und Arzneimittelmetaboliten. Die Bildung von positiven oder negativen Ionen (abhängig vom Vorzeichen des angelegten elektrischen Feldes) erfolgt in hoher Ausbeute. Im positiven Ionenmodus protonierten und / oder Alkali-Addukt Analytmoleküle in der Regel in den Massenspektren beobachtet. Im Negativ-Ionen-Modus werden Peaks beobachtet, die deprotonierten Analytmolekülen entsprechen. ESI wird als eine sehr „weiche“ Ionisationstechnik beschrieben, bei der das umgebende Badgas eine moderierende Wirkung auf die inneren und translationalen Energien desorbierter Ionen hat.
Vorteile von ESI:
- Weicher Ionisationsprozess, so dass intakte Molekülionen beobachtet werden
- ESI ermöglicht die Herstellung mehrfach geladener Ionen. Dies führt zu der Fähigkeit, Spezies mit sehr hohem Molekulargewicht mit den meisten verfügbaren Massenanalysatoren (z. B. Quadrupolen) zu analysieren.
- ESI ist ein atmosphärischer Druckprozess. Dies macht es einfach zu bedienen und einfach mit HPLC- und CE-Trenntechniken zu verbinden.
Matrix assistierte Laserdesorption (MALDI)
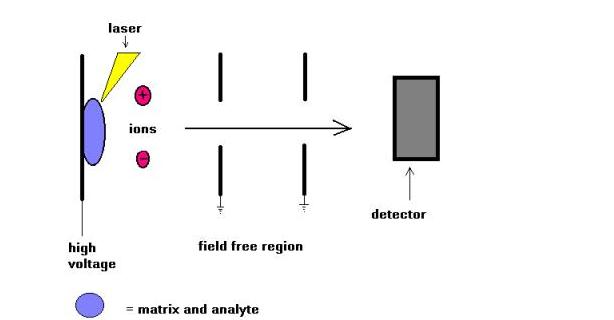
Matrix Assisted Laser Desorption (MALDI) Massenspektrometrie-Technik wurde von Karas und Hillkamp im Jahr 1988 für die Ionisierung von Peptiden und Proteinen eingeführt. Bald darauf war diese Technik in der Lage, andere Arten von Biomolekülen wie Oligosaccharide, Glycolipide, Nukleotide und synthetische Polymere zu analysieren. Bei dieser Technik werden Proben mit einer UV-absorbierenden Substanz namens Matrix mitkristallisiert. Zum Beispiel für Proteine ist die Matrix der Wahl oft Sinapinsäure. Eine 337 nm Strahlung von Stickstofflaser wird am häufigsten verwendet. Der Laser hilft, Energie in das molekulare System einzuführen, so dass eine thermische Zersetzung verhindert wird.
MALDI wird aufgrund der pulsierenden Natur der Technik und der Massenbereichsfähigkeit häufig mit Time-of-Time-Massenspektrometern (TOF) verwendet. Molekulargewichte bis zu einigen hundert Dalton konnten gemessen werden. In den letzten Jahren wurde versucht, MALDI- und ESI-Ionisationstechniken zu vergleichen. Meiner Meinung nach sind diese beiden Techniken nicht wettbewerbsfähig, sondern komplementär. Um nur einige zu nennen, führt MALDI bei hochmolekularen Spezies zur Bildung von einfach geladenen Molekülionen, während ESI die Bildung von mehrfach geladenen Molekülionen ermöglicht.
Praktische Überlegungen:
- Das endgültige Molverhältnis Probe/Matrix beträgt etwa oder etwa 1/5000.
- Die Endkonzentration der Probe liegt zwischen 1 und 10 pmol / ul
- Unsere Erfahrung mit MALDI zeigt einen dynamischen Bereich von 100 fmol/ ul bis zu einigen hundert pmol/ ul
- MALDI ist eine relativ robuste Ionisationstechnik, die die Verwendung von Salzen und Tensiden und Puffern toleriert. Obwohl es am besten ist, sie für eine bessere Leistung zu entfernen.
Peptid- und Proteinstandards für MALDI:
- Angiotensin II (Mensch) MW: 1046,2
- Substanz P (Mensch) MW: 1347,7
- Insulin (Rind) MW: 5733,6
- Cytochrom c (Pferd) MW: 12.360.1
- RNase A (Rind) MW: 13,682.2
- Apo-Myoglobin (Pferde) MW: 16,951.5
- Trypsinogen (Rinder) MW: 23,980.9
Atmosphärendruck Chemische Ionisation
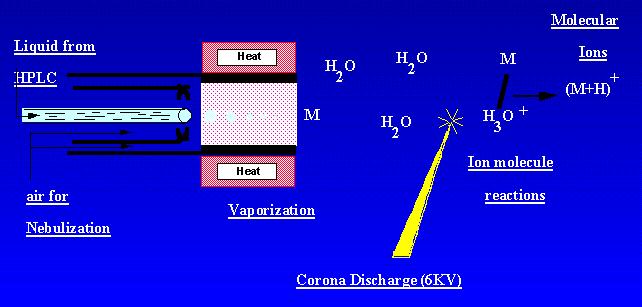
APCI ist eine Technik, die Ionen bei Atmosphärendruck erzeugt. Eine Probenlösung strömt durch ein beheiztes Rohr, wo sie in einem Nebel verflüchtigt und mit Hilfe der Stickstoffvernebelung in eine Koronaentladung gesprüht wird. Probenmoleküle werden durch Ionenmolekülreaktionen aus den Umgebungskorona-Entladungsionen ionisiert. Ionen werden in der Entladung erzeugt und in das Massenspektrometer extrahiert. APCI eignet sich am besten für relativ polare, halbflüchtige Proben. Ein APCI-Massenspektrum enthielt üblicherweise das quasimolekulare Ion, – oder +.
Analyse von Ionen
Es ist möglich, verschiedene physikalische Parameter zu verwenden, um eine Massentrennung zu erreichen. Gängige Arten von Massenanalysatoren werden nachstehend erörtert. Jeder hat Vor- und Nachteile. In unserer Einrichtung verfügen wir derzeit über Quadrupol-, Ionenfallen- und Flugzeit-Massenspektrometer (TOF).
Magnetsektor-Massenspektrometer
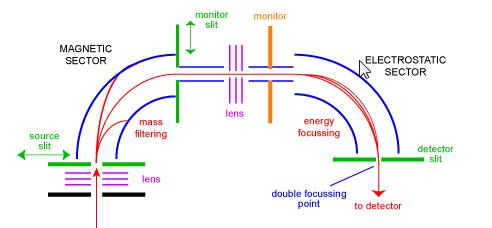
Das Sektor-Massenspektrometer war eine der häufigsten Arten von Massenanalysatoren und dem Alltagswissenschaftler wahrscheinlich am vertrautesten. In den 1950er Jahren waren die ersten kommerziellen Massenspektrometer Sektorinstrumente. Sie bestehen aus einer Kombination eines großen elektromagnetischen und einer Art elektrostatischer Fokussierungsvorrichtung. Verschiedene Hersteller verwenden unterschiedliche Geometrien. Abbildung 1 zeigt eine schematische Darstellung eines Standard-Doppelfokussierungsinstruments mit BE-Geometrie. Die BE-Konfiguration wird auch als umgekehrtes Geometrie-Sektor-Massenspektrometer bezeichnet – das heißt, ein Dual-Sektor-Instrument, das aus einem magnetischen Sektor gefolgt von einem elektrostatischen Sektor besteht.
Ionen gelangen von der Quelle (unten links) in das Instrument, wo sie zunächst fokussiert werden. Sie treten durch den Quellspalt in den magnetischen Sektor ein, wo sie gemäß der linken Regel abgelenkt werden. Ionen mit höherer Masse werden weniger abgelenkt als Ionen mit niedrigerer Masse. Durch Abtasten des Magneten können Ionen unterschiedlicher Masse auf den Monitorspalt fokussiert werden. In diesem Stadium wurden die Ionen nur durch ihre Massen getrennt. Um ein Spektrum guter Auflösung zu erhalten, bei dem alle Ionen mit demselben m / z als ein Peak im Spektrum zusammenfallen, müssen Ionen nach ihren kinetischen Energien gefiltert werden. Nach einer weiteren Stufe der Fokussierung gelangen die Ionen in den elektrostatischen Sektor, wo Ionen gleicher m/z in ihrer Energieverteilung korrigiert werden und am Doppelfokussierungspunkt auf dem Detektorspalt fokussiert werden.
Sektorinstrumente hatten in den 1950er und 1960er Jahren große kommerzielle Erfolge, da sie die einzige praktische Möglichkeit waren, hochauflösende Daten zu erhalten. In den letzten 20 Jahren oder so, mit den sinkenden Preisen von FTMS und der Entwicklung von hochauflösenden Alternativen (zum Beispiel Q-Tof) sind Sektorinstrumente rückläufig.
Flugzeit-Massenspektrometrie (TOF-MS)
Ein Flugzeit-Massenspektrometer nutzt die Laufzeitunterschiede durch eine Driftregion, um Ionen unterschiedlicher Masse zu trennen. Es arbeitet in einem gepulsten Modus, so dass Ionen in Impulsen erzeugt oder extrahiert werden müssen. Ein elektrisches Feld beschleunigt alle Ionen in einen feldfreien Driftbereich mit einer kinetischen Energie von qV, wobei q die Ionenladung und V die angelegte Spannung ist. Da die ionenkinetische Energie 0,5 mv2 beträgt, haben leichtere Ionen eine höhere Geschwindigkeit als schwerere Ionen und erreichen den Detektor am Ende der Driftregion früher.
Theorie:
- K.E. = qV
- 1/2 mv2 = qV
- v = (2qV/m)1/2
Die Laufzeit (t) durch die Driftröhre beträgt L /v, wobei L die Länge der Driftröhre ist
- t=L / (2V /m / q)1/2
Schema eines linearen TOF-MS

Dieses Schema zeigt die Ablation von Ionen aus einer festen Probe mit einem gepulsten Laser. Das Reflectron ist eine Reihe von Ringen oder Gittern, die als Ionenspiegel wirken. Dieser Spiegel kompensiert die Streuung der kinetischen Energien der Ionen beim Eintritt in den Driftbereich und verbessert die Auflösung des Instruments. Der Ausgang eines Ionendetektors wird auf einem Oszilloskop als Funktion der Zeit angezeigt, um das Massenspektrum zu erzeugen.
Ionenfalle
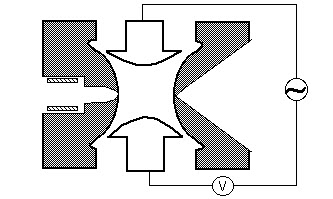
Ionen, die durch Elektronenaufprall (EI), Elektrospray (ESI) oder Matrix-assisted Laser Desorption (MALDI) Ionisation erzeugt werden, werden mit einem elektrostatischen Linsensystem in die Ionenfalle fokussiert. Ein elektrostatisches Ionentor pulsiert offen (-V) und geschlossen (+ V), um Ionen in die Ionenfalle zu injizieren. Das Pulsieren des Ionengates unterscheidet Ionenfallen von „Strahl“ -Instrumenten wie Quadrupolen, bei denen Ionen kontinuierlich in den Massenanalysator gelangen. Die Zeit, während der Ionen in die Falle gelassen werden, die als „Ionisationsdauer“ bezeichnet wird, ist so eingestellt, dass das Signal maximiert und gleichzeitig Raumladungseffekte minimiert werden. Raumladung resultiert aus zu vielen Ionen in der Falle, die eine Verzerrung der elektrischen Felder verursachen, was zu einer allgemeinen Leistungsminderung führt. Die Ionenfalle ist typischerweise mit Helium bis zu einem Druck von etwa 1 mtorr gefüllt. Kollisionen mit Helium dämpfen die kinetische Energie der Ionen und dienen dazu, die Trajektorien schnell in Richtung des Zentrums der Ionenfalle zusammenzuziehen, wodurch das Einfangen injizierter Ionen ermöglicht wird. Gefangene Ionen werden weiter in Richtung der Mitte der Falle durch die Verwendung eines oszillierenden Potentials fokussiert, das als Grundfrequenz bezeichnet wird und an die Ringelektrode angelegt wird. Ein Ion wird in Abhängigkeit von den Werten für die Masse und Ladung des Ions, der Größe der Ionenfalle (r), der Schwingfrequenz der Grundfrequenz (w) und der Amplitude der Spannung an der Ringelektrode (V) stabil eingefangen. Die Abhängigkeit der Ionenbewegung von diesen Parametern wird durch den dimensionslosen Parameter qz, qz = 4eV/mr2w2
Quadrupol beschrieben
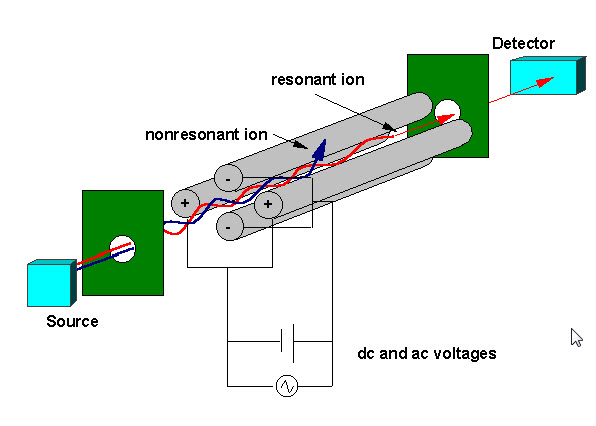
Ein Quadrupol-Massefilter besteht aus vier parallelen Metallstäben, die wie in der folgenden Abbildung angeordnet sind. Zwei gegenüberliegende Stäbe haben ein angelegtes Potential von (U + Vcos (wt)) und die anderen beiden Stäbe haben ein Potential von -(U + Vcos (wt)), wobei U eine Gleichspannung und Vcos (wt) eine Wechselspannung ist. Die angelegten Spannungen beeinflussen die Flugbahn der Ionen, die sich entlang der Flugbahn zwischen den vier Stäben bewegen. Bei gegebenen Gleich- und Wechselspannungen passieren nur Ionen eines bestimmten Masse-Ladungs-Verhältnisses den Quadrupolfilter und alle anderen Ionen werden aus ihrem ursprünglichen Weg geworfen. Ein Massenspektrum wird erhalten, indem die Ionen überwacht werden, die durch den Quadrupolfilter strömen, wenn die Spannungen an den Stäben variiert werden. Es gibt zwei Methoden: Variieren von w und Halten von U und V konstant oder Variieren von U und V (U / V) für ein konstantes w.
Ein Quadrupol-Massefilter besteht aus vier parallelen Metallstäben, die wie in der folgenden Abbildung angeordnet sind. Zwei gegenüberliegende Stäbe ha
Tandem-Massenspektrometrie:
Bei der Tandem-Massenspektrometrie, die üblicherweise als MS/ MS bezeichnet wird, werden 2 oder mehr Massenanalysatoren verwendet. Es wird häufig verwendet, um einzelne Komponenten in einer Mischung zu analysieren. Diese Technik fügt einer bestimmten Analyse Spezifität hinzu. Obwohl die Tandem-Massenspektrometrie auf MS / MS, MS / MS / MS usw. bezogen werden kann…, in dieser Präsentation werde ich nur MS / MS beschreiben.
Die Grundidee von MS / MS ist eine Auswahl eines m / z eines gegebenen Ions, das in der Ionenquelle gebildet wird, und unterwirft dieses Ion einer Fragmentierung, normalerweise durch Kollision mit Inertgas (z. Argon). Die Produkt-Ionen werden dann detektiert. Dies ist eine leistungsstarke Möglichkeit, die Identität bestimmter Verbindungen zu bestätigen und die Struktur unbekannter Arten zu bestimmen. MS / MS ist also ein Prozess, der 3 Schritte umfasst: Ionisation, Massenauswahl, Massenanalyse.
MS/MS könnte durchgeführt werden auf instrumente wie triple quadrupol (QQQ), ionen falle, zeit von flug, fourier-transformation, etc… Der dreifache Quadrupol ist das am häufigsten verwendete Massenspektrometer für MS / MS, möglicherweise unter anderem wegen der Kosten und der Benutzerfreundlichkeit.
Trennverfahren zur Kopplung mit Masse Spec
- GC-MS: Probengemische werden direkt verdampft und gelangen in gebundene Quarzglassäulen. Die Komponenten der Mischung werden aufgrund ihrer Affinitätsdifferenz zur gebundenen Phase getrennt. Abgetrennte Verbindungen verlassen die Säule und gelangen in das Vakuumsystem des Massenspektrometers. Probenmoleküle werden ionisiert (EI oder CI) und in einen vorkalibrierten Massenanalysator (z. B. Q, Ionenfalle, TOF, FTMS usw.) beschleunigt…). Retentionszeiten, Molekülmassen und Fragmentierungsmuster werden aufgezeichnet. Eine der wichtigsten Überlegungen von GC/MS ist, dass die Probe (n) nicht thermostabil sein muss (müssen).
- LC-MS: Für thermisch instabile Verbindungen wird die LC/MS-Methode in Betracht gezogen. Die Trennung basiert auf der diffrence in der Affinität von Proben mit stationärer Phase und der mobilen Phase. z.B. Hydrophobie bei RP-Chromatographie.
- CZE-MS: Diese Methode basiert auf Diffenzen der elektrophoretischen Mobilität von Proben, wenn sich die Quarzglassäule unter einer Potentialdifferenz zwischen Injektionsseite und Detektorseite befindet.
- CIEF-MS: Dies ist eine Variante von CZE. Es basiert auf Beugungen in isoelektrischen Punkten von Analyten.