- Introducción
- Materiales y métodos
- Preparación de tejidos
- Inmunohistoquímica de Fluorescencia de doble etiqueta
- Caracterización de anticuerpos
- Análisis Confocal
- Controles de anticuerpos
- Resultados
- Inmunomarcaje de NGF
- NGF y Co-Localización gabaérgica
- La co-Localización de NGF y Glutamatérgica
- Discusión
- Declaración de Conflicto de Intereses
- Reconocimientos
- Material suplementario
Introducción
El factor de crecimiento nervioso de neurotrofina (NGF) está involucrado en varios procesos críticos en el sistema nervioso de mamíferos en desarrollo y maduros, incluida la inervación diana, la diferenciación celular y la supervivencia neuronal (Large et al., 1986; Li et al., 1995; Sofroniew et al., 2001; Lad et al., 2003). En el cerebro adulto, el NGF desempeña un papel clave en el mantenimiento y la función del sistema colinérgico del cerebro anterior basal (Lad et al., 2003). Los niveles de NGF son más altos en las áreas que reciben el mayor número de proyecciones colinérgicas del cerebro anterior basal, a saber, el hipocampo y la corteza (Korsching et al., 1985; Shelton y Reichardt, 1986), y los receptores de NGF en la corteza están confinados en gran medida a las proyecciones corticopetales del cerebro anterior basal (Kordower et al., 1988; Sofroniew et al., 2001; Rossi et al., 2002). La señalización del factor de crecimiento nervioso mantiene las proyecciones corticopetales colinérgicas durante la edad adulta (Chen et al., 1997; Debeir et al., 1999) y puede prevenir la degeneración de estas neuronas tras la transección de sus axones (Hefti, 1986; Tuszynski et al., 1990; Kordower et al., 1994). Además, el NGF aumenta la liberación de acetilcolina de cultivos de cerebro anterior basal(Auld et al., 2001) y puede modular la función colinérgica a través del control fenotípico del locus del gen colinérgico (Rylett et al., 1993; Hu et al., 1997).
El sistema colinérgico del cerebro anterior basal influye en la plasticidad dependiente del aprendizaje y la experiencia en la corteza (Bakin y Weinberger, 1996; Kilgard y Merzenich, 1998; Conner et al., 2003, 2005), y la señalización de NGF se ha hipotetizado para apoyar, y posiblemente mejorar, el aprendizaje y la plasticidad mediada por el cerebro anterior basal. Por ejemplo, el bloqueo de la señalización de NGF a través de inyecciones repetidas de anticuerpos NGF en la corteza insular reduce la inervación colinérgica local e interrumpe la adquisición de dos procesos que dependen de la integridad de las entradas colinérgicas, la aversión al gusto condicionada y el aprendizaje de evitación inhibitoria (Gutiérrez et al., 1997). Un estudio reciente de Conner et al. (2009) demostraron que tanto el aprendizaje espacial como la potenciación a largo plazo del hipocampo (LTP) se mejoran después de las infusiones de NGF en el núcleo septal, la fuente primaria de inervación colinérgica en el hipocampo.
La aplicación focal de NGF también puede inducir una rápida expansión de la representación local de bigotes en la corteza del barril de ratas. Este proceso depende de las proyecciones colinérgicas del cerebro anterior basal (Prakash et al., 1996, 2004), sugiriendo que la señalización cortical de NGF puede estimular una rápida reorganización funcional colinérgica dependiente. Por lo tanto, además de sus efectos tróficos a largo plazo en las células colinérgicas del cerebro anterior basal, el NGF también puede participar en la remodelación de circuitos a corto plazo. Esta hipótesis de «doble acción» está respaldada por la existencia de mecanismos de liberación constitutivos y dependientes de la actividad del NGF (Blochl y Thoenen, 1995; Lessmann et al., 2003), potencialmente subyacentes a los efectos moduladores tróficos a largo plazo y a corto plazo del NGF, respectivamente. Además, se han observado vías de señalización retrógradas (a largo plazo) y locales (a corto plazo) para NGF (Huang y Reichardt, 2003).
Se han detectado células que expresan FGN en la corteza, el cerebelo, el hipocampo, el tálamo, el cuerpo estriado, el cerebro anterior basal y el tronco cerebral (Gall e Isackson, 1989; Maisonpierre et al., 1990; Isackson et al., 1991; Conner y Varon, 1992; Hayashi et al., 1993; Mufson et al., 1994; Zhang et al., 2007). Aunque se ha observado ARNm de NGF en astrocitos y otras glias, la gran mayoría del NGF cortical es producido por neuronas (Sofroniew et al., 2001). Sin embargo, no se conocen los tipos específicos de neuronas que producen NGF en la corteza, y se ha demostrado que las proyecciones corticopetales colinérgicas inervan las neuronas excitadoras e inhibidoras de la corteza (Zaborszky et al., 1999). En regiones extracorticales como el hipocampo, el cuerpo estriado y el cerebro anterior basal, la producción de NGF se localiza predominantemente en neuronas inhibidoras gabaérgicas (Lauterborn et al., 1993, 1995; Pascual et al., 1998; Bizon et al., 1999). La identificación de células productoras de NGF en la corteza es importante para identificar los mecanismos potenciales subyacentes a la modulación de las entradas corticales colinérgicas y los mecanismos de plasticidad cortical. En el presente estudio, identificamos un subconjunto de células gabaérgicas corticales como la fuente primaria de producción de NGF en la corteza adulta, con una producción relativamente rara por parte de las neuronas glutamatérgicas.
Materiales y métodos
Todos los sujetos fueron tratados de acuerdo con las directrices institucionales para el cuidado de animales. Debido a los bajos niveles endógenos de expresión cortical de NGF que prohibían la identificación de fuentes específicas de tipo celular de NGF en estudios anteriores, realizamos infusiones locales de colchicina para inhibir la polimerización de microtúbulos, bloqueando así el transporte de NGF fuera del cuerpo celular y dando como resultado la acumulación de antígeno NGF detectable en el soma de las células productoras (Schubert et al., 1972; Hoffelt et al., 1975; Hanson y Edström, 1978; Conner y Varon, 1992). Informes anteriores han demostrado que el tratamiento con colchicina aumenta la detección de NGF mediante técnicas inmunohistoquímicas (Conner y Varon, 1992). Además, los niveles de colchicina similares a los utilizados en el estudio actual no inducen anomalías graves en la distribución neuronal del miembro de la familia de neurotrofinas BDNF (Conner et al., 1997).
Preparación de tejidos
Ocho ratas Fischer 344 adultas (4 machos, 4 hembras; Harlan Sprague Dawley) fueron anestesiadas con 2 ml/kg de un cóctel de 25 mg/ml de ketamina, 1,3 mg/ml de xilazina y 0,25 mg/ml de acepromazina, e inyectadas con 5.0 µl de colchicina (10 µg/µl en aCSF) en las ubicaciones corticales enumeradas a continuación a una velocidad de 0,5 µl/min utilizando una jeringa Hamilton de 10 µl. Después de la infusión, la aguja permaneció en su lugar durante cuatro minutos para permitir una difusión adecuada al tejido circundante. Cuatro animales recibieron inyecciones bilaterales en la corteza motora primaria (M1) a +1,2 mm anterior (A/P) y ±2,5 mm lateral (M/L) a bregma. La mitad de la solución se inyectó a 1,6 mm por debajo de la superficie del cerebro (D / V), y el resto a 1,0 mm. Los cuatro animales restantes recibieron inyecciones unilaterales en la corteza prefrontal (A/P: +3. 0, M/L: +0.5, D/V: -2.3 y -1.8), la corteza temporal (A/P: -6.5, M/L: +5.0, D/V: -7.5 y -7.0), y la corteza parietal (A/P: -3.0, M/L: +5.0, D/V: -1.8 y -1.3). Después de 48 h, los animales fueron anestesiados profundamente y perfundidos transcardialmente con 250 ml de solución salina tamponada de fosfato en frío (pH 7,4), seguido de 250 ml de paraformaldehído en frío al 2% + 0,2% parabenzoquinona en tampón de fosfato de 0,1 M. Los cerebros se extrajeron, se postfijaron durante 2 h en el mismo fijador y se crioprotegieron en tampón de fosfato de 0,1 M que contenía sacarosa al 30% durante al menos 72 h a 4°C. Las secciones coronales (40 µm) se cortaron en un microtomo deslizante de congelación y se almacenaron en crioprotector (TCS) a 4°C hasta que se procesaron para inmunohistoquímica.
Inmunohistoquímica de Fluorescencia de doble etiqueta
Se utilizó inmunohistoquímica secuencial de doble etiqueta para visualizar neuronas que expresaban NGF y marcadores de células gabaérgicas o glutamatérgicas. Las secciones flotantes se lavaron en Solución salina tamponada Tris (TBS), se permeabilizaron con Tritón X-100 al 0,25% y el etiquetado inespecífico se bloqueó con suero de burro al 5%. Se incubaron secciones durante 72 h a 4 ° C en anticuerpos anti-NGF de conejo (Conner y Varon, 1992) diluidos 1:1000 en TBS, Tritón X-100 al 0,25% y suero de burro al 5%. Después de la incubación de anticuerpos primarios, se incubaron secciones en IgG conjugada con biotina anti-conejo de burro (1:200; Vector Laboratories, Burlingame, CA, EE.UU.). Se aplicó amplificación de señal de tiramida (TSA; PerkinElmer, Waltham, MA, EE. UU.) para amplificar la señal NGF, después de lo cual se lavaron secciones en TBS y se incubaron en estreptavidina conjugada con Fluor Alexa 488 o 594 (Invitrogen, Carlsbad, CA, EE. UU.) diluida 1:200 durante 3 h a 4°C. Después de un breve lavado, se incubaron secciones en ratones anti-glutamato descarboxilasa (GAD) 65 (GAD-6, Registro Antibódico:AB_528264,1:2000; Estudios de desarrollo Hybridoma Bank, Iowa City, IA, EE. UU.) y anti-GAD67 de ratones (Registro Anítbódico: AB_2278725, 1:1500; Millipore, Temecula, CA, EE. parvalbúmina (AntibodiRegistro: AB_2174013, 1:30000; Millipore, Temecula, CA, EE. UU.), anti-calbindina-D-28K de ratón (AntibodiRegistro: AB_476894, 1:1500; Sigma-Aldrich, St. Louis, MO, EE. UU.), o proteína quinasa IIA dependiente de Ca2+/calmodulina de ratón (CaMKIIa, AntibodiRegistro: AB_2067919, 1:1500; Millipore) durante 72 h a 4 ° C. Finalmente, se lavaron las secciones, se incubaron en Alexa Fluor 594 o 488-anti-ratón de burro conjugado (Invitrogen) durante 3 h a temperatura ambiente, se lavaron nuevamente, se montaron en portaobjetos de vidrio y se cubrieron en Fluoromount-G (Southern Biotech, Birminghan, AL, EE.UU.). Para maximizar la identificación de las células gabaérgicas, se co-incubaron los anticuerpos GAD65 y GAD67. Se cubrió un subconjunto de secciones en ProLong Gold con DAPI (Invitrogen) para la visualización de núcleos celulares.
Caracterización de anticuerpos
El anticuerpo NGF utilizado en este estudio es un policlonal purificado por afinidad criado en conejo contra NGF purificado de ratón (Conner y Varon, 1992). El anticuerpo reconoce el NGF humano recombinante y de ratón purificado, pero no reacciona de forma cruzada con BDNF recombinante o NT-3 (Conner y Varon, 1996). Además, el patrón inmunorreactivo de la expresión de NGF en el cerebro de rata coincide estrechamente con el obtenido del análisis in situ en el cerebro de rata (Conner y Varon, 1997).
El anticuerpo monoclonal GAD-65 (Banco de Estudios de Desarrollo de Hibridomas, Gad-6) se produjo inmunizando ratones con inmunoafinidad de proteína GAD purificada del cerebro de rata. El análisis de Western blot de homogeneizados cerebrales de ratas reveló que el anticuerpo reconoce selectivamente el GAD-65, pero no el GAD-67 (Chang y Gottlieb, 1988). Estudios adicionales han demostrado que el anticuerpo GAD – 6 reconoce un epítopo ubicado entre los aminoácidos 475-571 del terminal C del GAD-65 (Butler et al., 1993).
El ratón GAD-67 monoclonal (Miliporo, MAB 5406, lote: 25010139) se levantó contra los residuos de aminoácidos 4-101 del GAD-67 humano, y reconoce una sola banda de 67 kDa en el análisis de Western blot del cerebro de rata (información técnica del fabricante). La preincubación del anticuerpo con una proteína de fusión GST-GAD – 67 no produjo señal inmunopositiva en el cerebro (It et al., 2007).
El anti-CaMKIIa monoclonal de ratón (Milipora, MAB 8699, lote: LV1366080) reconoce específicamente la subunidad alfa de la proteína quinasa II dependiente de calcio/calmodulina. El análisis de Western blot demuestra que el anticuerpo identifica una sola banda de 50 kDa y reconoce tanto las formas fosforiladas como las no fosforiladas (Erondu y Kennedy, 1985).
Anti-calbindina-D-28k monoclonal (Sigma–Aldrich, C9848, lote: 088k4799) se deriva de ratones BALB/c inmunizados con calbindina-D-28k de riñón bovino purificado. El inmunoblot mostró que el anticuerpo reconoce una banda de 28 kDa y no reacciona con moléculas similares, como calbindina-D-9K, calretinina, cadena ligera de miosina y parvalbúmina (información técnica del fabricante). Se demostró que la preabsorción con una proteína calbindina-D-27 kDa purificada de cerebros de pollos y ratas eliminaba la inmunotinción de calbindina en el cerebro (Pasteels et al., 1987).
Se recolectó antiparvalbúmina (Milipora, MAB 1572, lote: LV1378387) de ratones inmunizados contra parvalbúmina purificada de músculo de rana. El anticuerpo monoclonal se dirige contra un epítopo en el primer sitio de unión a Ca2+y el análisis de inmunoblots demuestra que reconoce una proteína cerebral de 12 kDa (información técnica del fabricante).
Análisis Confocal
Las imágenes se capturaron con un software Olympus AX70 con Magnafire (versión 2.0; Karl Storz Imaging, Goleta, CA, EE.UU.). Debido a que el etiquetado de NGF se redujo sustancialmente aproximadamente 2 mm anterior/posterior a los sitios de inyección de colchicina, presumiblemente debido a la falta de difusión de colchicina y la resultante ausencia de acumulación somática de NGF, solo se analizaron secciones dentro de 1,5 mm de cada sitio de inyección de colchicina. Se examinó cada décima sección (400 µm) dentro de una región cortical. Las células se contaron manualmente y se analizaron al menos tres secciones en cada región cortical y combinación de anticuerpos por sujeto. Solo tres animales fueron evaluados en la región temporal debido al etiquetado indetectable de NGF en el cuarto. Las células de una y dos etiquetas se cuantificaron utilizando imágenes de un solo canal y de dos canales. Se utilizaron varios criterios para identificar las células marcadas, incluido el tamaño, la morfología, la señal frente al fondo y el etiquetado coincidente de DAPI al evaluar el tejido teñido con DAPI. En un subconjunto de secciones, se recolectaron pilas z de 5 µm utilizando un Olympus Fluoview FV1000 para garantizar la localización neuronal del objeto etiquetado. Debido a nuestro interés en la proporción, y no en el número absoluto, de células con doble etiqueta, no se utilizaron métodos estereológicos.
Se determinó el porcentaje de células con doble etiqueta por grupo de células inmunorreactivas (IR) para cada campo de imagen. Se calculó la media ± error estándar para cada región cortical examinada. Se utilizó el análisis de varianza unidireccional (ANOVA) para evaluar las diferencias entre regiones corticales. La DSH de Fisher se utilizó para el análisis post-hoc. Todos los análisis estadísticos se realizaron con el programa SPSS 15.0 para Windows.
Controles de anticuerpos
Los controles incluyeron la omisión de anticuerpos primarios, la omisión de anticuerpos secundarios y la sustitución de anticuerpos primarios por anticuerpos inespecíficos (IgG de conejo). Todas las manipulaciones tuvieron los efectos esperados y respaldaron la afirmación de que las células marcadas representan el verdadero etiquetado de antígenos por sus anticuerpos correspondientes.
Resultados
Inmunomarcaje de NGF
Se observó un marcado de NGF distinto en un radio de 1.a 5 mm de los lugares de inyección cortical de colchicina. Dentro de estas áreas, el etiquetado de NGF se limitó predominantemente al somata celular (Figura 1). En raras ocasiones, uno o más procesos celulares también se pueden distinguir. Fuera de este radio de 1,5 mm, el etiquetado de NGF era prácticamente indetectable en la corteza. Como la expresión cortical de los receptores de NGF TrkA y p75 están confinados a fibras corticopetales colinérgicas, es poco probable que el etiquetado observado de NGF refleje NGF endocitosado, pero en su lugar es indicativo de células productoras de NGF (Holtzman et al., 1995; Rossi et al., 2002; Stephens et al., 2005). Como se informó anteriormente (Ribak et al., 1978), el tratamiento con colchicina intensificó el etiquetado de TAG en cuerpos celulares, así como en procesos neuronales. La colchicina no tuvo un efecto detectable en el etiquetado de parvalbúmina, calbindina o camquiia.FIGURA
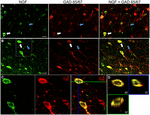
GRÁFICO 1 El factor de crecimiento nervioso se coloca ampliamente con marcadores celulares inhibitorios. Células inmunorreactivas en la (A) corteza motora primaria y (B) corteza prefrontal. Las imágenes muestran que las células marcadas con NGF (verde) se colocan ampliamente con células marcadas con GAD 65/67 (rojo). Las flechas blancas muestran un ejemplo de células inmunorreactivas para NGF y GAD 65/67 en cada región cortical. Las flechas azules muestran células inmunorreactivas solo para GAD 65/67. (C) Imagen ampliada del área dentro de la caja blanca en (B). (D) Reconstrucción X–Y–Z de la célula de doble etiqueta indicada en (C). Las líneas verdes y azules indican los niveles de disección en los planos XZ e YZ, respectivamente. Barras de escala = 25 µm.
NGF y Co-Localización gabaérgica
Factor de crecimiento nervioso co-localizado ampliamente con los marcadores de células gabaérgicas GAD65 y GAD67, independientemente del área cortical examinada (Figura 1; Tabla 1). En general, el 91 ± 0,9% de las células corticales marcadas con NGF también están marcadas para GAD65/67. El porcentaje de células marcadas con NGF que co-expresan GAD65/67 mostró poca diferencia entre las cortezas prefrontal (90,0 ± 1,5%), motora (91,7 ± 1,5%), parietal (89,6 ± 3,5%) y temporal (93,4 ± 8,1%) (ANOVA unidireccional; p = 0,78). Por el contrario, NGF co-localizado con solo 55 ± 2.3% de todas las células marcadas con GAD65/67. Para determinar si la producción de NGF se restringió a un subtipo específico de neurona gabaérgica, se etiquetó conjuntamente el tejido para NGF y parvalbúmina o calbindina (Figura 2). Se observó que las células marcadas con NGF se colocalizaban con ambos marcadores. Sin embargo, la colocalización de NGF con parvalbúmina (67,8 ± 3,6%) fue más de 2× mayor que con calbindina (29,1 ± 3,9%). Además, las células NGF-IR constituyeron menos de la mitad de todas las células inmunorreactivas de parvalbúmina (47,7 ± 4,6%) y calbindina (25,7 ± 4,9%).FIGURA

GRÁFICO 2 NGF combinado con marcadores de subclase neuronal inhibitoria. Se marcaron cortes de la corteza motora para NGF y parvalbúmina o calbindina. A) Las células mostraron una amplia superposición de las etiquetas de NGF y parvalbúmina (flechas blancas). B) Por el contrario, el etiquetado conjunto de NGF y calbindina era menos común. Barras de escala = 25 µm.

CUADRO 1 Células inmunorreactivas NGF y GAD65/67 por región cortical.
Se observaron neuronas que expresan el factor de crecimiento nervioso en todas las capas corticales. Estudios previos han reportado una distribución desigual de neuronas marcadas con NGF en las láminas corticales (Pitts y Miller, 2000; Patz y Wahle, 2006). Sin embargo, en el presente estudio no se realizó un análisis cuantitativo por capa, ya que la intensidad del etiquetado de NGF disminuyó al aumentar la distancia desde el lugar de inyección de colchicina.
La co-Localización de NGF y Glutamatérgica
El etiquetado para CaMKIIa se observó principalmente dentro de los procesos proximales y somáticos celulares (Figura 3). A diferencia de la extensa co-localización observada con marcadores NGF y GABAérgicos, las células marcadas con NGF rara vez se co-localizan con células marcadas con CaMKIIa (Figura 3; Tabla 2). En total, el 4,9 ± 1,1% de las células inmunorreactivas a NGF fueron marcadas conjuntamente con anticuerpos CaMKIIa. La co-localización difería significativamente según la región cortical (ANOVA unidireccional; p = 0,03); el post hoc de Fisher reveló que la corteza prefrontal tenía una mayor proporción de células NGF de doble etiqueta (7,6 ± 2,1%) en comparación con la corteza motora primaria (2,4 ± 1,0%; p = 0,02) y la corteza parietal (2,9% ± 1,5; p = 0,01).FIGURA

GRÁFICO 3 El factor de crecimiento nervioso se coloca mínimamente con el marcador celular excitador CaMKIIa. Células inmunorreactivas en la corteza prefrontal. Las células rara vez se agruparon para NGF (verde) y CaMKIIa (rojo), independientemente de la región cortical examinada. Las flechas doradas muestran un ejemplo de una célula inmunorreactiva solo para NGF. Barras de escala = 25 µm.

CUADRO 2 Células inmunorreactivas NGF y CaMKIIa por región cortical.
Células inmunorreactivas para CaMKIIa superaron en gran medida a las marcadas con anticuerpos NGF. La proporción total de células marcadas con CaMKIIa que expresaban simultáneamente la señal NGF fue de 2 ± 0,6%. Este porcentaje difería significativamente por región (ANOVA unidireccional p = 0,003), con la corteza prefrontal exhibiendo una mayor proporción de células NGF/CaMKIIa de doble etiqueta (3,7 ± 1,1%) que la corteza motora primaria (0,8% ± 0,3; p = 0,001), la corteza parietal (1,4% ± 0,6; p = 0,01) y la corteza temporal (1,5 ± 0,6%; p = 0,01).
Discusión
El estudio actual demuestra que la gran mayoría (>90%) de las neuronas productoras de NGF de la corteza son gabaérgicas, mientras que la mitad de todas las neuronas gabaérgicas se colocalizan con NGF. En contraste, los marcadores de neuronas excitadoras exhiben solo co-localización rara con NGF. Estos resultados fueron consistentes a lo largo de múltiples regiones corticales analizadas en este estudio, lo que indica que el NGF se produce principalmente por interneuronas inhibidoras en el neocórtex de ratas.
Aunque la inmunorreactividad al NGF rara vez coincidió con marcadores de células excitatorias (CAMKIIa), un pequeño porcentaje (~5%) fue positivo para CaMKIIa en todas las regiones corticales examinadas. El análisis confocal confirmó que este doble etiquetado se originó en el mismo plano focal, y no se debió a una señal discreta que surgió de celdas superpuestas. La importancia funcional de la expresión de NGF en una fracción tan pequeña de células excitadoras no se conoce, pero es posible que estas neuronas productoras de NGF representen una subclase de neuronas excitadoras en el neocórtex no identificada previamente.
Nuestros resultados son consistentes con hallazgos de estudios anteriores en otras regiones cerebrales que demuestran que el NGF co-localiza casi exclusivamente con células gabaérgicas en el cuerpo estriado, el cerebro anterior basal y el hipocampo (Lauterborn et al., 1993, 1995; Pascual et al., 1998; Bizon et al., 1999). Por lo tanto, la producción de NGF por células gabaérgicas puede ser una propiedad general de todos los blancos que reciben inervación colinérgica del cerebro anterior basal (incluido el propio cerebro anterior basal). Estas poblaciones neuronales colinérgicas requieren NGF para el mantenimiento de su fenotipo y proyecciones (Rylett et al., 1993; Chen et al., 1997; Hu et al., 1997; Debeir et al., 1999). A través de los estudios, las interneuronas inhibidoras ahora emergen como la fuente primaria de trofismo NGF para las neuronas colinérgicas del cerebro anterior basal.
Aunque las neuronas colinérgicas del cerebro anterior basal inervan las redes corticales excitatorias e inhibitorias (Zaborszky et al., 1999), la fuente de soporte trófico proviene mayoritariamente de la población inhibitoria, que se sabe que desempeña un papel crítico en la mediación de la plasticidad en los circuitos corticales (Hensch y Stryker, 2004; Yazaki-Sugiyama et al., 2009; Donato et al., 2013). La señalización colinérgica parece contribuir a la activación diferencial de varias subpoblaciones inhibitorias, modulando así el equilibrio excitatorio-inhibitorio (Xiang et al., 1998; Froemke et al., 2007). Por lo tanto, el NGF puede servir como una señal de retroalimentación entre las redes inhibidoras altamente plásticas y las entradas colinérgicas que las activan. De hecho, el NGF aumenta la plasticidad y el aprendizaje conductual a través de mecanismos colinérgicos dependientes(Prakash et al., 1996, 2004; Gutiérrez et al., 1997; Conner et al., 2009). Liberación dependiente de la actividad de NGF (Blochl y Thoenen, 1995; Lessmann et al., 2003), junto con la capacidad del NGF para aumentar la actividad colinérgica (Rylett et al., 1993; Hu et al., 1997; Auld et al., 2001), sugiere que el NGF puede promover la reorganización de los circuitos activos a través de una función colinérgica mejorada.
Futuros estudios intentarán identificar qué subclases de neuronas inhibidoras expresan NGF y cómo esta expresión influye precisamente en los circuitos corticales. Con este fin, tomamos medidas preliminares para determinar si el NGF co-localizado con dos marcadores comunes de neuronas inhibidoras, la parvalbúmina (asociada principalmente con células de canasta y lámparas de araña) y la calbindina (asociada con numerosos tipos de células inhibidoras; McBain y Fisahn, 2001; Markram et al., 2004). Nuestros resultados demuestran que el NGF se detectó principalmente en células inmunorreactivas de parvalbúmina, aunque muchas células marcadas con parvalbúmina no expresaban conjuntamente NGF. Es importante destacar que las células NGF-IR también se colocalizaron con células marcadas con calbindina, lo que sugiere que más de una subclase de neurona inhibidora produce NGF.
En resumen, dentro del neocórtex de la rata, el NGF se expresa principalmente por neuronas inhibidoras, una propiedad que parece conservarse de áreas cerebrales filogenéticamente más antiguas y que puede generalizarse al cerebro en su conjunto. Nuestros resultados sugieren que las interneuronas inhibidoras corticales desempeñan un papel vital en el mantenimiento de las neuronas de proyección colinérgica del cerebro anterior basal. Por lo tanto, las interneuronas gabaérgicas pueden promover la reorganización cortical a través de la señalización regulada de NGF.
Declaración de Conflicto de Intereses
Los autores declaran que la investigación se realizó en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un conflicto de intereses potencial.
Reconocimientos
Financiados por los NIH (AG10435), la Administración de Veteranos, la Asociación de Alzheimer y la Fundación de Investigación Médica Dr. Miriam y Sheldon G. Adelson.
Material suplementario
El Material Suplementario para este artículo se puede encontrar en línea en: http://www.frontiersin.org/journal/10.3389/fncel.2014.00220/abstract
Auld, D. S., Mennicken, F., y Quirion, R. (2001). El factor de crecimiento nervioso induce rápidamente la liberación prolongada de acetilcolina de las neuronas del cerebro anterior basal cultivadas: diferenciación entre influencias neuromoduladoras y neurotróficas. J. Neurocirujano. 21, 3375–3382.
Resumen de Pubmed / Texto Completo de Pubmed
Bakin, J. S., and Weinberger, N. M. (1996). Inducción de una memoria fisiológica en la corteza cerebral por estimulación del núcleo basálico. Proc. Natl. Acad. Sci. U. S. A. 93, 11219-11224. doi: 10.1073 / pnas.93.20.11219
Texto completo cruzado
Bizon, J. L., Lauterborn, J.C., and Gall, C. M. (1999). Las subpoblaciones de interneuronas estriadas se pueden distinguir sobre la base de la expresión del factor neurotrófico. J. Comp. Neurol. 408, 283–298. doi: 10.1002 / (SICI)1096-9861(19990531)408:2<283::AYUDA-CNE9>3.0.CO;2-2
Resumen de Pubmed / Texto Completo de Pubmed / Texto Cruzado Completo
Blochl, A., y Thoenen, H. (1995). Characterization of nerve growth factor (NGF) release from hippocampal neurons: evidence for a constitutive and an unconventional sodium-dependent regulated pathway. EUR. J. Neurocirujano. 7, 1220–1228. doi: 10.1111 / j. 1460-9568. 1995.tb01112.x
Resumen de Pubmed / Texto Completo de Pubmed / Texto Cruzado Completo
Butler, M. H., Solimena, M., Dirkx, R. Jr., Hayday, A., and De Camilli, P. (1993). Identificación de un epítopo dominante de ácido glutámico descarboxilasa (GAD-65) reconocido por autoanticuerpos en el síndrome del hombre rígido. J. Exp. Mediterráneo. 178, 2097–2106. doi: 10.1084 / jem.178.6.2097
Resumen de Pubmed / Texto Completo de Pubmed / Texto Cruzado Completo
Chang, Y. C., and Gottlieb, D. I. (1988). Caracterización de las proteínas purificadas con anticuerpos monoclonales a la descarboxilasa del ácido glutámico. J. Neurocirujano. 8, 2123–2130.
Chen, K. S., Nishimura, M. C., Armanini, M. P., Crowley, C., Spencer, S. D., and Phillips, H. S. (1997). La alteración de un solo alelo del gen del factor de crecimiento nervioso provoca atrofia de las neuronas colinérgicas del cerebro anterior basal y déficits de memoria. J. Neurocirujano. 17, 7288–7296.
Resumen de Pubmed / Texto Completo de Pubmed
Conner, J. M., Chiba, A. A., and Tuszynski, M. H. (2005). El sistema colinérgico del cerebro anterior basal es esencial para la plasticidad cortical y la recuperación funcional después de una lesión cerebral. Neurona 46, 173-179. doi: 10.1016 / j. neurona.2005.03.003
Resumen de Pubmed / Texto Completo de Pubmed / Texto Cruzado Completo
Conner, J. M., Culberson, A., Packowski, C., Chiba, A. A., and Tuszynski, M. H. (2003). Las lesiones del sistema colinérgico del cerebro anterior basal perjudican la adquisición de tareas y suprimen la plasticidad cortical asociada con el aprendizaje de habilidades motoras. Neurona 38, 819-829. doi: 10.1016 / S0896-6273(03)00288-5
Resumen de Pubmed / Texto Completo de Pubmed / Texto Completo de CrossRef
Conner, J. M., Franks, K. M., Titterness, A. K., Russell, K., Merrill, D. A., Christie,B. R., et al. (2009). El NGF es esencial para la plasticidad y el aprendizaje del hipocampo. J. Neurocirujano. 29, 10883–10889. doi: 10.1523 / JNEUROSCI.2594-09.2009
Resumen de Pubmed / Texto Completo de Pubmed / Texto Cruzado Completo
Conner, J. M., Lauterborn, J.C., Yan, Q., Gall, C. M., and Varon, S. (1997). Distribution of brain-derived neurotrophic factor (BDNF) protein and mRNA in the normal adult rat SNC: evidence for anterograde axonal transport. J. Neurocirujano. 17, 2295–2313.
Resumen de Pubmed / Texto Completo de Pubmed
Conner, J. M., and Varon, S. (1992). Distribución de neuronas inmunorreactivas similares al factor de crecimiento nervioso en el cerebro de rata adulta después del tratamiento con colchicina. J. Comp. Neurol. 326, 347–362. doi: 10.1002 / cne.903260304
Pubmed Resumen / Texto Completo de Pubmed / Texto Cruzado Completo
Conner, J. M., and Varon, S. (1996). Caracterización de anticuerpos frente al factor de crecimiento nervioso: variabilidad dependiente del ensayo en la reactividad cruzada con otras neurotrofinas. J. Neurocirujano. Methods 65, 93-99. doi: 10.1016/0165-0270(95)00151-4
Resumen de Pubmed / Texto Completo de Pubmed / Texto Completo de CrossRef
Conner, J. M., y Varon, S. (1997). Perfil de desarrollo de la inmunorreactividad a NGF en el cerebro de rata: un posible papel del NGF en el establecimiento de campos terminales colinérgicos en el hipocampo y la corteza. Cerebro Res. Dev. Brain Res. 101, 67-79. doi: 10.1016 / S0165-3806(97)00051-5
Resumen de Pubmed / Texto Completo de Pubmed / Texto Completo de CrossRef
Debeir, T., Saragovi, H. U., y Cuello, A.C. (1999). Un antagonista mimético del factor de crecimiento nervioso AtrA provoca la retirada de los botones colinérgicos corticales en la rata adulta. Proc. Natl. Acad. Sci. U. S. A. 96, 4067-4072. doi: 10.1073 / pnas.96.7.4067
Resumen de Pubmed / Texto Completo de Pubmed / Texto Cruzado Completo
Donato, F., Rompani, S. B., y Caroni, P. (2013). La plasticidad inducida por la experiencia de la red de cestas de expresión de parvalbúmina regula el aprendizaje de adultos. Nature 504, 272-276. doi: 10.1038 / nature12866
Resumen de Pubmed / Texto Completo de Pubmed / Texto Cruzado Completo
Erondu, N. E., and Kennedy, M. B. (1985). Distribución regional de la proteína quinasa dependiente de calmodulina tipo II Ca2+en el cerebro de rata. J. Neurocirujano. 5, 3270–3277.
Froemke, R. C., Merzenich, M. M., and Schreiner, C. E. (2007). Un rastro de memoria sináptica para plasticidad de campo receptivo cortical. Nature 450, 425-429. doi: 10.1038 / nature06289
Resumen de Pubmed / Texto Completo de Pubmed / Texto Cruzado Completo
Gall, C. M., and Isackson, P. J. (1989). Las convulsiones límbicas aumentan la producción neuronal de ARN mensajero para el factor de crecimiento nervioso. Science 245, 758-761. doi: 10.1126 / ciencia.2549634
Texto completo del texto cruzado
Gutiérrez, H., Miranda, M. I., and Bermudez-Rattoni, F. (1997). Deterioro del aprendizaje y desaferentación colinérgica después de la privación del factor de crecimiento del nervio cortical. J. Neurocirujano. 17, 3796–3803.
Resumen de Pubmed / Texto Completo de Pubmed
Hanson, M., and Edström, A. (1978). Inhibidores de la mitosis y transporte axonal. Int. Apo. Cytol. Suppl. 373–402.
Hayashi, M., Yamashita, A., Shimizu, K., Sogawa, K., and Fujii, Y. (1993). Expresión del gen del factor de crecimiento nervioso (NGF) en el sistema nervioso central del mono. Brain Res. 618, 142-148. doi: 10.1016/0006-8993 (93)90437-R
Texto completo cruzado
Hefti, F. (1986). Factor de crecimiento nervioso promueve la supervivencia de las neuronas colinérgicas septales después de fimbriales transectos. J. Neurocirujano. 6, 2155–2162.
Hensch, T. K., and Stryker, M. P. (2004). Arquitectura columnar esculpida por circuitos GABA en la corteza visual de gato en desarrollo. Science 303, 1678-1681. doi: 10.1126 / ciencia.1091031
Resumen de Pubmed / Texto Completo de Pubmed / Texto Cruzado Completo
Hoffelt, T., Kellerth, J. O., Nilsson, G., and Pernow, B. (1975). Estudios inmunohistoquímicos experimentales sobre la localización y distribución de la sustancia P en neuronas sensoriales primarias de gatos. Brain Res .. 100, 235-252. doi: 10.1016/0006-8993(75)90481-3
Resumen de Pubmed / Texto Completo de Pubmed / Texto Completo de CrossRef
Holtzman, D. M., Kilbridge, J., Li, Y., Cunningham, E. T. Jr., Lenn, N. J., Clary, D. O., et al. (1995). Expresión de TrkA en el SNC: evidencia de la existencia de varias neuronas del SNC nuevas que responden al NGF. J. Neurocirujano. 15, 1567–1576.
Resumen de Pubmed / Texto Completo de Pubmed
Hu, L., Cote, S.L., y Cuello, A.C. (1997). Modulación diferencial del fenotipo colinérgico de las neuronas nucleus basalis magnocellularis mediante la aplicación de NGF en el cuerpo celular o campos terminales corticales. Exp. Neurol. 143, 162–171. doi: 10.1006 / exnr.1996.6357
Resumen de Pubmed / Texto Completo de Pubmed / Texto Cruzado Completo
Huang, E. J., y Reichardt, L. F. (2003). Receptores Trk: funciones en la transducción de señales neuronales. Annu. Apo. Biochem. 72, 609–642. doi: 10.1146 / annurev.bioquímica.72.121801.161629
Texto completo del texto cruzado
Isackson, P. J., Huntsman, M. M., Murray, K. D., and Gall, C. M. (1991). La expresión de ARNm de BDNF aumenta en el cerebro anterior de rata adulta después de convulsiones límbicas: patrones temporales de inducción distintos de NGF. Neurona 6, 937-948. doi: 10.1016/0896-6273(91)90234-Q
Pubmed Abstract | Pubmed Texto Completo | CrossRef Texto Completo
Ito, T., Hioki, H., Nakamura, K., Tanaka, Y., Nakade, H., Kaneko, T.,et al. (2007). Las neuronas pregangliónicas simpáticas que contienen ácido gamma-aminobutírico en la médula espinal torácica de rata envían sus axones al ganglio cervical superior. J. Comp. Neurol. 502, 113–125. doi: 10.1002 / cne.21309
Resumen de Pubmed / Texto Completo de Pubmed / Texto Cruzado Completo
Kilgard, M. P., y Merzenich, M. M. (1998). Reorganización de mapas corticales habilitada por la actividad del núcleo basálico. Science 279, 1714-1718. doi: 10.1126 / ciencia.279.5357.1714
Resumen de Pubmed / Texto Completo de Pubmed / Texto Cruzado Completo
Kordower, J. H., Bartus, R. T., Bothwell, M., Schatteman, G., and Gash, D. M. (1988). Actividad inmunórica del receptor del factor de crecimiento nervioso en el primate no humano (Cebus apella): distribución, morfología y colocalización con enzimas colinérgicas. J. Comp. Neurol. 277, 465–486. doi: 10.1002 / cne.902770402
Pubmed Resumen / Texto Completo de Pubmed / Texto Cruzado Completo
Kordower, J. H., Winn, S. R., Liu, Y. T., Mufson, E. J., Sladek, J. R. Jr., Hammang, J. P., et al. (1994). Cerebro anterior basal del mono envejecido: rescate y brotación de neuronas axotomizadas basales del cerebro anterior después de injertos de células encapsuladas que secretan el factor de crecimiento nervioso humano. Proc. Natl. Acad. Sci. U. S. A. 91, 10898-10902. doi: 10.1073 / pnas.91.23.10898
Resumen de Pubmed / Texto Completo de Pubmed / Texto Cruzado Completo
Korsching, S., Auburger, G., Heumann, R., Scott, J., and Thoenen, H. (1985). Los niveles del factor de crecimiento nervioso y su ARNm en el sistema nervioso central de la rata se correlacionan con la inervación colinérgica. EMBO J. 4, 1389-1393.
Resumen de Pubmed / Texto Completo de Pubmed
Lad, S. P., Neet, K. E., y Mufson, E. J. (2003). Factor de crecimiento nervioso: estructura, función e implicaciones terapéuticas para la enfermedad de Alzheimer. Curr. El Fármaco Se Dirige al Neurológico del SNC. Disord. 2, 315–334. doi: 10.2174/1568007033482724
Resumen de Pubmed / Texto Completo de Pubmed / Texto Completo de CrossRef
Large, T. H., Bodary, S. C., Clegg, D. O., Weskamp, G., Otten, U., and Reichardt, L. F. (1986). Expresión génica del factor de crecimiento nervioso en el cerebro de rata en desarrollo. Science 234, 352-355. doi: 10.1126/ciencia.3764415
Texto completo del texto cruzado
Lauterborn, J.C., Bizon, J. L., Tran, T. M., and Gall, C. M. (1995). El ARNm de NGF se expresa por neuronas gabaérgicas pero no colinérgicas en el cerebro anterior basal de rata. J. Comp. Neurol. 360, 454–462. doi: 10.1002 / cne.903600307
Resumen de Pubmed / Texto Completo de Pubmed / Texto Cruzado Completo
Lauterborn, J.C., Tran, T. M., Isackson, P. J., and Gall, C. M. (1993). El ARNm del factor de crecimiento nervioso se expresa por neuronas gabaérgicas en el hipocampo de rata. Neuroreport 5, 273-276. doi: 10.1097/00001756-199312000-00023
Texto completo de CrossRef
Lessmann, V., Gottmann, K., y Malcangio, M. (2003). Secreción de neurotrofinas: hechos actuales y perspectivas futuras. Prog. Neurobiol. 69, 341–374. doi: 10.1016 / S0301-0082(03)00019-4
Resumen de Pubmed / Texto Completo de Pubmed / Texto Completo de CrossRef
Li, Y., Holtzman, D. M., Kromer, L. F., Kaplan, D. R., Chua-Couzens, J., Clary, D. O., et al. (1995). Regulación de la expresión de AtrC y ChAT en el cerebro basal de rata en desarrollo: evidencia de que tanto el NGF exógeno como el endógeno regulan la diferenciación de las neuronas colinérgicas. J. Neurocirujano. 15, 2888–2905.
Resumen de Pubmed / Texto Completo de Pubmed
Maisonpierre, P. C., Belluscio, L., Friedman, B., Alderson, R. F., Wiegand, S. J., Furth,M. E., et al. (1990). NT-3, BDNF y NGF en el sistema nervioso de rata en desarrollo: patrones de expresión paralelos y recíprocos. Neurona 5, 501-509. doi: 10.1016 / 0896-6273(90)90089-X
Resumen de Pubmed / Texto Completo de Pubmed / Texto Cruzado Completo
Markram, H., Toledo-Rodriguez, M., Wang, Y., Gupta, A., Silberberg, G., and Wu, C. (2004). Interneuronas del sistema inhibitorio neocortical. NAT. Reverendo Neurocirujano. 5, 793–807. doi: 10.1038 / nrn1519
Pubmed Resumen / Pubmed Texto Completo / Texto Cruzado
McBain, C. J., y Fisahn, A. (2001). Interneuronas sin consolidar. NAT. Reverendo Neurocirujano. 2, 11–23. doi: 10.1038/35049047
Resumen de Pubmed / Texto Completo de Pubmed / Texto Completo de CrossRef
Mufson, E. J., Conner, J. M., Varon, S., and Kordower, J. H. (1994). Perfiles inmunorreactivos similares a factores de crecimiento nervioso en el cerebro anterior basal de los primates y la formación del hipocampo. J. Comp. Neurol. 341, 507–519. doi: 10.1002 / cne.903410407
Pubmed Resumen / Texto Completo de Pubmed / Texto Cruzado Completo
Pascual, M., Rocamora, N., Acsady, L., Freund, T. F., and Soriano, E. (1998). Expresión del factor de crecimiento nervioso y la neurotrofina-3 ARNm en interneuronas hipocampales: caracterización morfológica, niveles de expresión y colocalización del factor de crecimiento nervioso y la neurotrofina-3. J. Comp. Neurol. 395, 73–90. doi: 10.1002 / (SICI)1096-9861(19980525)395:1<73::AYUDA-CNE6>3.0.CO; 2-E
Resumen de Pubmed / Texto Completo de Pubmed / Texto Cruzado Completo
Pasteels, B., Miki, N., Hatakenaka, S., and Pochet, R. (1987). Reactividad cruzada inmunohistoquímica y comigración electroforética entre calbindina D-27 kDa y visinina. Brain Res. 412, 107-113. doi: 10.1016/0006-8993(87)91444-2
Resumen de Pubmed / Texto Completo de Pubmed / Texto Completo de CrossRef
Patz, S., y Wahle, P. (2006). Cambios en el desarrollo de la expresión de ARNm de neurotrofina en las capas de la corteza visual de rata. EUR. J. Neurocirujano. 24, 2453–2460. doi: 10.1111 / j. 1460-9568. 2006. 05126.x
Resumen de Pubmed / Texto Completo de Pubmed / Texto Cruzado Completo
Pitts, A. F., and Miller, M. W. (2000). Expresión del factor de crecimiento nervioso, del factor neurotrófico derivado del cerebro y de la neurotrofina-3 en la corteza somatosensorial de la rata madura: coexpresión con receptores de neurotrofinas de alta afinidad. J. Comp. Neurol. 418, 241–254. doi: 10.1002 / (SICI)1096-9861(20000313)418:3<241::AYUDA-CNE1 >3.0.CO;2-M
Resumen de Pubmed / Texto Completo de Pubmed / Texto Cruzado Completo
Prakash, N., Cohen-Cory, S., and Frostig, R. D. (1996). Efectos rápidos y opuestos de BDNF y NGF en la organización funcional de la corteza adulta in vivo. Nature 381, 702-706. doi: 10.1038 / 381702a0
Resumen de Pubmed / Texto Completo de Pubmed / Texto Cruzado Completo
Prakash, N., Cohen-Cory, S., Penschuck, S., and Frostig, R. D. (2004). El sistema colinérgico del cerebro anterior basal está implicado en la plasticidad inducida por el factor de crecimiento nervioso rápido (FGN) en la corteza del barril de ratas adultas. J. Neurofisiol. 91, 424–437. doi: 10.1152 / jn.00489.2003
Resumen de Pubmed / Texto Completo de Pubmed / Texto Cruzado Completo
Ribak, C. E., Vaughn, J. E., and Saito, K. (1978). Localización inmunocitoquímica de la descarboxilasa del ácido glutámico en somata neuronal tras la inhibición de la colchicina del transporte axonal. Brain Res .. 140, 315-332. doi: 10.1016/0006-8993(78)90463-8
Resumen de Pubmed / Texto Completo de Pubmed / Texto Completo de CrossRef
Rossi, F. M., Sala, R., y Maffei, L. (2002). Expresión de los receptores del factor de crecimiento nervioso TrkA y p75NTR en la corteza visual de la rata: desarrollo y regulación por la entrada colinérgica. J. Neurocirujano. 22, 912–919.
Resumen de Pubmed / Texto Completo de Pubmed
Rylett, R. J., Goddard, S., Schmidt, B. M., and Williams, L. R. (1993). Síntesis y liberación de acetilcolina tras la administración intracerebral continua de NGF en ratas Fischer-344 adultas y de edad avanzada. J. Neurocirujano. 13, 3956–3963.
Resumen de Pubmed / Texto Completo de Pubmed
Schubert, P., Kreutzberg, G. W., y Lux, H. D. (1972). Transporte neuroplasmático en dendritas: efecto de la colchicina en la morfología y fisiología de las motoneuronas en el gato. Brain Res. 47, 331-343. doi: 10.1016/0006-8993(72)90643-9
Resumen de Pubmed / Texto Completo de Pubmed / Texto Completo de CrossRef
Shelton, D. L., and Reichardt, L. F. (1986). Estudios sobre la expresión del gen del factor de crecimiento del nervio beta (NGF) en el sistema nervioso central: nivel y distribución regional del ARNm de NGF sugieren que el NGF funciona como un factor trófico para varias poblaciones distintas de neuronas. Proc. Natl. Acad. Sci. U. S. A. 83, 2714-2718. doi: 10.1073 / pnas.83.8.2714
Resumen de Pubmed / Texto Completo de Pubmed / Texto Cruzado Completo
Sofroniew, M. V., Howe, C. L., and Mobley, W. C. (2001). Señalización del factor de crecimiento nervioso, neuroprotección y reparación neuronal. Annu. Reverendo Neurocirujano. 24, 1217–1281. doi: 10.1146 / annurev.neuro.24.1.1217
Texto completo cruzado
Stephens, H. E., Belliveau, A.C., Gupta, J. S., Mirkovic, S., and Kablar, B. (2005). El papel de las neurotrofinas en el mantenimiento de las neuronas motoras de la médula espinal y las neuronas sensoriales propioceptivas de los ganglios de la raíz dorsal. Int. J. Dev. Neurociencia. 23, 613–620. doi: 10.1016 / j. ijdevneu.2005.07.002
Resumen de Pubmed / Texto Completo de Pubmed / Texto Cruzado Completo
Tuszynski, M. H., Armstrong, D. M., and Gage, F. H. (1990). Pérdida de células del cerebro anterior basal tras la transección de fimbria / fórnix. El Cerebro De Res. 508, 241–248. doi: 10.1016 / 0006-8993 (90)90402-W
Texto completo cruzado
Xiang, Z., Huguenard, J. R., and Prince, D. A. (1998). Conmutación colinérgica dentro de redes inhibitorias neocorticales. Science 281, 985-988. doi: 10.1126 / ciencia.281.5379.985
Resumen de Pubmed / Texto Completo de Pubmed / Texto Cruzado Completo
Yazaki-Sugiyama, Y., Kang, S., Cateau, H., Fukai, T., and Hensch, T. K. (2009). Plasticidad bidireccional en circuitos GABA de punta rápida por experiencia visual. Nature 462, 218-221. doi: 10.1038 / nature08485
Resumen de Pubmed / Texto Completo de Pubmed / Texto Cruzado Completo
Zaborszky, L., Pang, K., Somogyi, J., Nadasdy, Z., and Kallo, I. (1999). El sistema corticopetal del cerebro anterior basal revisado. Ana. Acad de Nueva York. Sci. 877, 339–367. doi: 10.1111 / j. 1749-6632. 1999.tb09276.x
Resumen de Pubmed / Texto Completo de Pubmed / Texto Cruzado Completo
Zhang, H. T., Li, L. Y., Zou, X. L., Song, X. B., Hu, Y. L., Feng, Z. T., et al. (2007). Distribución inmunohistoquímica de NGF, BDNF, NT-3 y NT-4 en cerebros de monos rhesus adultos. J. Histochem. Cytochem. 55, 1–19. doi: 10.1369/jhc.6A6952.2006
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text