Introdução
A neurotrofina fator de crescimento do nervo (NGF) está envolvido em vários processos críticos no desenvolvimento e maduro de mamíferos do sistema nervoso, incluindo alvo inervação, a diferenciação celular e sobrevivência neuronal (Grande et al., 1986; Li et al., 1995; Sofroniew et al., 2001; Lad et al., 2003). No cérebro adulto, a NGF desempenha um papel fundamental na manutenção e na função do sistema colinérgico basal do cérebro dianteiro (Lad et al., 2003). Os níveis de NGF são mais elevados nas áreas que recebem o maior número de projecções colinérgicas basais do cérebro dianteiro, nomeadamente o hipocampo e o córtex (Korsching et al., 1985; Shelton and Reichardt, 1986), e os receptores para NGF no córtex estão em grande parte confinados a projecções corticopetais basais do forebrain (Kordower et al., 1988; Sofroniew et al., 2001; Rossi et al., 2002). A sinalização do fator de crescimento nervoso mantém projeções corticopetais colinérgicas durante a idade adulta (Chen et al., 1997; Debeir et al., 1999) e pode prevenir a degeneração desses neurônios após a transecção de seus axônios (Hefti, 1986; Tuszynski et al., 1990; Kordower et al., 1994). Além disso, o NGF aumenta a libertação de acetilcolina a partir de culturas basais do proebrain (Auld et al., 2001) e pode modular a função colinérgica através do controle fenotípico do gene colinérgico locus (Rylett et al., 1993; Hu et al., 1997).
o sistema colinérgico basal influencia a aprendizagem e a plasticidade dependente da experiência no córtex (Bakin e Weinberger, 1996; Kilgard e Merzenich, 1998; Conner et al., 2003, 2005), e a sinalização NGF tem sido hipotetizada para suportar, e possivelmente melhorar, a aprendizagem e plasticidade mediada pelo cérebro dianteiro basal. Por exemplo, o bloqueio da sinalização NGF através de injecções repetidas de anticorpos NGF no córtex insular reduz a inervação colinérgica local e interrompe a aquisição de dois processos que dependem da integridade das entradas colinérgicas, aversão ao sabor condicionado e aprendizagem inibitória de evitar (Gutierrez et al., 1997). A recent study by Conner et al. (2009) demonstrou que tanto a aprendizagem espacial como a potenciação hippocampal a longo prazo (LTP) são melhoradas após perfusões de NGF no núcleo septal, a principal fonte de inervação colinérgica para o hipocampo.
a aplicação Focal do NGF também pode induzir uma rápida expansão da representação de whisker local no córtex do barril de ratos. Este processo é dependente de projeções colinérgicas do proebrain basal (Prakash et al., 1996, 2004), sugerindo que a sinalização cortical NGF pode estimular a rápida reorganização funcional dependente do colinérgico. Assim, além dos seus efeitos tróficos a longo prazo sobre as células colinérgicas basais do cérebro dianteiro, o NGF pode também participar na remodelação do circuito a curto prazo. Esta hipótese de “dual-action” é apoiada pela existência de mecanismos de libertação constitutivos e dependentes da atividade da NGF (Blochl e Thoenen, 1995; Lessmann et al., 2003), potencialmente subjacente aos efeitos tróficos a longo prazo e modulatórios a curto prazo da NGF, respectivamente. Além disso, foram observadas vias de sinalização retrógradas (de longo prazo) e locais (de curto prazo) para NGF (Huang e Reichardt, 2003).
as células que expressam NGF foram detectadas no córtex, cerebelo, hipocampo, tálamo, estriato, cérebro anterior basal e tronco cerebral (Gall e Isackson, 1989; Maisonpierre et al., 1990; Isackson et al., 1991; Conner and Varon, 1992; Hayashi et al., 1993; Mufson et al., 1994; Zhang et al., 2007). Embora o mRNA NGF tenha sido observado em astrocitos e outros glia, a grande maioria do NGF cortical é produzido por neurônios (Sofroniew et al., 2001). Os tipos específicos de neurônios que produzem NGF no córtex não são conhecidos, no entanto, e colinérgicos corticopetal projeções têm sido mostrados para innervate tanto excitatórios e inibitórios neurônios no córtex (Zaborszky et al., 1999). Em regiões extracorticais como o hipocampo, o estriato e o forebrain basal, a produção de NGF é predominantemente localizada em neurónios inibitórios GABAérgicos (Lauterborn et al., 1993, 1995; Pascual et al., 1998; Bizon et al., 1999). A identificação das células produtoras de NGF no córtex é importante para identificar mecanismos potenciais subjacentes à modulação das entradas corticais colinérgicas e mecanismos de plasticidade cortical. No estudo atual, identificamos um subconjunto de células Gabaérgicas corticais como a principal fonte de produção de NGF no córtex adulto, com produção relativamente rara por neurônios glutamatérgicos.
materiais e métodos
todos os indivíduos foram tratados de acordo com as directrizes institucionais para os cuidados a animais. Devido aos baixos níveis endógenos de cortical NGF expressão que proibia a identificação da célula específica do tipo de fontes de NGF em estudos anteriores, foi realizada em local a colchicina infusões para inibir microtubule de polimerização, assim, bloquear a NGF de transporte para longe do corpo celular e resultando na acumulação de detectáveis NGF antigen na soma das células produtoras (Schubert et al., 1972; Hokfelt et al., 1975; Hanson and Edström, 1978; Conner and Varon, 1992). Relatórios anteriores demonstraram que o tratamento com colchicina aumenta a detecção de NGF utilizando técnicas imunohistoquímicas (Conner e Varon, 1992). Além disso, os níveis de colchicina semelhantes aos utilizados no presente estudo não induzem anomalias brutas na distribuição neuronal do membro da família das neurotrofinas BDNF (Conner et al., 1997).
Tecido de Preparação de
Oito adultos Fischer 344 ratos (4 do sexo masculino, 4 do sexo feminino; Harlan Sprague Dawley) foram anestesiados com 2 ml/kg de 25 mg/ml de ketamina, 1,3 mg/ml de xilazina e 0,25 mg/ml acepromazine cocktail, e injetado com 5.0 µl de colchicina (10 µg/µl em aCSF) nos locais corticais a seguir indicados, a uma taxa de 0,5 µl/min, utilizando uma seringa de Hamilton de 10 µl. Após a perfusão, a agulha permaneceu no local durante quatro minutos para permitir uma difusão adequada ao tecido circundante. Quatro animais receberam injecções bilaterais no córtex motor primário (M1) a +1,2 mm anterior (A/P) e ±2,5 mm laterais (M/L) a bregma. Metade da solução foi injetada em 1,6 mm abaixo da superfície do cérebro (D/V), e o resto de 1,0 mm. Os restantes quatro animais, todos receberam unilateral injeções no córtex pré-frontal (A/P: +3.0, M/L: +0.5, D/V: -2.3 e -1.8), temporal córtex (A/P: -6.5, M/L: +5.0, D/V: -7.5 e -7.0), e o córtex parietal (A/P: -3.0, M/L: +5.0, D/V: -1.8 e -1.3). Após 48 h, os animais foram profundamente anestesiados e transcardiamente perfundidos com 250 ml de solução salina tampão de fosfato frio (pH 7.4), seguidos de 250 ml de paraformaldeído a 2% frio + 0,2% de parabenzoquinona em tampão de fosfato 0,1 M. Os cérebros foram extraídos, postfixados para 2 h no mesmo fixador, e crioproteccionados em tampão fosfato de 0,1 M contendo 30% de sacarose durante, pelo menos, 72 h a 4°C. As secções coronais (40 µm) foram cortadas num microtoma deslizante congelante e armazenadas em crioprotectante (TCS) a 4°C até serem posteriormente processadas para imunohistoquímica.Foi utilizada imunohistoquímica de fluorescência de dupla etiqueta para visualizar neurónios que expressem NGF e marcadores celulares GABAérgicos ou glutamatérgicos. As secções flutuantes livres foram lavadas em solução salina tamponada Tris (TBS), permeabilizadas com Tritão x-100 a 0, 25%, e a rotulagem não específica foi então bloqueada com soro de burro a 5%. Incubaram-se secções durante 72 h a 4°C em anticorpos anti-NGF de coelho (Conner e Varon, 1992) diluídas 1:1000 em TBS, 0, 25% Triton X-100 e 5% soro de burro. Após a incubação primária de anticorpos, foram incubadas secções em IGG conjugada com biotina (1:200; Vector Laboratories, Burlingame, CA, EUA) de burro anti-coelho. A amplificação do sinal de tiramida (TSA; PerkinElmer, Waltham, MA, EUA) foi aplicada para amplificar o sinal NGF, após o que as secções foram lavadas em TBS e incubadas em Alexa Fluor 488 ou 594-streptavidina conjugada (Invitrogen, Carlsbad, CA, EUA) diluída 1: 200 durante 3 h a 4 ° C. Depois de uma breve lavagem, os cortes foram incubados em ambos mouse anti-glutamato descarboxilase (GAD) 65 (GAD-6, AntibodyRegistry:AB_528264,1:2000; Desenvolvimento de Estudos de Hibridoma Banco, Iowa City, IA, EUA) e de rato anti-GAD67 (AnitbodyRegistry: AB_2278725, 1:1500; Millipore, Temecula, CA, EUA), ou no mouse anti-parvalbumin (AntibodyRegistry: AB_2174013, 1:30000; Millipore, Temecula, CA, EUA), mouse anti-calbindin-D-28K (AntibodyRegistry: AB_476894, 1:1500; Sigma-Aldrich, St. Louis, MO, EUA), ou de rato anti-Ca2+/calmodulin dependente da proteína quinase IIa (CaMKIIa, AntibodyRegistry: AB_2067919, 1:1500; Milipore) durante 72 h a 4°C. Por último, foram lavadas secções, incubadas em Alexa Fluor 594 ou 488-conjugadas de burro anti-rato (Invitrogen) durante 3 h à temperatura ambiente, lavadas novamente, montadas em lâminas de vidro e cobertas em Fluoromount-G (Southern Biotech, Birminghan, AL, EUA). A fim de maximizar a identificação das células Gabaérgicas, os anticorpos GAD65 e GAD67 foram co-incubados. Um subconjunto de seções foi coberto em ouro prolongado com DAPI (Invitrogen) para visualização de núcleos celulares.
caracterização de anticorpos
o anticorpo NGF utilizado neste estudo é um policlonal purificado de afinidade elevado no coelho contra o NGF do rato purificado (Conner e Varon, 1992). O anticorpo reconhece o ratinho purificado e o NGF humano recombinante, mas não reage cruzada com o BDNF recombinante ou NT-3 (Conner e Varon, 1996). Além disso, o padrão imunoreactivo da expressão do NGF no cérebro de rato coincide estreitamente com o obtido da análise in situ no cérebro de rato (Conner e Varon, 1997).
o anticorpo monoclonal GAD-65 (estudos de desenvolvimento Hybridoma Bank, Gad-6) foi produzido por imunização de ratinhos com proteína GAD imunoafinidade purificada a partir do cérebro de rato. A análise Western blot de homogeneizados do cérebro de rato revelou que o anticorpo reconhece selectivamente o GAD-65, mas não o GAD-67 (Chang e Gottlieb, 1988). Estudos adicionais demonstraram que o anticorpo GAD-6 reconhece um epítopo localizado entre os aminoácidos 475-571 do C-terminus de GAD-65 (Butler et al., 1993).
o monoclonal do rato GAD-67 (Millipore, MAB 5406, lote: 25010139) foi levantado contra os resíduos de aminoácidos 4-101 do GAD-67 humano, e reconhece uma única banda 67-kDa na análise Western blot do cérebro de rato (informação técnica do fabricante). A pré -incubação do anticorpo com uma proteína de fusão GST-GAD-67 resultou em nenhum sinal imunopositivo no cérebro (Ito et al., 2007).
o rato anti-Camkia monoclonal (Millipore, MAB 8699, lote: LV1366080) reconhece especificamente a subunidade alfa da proteína cinase II dependente do cálcio/calmodulina. A análise Western blot demonstra que o anticorpo identifica uma única banda de 50 kDa e reconhece ambas as formas fosforiladas e não-fosforiladas (Erondu e Kennedy, 1985).
anti-calbindin-D-28k Monoclonal (Sigma–Aldrich, c9848, lot: 088k4799) é derivado de ratinhos BALB/c imunizados com calbindin-D-28k rim bovino purificado. Foi demonstrado que a pré-absorção com uma proteína de calbindin-D-27 kDa purificada a partir do cérebro de galinha e de rato eliminou a imunossupressão de calbindin no cérebro (Pasteels et al., 1987).
Anti-parvalbumina (Millipore, MAB 1572, lot: LV1378387) foi recolhida de ratos imunizados contra a parvalbumina purificada a partir do músculo da rÃ. O anticorpo monoclonal é dirigido contra um epítopo no primeiro local de ligação Ca2+e a análise imunoblot demonstra que reconhece uma proteína cerebral de 12 kDa (informação técnica do fabricante).
análise Confocal
imagens foram captadas usando um Olympus AX70 com software Magnafire (versão 2.0; Karl Storz Imaging, Goleta, CA, EUA). Uma vez que a rotulagem do NGF foi substancialmente reduzida aproximadamente 2 mm antes/posterior aos locais de injecção da colchicina, presumivelmente devido à falta de difusão da colchicina e à ausência resultante de acumulação somática do NGF, foram analisadas apenas secções dentro de 1, 5 mm de cada local de injecção de colchicina. Cada décima secção (400 µm) foi examinada numa região cortical. As células foram contadas manualmente, e pelo menos três seções foram analisadas em cada região cortical e combinação de anticorpos por indivíduo. Apenas três animais foram avaliados na região temporal devido à indetectável rotulagem NGF no quarto. As células individuais e duplamente rotuladas foram quantificadas usando imagens de canal simples e de canal duplo. Vários critérios foram usados para identificar células rotuladas, incluindo tamanho, morfologia, sinal vs. fundo, e coincidente rotulagem DAPI ao avaliar o tecido manchado por DAPI. Em um subconjunto de Seções, 5 µm z-stacks foram coletadas usando um Olympus Fluoview FV1000 para garantir a localização neuronal do objeto rotulado. Devido ao nosso interesse na proporção, e não no número absoluto, de células duplamente rotuladas, métodos estereológicos não foram usados.
a percentagem de células duplamente marcadas por grupo de células imunoreativas (IR) foi determinada para cada campo de imagem. O erro médio ± padrão foi calculado para cada região cortical examinada. A análise de Sentido Único da variância (ANOVA) foi utilizada para avaliar as diferenças entre as regiões corticais. O HSD de Fisher foi usado para análise post-hoc. Todas as análises estatísticas foram realizadas com SPSS 15.0 Para Windows.Os controlos de anticorpos
incluíram a omissão de anticorpos primários, a omissão de anticorpos secundários e a substituição de anticorpos primários por anticorpos não específicos (IgG de coelho). Todas as manipulações tiveram os efeitos esperados e apoiaram a afirmação de que as células rotuladas representam a rotulagem do antigénio verdadeiro por seus correspondentes anticorpos.
resultados
NGF Immunolabeling
etiquetagem NGF distinta foi visível dentro de um raio de 1.A 5 mm dos locais de injecção do cortical da cólquica. Dentro destas áreas, a rotulagem do NGF estava predominantemente confinada ao somata celular (Figura 1). Raramente, um ou mais processos celulares também podem ser distinguidos. Fora deste raio de 1,5 mm, a rotulagem do NGF era virtualmente indetectável no córtex. Como a expressão cortical dos receptores NGF TrkA e p75 estão confinados às fibras corticopetais colinérgicas, é improvável que a rotulagem observada de NGF reflicta o NGF endocitado, mas em vez disso é indicativo de células produtoras de NGF (Holtzman et al., 1995; Rossi et al., 2002; Stephens et al., 2005). Tal como referido anteriormente (Ribak et al., 1978), o tratamento com colchicina intensificou a rotulagem GAD em corpos celulares, bem como processos neuronais. A colchicina não teve qualquer efeito detectável na rotulagem de parvalbumina, calbindin ou Camkia.
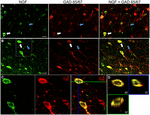
FIGURA 1. O factor de crescimento do nervo colocaliza extensivamente com marcadores celulares inibitórios. Células imunoreativas no (a) córtex motor primário e (B) córtex pré-frontal. As imagens mostram que as células marcadas com NGF (verde) se colocalizam extensivamente com as células marcadas com GAD 65/67 (vermelho). As setas brancas mostram um exemplo de imunoreactividade celular para NGF e GAD 65/67 em cada região cortical. As setas azuis mostram células imunoreativas apenas para o GAD 65/67. C) imagem ampliada da área dentro da caixa branca na alínea b). D) reconstrução X–Y–Z da célula duplamente marcada indicada na alínea C). Linhas verdes e azuis indicam níveis de dissecação em planos XZ e YZ, respectivamente. Barras de escala = 25 µm.
NGF e Gabaérgico Co-Localização
fator de crescimento do Nervo co-localizadas amplamente com a Gabaérgico marcadores de célula de GAD65 e GAD67, independentemente da cortical da área analisada (Figura 1; Tabela 1). Globalmente, 91 ± 0, 9% das células corticais marcadas com NGF também rotuladas com GAD65/67. A percentagem de NGF-chamados de células co-expressão de GAD65/67 mostrou pouca diferença entre os pré-frontal (90.0 de ± 1,5%), motor (91.7 de ± 1,5%), parietal (89.6 ± 3,5%) e temporal (de 93,4 ± 8.1%) córtex (one-way ANOVA; p = 0.78). Inversamente, NGF foi co-localizada com apenas 55 ± 2.3% de todas as células marcadas com GAD65/67. Para determinar se a produção de NGF estava restrita a um subtipo específico de neurônio Gabaérgico, nós co-rotulado tecido para NGF e parvalbumina ou calbindina (Figura 2). Observou-se que as células marcadas com NGF se colocalizam com ambos os marcadores. No entanto, a colocalização da NGF com a parvalbumina (67,8 ± 3,6%) foi superior a 2× maior do que com a calbindina (29,1 ± 3,9%). Adicionalmente, as células NGF-IR constituíram menos de metade de todas as células imunoreativas da parvalbumina (47, 7 ± 4, 6%) e da calbindina (25, 7 ± 4, 9%).

FIGURA 2. NGF colabeled with inhibitory neuron subclass markers. Fatias do córtex motor foram rotuladas para NGF e parvalbumin ou calbindin. (A) as células mostraram uma extensa sobreposição de NGF e de etiquetagem de parvalbumina (setas brancas). (B) inversamente, a colabelagem de NGF e calbindina era menos comum. Barras de escala = 25 µm.

QUADRO 1. NGF-e GAD65/67-células imunoreativas por região cortical.Foram observados neurónios que expressam o factor de crescimento nervoso ao longo de todas as camadas corticais. Estudos anteriores relataram distribuição desigual de neurônios marcados com NGF nas lâminas corticais (Pitts e Miller, 2000; Patz e Wahle, 2006). A análise quantitativa por camada não foi realizada no estudo actual, no entanto, uma vez que a intensidade de rotulagem do NGF diminuiu com o aumento da distância do local de injecção da colchicina.
NGF e co-localização glutamatérgica
a rotulagem da Camkia foi observada principalmente nos processos de somata celular e proximal (Figura 3). Ao contrário da extensa co-localização observada com marcadores NGF e GABAérgicos, as células marcadas com NGF raramente são co-localizadas com células marcadas com Camkia (Figura 3; Tabela 2). No total, 4, 9 ± 1, 1% das células IMUNOREATIVAS do NGF foram co-rotuladas com anticorpos Camkia. Co-localização diferem significativamente por região cortical (one-way ANOVA; p = 0,03); Fisher post hoc revelou que o córtex pré-frontal tinham uma maior proporção de duas vezes rotulado como NGF células (7.6 ± 2.1%), em comparação com o córtex motor primário (2.4 ± 1.0%; p = 0,02), e o córtex parietal (2.9% de ± 1,5; p = 0,01).

FIGURA 3. O Fator de crescimento do nervo colocaliza-se minimalmente com a marca da célula excitatória Camkia. Células imunoreativas no córtex pré-frontal. As células raramente eram colabeladas para NGF (verde) e Camkia (vermelha), independentemente da região cortical examinada. Setas de ouro mostram um exemplo de uma célula imunoreativa apenas para NGF. Barras de escala = 25 µm.

QUADRO 2. Células NGF-e Camkia-imunoreativas por região cortical.
as células imunoreativas para Camkia superaram em grande número as rotuladas por anticorpos NGF. A proporção total de células marcadas com Camkia expressando simultaneamente o sinal NGF foi de 2 ± 0,6%. Esse percentual difere significativamente por região (one-way ANOVA, p = 0,003), com o córtex pré-frontal apresentando uma maior proporção de duas vezes rotulado como NGF/CaMKIIa células (3.7 ± 1.1%) do que o córtex motor primário (0.8% ± 0.3; p = 0,001), o córtex parietal (1.4% ± 0.6; p = 0,01), e o córtex temporal (1.5 ± 0.6%; p = 0,01).
discussão
o estudo actual demonstra que a grande maioria (>90%) dos neurónios produtores de NGF do córtex são GABAérgicos, enquanto metade de todos os neurónios GABAérgicos se coocalizam com NGF. Em contraste, os marcadores de neurônios excitatórios exibem apenas uma co-localização rara com NGF. Estes resultados foram consistentes em várias regiões corticais analisadas neste estudo, indicando que o NGF é produzido principalmente por interneurões inibitórios no neocortex no rato.
embora a imunoreactividade do NGF raramente tenha coincidido com marcadores de células excitatórias (Camkia), uma pequena percentagem (~5%) foi positiva para a Camkia em todas as regiões corticais examinadas. A análise Confocal confirmou que esta dupla rotulagem se originou do mesmo plano focal, e não foi devido a sinais discretos decorrentes de células sobrepostas. A significância funcional da expressão NGF em uma fração tão pequena de células excitatórias não conhecidas, mas é possível que estes neurônios produtores de NGF representem uma subclasse previamente não identificada de neurônios excitatórios no neocórtex.
os Nossos resultados são consistentes com os achados de estudos anteriores em outras regiões do cérebro, demonstrando que NGF co-localiza-se quase exclusivamente com Gabaérgico células do corpo estriado, prosencéfalo basal, e hipocampo (Lauterborn et al., 1993, 1995; Pascual et al., 1998; Bizon et al., 1999). Assim, a produção de NGF por células Gabaérgicas pode ser uma propriedade geral de todos os alvos que recebem inervação colinérgica basal do forebrain (incluindo o próprio forebrain basal). Estas populações neuronais colinérgicas requerem NGF para a manutenção de seu fenótipo e projeções (Rylett et al., 1993; Chen et al., 1997; Hu et al., 1997; Debeir et al., 1999). Através dos estudos, os interneuros inibitórios emergem agora como a principal fonte do trofismo NGF para os neurónios colinérgicos basais do forebrain.
embora os neurónios colinérgicos primitivos basais inervem redes corticais excitatórias e inibitórias (Zaborszky et al., 1999), a fonte de apoio trófico é esmagadoramente da população inibitória, que é conhecida por desempenhar um papel crítico na mediação da plasticidade em circuitos corticais (Hensch E Stryker, 2004; Yazaki-Sugiyama et al., 2009; Donato et al., 2013). A sinalização colinérgica parece contribuir para a activação diferencial de várias subpopulações inibitórias, modulando assim o equilíbrio excitatório-inibitório (Xiang et al., 1998; Froemke et al., 2007). O NGF pode, assim, servir como um sinal de feedback entre redes inibitórias altamente plásticas e as entradas colinérgicas que as activam. Na verdade, a NGF aumenta a plasticidade e a aprendizagem comportamental através de mecanismos dependentes do colinérgico (Prakash et al., 1996, 2004; Gutierrez et al., 1997; Conner et al., 2009). Activity-dependent release of NGF (Blochl and Thoenen, 1995; Lessmann et al., 2003), emparelhado com a capacidade da NGF para aumentar a actividade colinérgica (Rylett et al., 1993; Hu et al., 1997; Auld et al., 2001), sugere que a NGF pode promover a reorganização dos circuitos ativos através de uma função colinérgica melhorada.Estudos futuros tentarão identificar quais subclasses de neurônios inibitórios expressam NGF e como esta expressão influencia precisamente os circuitos corticais. Para isso, foram etapas preliminares para determinar se NGF co-localizado com dois marcadores mais comuns dos neurónios inibidores, parvalbumin (principalmente associados com a cesta e o candelabro de células), e calbindin (associadas a diversos inibidores tipos de células; McBain e Fisahn, 2001; Markram et al., 2004). Os nossos resultados demonstram que o NGF foi detectado principalmente em células imunoreativas da parvalbumina, embora muitas células rotuladas pela parvalbumina não tenham co-expresso o NGF. O importante é que as células NGF-IR também colocalizaram com células marcadas com calbindina, sugerindo que mais de uma subclasse de neurônio inibitório produz NGF.
Em resumo, no prazo de ratos neocórtex NGF é principalmente expressa por os neurônios inibitórios, uma propriedade que parece ser conservados a partir de filogeneticamente mais antigas áreas do cérebro e que podem ser generalizadas para o cérebro como um todo. Nossos resultados sugerem que os interneuros inibitórios corticais desempenham um papel vital na manutenção dos neurônios de projeção colinérgica do prosencéfalo basal. Os interneurões GABAérgicos podem, assim, promover a reorganização cortical através de uma sinalização regulada pelo NGF.
Declaração de conflito de interesses
os autores declaram que a investigação foi realizada na ausência de quaisquer relações comerciais ou financeiras que possam ser interpretadas como um potencial conflito de interesses.
agradecimentos
financiado pela NIH (AG10435), a administração de Veteranos, a Associação de Alzheimer e a Dr. Miriam e Sheldon G. Adelson Medical Research Foundation.
Material Suplementar
O Material Suplementar para este artigo podem ser encontradas online em: http://www.frontiersin.org/journal/10.3389/fncel.2014.00220/abstract
Auld, D. S., Mennicken, F., e Quirion, R. (2001). O factor de crescimento do nervo induz rapidamente a libertação prolongada de acetilcolina a partir de neurónios do forebrain basal: diferenciação entre influências neuromodulatórias e neurotróficas. J. Neurosci. 21, 3375–3382.
Pubmed Abstract / Pubmed texto completo
Bakin, J. S., and Weinberger, N. M. (1996). Indução de uma memória fisiológica no córtex cerebral por estimulação do núcleo basalis. Procedimento. Natl. Acad. Ciência. U. S. A. 93, 11219-11224. doi: 10.1073 / pnas.93.20.11219
CrossRef Texto Completo
Bizon, J. L., Lauterborn, J. C., e Fel, C. M. (1999). As subpopulações de interneurões estriatais podem ser distinguidas com base na expressão do fator neurotrófico. J. Comp. Neurol. 408, 283–298. doi: 10.1002/(SICI)1096-9861(19990531)408:2<283::AUXÍLIO-CNE9>3.0.CO;2-2
Pubmed Resumo | Pubmed Texto Completo | CrossRef Texto Completo
Blochl, A., e Thoenen, H. (1995). Characterization of nerve growth factor (NGF) release from hippocampal neurons: evidence for a constitutive and an unconventional sodium-dependent regulated pathway. Euro. J. Neurosci. 7, 1220–1228. doi: 10.1111 / J. 1460-9568.1995.tb01112.x
Pubmed Resumo | Pubmed Texto Completo | CrossRef Texto Completo
Butler, M. H., Solimena, M., Dirkx, R. Jr., Hayday, A., e De Camilli, P. (1993). Identificação de um epítopo dominante da descarboxilase do ácido glutâmico (GAD-65) reconhecido por auto-anticorpos na síndrome do homem rígido. J. Exp. Med. 178, 2097–2106. doi: 10.1084 / jem.178.6.2097
Pubmed Resumo | Pubmed Texto Completo | CrossRef Texto Completo
Chang, Y. C., e Gottlieb, D. I. (1988). Caracterização das proteínas purificadas com anticorpos monoclonais à descarboxilase do ácido glutâmico. J. Neurosci. 8, 2123–2130.
Chen, K. S., Nishimura, M. C., Armanini, M. P., Crowley, C., Spencer, S. D., e Phillips, H. S. (1997). A interrupção de um único alelo do gene do fator de crescimento do nervo resulta em atrofia dos neurônios colinérgicos primitivos basais e déficits de memória. J. Neurosci. 17, 7288–7296.
Pubmed Abstract / Pubmed texto completo
Conner, J. M., Chiba, A. A., and Tuszynski, M. H. (2005). O sistema colinérgico basal do cérebro é essencial para a plasticidade cortical e recuperação funcional após lesão cerebral. Neuron 46, 173-179. doi: 10.1016 / j. neuron.2005.03.003
Pubmed Resumo | Pubmed Texto Completo | CrossRef Texto Completo
Conner, J. M.), Culberson, A., Packowski, C., Chiba, A. A., and Tuszynski, M. H. (2003). As lesões do sistema colinérgico basais do cérebro dianteiro prejudicam a aquisição de tarefas e suprimem a plasticidade cortical associada à aprendizagem de competências motoras. Neuron 38, 819-829. doi: 10.1016/S0896-6273(03)00288-5
Pubmed Resumo | Pubmed Texto Completo | CrossRef Texto Completo
Conner, J. M., Francos, K. M., Titterness, A. K., Russell, K., Merrill, D. A., Christie, B. R.,et al. (2009). A NGF é essencial para a plasticidade hipocampo e para a aprendizagem. J. Neurosci. 29, 10883–10889. doi: 10.1523/JNEUROSCI.2594-09.2009
Pubmed Resumo | Pubmed Texto Completo | CrossRef Texto Completo
Conner, J. M., Lauterborn, J. C., Yan, P., Vesícula, C. M., e Varon, S. (1997). Distribuição da proteína do factor neurotrófico derivado do cérebro (BDNF) e do ARNm no SNC adulto normal do SNC: evidência de transporte axonal anterógrado. J. Neurosci. 17, 2295–2313.
Pubmed Abstract / Pubmed texto completo
Conner, J. M., and Varon, s. (1992). Distribuição de neurónios imunoreactivos do factor de crescimento nervoso no cérebro de rato adulto após tratamento com colchicina. J. Comp. Neurol. 326, 347–362. doi: 10.1002/cne.903260304
Pubmed Resumo | Pubmed Texto Completo | CrossRef Texto Completo
Conner, J. M., e Varon, S. (1996). Caracterização dos anticorpos ao factor de crescimento do nervo: variabilidade dependente do doseamento na reactividade cruzada com outras neurotrofinas. J. Neurosci. Methods 65, 93-99. doi: 10.1016/0165-0270(95)00151-4
Pubmed Resumo | Pubmed Texto Completo | CrossRef Texto Completo
Conner, J. M., e Varon, S. (1997). Perfil de desenvolvimento da imunoreactividade do NGF no cérebro do rato: um possível papel da NGF no estabelecimento de campos terminais colinérgicos no hipocampo e córtex. Brain Res. Dev. Brain Res. 101, 67-79. doi: 10.1016/S0165-3806(97)00051-5
Pubmed Resumo | Pubmed Texto Completo | CrossRef Texto Completo
Debeir, T., Saragovi, H. U., e Cuello, A. C. (1999). Um factor de crescimento dos nervos o antagonista mimético da TrkA provoca a suspensão dos boutons colinérgicos corticais no rato adulto. Procedimento. Natl. Acad. Ciência. U. S. A. 96, 4067-4072. doi: 10.1073 / pnas.96.7.4067
Pubmed Resumo | Pubmed Texto Completo | CrossRef Texto Completo
Donato, F., Rompani, S. B., e Caroni, P. (2013). A plasticidade da rede de células cestas que exprime a parvalbumina induzida pela experiência regula a aprendizagem de adultos. Nature 504, 272-276. doi: 10.1038/nature12866
Pubmed Resumo | Pubmed Texto Completo | CrossRef Texto Completo
Erondu, N. E., e Kennedy, M. B. (1985). Distribuição Regional da proteína cinase dependente da calmodulina Tipo II no cérebro de rato. J. Neurosci. 5, 3270–3277.
Froemke, R. C.), Merzenich, M. M., and Schreiner, C. E. (2007). Um traço sináptico de memória para plasticidade de campo receptivo cortical. Nature 450, 425-429. doi: 10.1038/nature06289
Pubmed Resumo | Pubmed Texto Completo | CrossRef Texto Completo
Fel, C. M., e Isackson, P. J. (1989). Convulsões límbicas aumentam a produção neuronal de RNA mensageiro para o Fator de crescimento nervoso. Science 245, 758-761. doi: 10.1126 / science.2549634
CrossRef Texto Completo
Gutierrez, H., Miranda, M. I., e Bermudez-Rattoni, F. (1997). Insuficiência de aprendizagem e desaferentação colinérgica após privação do factor de crescimento do nervo cortical. J. Neurosci. 17, 3796–3803.
Pubmed Abstract / Pubmed texto completo
Hanson, M., and Edström, A. (1978). Inibidores da mitose e transporte axonal. T. Rev. Cytol. Suppl. 373–402.
Hayashi, M., Yamashita, A., Shimizu, K., Sogawa, K., and Fujii, Y. (1993). Expressão do gene para o factor de crescimento dos nervos (NGF) no sistema nervoso central do macaco. Brain Res. 618, 142-148. doi: 10.1016/0006-8993(93)90437-R
CrossRef Texto Completo
Hefti, F. (1986). O factor de crescimento do nervo promove a sobrevivência dos neurónios colinérgicos septais após as transecções fimbriais. J. Neurosci. 6, 2155–2162.
Hensch, T. K., and Stryker, M. P. (2004). Arquitetura colunar esculpida por circuitos GABA no desenvolvimento do córtex visual cat. Science 303, 1678-1681. doi: 10.1126 / science.1091031
Pubmed Resumo | Pubmed Texto Completo | CrossRef Texto Completo
Hokfelt, T., Kellerth, J. O., Nilsson, G., e Pernow, B. (1975). Estudos imunohistoquímicos experimentais sobre a localização e distribuição da substância P nos neurónios sensoriais primários da cat. Brain Res. 100, 235-252. doi: 10.1016/0006-8993(75)90481-3
Pubmed Resumo | Pubmed Texto Completo | CrossRef Texto Completo
Holtzman, D. M., Kilbridge, J., Li, Y., Cunningham, E. T. Jr., Lenn, N. J., Clary, D. O.,et al. (1995). TrkA expression in the CNS: evidence for the existence of several novel NGF-responsive SNC neurons. J. Neurosci. 15, 1567–1576.
Pubmed Abstract / Pubmed Texto Completo
Hu, L.), Cote, S. L., and Cuello, A. C. (1997). Modulação diferencial do fenótipo colinérgico do núcleo basalis magnocellularis aplicando NGF no corpo celular ou nos campos terminais corticais. Expo. Neurol. 143, 162–171. D. N.: 10.1006 / exnr.1996.6357
Pubmed Resumo | Pubmed Texto Completo | CrossRef Texto Completo
Huang, E. J., e Reichardt, L. F. (2003). Receptores Trk: funções na transdução do sinal neuronal. Annu. Rev. Biochem. 72, 609–642. doi: 10.1146 / annurev.bioquímica.72.121801.161629
CrossRef Texto Completo
Isackson, P. J., Caçador, M. M., Murray, K. D., e Fel, C. M. (1991). A expressão de mRNA BDNF é aumentada no cérebro dianteiro do rato adulto após convulsões límbicas: padrões temporais de indução distintos do NGF. Neuron 6, 937-948. doi: 10.1016/0896-6273(91)90234-Q
Pubmed Resumo | Pubmed Texto Completo | CrossRef Texto Completo
Ito, T., Hioki, H., Nakamura, K., Tanaka, Y., Nakade, H., Kaneko, T.,et al. (2007). Ácido gama-aminobutírico contendo neurónios preganglionicos simpáticos na medula espinhal torácica do rato enviam os seus axões para o gânglio cervical superior. J. Comp. Neurol. 502, 113–125. doi: 10.1002/cne.21309
Pubmed Resumo | Pubmed Texto Completo | CrossRef Texto Completo
Kilgard, M. P., e Merzenich, M. M. (1998). Reorganização do mapa Cortical permitida pela actividade do núcleo basalis. Science 279, 1714-1718. doi: 10.1126 / science.279.5357.1714
Pubmed Resumo | Pubmed Texto Completo | CrossRef Texto Completo
Kordower, J. H., Bartus, R. T., Bothwell, M., Schatteman, G., and Gash, D. M. (1988). Actividade imunológica do receptor do factor de crescimento nervoso no primata não humano (Cebus apella): distribuição, morfologia e colocalização com enzimas colinérgicas. J. Comp. Neurol. 277, 465–486. doi: 10.1002/cne.902770402
Pubmed Resumo | Pubmed Texto Completo | CrossRef Texto Completo
Kordower, J. H., Winn, S. R., Liu, Y. T., Mufson, E. J., Sladek, J. R. Jr., Hammang, J. P.,et al. (1994). O velho prosencéfalo basal dos Macacos: recuperação e desenvolvimento de neurónios do cérebro dianteiro basal axotomizados após enxertos de células encapsuladas que segregam o factor de crescimento do nervo humano. Procedimento. Natl. Acad. Ciência. U. S. A. 91, 10898-10902. doi: 10.1073 / pnas.91.23.10898
Pubmed Resumo | Pubmed Texto Completo | CrossRef Texto Completo
Korsching, S., Auburger, G., Heumann, R., Silva, J., e Thoenen, H. (1985). Os níveis do factor de crescimento do nervo e do seu ARNm no sistema nervoso central do rato estão correlacionados com a inervação colinérgica. EMBO J. 4, 1389-1393.
Pubmed Abstract / Pubmed texto completo
Lad, S. P., Neet, K. E., and Mufson, E. J. (2003). Fator de crescimento do nervo: estrutura, função e implicações terapêuticas para a doença de Alzheimer. Moeda. A droga ataca o SNC Neurol. Disord. 2, 315–334. doi: 10.2174/1568007033482724
Pubmed Resumo | Pubmed Texto Completo | CrossRef Texto Completo
Grande, T. H., Bodary, S. C., Clegg, D. O., Weskamp, G., Otten, U., e Reichardt, L. F. (1986). Expressão do gene do factor de crescimento nervoso no cérebro de rato em desenvolvimento. Science 234, 352-355. doi: 10.1126 / science.3764415
CrossRef Texto Completo
Lauterborn, J. C., Bizon, J. L., Silva, T. M., e Fel, C. M. (1995). O ARNm NGF é expresso por neurónios GABAérgicos mas não colinérgicos no proebrain basal de ratos. J. Comp. Neurol. 360, 454–462. doi: 10.1002/cne.903600307
Pubmed Resumo | Pubmed Texto Completo | CrossRef Texto Completo
Lauterborn, J. C., Silva, T. M., Isackson, P. J., e Fel, C. M. (1993). O factor de crescimento do nervo mRNA é expresso por neurónios GABAérgicos no hipocampo de rato. Neuroreport 5, 273-276. doi: 10.1097/00001756-199312000-00023
CrossRef Texto Completo
Lessmann, V., Gottmann, K., e Malcangio, M. (2003). Secreção de neurotrofinas: factos actuais e perspectivas futuras. Programa. Neurobiol. 69, 341–374. doi: 10.1016/S0301-0082(03)00019-4
Pubmed Resumo | Pubmed Texto Completo | CrossRef Texto Completo
Li, Y., Holtzman, D. M., Kromer, L. F., Kaplan, R. D., Chua-Couzens, J., Clary, D. O.,et al. (1995). Regulação do TrkA e da expressão de ChAT no desenvolvimento do prosencéfalo basal no rato: evidência de que tanto o NGF exógeno como o endógeno regulam a diferenciação dos neurónios colinérgicos. J. Neurosci. 15, 2888–2905.
Pubmed Resumo | Pubmed Texto Completo
Maisonpierre, P. C., Belluscio, L. Friedman, B., Alderson, R. F., Wiegand, S. J., Furth, M. E.,et al. (1990). NT-3, BDNF, and NGF in the developing rat nervous system: parallel as well as reciprocal patterns of expression. Neuron 5, 501-509. doi: 10.1016/0896-6273(90)90089-X
Pubmed Resumo | Pubmed Texto Completo | CrossRef Texto Completo
Markram, H., Toledo-Rodriguez, M., Wang, Y., Gupta, A., Silberberg, G., and Wu, C. (2004). Interneurões do sistema inibitório neocortical. Conversao. Rev. Neurosci. 5, 793–807. doi: 10.1038/nrn1519
Pubmed Resumo | Pubmed Texto Completo | CrossRef Texto Completo
McBain, C. J., e Fisahn, A. (2001). Interneurões não presos. Conversao. Rev. Neurosci. 2, 11–23. doi: 10.1038/35049047
Pubmed Resumo | Pubmed Texto Completo | CrossRef Texto Completo
Mufson, E. J., Conner, J. M., Varon, S., e Kordower, J. H. (1994). Os perfis imunoreactivos do factor de crescimento do nervo no proebrain basal primata e na formação hipocampa. J. Comp. Neurol. 341, 507–519. doi: 10.1002/cne.903410407
Pubmed Resumo | Pubmed Texto Completo | CrossRef Texto Completo
Pascual, M., Rocamora, N., Acsady, L., Freund, T. F., e Soriano, E. (1998). Expression of nerve growth factor and neurotrophin-3 mRNAs in hippocampal interneurons: morphological characterization, levels of expression, and colocalization of nerve growth factor and neurotrophin-3. J. Comp. Neurol. 395, 73–90. doi: 10.1002/(SICI)1096-9861(19980525)395:1<73::AUXÍLIO-CNE6>3.0.CO;2-E
Pubmed Resumo | Pubmed Texto Completo | CrossRef Texto Completo
Pasteels, B., Miki, N., Hatakenaka, S., e Pochet, R. (1987). Imunohistochemical cross-reactivity and electrophoretic comigration between calbindin D-27 kDa and visininin. Brain Res. 412, 107-113. doi: 10.1016/0006-8993(87)91444-2
Pubmed Resumo | Pubmed Texto Completo | CrossRef Texto Completo
Patz, S., e Wahle, P. (2006). Alterações no desenvolvimento da expressão mRNA neurotrofina nas camadas do córtex visual do rato. Euro. J. Neurosci. 24, 2453–2460. doi: 10.1111 / J. 1460-9568. 2006. 05126.X
Pubmed Abstract / Pubmed texto completo | CrossRef texto completo
Pitts, A. F., and Miller, M. W. (2000). Expressão do factor de crescimento dos nervos, do factor neurotrófico derivado do cérebro e da neurotrofina-3 no córtex somatosensorial do rato Maduro: Co-expressão com receptores neurotrofínicos de elevada afinidade. J. Comp. Neurol. 418, 241–254. doi: 10.1002/(SICI)1096-9861(20000313)418:3<241::AUXÍLIO-CNE1>3.0.CO;2-M
Pubmed Resumo | Pubmed Texto Completo | CrossRef Texto Completo
Prakash, N. Cohen-Cory, S., e Frostig, R. D. (1996). Efeitos rápidos e opostos de BDNF e NGF na organização funcional do córtex adulto in vivo. Nature 381, 702-706. doi: 10.1038/381702a0
Pubmed Resumo | Pubmed Texto Completo | CrossRef Texto Completo
Prakash, N. Cohen-Cory, S., Penschuck, S., e Frostig, R. D. (2004). O sistema colinérgico Basal do forebrain está envolvido na plasticidade induzida pelo factor de crescimento nervoso rápido (NGF) no córtex de ratos adultos. J. Neurofisiol. 91, 424–437. doi: 10.1152/jn.00489.2003
Pubmed Resumo | Pubmed Texto Completo | CrossRef Texto Completo
Ribak, C. E., Vaughn, J. E., e Saito, K. (1978). Localização imunocitoquímica da descarboxilase do ácido glutâmico no somata neuronal após inibição da colchicina do transporte axonal. Brain Res. 140, 315-332. doi: 10.1016/0006-8993(78)90463-8
Pubmed Resumo | Pubmed Texto Completo | CrossRef Texto Completo
Rossi, F. M., Sala, R., e Maffei, L. (2002). Expressão dos receptores do factor de crescimento nervoso TrkA e p75NTR no córtex visual do rato: desenvolvimento e regulação pela entrada colinérgica. J. Neurosci. 22, 912–919.
Pubmed Resumo | Pubmed Texto Completo
Rylett, R. J., Goddard, S., Schmidt, B. M., e Williams, L. R. (1993). Síntese e libertação da acetilcolina após administração intracerebral contínua de NGF em ratos Fischer-344 adultos e idosos. J. Neurosci. 13, 3956–3963.
Pubmed Abstract / Pubmed texto completo
Schubert, P., Kreutzberg, G. W., and Lux, H. D. (1972). Neuroplasmic transport in dendrites: effect of colchicine on morphology and physiology of motoneurones in the cat. Brain Res. 47, 331-343. doi: 10.1016/0006-8993(72)90643-9
Pubmed Resumo | Pubmed Texto Completo | CrossRef Texto Completo
Shelton, D. L., e Reichardt, L. F. (1986). Estudos sobre a expressão do gene do fator de crescimento do nervo beta (NGF) no sistema nervoso central: nível e distribuição regional do mRNA NGF sugerem que o NGF funciona como um fator trófico para várias populações distintas de neurônios. Procedimento. Natl. Acad. Ciência. U. S. A. 83, 2714-2718. doi: 10.1073 / pnas.83.8.2714
Pubmed Resumo | Pubmed Texto Completo | CrossRef Texto Completo
Sofroniew, M. V., Howe, C. L., e Mobley, W. C. (2001). Sinais do factor de crescimento do nervo, neuroprotecção e reparação neural. Annu. Rev. Neurosci. 24, 1217–1281. doi: 10.1146 / annurev.neuro.24.1.1217
CrossRef Texto Completo
Stephens, H. E., Belliveau, A. C., Gupta, J. S., Mirkovic, S., e Kablar, B. (2005). O papel das neurotrofinas na manutenção dos neurônios motores da medula espinhal e dos gânglios sensoriais proprioceptivos das raízes dorsais. T. J. Dev. Neuroci. 23, 613–620. doi: 10.1016 / j. ijdevneu.2005.07.002
Pubmed Resumo | Pubmed Texto Completo | CrossRef Texto Completo
Tuszynski, M. H. Armstrong, D. M., e Gage, F. H. (1990). Perda Basal das células do cérebro dianteiro após a transecção fimbria / fornix. Brain Res. 508, 241–248. doi: 10.1016/0006-8993(90)90402-W
CrossRef Texto Completo
Xiang, Z., Huguenard, J. R. e Príncipe, D. R. (1998). Mudança colinérgica em redes inibitórias neocorticas. Science 281, 985-988. doi: 10.1126 / science.281.5379.985
Pubmed Resumo | Pubmed Texto Completo | CrossRef Texto Completo
Yazaki-Sugiyama, Y., Kang, S., Cateau, H., Fukai, T., e Hensch, T. K. (2009). Plasticidade bidirecional em circuitos GABA de ponta rápida por experiência visual. Nature 462, 218-221. doi: 10.1038/nature08485
Pubmed Resumo | Pubmed Texto Completo | CrossRef Texto Completo
Zaborszky, L., Angústia, K., Somogyi, J., Nadasdy, Z., e Kallo, I. (1999). O sistema corticopetal basal foi revisitado. Anao. N. Y. Acad. Ciência. 877, 339–367. doi: 10.1111 / J. 1749-6632. 1999.tb09276.x
Pubmed Resumo | Pubmed Texto Completo | CrossRef Texto Completo
Zhang, H. T., Li, L. Y., Zou, X. L., Música, X. B. Hu, Y. L., Feng, Z. T.,et al. (2007). Distribuição imunohistoquímica de NGF, BDNF, NT-3 e NT-4 em cérebros adultos de macacos rhesus. J. Histochem. Cytochem. 55, 1–19. doi: 10.1369/jhc.6A6952.2006
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text