introdução
o ciclo de glioxilato contorna os passos de descarboxilação do ciclo de Krebs e causa a assimilação do carbono líquido a partir da acetil-CoA. A liase isocitrato (EC 4.1.3.1) e a malato sintase (EC 2.3.3.9) são as únicas enzimas para esta via metabólica. O ciclo de glioxilato ocorre na germinação de sementes (Eastmond & Graham, 2001), em alguns invertebrados, como C. elegans (Edwards, Copes, Brito, Canfield, & Bradshaw, 2013) e em microorganismos, como E. coli (Nelson & Cox, 2009) e S. cerevisiae (Rezaei, Aslankoohi, Verstrepen, & Courtin, 2015). The pathway was described in 1957 during studies on microorganisms which grew on acetate and ethanol as carbon source (Kornberg & Krebs, 1957).
Acetil-CoA no ciclo do glioxilato liga-se ao oxaloacetato, produzindo respectivamente citrato e isocitrato. Este último produz glioxilato e succinato na reação catalisada pela liase isocirate. Além disso, o glioxilato condensa-se com uma segunda molécula de acetil-CoA em uma reação catalizada pela malato sintase, depois que o malato produzido é oxidado a oxaloacetato e assim regenerando o intermediário (passos B-1 A B-5, Figura 1). Duas moléculas acetil-CoA são introduzidas em cada repetição do ciclo de glioxilato e a síntese líquida de uma molécula de succinato ocorre (Beeckmans, 2009; Berg, Stryer, & Tymoczko, 2015; Torres & Marzzoco, 2007). Além disso, carboidratos produzidos a partir de lípidos de reserva em sementes oleaginosas são distribuídos para a planta e utilizados como fonte de carbono até que os cloroplastos comecem a diferenciar-se nas folíolas e iniciar a fotossíntese. Gorduras e óleos são importantes estruturas químicas no armazenamento de carbono de muitas sementes, embora em forma reduzida, compreendendo importantes espécies agronômicas como soja, amendoim, algodão e girassol (Junqueira, 2012). Os ácidos láurico (12:0), mirístico (14:0), palmítico (16:0) e esteárico (18:0) são os ácidos gordos saturados mais importantes dos produtos hortícolas.; enquanto que os ácidos insaturados são o ácido oleico (18: 1 (Δ9)), o ácido linoleico (18:2(Δ9, 12)) e o ácido linolénico (18:3(Δ9, 12, 15)) (Taiz & Zeiger, 2002).

Figura 1.
ácidos Graxos ou acetato de catabolismo toproduce energia através do glyoxylate ciclo, evidenciando a integração betweenß-oxidação(passos de A-1 a A-4), glyoxylate ciclo (etapas B-1 a B-5), o ciclo de Krebs (passos C-1through C-8), a gliconeogênese (passos D-1 a D-3) e a glicólise (passo-a-E-1).
ácidos gordos com um par de carbonos não resultam na síntese de hidratos de carbono em animais (Nelson & Cox, 2009). Este fato ocorre porque não há produção líquida de oxaloacetato para suportar a gluconeogênese uma vez que, neste caso, os ácidos graxos são catabolizados a acetil-CoA. O intermediário é oxidado no ciclo Krebs, e para cada dois carbonos que entram como acetil-CoA, dois carbonos são perdidos como CO2 (Eastmond & Graham, 2001; Nelson & Cox, 2009).
a ausência do ciclo do glioxilato nos mamíferos pode ser alvo de toxicidade selectiva no desenvolvimento de agentes antimicrobianos. The inhibitory activity of 3-nitropropionamides on isocitrate lyase in M. tuberculosis (Sriram et al., 2011), bromofenols (Oh et al., 2010) and alkaloids from sponges on isocitrate lyase in C. albicans (Lee et al., 2008; Oh et al., 2010) foram analisadas.
não existem dados na literatura sobre os aspectos energéticos que envolvem catabolismo lipídico através do ciclo do glioxilato. Neste contexto, a presente pesquisa investigou a relação entre a quantidade de energia produzida no ciclo do glioxilato, com o tamanho da cadeia de ácidos gordos, e comparou a eficiência energética nas células que utilizam esta abordagem, com as células animais sem o ciclo do glioxilato.
Materialand methods
foi realizado um balanço energético de etapas com produção e consumo de energia para obter uma equação que relaciona diretamente o tamanho da cadeia de um ácido gordo com um número de carbono múltiplo de 4, com a energia produzida pela sua degradação. Na equação gerada, o custo energético envolvido na ativação do ácido gordo para acil-CoA não foi contabilizado. É um passo antes da oxidação β e envolve a quebra de duas ligações de fosfato de alta energia.
a equação proposta foi validada comparando a quantidade ATP obtida pela sua aplicação, com as taxas ATP obtidas pela adição da quantidade ATP produzida por fosforilação oxidativa e fosforilação ao nível do substrato em cada etapa das vias metabólicas que participam na degradação dos ácidos gordos envolvendo o ciclo do glioxilato. A degradação dos ácidos gordos envolve a β-oxidação em glioxissomas, ciclo de glioxilato, ciclo de Krebs, parte da gluconeogénese e glicólise, a decarboxilação de piruvato e novamente ciclo de Krebs (Figura 1).
a eficiência energética da degradação dos ácidos gordos que envolve o ciclo do glioxilato foi comparada com o catabolismo dos ácidos gordos nas células animais. Equações previamente validadas foram usadas nesta comparação e a quantidade de energia produzida na β-oxidação como ocorre nos animais foi calculada (Gonçalves, Valduga, & Pereira, 2012), juntamente com equações desenvolvidas em pesquisas atuais. O factor de eficiência energética no ciclo do glioxilato (e%) foi definido pela razão ATP produzida em catabolismo de ácidos gordos, tendo em conta o ciclo do glioxilato e o catabolismo animal. O parâmetro foi traçado contra o número de átomos de carbono de ácido gordo. Além disso, a taxa ATP produzida pela unidade CH2 foi representada em função do número de carbonos da cadeia de ácidos gordos. GrapPad Prism 6.0 gerou os modelos matemáticos que representavam a relação entre as variáveis.
results and discussion
the mitochondrial matrix is the main site where the oxidation of fatty acids occurs in animal cells. No entanto, o catabolismo destas biomoléculas ocorre principalmente nos peroxissomas dos tecidos foliar e nos glioxissomas durante a germinação das sementes das plantas (Buchanan, Gruissem, Vickers, & Jones, 2015). A degradação dos ácidos gordos nos glioxissomas inclui as vias metabólicas indicadas no quadro 1.
paralelamente à produção de energia, a conversão de ácidos gordos em hidratos de carbono tem outras funções, tais como a produção de polissacáridos estruturais e nucleótidos através da Via do fosfato de pentose (Nelson & Cox, 2009). Quanto ao ganho de energia, a forma mais curta e mais energeticamente econômica, provavelmente selecionada pela evolução, inclui a gluconeogênese até o fosfoenolpiruvato (Passo D-3 Na Figura 1), degradado pela via glicolítica.
Amountof de energia (ATP) produzido durante o glyoxysomal degradação de ácidos graxos
quantidade de ATP (x) resultante fromglyoxysomal degradação de ácidos graxos com número de átomos de carbono múltiplo de 4, followedby gliconeogênese até phosphoenolpyruvate e seu catabolismo, para a produção de energia,pode ser calculada pela soma das taxas de ATP produzidas e consumidas na β-oxidação (ATP β-OX), glyoxylate ciclo de ATP (C GLYOX),o ciclo de Krebs (ATP C KREBS), gliconeogênese (ATP OXAL PEP) e a glicólise /ciclo de Krebs novamente (ATP PEP-CO2), de acordo com a Equação (1):

cada quebra da ligação carbono-Carbono Da β-oxidação em glioxissomas e peroxissomas produz um NADH que, fosforilação oxidativa, produz 2,5 ATPs (passo a-3 Na Figura 1). Em peroxissomas, a energia eletrônica removida durante o primeiro passo de β-oxidação é dissipada como calor (stepA-1 na Figura 1).

portanto, não há energia líquida da oxidação FADH2 (Buchanan et al., 2015). Uma vez que o carbono α é esterificado com a coenzima A, A β-oxidação ocorre 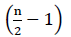 vezes, onde n é o número de carbono na cadeia de ácidos gordos. O ATPs quantidade produzida por β-oxidação em glyoxylate cycleis dada pela Equação (2):
vezes, onde n é o número de carbono na cadeia de ácidos gordos. O ATPs quantidade produzida por β-oxidação em glyoxylate cycleis dada pela Equação (2):

Para cada dois acetil-CoA moleculesdirected para o glyoxylate ciclo, há uma produção líquida de um succinatemolecule, o que corresponde a metade do acetil-CoA quantidade, de modo que n/4succinate moléculas são produzidos. No ciclo de Krebs, o succinato é oxidado a oxaloacetato, produzindo 1 FADH2 e 1 NADH, que produz 4 ATP em fosforilação oxidativa (passos C-6 e C-8, Figura 1). Esse valor multiplicado por n/4succinate moléculas é expresso pela Equação (3), que representa o ATPamount produziu o primeiro no ciclo de Krebs:

A regeneração de oxalacetate inglyoxylate ciclo envolve a oxidação do malato, que produz 1 NADH que yields2.5 ATPs na fosforilação oxidativa (etapa B-5 na Figura 1). Consequentemente, a quantidade de energia (ATP) produzida no ciclo de glioxilato pode ser expressa pela equação(4):

o oxaloacetato em excesso produzido no Krebscycle pode ser direcionado para a gluconeogénese. A fim de produzir energia, a tegluconeogênese ocorre na formação de fosfoenolpiruvato, com 1 GTP gasto (stepD3 na Figura 1), expresso na equação (5). A continuação da gluconeogénese para a formação de metabolitos derivados da hexose é um importante processo de ingestão de sementes (Buchanan et al., 2015; Eastmond & Graham, 2001; Quettier& Eastmond, 2009):

o catabolisminolpiruvato Fosfoenolpiruvato é uma fosforilação ao nível do substrato que produz piruvato (passo e-1,Figura 1), descarboxilação oxidativa do piruvato (passo F-1) com 1 Produção de NADH e oxidação acetil-CoA em CO2. Na oxidação acetil-CoA, a produção de 3 NADH, 1 FADH2 e 1 GTP corresponde a 10 fosfatebonds de alta energia. Este valor acrescentado ao nível do substrato fosforilação e fosforilação oxidativaassociada com a descarboxilação do piruvato gerada pela NADH, totalizando 13,5 ATP (equação 6).

equações de Substituição(2), (3), (4),(5) e (6) na equação (1), a equação (7) é obtida. Quando simplificadagricamente, a equação (8) estabelece uma relação direta entre a quantidade de energia produzida (x) e o tamanho da cadeia de ácidos graxos (n).

Validationof Equação (8) para calcular a energia (ATP) produzido por ácidos acidsdegradation através do glyoxylate ciclo
, de Modo que a Equação (8) pode ser validado,a quantidade de ATP, obtida a partir de sua aplicação, foi comparado com o ATP amountcalculated individualmente a partir da soma de acetil-CoA, NAHD e FADH2 moleculesnumber, e substrato nível de fosforilação, gerados na oxidação offatty ácidos com um número específico de átomos de carbono na glyoxysomes (Tabela 2). Em ambas as condições, os montantes ATP obtidos são equivalentes. Tendo em consideração estes resultados equivalentes, a equação desenvolvida no estudo actual determinou a quantidade de energia produzida em catabolismo lipídico, considerando a integração de vias metabólicas que envolve mais de vinte passos.

além disso, o equilíbrio energético das equações geradores, seguido da sua validação, pode ser uma ferramenta importante para a análise de diferentes vias metabólicas. Em Bioquímica, aspectos como as relações estequiométricas nas vias metabólicas podem ser abordados utilizando os resultados da investigação actual.

de acordo com estudos anteriores, a quantidade de energia nas células animais produzidas em ATP por ácidos gordos degradados com o número de pares de Carbões pode ser algebricamente relacionada com a dimensão da cadeia do fattyacid. Esta relação é expressa pela equação (9) (Gonçalves et al., 2012), que pode ser comparado à equação (8) desenvolvida no estudo atual. As duas consequências podem ser utilizadas para comparar a eficiência energética entre a β-oxidação em células de animais e organismos, onde ocorre o ciclo do glioxilato.

ao dividir a equação (8) pela equação(9) e multiplicando-se por 100, obtém-se a eficiência percentual (e%) da degradaçãode ácidos gordos para produzir energia, em relação ao catabolismo animal, expresso pela equação (10).

a representação gráfica de e% em relação ao comprimento da cadeia de ácidos gordos (Figura 2) verifica que a eficiência diminui com o aumento da cadeia de hidrocarbonetos. Além disso, a energia obtida por oxidação de ácidos gordos em células com ciclo de glioxilato atinge menos de 90% do nível de energia que seria gerado pela via similar em uma célula animal.
ATP produzido por átomo de carbono oxidado (ATP/n) É também dependente da cadeia de comprimento do ácido gordo, a uma taxa máxima próxima de seis ATP/n (Figura 3-a), enquanto que esta taxa é mais elevada nas células animais (Figura 3-b).

Figura 2.
Comparison between energetic efficiency of fatty acid degradation in animal β-oxidation and β-oxidation in organisms withglyoxylate cycle enzymes, due to fatty acid’s length chain.
Contrastingly to animals, vegetables and some microorganisms are able to convert the acetyl-CoA from fatty acids’oxidation into Sugar. Os organismos combinam o ciclo de glioxilato com as acções gluconeogenesis, que são compartimentalizadas entre glioxissomas / peroxissomas,mitocôndrias e citosol. Esta característica dá maior versatilidade metabólica, permitindo que as bactérias utilizem acetato como fonte de energia e plantas para estorelípidos nas sementes como fonte de energia a ser usada durante a germinação.

Figura 3.
ATP rate produced by carbon atom (ATP/n)due to acid fatty’s carbon atoms (n) in glyoxylate cycle (a) and inanimal catabolism (b). A taxa ATP / n aumenta significativamente até cerca de n = 20, a partir de agora a taxa aumenta de forma menos significativa.
Conclusão
A degradação dos ácidos graxos pelo glyoxylate ciclo para a produção de energia envolve a β-oxidação, com as suas características particulares em glyoxysomes, glyoxylate ciclo, o ciclo de Krebs, gliconeogênese e a glicólise. Apesar destas etapas e vias metabólicas, pode estabelecer-se em termos algébricos uma relação estequiométrica entre o comprimento da cadeia dos ácidos gordos e a quantidade de energia produzida na sua degradação.
a comparação entre a estequiometria energética envolvida nestas vias metabólicas e a estequiometria energética Da β-oxidação, como ocorre nas células animais, mostra uma redução na eficiência energética, quando comparada com o metabolismo animal. Enquanto o bypass das reações de descarboxilação do ciclo Krebs confere adaptações evolutivas aos organismos quando presente, ele também determina uma menor quantidade de energia gerada por átomo de carbono quando comparado com a degradação dos ácidos graxos nos animais.