autorzy: Brit Long, MD (@long_brit, Saushec em lekarz prowadzący) i Justin R. Warix, DO, FAAEM (em lekarz prowadzący, Central Peninsula Hospital, Soldotna, AK) // Edited by: Alex Koyfman, MD (@EMHighAK, em lekarz prowadzący, UT Southwestern Medical Center
witamy ponownie w emDocs cases! Dzisiaj mamy oparte na przypadku dyskusje na główny temat EM, z spojrzenie na pewne kontrowersje i najnowocześniejszych metod leczenia.
—————————-
62-letnia kobieta z historią choroby nerek na dializie, nadciśnieniu i CAD prezentuje nudności i osłabienie. Opuściła dzisiejszą sesję dializy. Jej VS są normalne, i jej badanie jest również normalne. Jaki jest twój pierwszy test, który otrzymujesz?
- EKG!
- jaka jest literatura tego schematu? Czy jest coś lepszego?
- zanim zaczniemy, omówmy kilka podstaw.
- Postępowanie
- 1) stabilizacja błony serca
- 2) przesunięcie przezskórne
- leczenie skojarzone
- 3) wydalanie potasu
- co się dzieje w przypadku zatrzymania krążenia z powodu hiperkaliemii?
- kluczowe punkty
- Referencje / Czytaj dalej:
EKG!
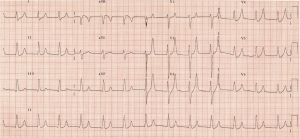
widać duże, szczytowe fale T z brakiem fal P. VBG powraca z potasem 7,3 mmol/l, z sodem 140 mmol / l i prawidłowym mleczanem. Prosisz o standardowy schemat hiperkalemii lub kroplę C BIG K – Zobacz Więcej z https://canadiem.org/tiny-tip-hyperkalemia-management/
ten schemat klasycznie składa się z wapnia (glukonian lub sól chlorkowa), beta-agonisty (10-20 mg albuterolu w nebulizacji) i/lub wodorowęglanu (1 amp), insuliny (10 jednostek regularnych/glukoza D50 1 amp), Kajeksalanu (15-30 g doustnie lub doodbytniczo), diuretyków (Furosemid 40 mg) i jednostek nerkowych do dializy pacjenta.
jaka jest literatura tego schematu? Czy jest coś lepszego?
zanim zaczniemy, omówmy kilka podstaw.
– większość potasu jest wewnątrzkomórkowa (98%), z czego 75% znajduje się w mięśniach szkieletowych. Istotny gradient pomiędzy środowiskiem wewnątrzkomórkowym i zewnątrzkomórkowym odgrywa istotną rolę w generowaniu potencjału komórkowego.1-5
– zmiany w tych poziomach wpływają na potencjał błon komórkowych i powodują objawy sercowe i nerwowo-mięśniowe. Pompa Na-K-ATPazy odgrywa dużą rolę w gradiencie błony komórkowej.
– łagodna hiperkaliemia: 5,5-6,5 mEq / l (blisko 10% przyjętych pacjentów).4-7
– umiarkowane poziomy wynoszą 6,5-7,5 mEq/L, a ciężkie > 7,5 mEq/L. 4-7
etiologia: przyczyny podwyższonego stężenia potasu obejmują: excessive exogenous potassium, excessive endogenous potassium (hemolysis, rhabdomyolysis, burns, tumor lysis syndrome, trauma), redistribution (acidemia, medications (succinylcholine, beta-blockers), and insulin deficiency), decrease in excretion (renal failure/injury, decreased mineral corticoids, medications), factitious (hemolysis, thrombocytosis, venipuncture issue, leukocytosis).5-8
Clinical Manifestations: Since potassium plays an important role in Na-K-ATPase physiology, hyperkalemia can result in several important effects, primarily cardiac and neuromuscular. Jednak cechy kliniczne są niespecyficzne i obejmują ogólne osłabienie, letarg lub splątanie. Głębokie odruchy ścięgien mogą być przygnębione lub nieobecne, choć nerwy czaszkowe, funkcja przepony i uczucie są zazwyczaj normalne. Efekty GI obejmują nudności, wymioty i biegunkę.
– EKG jest jednym z najważniejszych badań diagnostycznych w hiperkaliemii. Przewidywane zmiany są klasycznie uważane za następujące: 1) szczytowe fale T, 2) wydłużenie odstępu PR z utratą fali p, 3) poszerzenie QRS, 4) wzór fali sinusoidalnej i 6) asystolia. Szczytowe fale T są wynikiem zmian potencjału błony spoczynkowej.9-12
– te zmiany nie pojawiają się jednak w kolejności. Dodge i in. wykryte pacjenci mogą przejść od rytmu zatokowego do migotania V.13 EKG wykazuje czułość 34-43% w przewidywaniu hiperkaliemii, ze swoistością 85-86%.12, 14
– powolne zmiany stężenia potasu w surowicy mogą nie powodować zmian w zapisie EKG, a stężenia powyżej 9, 0 mEq/l mogą nie wykazywać spodziewanych wyników.12,15
u naszego pacjenta stwierdzono osłabienie i zmiany w EKG. Poprosiłeś o kilka leków i zacznijmy nasze głębokie nurkowanie w leczeniu hiperkalemii.
Postępowanie
– leczenie nie zależy od przyczyny hiperkaliemii, ale musi skupić się na odwróceniu lub uniknięciu efektów dysrytmicznych i powikłań.
– leczenie koncentruje się na stabilizacji serca, transcellular shift i wydalaniu potasu. Należy to rozpocząć natychmiast, gdy podejrzewa się hiperkaliemię, albo przez zmiany w EKG (w tym szczytowe fale T) lub przez potas > 6,5 mmol/l. 4,5,10,11,16

1) stabilizacja błony serca
wapń zmniejsza efekt depolaryzacji hiperkaliemii i zmniejsza potencjał progowy miocytów serca w ciągu kilku minut.4,5,17-19 stabilizuje to błonę komórkową serca, ale nie powoduje przesunięcia przez komórki ani wydalania potasu, co wymaga innych leków.
– wapń można podawać w dwóch postaciach: sól chlorkowa lub glukonianowa. Sól chlorku Ca zawiera 13,6 meq w 10 mL, natomiast sól glukonianu Ca zawiera 4,6 meq w 10 mL.Glukonian 4,5,18,19 Ca można podawać przez obwodową linię IV. Wynaczynienie chlorku Ca może powodować martwicę tkanek, a jeśli to możliwe, zaleca się wprowadzenie linii środkowej (chyba że sytuacja kodowa.) 4,5
– CaCl 1 g zawiera około 270 mg Ca2+, podczas gdy 3 ampułki glukonianu wapnia zawierają równoważną ilość (około 90 mg Ca2+ na ampułkę).18, 19
– Literatura sugeruje, że glukonian Ca ma podobny czas powstania jak chlorek Ca i może nie wymagać aktywności wątroby. W kilku badaniach przeprowadzonych u pacjentów po przeszczepieniu wątroby wykazano podobne zwiększenie stężenia Ca po każdym z tych leków.19-21 badanie przeprowadzone na psach i u dzieci wykazuje podobne wyniki.
– początek działania jest krótszy niż 3 minuty, a czas trwania 20-60 minut.4,5
Podsumowując: pacjentom z wynikami EKG (szczytowe fale T lub gorsze) należy podać 1 g (10 mL) glukonianu Ca IV, z ponowną oceną w ciągu 5 minut. W przypadku braku zmian lub pogorszenia EKG należy podać więcej wapnia. Pacjentowi z zatrzymaniem krążenia lub z dostępem centralnym należy podać 1 g chlorku Ca IV.
czy istnieje inna opcja stabilizacji serca? Hipertoniczny roztwór soli fizjologicznej (3%) można stosować w bolusach 100 ml, chociaż badano go głównie u pacjentów z hiponatremią i hiperkaliemią.
2) przesunięcie przezskórne
powinno to nastąpić wraz z wapniem lub bezpośrednio po nim w celu redystrybucji potasu.4,5,23-25

a) insulina i glukoza-środki te zmniejszają stężenie potasu w surowicy w sposób zależny od dawki.4,5,23-26 Aktywacja Na-K-ATPazy i wewnątrzkomórkowa Rekrutacja pompy (receptory GLUT4) do błony komórkowej są odpowiedzialne za transport K wewnątrzkomórkowy.
– zazwyczaj podaje się insulinę regularną 10-20 jednostek, z dekstrozą 25 g (jeden amp D50), jeśli stężenie glukozy we krwi jest mniejsze niż 250 mg / dL.4, 5, 28, 29
– insulina i glukoza zmniejszają potas o 0, 45-0, 61 mmol/l w ciągu 15 minut, 30-32 0.87 mmol/L po 30 minutach,33,34 i 0, 47 mmol/L po jednej godzinie.23, 24, 33, 34 inne badania sugerują, że może to spowodować zmniejszenie dawki do 1, 2 mmol/l. 23,24
– insulina / glukoza ma początek działania mniej niż 15 minut (częściej 5-10 minut), a czas maksymalnego działania 25-30 minut.23,24 czas działania wynosi 2 godziny.
– ryzyko obejmuje hipoglikemię, która jest często niedoceniana. Wskaźnik ten osiąga 8, 7% po podaniu 10 jednostek insuliny zwykłej.W badaniu z udziałem pacjentów ze schyłkową niewydolnością nerek u pacjentów poddawanych hemodializie wskaźnik ten wynosił 13%, natomiast u pacjentów poddawanych hemodializie po 60 minutach wynosił 75%.Przegląd systematyczny sugeruje 18%.
– czynniki obejmują brak wcześniejszej cukrzycy, brak leków na cukrzycę i niższy poziom glukozy przed leczeniem. Uszkodzenie nerek lub choroba jest potencjalnym czynnikiem, ponieważ insulina jest metabolizowana przez nerki.
– potencjalną zmianą jest stosowanie krótko działających insulin, takich jak lispro lub aspart, które charakteryzują się krótszym okresem półtrwania, są szybciej wchłaniane i nie wydłużają się w przypadku niewydolności nerek lub urazu. Można go podać w postaci krótkodziałającego bolusu insulinowego zawierającego tylko 10 jednostek lub 6 jednostek bolusu, a następnie 20 jednostek na godzinę wlewu leku lispro lub aspart. Schematy te zapewniają podobne zmniejszenie stężenia potasu w surowicy, a jednocześnie powodują mniejszą hipoglikemię.4,5
– nie zaleca się stosowania wyłącznie glukozy, co może powodować hipertoniczność i hiperkaliemię.37,38
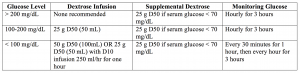
Podsumowując: insulina krótko działająca 10 jednostek IV, z wlewem glukozy jak powyżej.

B) agoniści Beta-Katecholaminy zwiększają aktywność pompy na-K-ATPazy i kotransportera na-K-2CL.1-5,39,40
– Nebulizowany albuterol podaje się w dawkach 10-20 mg, a nie w normalnych 5 mg w przypadku choroby obturacyjnej.
– Lewalbuterol i albuterol wykazują jednakową zdolność do zmniejszania potasu.4,5,23,24
-Albuterol można podawać dożylnie w dawkach 0,50 mg, a terbutalinę można podawać IM w dawkach 0,25 mg. 4,5,23,24,31,41-43
– potas zmniejsza się o 0, 6 mmol/L po dawce 10 mg i o 1, 0 mmol/L po dawce 20 mg po godzinie.31,41-43
– początek jest 20-30 minut, z trwaniem ponad dwie godziny.31,41-43
– preparaty IV obejmują epinefrynę, albuterol 0,5 mg lub salbutamol 2,5 mg, chociaż działania niepożądane są bardziej powszechne.23,24,34
– działania niepożądane obejmują drżenie, kołatanie serca i niepokój. Formy IV mają większe ryzyko podwyższonego ciśnienia krwi i bólu głowy.
– leczenie skojarzone z insuliną i glukozą powoduje jeszcze większe zmniejszenie stężenia potasu, 1.2-1, 5 mmol / l w godzinę po podaniu leku.31,41-43
Podsumowując: Albuterol 20 mg w 4 mL roztworu soli fizjologicznej nebulizowany przez 10 minut.

C) wodorowęglan sodu-w bolusie zalecano stosowanie wodorowęglanu sodu w ostrym leczeniu hiperkaliemii, na podstawie badań oceniających przedłużony wlew wodorowęglanu (w ciągu kilku godzin).23,24,31,32,44-46
– jednak Literatura u pacjentów z prawidłowym pH nie wspiera wodorowęglanów w hiperkaliemii.4,5,23,24
– w porównaniu z innymi lekami wodorowęglan nie powoduje znacznego zmniejszenia stężenia potasu po 30 i 60 minutach.W kilku kontrolowanych badaniach wykazano, że wodorowęglan sodu nie zmniejsza stężenia potasu w ciągu 60 minut.4,5,23,24 badania, które sugerują zmniejszenie wykorzystywane wlewu wodorowęglanu w ciągu godzin (zamiast bolus) oraz u pacjentów z kwasemią.47,48
leczenie skojarzone
– zastosowanie wielu środków zapewnia najlepsze sposoby redystrybucji potasu, a przegląd Cochrane zaleca jednoczesne stosowanie insuliny, glukozy i agonistów receptorów beta.4,5,23-26
– Allon et al. stwierdza maksymalny spadek potasu o 1,21 mmol / l z dożylną insuliną glukozą z nebulizowanym albuterolem.– 8984>
– nie należy stosować wodorowęglanów, chyba że u pacjenta występuje kwasowość.4,5
Podsumowując: wodorowęglan sodu może być stosowany u pacjentów z kwasemią i hiperkaliemią, ale nie jest przydatny u innych pacjentów. Leczenie skojarzone jest skuteczne z beta-agonistą i insuliną / glukozą w przemianie potasu.
stężenie glukozy u pacjenta wynosi 153. Podaje się glukonian wapnia 10% 10 mL dożylnie, a następnie 10 jednostek krótko działającej insuliny z jednym amp D50 i 20 mg albuterolu w nebulizacji. Jaki jest twój następny krok?
3) wydalanie potasu
sposoby wydalania obejmują mocz, układ pokarmowy i krew.Główną drogą wydalania jest 1-5 nerek. Lekarze powinni ocenić objętość pacjenta i zdolność do wytwarzania moczu. Jeśli pacjent może produkować mocz, środek moczopędny jest ważną opcją.4,5 jednak hemodializa jest najlepszym sposobem ostatecznego usunięcia potasu.

a) diureza moczowa – może być stosowana podczas przygotowywania pacjenta do hemodializy. Diureza moczowa nie jest pomocna, jeśli pacjent nie może wytwarzać moczu, choć może być pomocna u pacjentów z umiarkowanym zaburzeniem czynności nerek.4,5
– diuretyki pętlowe, takie jak furosemid, zapewniają największe wydalanie potasu z moczem.
– jednoczesne stosowanie z acetazolamidem może dodatkowo zwiększyć wydalanie potasu, chociaż nie zaleca się stosowania tego samego leku.
– leki te są najlepsze u pacjentów z hiperwolemią lub euvolemią. Jeśli tak się stanie, lekarz powinien dokładnie monitorować wydalanie moczu i elektrolitów.

B) GI-dostępnych jest kilka opcji, z kilkoma nowymi agentami oferującymi lepsze opcje niż Kayexalate.
– Polistyrenosulfonian sodu (SPS) lub Kayexalate, jest żywicą jonowymienną, która wymienia sód na Amon, wapń, magnez i potas, aby umożliwić eliminację potasu przez kał.4,5,23-26 niestety Literatura stojąca za SPS jest bardzo słaba, a ostatnie badania i recenzje Cochrane zalecają jej stosowanie.50,51 lek ten zapewnia ładunek sodu, jednocześnie narażając pacjenta na ryzyko zaparć, niedrożności, a co gorsza, niedokrwienia jelit i martwicy. Lek posiada nawet ostrzeżenie z czarnej skrzynki od FDA.4,5,23,24,52 więcej na http://www.emdocs.net/skeptical-em-myths-evidence/ i http://rebelem.com/kayexalate-useful-treatment-hyperkalemia-emergency-department/
– Patiromer to syntetyczny polimer składający się z niewchłanialnych kulek sferycznych.Początek działania leku wynosi 7-48 godzin, a czas działania 12-24 godzin. U 52-54 zdrowych ochotników wykazano zależne od dawki zmniejszenie stężenia potasu o 15-20 mmol.55-57 dawek 15-30 g/dzień wydaje się skuteczne. Najczęstszym działaniem niepożądanym jest hipomagnezemia (8,6%), chociaż u tych pacjentów nie stwierdzono zaburzeń rytmu serca. Warto zauważyć, że lek posiada ostrzeżenie o czarnej skrzynce dla oddzielenia co najmniej sześciu godzin od innych leków doustnych.4
– Cyklokrzemian cyrkonu sodu (ZS-9) jest syntetycznym polimerem składającym się z nie wchłanialnych kulek sferycznych.53,54 lek wiąże ponad dziewięciokrotną ilość potasu w porównaniu z SPS, ponieważ jeden porów wiążących w strukturze krystalicznej wiąże się specyficznie z potasem.Początek działania ZS-9 wynosi 1-6 godzin, a czas działania 4-12 godzin. Kilka badań potwierdza jego stosowanie, przy czym 10 g/dzień zmniejsza potas o 0,4 mmol/l w ciągu jednej godziny i 0,7 mmol/l w ciągu 4 godzin.58-60
– metaanaliza porównywała patiromer i ZS-9, stwierdzając, że patiromer zmniejsza potas o 0, 36 mEq/l w 3. dniu leczenia.61 ZS-9 wykazuje spadek o 0,17 mEq/L w ciągu jednej godziny i 0,67 mEq / l w ciągu 2 dni.61

C) Dializa-jest to najbardziej skuteczny sposób usuwania potasu, przy czym potas zmniejsza się o 1 mmol/l w ciągu 1 godziny i 2 mmol / l w ciągu 2-3 godzin. Zmniejszenie dializatu potasu i zwiększenie przepływu krwi może spowodować szybsze zmniejszenie stężenia potasu w surowicy.4,5
– zwiększenie prędkości pompy krwi maszynowej i stężenia dializy w osoczu może zmniejszyć stężenie potasu w ciągu kilku minut; stąd znaczenie dializy (zwłaszcza w przypadku zatrzymania krążenia).4,5,41
– po dializie można zaobserwować hiperkaliemię z odbicia, prawdopodobnie związaną z poziomem potasu przeddializą.4, 5
: Dializa jest najbardziej skuteczna w ostatecznym usuwaniu potasu. SPS nie jest skuteczny i należy go unikać ze względu na ryzyko martwicy jelita grubego.
dzwonisz do nefrologa w sprawie dializy i powtarzasz EKG, które pokazuje prawidłowy rytm zatokowy z szybkością 72 uderzeń na minutę. Nefrolog twierdzi, że zaraz przyjdzie do pacjenta.
co się dzieje w przypadku zatrzymania krążenia z powodu hiperkaliemii?
hiperkaliemia zmienia potencjał spoczynkowy kardiomiocytów, powodując inaktywację kanałów sodowych i blokując przewodzenie. Pacjenci w areszcie z powodu hiperkaliemii wymagają natychmiastowych ucisków i środków ACLS.28, 29
– pacjenci z zatrzymaniem krążenia ze stwierdzoną niewydolnością nerek w wywiadzie, chorobą krytyczną lub poddawani hemodializie wymagają szybkiej analizy gazowej we krwi, mierzącej stężenie potasu.
– podejrzenie hiperkaliemii, ponieważ etiologia wymaga chlorku wapnia 10% (1 amp lub 10 mL), z powtarzanym dawkowaniem do QRS < 100 ms, przez obwodową linię IV lub centralną.28,29
– należy podać epinefrynę, a także insulinę i glukozę.
– wodorowęglan sodu może być dostarczony jako 1 amp.
– ROSC może wystąpić po stabilizacji błony chlorku wapnia, która trwa 20-30 minut. W tym momencie celem jest przesunięcie wewnątrzkomórkowe i eliminacja.4,5,28,29,65
kluczowe punkty
– potas odgrywa kluczową rolę w fizjologii i jest głównie wykrywany wewnątrzkomórkowo. Hiperkaliemia powoduje zmiany w potencjale błony komórkowej, głównie w komórkach serca i nerwowo-mięśniowych.
– EKG jest pierwszym istotnym testem, ale brak wyników nie może być podstawą do wykluczenia hiperkaliemii.
– leczenie obejmuje stabilizację błony serca, przesunięcie przezskórne i wydalanie.
– glukonian wapnia 10% można podać w celu stabilizacji błony, chyba że u pacjenta występuje zatrzymanie akcji serca, w którym należy podać 10 mL chlorku wapnia.
– agoniści Beta i krótko działająca insulina z glukozą skutecznie zmieniają potas wewnątrzkomórkowo. Na podstawie stężenia glukozy w surowicy krwi należy podać infuzję dekstrozy.
– nie zaleca się stosowania wodorowęglanu sodu, chyba że u pacjenta występuje kwasowość.
– wydalanie obejmuje diurezę z moczem, eliminację przewodu pokarmowego i hemodializę.
Referencje / Czytaj dalej:
- Faridi AB, Weisberg LS. Zaburzenia kwasowo-zasadowe, elektrolitowe i metaboliczne. W: Medycyna krytycznej opieki: zasady diagnostyki i postępowania u dorosłych. Parrillo JE, Dellinger RP (Eds). Trzecia Edycja. Philadelphia, Elsevier, 2008;1203-1243.
- Mount DB, Zandi-Nejad K. zaburzenia równowagi potasowej. W: Brenner and Rector ’ s the Kidney, 9th Ed, WB Saunders & Company, Philadelphia 2011. S. 640.
- brązowy Homeostaza potasu i implikacje kliniczne. Am J Med.1984 Nov 5;77(5A):3-10.
- Weisberg LS. Postępowanie w ciężkiej hiperkaliemii. Crit Care Med. 2008;36(12):3246-51.
- Gennari FJ: zaburzenia homeostazy potasu. Hipokaliemia i hiperkaliemia. Crit Care Clin 2002;18:273-288
- Stevens MS, Dunlay RW. Hiperkaliemia u pacjentów hospitalizowanych. Int Urol Nephrol 2000; 32: 177-180.
- Mandal AK. Hipokaliemia i hiperkaliemia. Med Clin North Am. 1997;81(3):611-639.
- Fisch C. związek zaburzeń elektrolitowych z arytmią serca. Obieg 1973; 47: 408-419.
- Surawicz B. elektrolity i elektrokardiogram. Postgrad Med 1974; 55:123–129.
- Freeman K, Feldman JA, Mitchell P, et al. Wpływ prezentacji i elektrokardiogramu na czas leczenia hiperkaliemii. Acad Emerg Med. 2008 Mar;15(3):239-49.
- Mattu a, Brady WJ, Robinson D. Electrocardiographic manifestations of hyperkalemia. Am J Emerg Med. 2000; 18: 721–729.
- Dodge HT, Grant RP, Seavey PW. Wpływ indukowanej hiperkaliemii na prawidłowy i nieprawidłowy elektrokardiogram. Am Heart J. 1953 May;45(5):725-40.
- Wrenn KD, Slovis CM, Slovis BS. Zdolność lekarzy do przewidywania hiperkaliemii z EKG. Ann Emerg Med. 1991 Nov;20(11):1229-32.
- Szerlip HM, Weiss J, Singer I. głęboka hiperkaliemia bez objawów elektrokardiograficznych. Am J Nerka Dis. 1986 Jun;7 (6): 461-5.
- Montague BT, Ouellette JR, Buller GK. Retrospektywny przegląd częstości zmian EKG w Hiperkalemii. Clinical Journal of the American Society of Nephrology: CJASN. 2008;3(2):324-330.
- Chamberlain M. awaryjne leczenie hiperkaliemii. Lancet. 1964;1:464–467.
- Bisogno JL, Langley A, Von Dreele mm. Wpływ wapnia na odwrócenie elektrokardiograficznego wpływu hiperkaliemii w izolowanym sercu szczura: prospektywne badanie zależności dawki od odpowiedzi. Crit Care Med 1994; 22: 697-704.
- Martin T, Kang y, Robertson K, et al. Jonizacja i hemodynamiczne działanie chlorku wapnia i glukonianu wapnia przy braku czynności wątroby. Anestezjologia 1990; 73: 62-5.
- Davey M, Caldicott D. sole wapnia w leczeniu hiperkaliemii. Emergency Medicine Journal: EMJ. 2002;19(1):92-93.
- Chlorek wapnia a glukonian wapnia: porównanie efektów jonizacji i układu krążenia u dzieci i psów. Anestezjologia 1987;66: 465-70.
- Ballantyne F III, Davis LD, Reynolds Ew Jr, et al. Komórkowe podstawy odwrócenia hiperkalemicznych zmian elektrokardiograficznych przez sód. Am J Physiol 1975; 229: 935-940.
- Batterink J, Cessford TA, Taylor RAI. Interwencje farmakologiczne w ostrym leczeniu hiperkaliemii u dorosłych. Cochrane Database of Systematic Reviews 2015, Issue 10. Art. Nie.: CD010344 DOI: 10.1002 / 14651858.CD010344. pub2.
- Mahoney BA, Smith WA, Lo DS, et al. Interwencje Nadzwyczajne w hiperkaliemii. Cochrane Database Syst Rev. 2005 Apr 18; (2): CD003235.
- Elliott MJ, Ronksley PE, Clase CM, et al. Postępowanie u pacjentów z ostrą hiperkaliemią. 2010;182:1631–1635.
- Harel Z, Kamel ks. Optymalna dawka i sposób podawania dożylnego insuliny w leczeniu hiperkaliemii awaryjnej: przegląd systematyczny. Barretti P, ed. PLoS 1. 2016; 11(5):e0154963.
- Ho K. krytycznie szybka odpowiedź: stymulowany insuliną transport potasu i glukozy w mięśniach szkieletowych. Clin J Am Soc Nephrol. 2011;6:1513–1516.
- Soar J, Perkins GD, Abbas G, et al. European Resuscitation Council Guidelines for Resuscitation 2010 Section 8. Zatrzymanie akcji serca w szczególnych okolicznościach: zaburzenia elektrolitowe, zatrucie, utonięcie, przypadkowa hipotermia, hipertermia, astma, anafilaksja, kardiochirurgia, uraz, ciąża, porażenie prądem. Reanimacja. 2010;81:1400–1433.
- Vanden Hoek TL, Morrison LJ, Shuster m, et al. Część 12: zatrzymanie krążenia w szczególnych sytuacjach: wytyczne American Heart Association z 2010 r.dotyczące resuscytacji krążeniowo-oddechowej i awaryjnej opieki sercowo-naczyniowej. Krążenie. 2010;122 (suppl 3): S829-S861.
- Li Q, Zhou MT, Wang Y, et al. Wpływ insuliny na hiperkaliemię w anhepatycznym Stadium transplantacji wątroby. World J 2004;10: 2427-9.
- Allon m, Copkney C. Albuterol i insulina do leczenia hiperkaliemii u pacjentów hemodializowanych. Nerka Int 1990;38 (5): 869-72.
- Allon M, Shanklin N. Wpływ podawania wodorowęglanów na stężenie potasu w osoczu u pacjentów dializowanych: interakcje z insuliną i albuterolem. Am J. Dis 1996; 28: 508-14.
- Mahajan SK, Mangla M, Kishore K. Porównanie wlewów aminofiliny i insuliny-dekstrozy w ostrej terapii hiperkaliemii w schyłkowej fazie choroby nerek J Assoc India 2001; 49:1082-5.
- Ngugi NN, McLigeyo SO, Kayima JK. Leczenie hiperkaliemii przez zmianę gradientu transcellular u pacjentów z niewydolnością nerek: wpływ różnych terapeutycznych East Afr Med J 1997;74: 503-9.
- Schafers S, Naunheim R, Vijayan A, et al. Częstość występowania hipoglikemii po insulinowej ostrej stabilizacji leczenia hiperkaliemii. J Hosp Med. 2012;7(3):239-242.
- Apel J, Reutrakul S, Baldwin D. Hipoglikemia w leczeniu hiperkaliemii insuliną u pacjentów ze schyłkową chorobą nerek. Clin Kidney J. 2014;7(3):248-250.
- Goldfarb S, Cox M, Singer I, et al. Ostra hiperkaliemia wywołana hiperglikemią: mechanizmy hormonalne. Ann Intern Med. 1976;84:426–432.
- Palmer BF. Regulacja homeostazy potasu. Clin J Am Soc Nephrol. 2015;10:1050–1060.
- Clausen T, Everts ME. Regulacja Na, K-pompy w mięśniach szkieletowych. Nerka Int 1989; 35:1-13.
- Moratinos J, Reverte M. Wpływ katecholamin na stężenie potasu w osoczu: rola alfa-i beta-adrenoceptorów. Fundam Clin Pharmacol. 1993;7(3-4):143-53.
- Allon M. hiperkaliemia w schyłkowej fazie choroby nerek: mechanizmy i postępowanie. J Am Soc Nefrol 1995; 6: 1134.
- Allon m, Dunlay R, Copkney C. Nebulizowany albuterol w ostrej hiperkaliemii u pacjentów hemodializowanych. Ann Intern Med. 1989;110:426-9.
- Allon M, Shanklin N. wpływ leczenia albuterolem na późniejsze usuwanie potasu dialytowego. Am J. Dis 1995;26: 607-13.
- Blumberg a, Weidmann P, Shaw S, et al. Wpływ różnych metod terapeutycznych na stężenie potasu w osoczu i główne czynniki regulujące w końcowej niewydolności nerek. American Journal of Medicine. 1988;85(4):507–12.
- Iqbal Z, Friedman EA. Preferredtherapy hiperkaliemii w niewydolności nerek: badanie nefrologii szkolenia-program N Engl J Med. 1989 Jan 5; 320 (1): 60-1.
- Blumberg a, Weidmann P, Ferrari P. wpływ długotrwałego podawania wodorowęglanów na stężenie potasu w osoczu w końcowej niewydolności nerek. Nerka Int. 1992;41:369–374.
- Fraley DS, Adler S. Korekcja hiperkaliemii przez wodorowęglan pomimo stałego pH krwi.nerki Int. 1977 Nov; 12 (5): 354-60.
- Gutierrez R, Schlessinger F, Oster JR, et al. Wpływ hipertonicznego kontra izotonicznego wodorowęglanu sodu na stężenie potasu w osoczu u pacjentów ze schyłkową niewydolnością nerek. Górnik Elektrolit Metab. 1991;17(5):297-302.
- Jentzer JC, DeWald TA, Hernandez AF. Skojarzenie leków moczopędnych pętlowych z tiazydowymi lekami moczopędnymi w niewydolności serca. J Am Coll Cardiol. 2010 Nov 2;56(19):1527-34.
- Scherr L, Ogden DA, Mead AW, et al. Postępowanie z hiperkaliemią żywicą kationowymienną. N Engl J Med 1961; 264: 115-119.
- Flinn RB, Merrill JP, Welzant WR, et al. Leczenie pacjenta oligurowego nową żywicą sodową i sorbitolem; raport wstępny. N Engl J Med. 1961 Jan 19; 264: 111-5.
- Sterns RH, Rojas M, Bernstein P, et al. Żywice jonowymienne do leczenia hiperkaliemii: czy są bezpieczne i skuteczne? J Am Soc Nephrol. 2010 May; 21 (5): 733-5.
- Beccari MV, Meaney CJ. Użyteczność kliniczna patiromer, cyklokrzemian sodu cyrkonu i polistyrenosulfonian sodu do leczenia hiperkalemii: przegląd oparty na dowodach. Podstawowe Dowody. 2017;12:11-24.
- Weir MA, Juurlink DN, Gomes T, et al. Beta-blokery, trimetoprim sulfametoksazol i ryzyko hiperkaliemii wymagającej hospitalizacji u osób starszych: zagnieżdżone badanie kontrolne przypadku. Clin J Am Soc Nephrol. 2010;5:1544–1551.
- Huang I. RLY5016: nowy, nieabsorbowany, terapeutyczny polimer do kontroli stężenia potasu w surowicy. J Am Soc Nephrol. 2010;21:482A–483A.
- Bakris GL, Pitt B, Weir MR, et al, for the Amethyst-DN Investigators. Wpływ produktu patiromer na stężenie potasu w surowicy u pacjentów z hiperkaliemią i cukrzycową chorobą nerek: randomizowane badanie kliniczne AMETHYST-DN. JAMA. 2015;314:151–161.
- Montaperto AG, Gandhi MA, Gashlin LZ, et al. Patiromer: przegląd kliniczny. Curr Med Res Opin. 2016;32(1):155-64.
- Packham DK, Kosiborod M. Farmakodynamika i farmakokinetyka cyklokrzemianu cyrkonu sodu w leczeniu hiperkaliemii. Ekspert Opin Lek Metab Toxicol. 2016 May;12(5):567-73.
- Ash SR, Singh B, Lavin PT, et al. Badanie fazy 2 dotyczące leczenia hiperkaliemii u pacjentów z przewlekłą chorobą nerek sugeruje, że selektywna pułapka potasu, ZS-9, jest bezpieczna i skuteczna. Nerka Int. 2015;88:404–411.
- Packham DK, Rasmussen HS, Lavin PT, et al. Cyklokrzemian sodu cyrkonu w hiperkaliemii. N Engl J Med. 2015;372:222–231.
- Meaney CJ, Beccari MV, Yang Y, et al. Przegląd systematyczny i metaanaliza Patiromeru i Cyklokrzemianu cyrkonu sodu: nowe zbrojenie do leczenia hiperkaliemii. 2017 Apr;37(4):401-411.
- Blumberg a, Roser HW, Zehnder C, et al. Stężenie potasu w osoczu u pacjentów z nieuleczalną niewydolnością nerek podczas i po hemodializie; związek z usuwaniem potasu dialitycznego i potasu całkowitego w organizmie. Przeszczep Nefrolu. 1997;12:1629–1634.
- Feig P, A, R. Wpływ usuwania potasu podczas hemodializy na stężenie potasu w osoczu. Nefron. 1981;27:25–30.
- Agar BU, Culleton BF, Fluck R, Leypoldt JK. Kinetyka potasu podczas hemodializy. Hemodial Int. 2015;19:23–32.
- Alfonzo AV, Simpson K, Deighan C, Campbell S, Fox J. Modifications to advanced life support in renal failure. Resuscitation 2007;73:12–28.