autori: Brit lung, MD (@long_brit, SAUSHEC EM Medic curant) și Justin R. Warix, do, FAAEM (EM Medic curant, Spitalul Peninsula Central, Soldotna, Ak) // editat de: Alex Koyfman, MD (@EMHighAK, EM Medic curant, UT Southwestern Medical Center / parkland Memorial Hospital)
Bine ați revenit la cazurile emdocs! Astăzi avem discuții bazate pe caz pe un subiect de bază EM, cu o privire la unele controverse și tratamente de ultimă oră.
—————————-
o femeie în vârstă de 62 de ani cu antecedente de boală renală la dializă, hipertensiune arterială și CAD prezintă greață și slăbiciune. A lipsit de la ședința de dializă de azi. VS Ei sunt normale, iar examenul ei este, de asemenea, normal. Care este primul test pe care îl obțineți?
- ECG!
- care este literatura din spatele acestui regim? Există ceva mai bun?
- înainte de a începe, să acoperim câteva elemente de bază.
- Management
- 1) stabilizarea membranei cardiace
- 2) deplasarea Transcelulară
- tratament combinat
- 3) excreția de potasiu
- ce se întâmplă în stop cardiac din cauza hiperkaliemiei?
- puncte cheie
- referințe / lecturi suplimentare:
ECG!
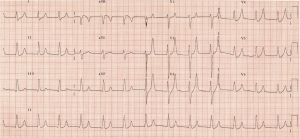
vedeți valuri T mari, cu vârf, cu absența undelor P. VBG revine cu potasiu de 7,3 mmol/L, cu sodiu 140 mmol / L și lactat normal. Cereți regimul standard de hiperkaliemie sau C BIG K DROP-vedeți mai multe de la https://canadiem.org/tiny-tip-hyperkalemia-management/
acest regim constă clasic din calciu (gluconat sau sare de clorură), beta agonist (10-20 mg albuterol nebulizat) și / sau bicarbonat (1 amp), insulină (10 unități regulate / glucoză D50 1 amp), Kayexalat (15-30 g oral sau rectal), diuretice (Furosemid 40 mg) și unitate renală pentru dializa pacientului.
care este literatura din spatele acestui regim? Există ceva mai bun?
înainte de a începe, să acoperim câteva elemente de bază.
– majoritatea potasiului este intracelular (98%), cu 75% găsit în mușchii scheletici. Un gradient semnificativ între mediul intracelular și extracelular joacă un rol vital în generarea potențialelor de acțiune celulară.1-5
– modificările acestor niveluri afectează potențialul membranei celulare și duc la simptome cardiace și neuromusculare. Pompa Na-K-ATPase joacă un rol important în gradientul membranei celulare.
– hiperkaliemie ușoară: 5,5-6,5 mEq/L (aproape 10% dintre pacienții admiși).4-7
– nivelurile Moderate sunt de 6,5-7,5 mEq/ L și severe > 7,5 mEq / L. 4-7
etiologie: cauzele potasiului crescut includ: excessive exogenous potassium, excessive endogenous potassium (hemolysis, rhabdomyolysis, burns, tumor lysis syndrome, trauma), redistribution (acidemia, medications (succinylcholine, beta-blockers), and insulin deficiency), decrease in excretion (renal failure/injury, decreased mineral corticoids, medications), factitious (hemolysis, thrombocytosis, venipuncture issue, leukocytosis).5-8
Clinical Manifestations: Since potassium plays an important role in Na-K-ATPase physiology, hyperkalemia can result in several important effects, primarily cardiac and neuromuscular. Cu toate acestea, caracteristicile clinice sunt nespecifice și includ slăbiciune generală, letargie sau confuzie. Reflexele profunde ale tendonului pot fi deprimate sau absente, deși nervii cranieni, funcția diafragmei și senzația sunt de obicei normale. Efectele GI includ greață, vărsături și diaree.
– ECG este unul dintre cele mai importante teste de diagnostic în hiperkaliemie. Modificările prezise sunt considerate în mod clasic că urmează 1) undele T maxime, 2) prelungirea intervalului PR cu pierderea undei p, 3) lărgirea QRS, 4) modelul undelor sinusoidale și 6) asistol. Undele T cu vârf sunt rezultatul modificărilor potențiale ale membranei de repaus.9-12
– aceste modificări nu apar în ordine, deși. Dodge și colab. pacienții găsiți pot progresa de la ritmul sinusal la V fib.13 ECG demonstrează sensibilitate de 34-43% în prezicerea hiperkaliemiei, cu specificitate 85-86%.12,14
– modificarea lentă a potasiului seric poate duce la absența modificărilor ECG, iar valorile peste 9,0 mEq/l pot să nu demonstreze rezultatele așteptate.12,15
pacientul nostru a prezentat slăbiciune și modificări ECG. Ați cerut mai multe medicamente și să începem să ne scufundăm adânc în tratamentul hiperkaliemiei.
Management
– tratamentul nu depinde de cauza hiperkaliemiei, ci trebuie să se concentreze pe inversarea sau evitarea efectelor și complicațiilor disritmice.
– managementul se concentrează pe stabilizarea cardiacă, deplasarea transcelulară și excreția de potasiu. Aceasta trebuie să înceapă imediat după ce se suspectează hiperkaliemia, fie prin modificări ECG (inclusiv unde T maxime), fie prin potasiu > 6, 5 mmol/L. 4,5,10,11,16

1) stabilizarea membranei cardiace
calciul scade efectul de depolarizare al hiperkaliemiei și reduce potențialul de prag al miocitelor cardiace în câteva minute.4,5,17-19 aceasta stabilizează membrana celulară cardiacă, dar nu are ca rezultat schimbarea transcelulară sau excreția de potasiu, care necesită alte medicamente.
– calciul poate fi administrat sub două forme: clorură sau sare gluconat. Sarea de clorură de Ca conține 13,6 meq în 10 mL, în timp ce sarea de gluconat de Ca conține 4,6 meq în 10 mL.4,5,18,19 ca gluconatul poate fi administrat printr-o linie periferică IV. Extravazarea clorurii de ca poate provoca necroză tisulară, iar linia centrală este recomandată dacă este posibil (cu excepția situației codului.) 4,5
– CaCl 1 g conține aproximativ 270 mg Ca2+, în timp ce 3 fiole gluconat de calciu conține cantitatea echivalentă (aproximativ 90 mg Ca2+ per fiolă).18,19
– literatura de specialitate sugerează că gluconatul de Ca are un timp de debut similar cu cel al clorurii de ca și poate să nu necesite activitate hepatică. Mai multe studii efectuate la pacienții supuși unui transplant hepatic demonstrează o creștere similară a Ca după oricare dintre formulări.19-21 un studiu efectuat la câini și pacienți pediatrici demonstrează constatări similare.21
– debutul acțiunii este mai mic de 3 minute, cu o durată de 20-60 de minute.4,5
linia de fund: 1g (10 mL) gluconat de ca IV trebuie furnizat pacienților cu constatări ECG (unde T maxime sau mai rău), cu reevaluare în decurs de 5 minute. Trebuie furnizat mai mult calciu dacă nu se observă nicio modificare sau agravare a ECG. Un pacient în stop cardiac sau cu acces central trebuie să primească 1 g clorură de Ca IV.
există o altă opțiune pentru stabilizarea cardiacă? Soluția salină hipertonică (3%) poate fi utilizată în bolusuri de 100 ml, deși aceasta a fost studiată predominant la pacienții cu hiponatremie și hiperkaliemie.22
2) deplasarea Transcelulară
aceasta ar trebui să aibă loc cu sau imediat după calciu pentru a redistribui potasiul.4,5,23-25

a) insulina și glucoza – aceste măsuri scad potasiul seric într-un mod dependent de doză.4,5,23-26 activarea Na-K-ATPazei și recrutarea pompei intracelulare (receptorii GLUT4) la membrana celulară sunt responsabile pentru transportul K intracelular.27
– în mod clasic, este furnizată insulină regulată de 10-20 unități, cu dextroză 25 g (un amp De D50) dacă nivelul glicemiei este mai mic de 250 mg/dl.4,5,28,29
– insulina și glucoza scad potasiul cu 0,45-0,61 mmol/L în decurs de 15 minute,30-32 0.87 mmol/L la 30 de minute,33,34 și 0,47 mmol / L la o oră.23,24,33,34 alte studii sugerează că poate duce la o scădere de până la 1,2 mmol/L. 23,24
– insulina / glucoza are debut de acțiune mai puțin de 15 minute (mai frecvent 5-10 minute) și timp de acțiune maximă 25-30 minute.23,24 durata acțiunii este de 2 ore.
– riscurile includ hipoglicemia, care este adesea subestimată. Această rată atinge 8,7% cu 10 unități de insulină obișnuită.35 o rată de 13% a fost sugerată într-un studiu al pacienților cu boală renală în stadiu final,36 care atinge 75% la 60 de minute la pacienții supuși hemodializei.26 o revizuire sistematică sugerează 18%.26
– cantitatea de glucoză care trebuie furnizată poate fi dificil de determinat, iar tabelul 1 de mai jos oferă un mijloc ușor de urmat pentru a determina ce trebuie furnizat.
– factorii includ absența diabetului zaharat anterior, absența medicamentelor diabetice și scăderea glucozei înainte de tratament. Leziunea renală sau boala este un factor potențial, deoarece insulina este metabolizată pe cale renală.4,5,36
– o modificare potențială include utilizarea insulinei cu acțiune scurtă, cum sunt lispro sau aspart, care au timpi de înjumătățire mai scurți, sunt absorbiți mai rapid și nu sunt prelungiți în cazul insuficienței renale/leziunilor. Aceasta poate fi furnizată sub formă de bolus de insulină cu acțiune scurtă de numai 10 unități sau 6 unități în bolus urmat de perfuzie cu lispro sau aspart de 20 unități pe oră. Aceste regimuri asigură scăderi similare ale potasiului seric, ducând în același timp la o hipoglicemie mai mică.4,5
– numai glucoza nu este recomandată, ceea ce poate duce la hipertonicitate și hiperkaliemie.37,38
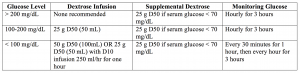
linia de fund: insulină cu acțiune scurtă 10 unități IV, cu perfuzie de glucoză ca mai sus.

B) agoniștii Beta – catecolaminele cresc activitatea pompei de Na-K-ATPază și a cotransporterului Na-K-2CL.1-5,39,40
– Albuterolul nebulizat se administrează în doze de 10-20 mg, mai degrabă decât 5 mg normal pentru boala obstructivă.
– levalbuterolul și albuterolul demonstrează capacitatea egală de a scădea potasiul.4,5,23,24
-Albuterolul poate fi administrat IV în doze de 0,50 mg, iar terbutalina poate fi administrată IM în doze de 0,25 mg. 4,5,23,24,31,41-43
– potasiul scade cu 0,6 mmol/L cu 10 mg și 1,0 mmol / L cu 20 mg la o oră.31,41-43
– debutul este de 20-30 de minute, cu o durată de peste două ore.31,41-43
– formulările IV includ epinefrină, albuterol 0,5 mg sau salbutamol 2,5 mg, deși efectele secundare sunt mai frecvente.23,24,34
– reacțiile adverse includ tremor, palpitații și anxietate. Formele IV prezintă un risc mai mare de creștere a tensiunii arteriale și dureri de cap.
– tratamentul combinat cu insulină și glucoză are ca rezultat o scădere și mai mare a potasiului, 1.2-1, 5 mmol/L la o oră după administrarea medicamentelor.31,41-43
linia de fund: Albuterol 20 mg în 4 mL soluție salină normală nebulizată timp de 10 minute.

c) bicarbonat de sodiu – bolus bicarbonatul de sodiu a fost recomandat pentru tratamentul acut al hiperkaliemiei, pe baza studiilor de evaluare a perfuziei prelungite de bicarbonat (peste ore).23,24,31,32,44-46
– cu toate acestea, literatura de specialitate la pacienții cu pH normal nu susține bicarbonatul pentru hiperkaliemie.4,5,23,24
– în comparație cu alți agenți, bicarbonatul nu are ca rezultat o scădere semnificativă a potasiului la 30 și 60 de minute.23,24,32 mai multe studii controlate indică faptul că bicarbonatul de sodiu nu scade potasiul în decurs de 60 de minute.4,5,23,24 studii care sugerează o scădere a bicarbonatului utilizat infuzat peste ore (mai degrabă decât bolus) și la pacienții cu acidemie.47,48
tratament combinat
– utilizarea mai multor medicamente asigură cele mai bune mijloace de redistribuire a potasiului, Cochrane review recomandând insulină combinată, glucoză și beta agoniști.4,5,23-26
– Allon și colab. găsește scăderea maximă a potasiului cu 1,21 mmol/L cu insulină IV glucoză cu albuterol nebulizat.31
– bicarbonatul nu trebuie utilizat decât dacă pacientul este acidemic.4,5
linia de fund: bicarbonatul de sodiu poate fi utilizat la pacienții cu acidemie și hiperkaliemie, dar nu este util la alți pacienți. Terapia asociată este eficace cu beta-agonist și insulină/glucoză în schimbarea potasiului.
glucoza pacientului este 153. Administrați gluconat de calciu 10% 10 mL IV, urmat de 10 unități insulină cu acțiune scurtă, cu un amp D50 și 20 mg albuterol nebulizat. Care este următorul pas?
3) excreția de potasiu
mijloacele de excreție includ urina, sistemul GI și sângele.1-5 rinichi sunt calea predominantă de excreție. Medicii trebuie să evalueze starea volumului pacientului și capacitatea de a produce urină. Dacă pacientul poate produce urină, un diuretic este o opțiune validă.4,5 cu toate acestea, hemodializa este cel mai bun mijloc de eliminare definitivă a potasiului.

a) diureza urinară – aceasta poate fi utilizată în timpul pregătirii pacientului pentru hemodializă. Diureza urinară nu este utilă dacă pacientul nu poate produce urină, deși poate fi utilă la pacienții cu funcție renală moderat compromisă.4,5
– diureticele de ansă, cum este furosemidul, asigură cea mai mare excreție urinară de potasiu.
– asocierea cu acetazolamidă poate crește excreția de potasiu în continuare, deși acest agent singur nu este recomandat.49
– acești agenți sunt cei mai buni la pacienții cu hipervolemie sau euvolemie. Dacă este furnizat, medicii trebuie să monitorizeze cu atenție producția urinară și electroliții.
– dacă este hipovolemic, trebuie furnizate lichide IV. Acest post nu va evalua care este cel mai bun, dar literatura sugerează Ringers lactat sau plasmalyte este mai bună decât ser fiziologic Normal. Vezi acest post de la Josh Farkas la PulmCrit pentru mai multe: https://emcrit.org/pulmcrit/myth-busting-lactated-ringers-is-safe-in-hyperkalemia-and-is-superior-to-ns/.

B) GI – sunt disponibile mai multe opțiuni, cu mai mulți agenți noi care oferă opțiuni mai bune decât Kayexalat.
– sulfonatul de polistiren de sodiu (SPS) sau Kayexalat, este o rășină schimbătoare de ioni care schimbă sodiu pentru amoniu, calciu, magneziu și potasiu pentru a permite eliminarea potasiului prin fecale.4,5,23-26 Din păcate, literatura din spatele SPS este extrem de slabă, studiile recente și recenziile Cochrane recomandând împotriva utilizării sale.50,51 acest medicament oferă o încărcătură de sodiu în timp ce pune pacientul în pericol de constipație, obstrucție și, chiar mai rău, ischemie intestinală și necroză. Medicamentul are chiar și un avertisment cutie neagră de la FDA.4,5,23,24,52 pentru mai multe detalii, a se vedea http://www.emdocs.net/skeptical-em-myths-evidence/ și http://rebelem.com/kayexalate-useful-treatment-hyperkalemia-emergency-department/
– Patiromer este un polimer sintetic format din margele sferice neabsorbabile.52,53 debutul acțiunii medicamentului este de 7-48 ore, durata efectului fiind de 12-24 ore. 52-54 voluntari sănătoși demonstrează o scădere a potasiului legată de doză cu 15-20 mmol.55-57 doze de 15-30g / zi par eficiente. Cel mai frecvent efect secundar include hipomagneziemia (8,6%), deși nu s-au găsit disritmii cardiace la acești pacienți. De remarcat, medicamentul are un avertisment cutie neagră pentru separarea de cel puțin șase ore de la alte medicamente pe cale orală.4
– ciclosilicat de zirconiu de sodiu (ZS-9) este un polimer sintetic format din bile sferice neabsorbabile.53,54 medicamentul se leagă de mai mult de nouă ori cantitatea de potasiu în comparație cu SPS, deoarece un por de legare din structura cristalină se leagă în mod specific de potasiu.143.149 debutul acțiunii ZS-9 este de 1-6 ore, cu durata efectului 4-12 ore. Mai multe studii susțin utilizarea acestuia, 10g/zi scăzând potasiul cu 0,4 mmol/L la o oră și 0,7 mmol/l la 4 ore.58-60
– o meta-analiză a comparat patiromer și ZS-9, constatând că patiromer scade potasiul cu 0, 36 mEq/L în ziua 3 a tratamentului.61 ZS-9 demonstrează o scădere cu 0,17 mEq/L la o oră și 0,67 mEq / l la 2 zile.61

c) dializa – acesta este cel mai eficient mod de a elimina potasiul, potasiul scăzând cu 1 mmol/L la 1 oră și 2 mmol/l cu 2-3 ore. Scăderea dializatului de potasiu și creșterea fluxului sanguin pot duce la scăderea mai rapidă a potasiului seric.4,5
– creșterea vitezei pompei de sânge a mașinii și a concentrației plasmatice până la dializat pot scădea potasiul în câteva minute; astfel, importanța dializei (în special în stop cardiac).4,5,41
– hiperkaliemia de Rebound poate fi observată după dializă, probabil legată de nivelurile de potasiu predializate.4,5
– hemodializa trebuie luată în considerare la începutul pacientului cu insuficiență renală diagnosticată, incapacitate de a produce urină, hiperkaliemie rezistentă la alte tratamente, stop cardiac și distrugere tisulară marcată.62-64
Linia De Fund: Dializa este cea mai eficientă în eliminarea definitivă a potasiului. SPS nu este eficient și trebuie evitat din cauza riscului de necroză a colonului.
apelați nefrologul în ceea ce privește dializa și repetați un ECG, care demonstrează ritmul sinusal normal cu rata 72 bpm. Nefrologul afirmă că va veni imediat să vadă pacientul.
ce se întâmplă în stop cardiac din cauza hiperkaliemiei?
hiperkaliemia modifică potențialul de repaus al cardiomiocitelor, rezultând inactivarea canalelor de sodiu și blocarea conducerii. Pacienții aflați în arest din cauza hiperkaliemiei necesită comprimări imediate și măsuri ACLS.28,29
– pacienții cu stop cardiac cu antecedente de insuficiență renală cunoscută, boală critică sau hemodializă necesită o evaluare rapidă a gazelor din sânge, măsurând potasiul.
– suspiciunea de hiperkaliemie ca etiologie necesită clorură de calciu 10% (1 amp sau 10 mL), cu dozare repetată până la QRS < 100 ms, prin linia periferică IV sau centrală.28,29
– epinefrina trebuie furnizată pentru a urma, precum și insulina și glucoza.
– bicarbonatul de sodiu poate fi furnizat ca 1 amp.
– ROSC poate apărea după stabilizarea membranei de clorură de calciu, care durează 20-30 de minute. În acest moment, schimbarea intracelulară și eliminarea sunt obiective.4,5,28,29,65
puncte cheie
– potasiul joacă un rol cheie în fiziologie și se găsește predominant intracelular. Hiperkaliemia are ca rezultat modificarea potențialelor membranei celulare, în primul rând în celulele cardiace și neuromusculare.
– ECG este primul test esențial, dar absența constatărilor nu poate fi invocată pentru a exclude hiperkaliemia.
– Managementul include stabilizarea membranei cardiace, deplasarea transcelulară și excreția.
– gluconatul de calciu 10% poate fi administrat pentru stabilizarea membranei, cu excepția cazului în care pacientul este în stop cardiac, în care trebuie administrate 10 mL clorură de calciu.
– agoniștii Beta și insulina cu acțiune scurtă cu glucoză sunt eficienți în deplasarea intracelulară a potasiului. Infuzia de dextroză trebuie furnizată pe baza glucozei serice.
– bicarbonatul de sodiu nu este recomandat decât dacă pacientul este acidemic.
– excreția include diureza urinară, eliminarea GI și hemodializa.
– SPS sau kayexalat nu sunt recomandate. Noi medicamente, inclusiv patiromer și ciclosilicat de zirconiu de sodiu, promit pentru excreția GI.
– dializa este ultimul mijloc de eliminare a potasiului. Ringerele lactate și Plasmalitele pot fi mai sigure pentru rehidratarea fluidelor, dacă este necesar.
referințe / lecturi suplimentare:
- Faridi AB, Weisberg LS. Anomalii acido-bazice, electrolitice și metabolice. În: medicina de îngrijire critică: principiile diagnosticului și managementului la adulți. Parrillo JE, Dellinger RP (Eds). Ediția A Treia. Philadelphia, Elsevier,2008; 1203-1243.
- Mount DB, Zandi-Nejad K. tulburări ale echilibrului de potasiu. În: Brenner și Rector rinichi, 9 Ed, WB Saunders & companie, Philadelphia 2011. p. 640.
- maro RS. Homeostazia potasiului și implicațiile clinice. Sunt J Med.1984 5 noiembrie; 77 (5A):3-10.
- Rinichi Internațional 2016;89:546-554.
- Weisberg LS. Managementul hiperkaliemiei severe. Crit Care Med. 2008;36(12):3246-51.
- Gennari FJ: tulburări ale homeostaziei potasiului. Hipokaliemie și hiperkaliemie. Crit Care Clin 2002;18:273-288
- Stevens MS, Dunlay RW. Hiperkaliemia la pacienții spitalizați. Int Urol Nephrol 2000; 32: 177-180.
- Mandal AK. Hipokaliemie și hiperkaliemie. Med Clin Nord Am. 1997;81(3):611-639.
- Fisch C. relația tulburărilor electrolitice cu aritmiile cardiace. Circulație 1973; 47:408-419.
- Surawicz B. electroliți și electrocardiograma. Postgrad Med 1974; 55:123–129.
- Freeman K,Feldman JA, Mitchell P și colab. Efectele prezentării și electrocardiogramei la timp până la tratamentul hiperkaliemiei. Acad Emerg Med. 2008 Mar;15 (3):239-49.
- Mattu a, Brady WJ, Robinson D. manifestări electrocardiografice ale hiperkaliemiei. Sunt J Emerg Med. 2000; 18: 721–729.
- Dodge HT, Grant RP, Seavey PW. Efectul hiperkaliemiei induse asupra electrocardiogramei normale și anormale. Am Heart J. 1953 Mai; 45 (5):725-40.
- Wrenn KD,Slovis CM, Slovis BS. Capacitatea medicilor de a prezice hiperkaliemia de la ECG. Ann Emerg Med. 1991 noiembrie; 20 (11): 1229-32.
- Szerlip HM,Weiss J, Singer I. hiperkaliemie profundă fără manifestări electrocardiografice. Am J Rinichi Dis. 1986 Iunie;7 (6):461-5.
- Montague BT, Ouellette JR, Buller GK. Revizuirea retrospectivă a frecvenței modificărilor ECG în hiperkaliemie. Jurnalul Clinic al Societății Americane de Nefrologie: CJASN. 2008;3(2):324-330.
- Chamberlain M. tratamentul de Urgență al hiperkaliemiei. Lancet. 1964;1:464–467.
- Bisogno JL, Langley A, Von Dreele mm. Efectul calciului pentru a inversa efectele electrocardiografice ale hiperkaliemiei în inima izolată a șobolanului: un studiu prospectiv, doză-răspuns. Crit Îngrijire Med 1994; 22: 697-704.
- Martin T, Kang Y, Robertson K, și colab. Ionizarea și efectele hemodinamice ale clorurii de calciu și gluconatului de calciu în absența funcției hepatice. Anestezie 1990; 73: 62-5.
- Davey m, Caldicott D. săruri de calciu în tratamentul hiperkaliemiei. Jurnalul de medicină de urgență: EMJ. 2002;19(1):92-93.
- Cote CJ, picătură LJ, Daniels Al, și colab. Clorură de calciu versus gluconat de calciu: Compararea ionizării și a efectelor cardiovasculare la copii și câini. Anesteziologie 1987; 66:465-70.
- Ballantyne F III, Davis LD, Reynolds EW Jr, și colab. Baza celulară pentru inversarea modificărilor electrocardiografice hiperkalemice de sodiu. Am J Physiol 1975; 229:935-940.
- Batterink J, Cessford TA, Taylor RAI. Intervenții farmacologice pentru tratamentul acut al hiperkaliemiei la adulți. Baza de date Cochrane de recenzii sistematice 2015, numărul 10. Artă. Nu.: CD010344. DOI: 10.1002 / 14651858.CD010344. pub2.
- Mahoney BA,Smith WA, Lo DS și colab. Intervenții de urgență pentru hiperkaliemie. Cochrane baza de date Syst Rev. 2005 Aprilie 18; (2): CD003235.
- Elliott MJ, Ronksley pe, Clase CM, și colab. Managementul pacienților cu hiperkaliemie acută. 2010;182:1631–1635.
- Harel Z, Kamel KS. Doza optimă și metoda de administrare a insulinei intravenoase în gestionarea hiperkaliemiei de urgență: o revizuire sistematică. Barretti P, ed. PLoS unu. 2016; 11 (5):e0154963.
- Ho K. un răspuns critic rapid: transportul de potasiu și glucoză stimulat de insulină în mușchii scheletici. Clin J Am Soc Nephrol. 2011;6:1513–1516.
- avânta J, Perkins GD, Abbas G, și colab. Orientările Consiliului European de resuscitare pentru resuscitare 2010 secțiunea 8. Stop Cardiac în circumstanțe speciale: anomalii electrolitice, otrăvire, înec, hipotermie accidentală, hipertermie, astm, anafilaxie, chirurgie cardiacă, traume, sarcină, electrocutare. Resuscitare. 2010;81:1400–1433.
- Vanden Hoek TL, Morrison LJ, Shuster M și colab. Partea 12: stop cardiac în situații speciale: 2010 liniile directoare ale Asociației Americane a inimii pentru resuscitarea cardiopulmonară și îngrijirea cardiovasculară de urgență. Circulație. 2010;122 (suppl 3): S829–S861.
- Li Q, Zhou MT, Wang Y, și colab. Efectul insulinei asupra hiperkaliemiei în timpul stadiului anhepatic al transplantului hepatic. Lumea J Gastroenterol 2004; 10: 2427-9.
- Allon M, Copkney C. Albuterol și insulină pentru tratamentul hiperkaliemiei la pacienții hemodializați. Rinichi Int 1990; 38(5):869-72.
- Allon M, Shanklin N. efectul administrării bicarbonatului asupra potasiului plasmatic la pacienții dializați: Interacțiuni cu insulina și albuterolul. Am J Rinichi Dis 1996; 28: 508-14.
- Mahajan SK, Mangla M, Kishore K. Compararea infuziilor de aminofilină și insulină–dextroză în terapia acută a hiperkaliemiei în boala renală în stadiu final J Assoc Physicians India 2001;49:1082-5.
- Ngugi NN, McLigeyo deci, Kayima JK. Tratamentul hiperkaliemiei prin modificarea gradientului transcelular la pacienții cu insuficiență renală: efectul diferitelor terapeutice East Afr Med J 1997;74:503-9.
- Schafers s, Naunheim R, Vijayan A și colab. Incidența hipoglicemiei după stabilizarea acută pe bază de insulină a tratamentului cu hiperkaliemie. J Hosp Med. 2012;7(3):239-242.
- Apel J, Reutrakul S, Baldwin D. Hipoglicemia în tratamentul hiperkaliemiei cu insulină la pacienții cu boală renală în stadiu final. Rinichi Clin J. 2014; 7 (3):248-250.
- Goldfarb S, Cox M, Singer I, și colab. Hiperkaliemia acută indusă de hiperglicemie: mecanisme hormonale. Ann Intern Med. 1976;84:426–432.
- Palmer BF. Reglarea homeostaziei de potasiu. Clin J Am Soc Nephrol. 2015;10:1050–1060.
- Clausen T, Everts mine. Reglarea pompei Na, K în mușchiul scheletic. Rinichi Int 1989; 35: 1-13.
- Moratinos J, Reverte M. efectele catecolaminelor asupra potasiului plasmatic: rolul alfa-și beta-adrenoceptorilor. Fundam Clin Pharmacol. 1993;7(3-4):143-53.
- Allon M. hiperkaliemia în boala renală în stadiu final: mecanisme și management. J Am Soc Nephrol 1995; 6: 1134.
- Allon M, Dunlay R, Copkney C. Albuterol nebulizat pentru hiperkaliemie acută la pacienții hemodializați. Ann Intern Med. 1989;110:426-9.
- Allon M, Shanklin N. efectul tratamentului cu albuterol asupra îndepărtării ulterioare a potasiului dialitic. Am J Rinichi Dis 1995;26:607-13.
- Blumberg A, Weidmann P, Shaw S, și colab. Efectul diferitelor abordări terapeutice asupra potasiului plasmatic și a factorilor majori de reglare în insuficiența renală terminală. Jurnalul American de Medicină. 1988;85(4):507–12.
- Iqbal Z, Friedman EA. Preferredterapia hiperkaliemiei în insuficiența renală: studiul formării nefrologiei-programul n Engl J Med. 1989 Jan 5; 320 (1): 60-1.
- Blumberg a, Weidmann P, Ferrari P. efectul administrării prelungite de bicarbonat asupra potasiului plasmatic în insuficiența renală terminală. Rinichi Int. 1992;41:369–374.
- Fraley DS,Adler S. Corectarea hiperkaliemiei prin bicarbonat în ciuda pH-ului constant al sângelui. rinichi Int. 1977 Noiembrie; 12 (5): 354-60.
- Gutierrez R,Schlessinger F, Oster JR, și colab. Efectul bicarbonatului de sodiu hipertonic versus izotonic asupra concentrației plasmatice de potasiu la pacienții cu boală renală în stadiu final. Miner Electrolit Metab. 1991;17(5):297-302.
- Jentzer JC,DeWald TA, Hernandez AF. Combinație de diuretice de ansă cu diuretice de tip tiazidic în insuficiența cardiacă. J Sunt Coll Cardiol. 2010 2 noiembrie;56 (19):1527-34.
- Scherr L, Ogden DA, Mead AW și colab. Gestionarea hiperkaliemiei cu o rășină schimbătoare de cationi. N Engl J Med 1961; 264: 115-119.
- Flinn RB, Merrill JP, Welzant WR și colab. Tratamentul pacientului oliguric cu o nouă rășină schimbătoare de sodiu și sorbitol; un raport preliminar. N Engl J Med. 1961 19 ianuarie; 264: 111-5.
- Sterns RH,Rojas M, Bernstein P, și colab. Rășini schimbătoare de ioni pentru tratamentul hiperkaliemiei: sunt sigure și eficiente? J Sunt Soc Nephrol. 2010 Mai; 21 (5):733-5.
- Beccari MV, Meaney CJ. Utilitatea clinică a patiromer, ciclosilicat de zirconiu de sodiu și sulfonat de polistiren de sodiu pentru tratamentul hiperkaliemiei: o revizuire bazată pe dovezi. Dovezi De Bază. 2017;12:11-24.
- Weir MA, Juurlink DN, Gomes T, și colab. Beta-blocante, trimetoprim sulfametoxazol și riscul de hiperkaliemie care necesită spitalizare la vârstnici: un studiu imbricat de control al cazurilor. Clin J Am Soc Nephrol. 2010;5:1544–1551.
- Huang I. RLY5016: un polimer terapeutic nou, neabsorbit, pentru controlul potasiului seric. J Sunt Soc Nephrol. 2010; 21: 482A–483A.
- Bakris GL, Pitt B, Weir MR și colab., pentru Anchetatorii ametist-DN. Efectul patiromer asupra nivelului seric de potasiu la pacienții cu hiperkaliemie și boală renală diabetică: studiul clinic randomizat ametist-DN. JAMA. 2015;314:151–161.
- Montaperto AG,Gandhi MA, Gashlin LZ și colab. Patiromer: o revizuire clinică. Curr Med Res Opin. 2016;32(1):155-64.
- Packham DK,Kosiborod M. farmacodinamica și farmacocinetica ciclosilicatului de zirconiu de sodiu în tratamentul hiperkaliemiei. Expert Opin Droguri Metab Toxicol. 2016 Mai; 12 (5): 567-73.
- Ash SR, Singh B, Lavin PT, și colab. Un studiu de fază 2 privind tratamentul hiperkaliemiei la pacienții cu boală renală cronică sugerează că capcana selectivă de potasiu, ZS-9, este sigură și eficientă. Rinichi Int. 2015;88:404–411.
- Packham DK, Rasmussen HS, Lavin PT și colab. Ciclosilicat de zirconiu de sodiu în hiperkaliemie. N Engl J Med. 2015;372:222–231.
- Meaney CJ, Beccari MV, Yang Y, și colab. Revizuirea sistematică și Meta-analiza Patiromer și ciclosilicat de zirconiu de sodiu: un nou Armamentarium pentru tratamentul hiperkaliemiei. 2017 Aprilie; 37 (4):401-411.
- Blumberg A, Roser HW, Zehnder C și colab. Potasiul plasmatic la pacienții cu insuficiență renală terminală în timpul și după hemodializă; relația cu eliminarea Dial-Dial a potasiului și potasiul total din organism. Transplant De Apelare Nephrol. 1997;12:1629–1634.
- Feig P, Shook a, Sterns R. efectul eliminării potasiului în timpul hemodializei asupra concentrației plasmatice de potasiu. Nephron. 1981;27:25–30.
- Agar BU, Culleton BF, Fluck R, Leypoldt JK. Cinetica de potasiu în timpul hemodializei. Hemodial Int. 2015;19:23–32.
- Alfonzo AV, Simpson K, Deighan C, Campbell S, Fox J. Modifications to advanced life support in renal failure. Resuscitation 2007;73:12–28.