Autores: Brit Long, MD (@long_brit, SAUSHEC EM Attending Physician) y Justin R. Warix, DO, FAAEM (EM Attending Physician, Central Peninsula Hospital, Soldotna, AK) // Editado por: Alex Koyfman, MD (@EMHighAK, EM Attending Physician, UT Southwestern Medical Center / Parkland Memorial Hospital)
¡Bienvenido de nuevo a los casos emDocs! Hoy tenemos una discusión basada en casos sobre un tema central de EM, con un vistazo a algunas controversias y tratamientos de vanguardia.
—————————-
Una mujer de 62 años con antecedentes de enfermedad renal en diálisis, hipertensión y EAC presenta náuseas y debilidad. Se perdió la sesión de diálisis de hoy. Su VS es normal, y su examen también es normal. ¿Cuál es su primera prueba que obtiene?
- ¡El ECG!
- ¿Cuál es la literatura detrás de este régimen? ¿Hay algo mejor?
- Antes de empezar, vamos a cubrir algunos aspectos básicos.
- Manejo
- 1) Estabilización de membrana cardíaca
- 2) Desplazamiento transcelular
- Tratamiento combinado
- 3) Excreción de potasio
- ¿Qué sucede en un paro cardíaco debido a hiperpotasemia?
- Puntos clave
- Referencias / Lecturas complementarias:
¡El ECG!
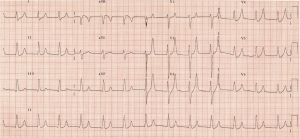
Se ven ondas T grandes y de pico con ausencia de ondas P. El VBG regresa con potasio de 7,3 mmol / L, con sodio de 140 mmol / L y lactato normal. Solicita su régimen estándar de hiperpotasemia, o C BIG K DROP, vea más en https://canadiem.org/tiny-tip-hyperkalemia-management/
Este régimen consiste clásicamente en Calcio (gluconato o cloruro de sal), agonista Beta (10-20 mg de albuterol nebulizado) y/o Bicarbonato (1 amp), Insulina (10 unidades regulares/Glucosa D50 1 amp), Kayexalato (15-30 g por vía oral o rectal), Diuréticos (Furosemida 40 mg) y unidad renal para diálisis Del Paciente.
¿Cuál es la literatura detrás de este régimen? ¿Hay algo mejor?
Antes de empezar, vamos a cubrir algunos aspectos básicos.
– La mayor parte del potasio es intracelular (98%), con un 75% en el músculo esquelético. Un gradiente significativo entre el entorno intracelular y extracelular juega un papel vital en la generación de potenciales de acción celular.1-5
– El sistema renal juega el papel más importante en la regulación del potasio (90% de la excreción). Los niveles normales son de 3,5 a 5,0 mEq / L o mmol / L. 1,2
– Los cambios en estos niveles afectan los potenciales de membrana celular y dan lugar a síntomas cardíacos y neuromusculares. La bomba Na-K-ATPasa desempeña un papel importante en el gradiente de membrana celular.
– Hiperpotasemia leve: 5,5-6,5 mEq / L (cerca del 10% de los pacientes ingresados).4-7
– Los niveles moderados son 6.5-7.5 mEq / L, y severos > 7.5 mEq / L. 4-7
Etiología: Las causas de potasio elevado incluyen: excessive exogenous potassium, excessive endogenous potassium (hemolysis, rhabdomyolysis, burns, tumor lysis syndrome, trauma), redistribution (acidemia, medications (succinylcholine, beta-blockers), and insulin deficiency), decrease in excretion (renal failure/injury, decreased mineral corticoids, medications), factitious (hemolysis, thrombocytosis, venipuncture issue, leukocytosis).5-8
Clinical Manifestations: Since potassium plays an important role in Na-K-ATPase physiology, hyperkalemia can result in several important effects, primarily cardiac and neuromuscular. Sin embargo, las características clínicas son inespecíficas e incluyen debilidad general, letargo o confusión. Los reflejos tendinosos profundos pueden estar deprimidos o ausentes, aunque los nervios craneales, la función del diafragma y la sensibilidad suelen ser normales. Los efectos gastrointestinales incluyen náuseas, vómitos y diarrea.
– El ECG es una de las pruebas diagnósticas más importantes en hiperpotasemia. Clásicamente se cree que los cambios predichos siguen 1) Ondas T con pico, 2) prolongación del intervalo PR con pérdida de onda p, 3) Ensanchamiento del QRS, 4) Patrón de onda sinusoidal y 6) Asistolia. Las ondas T en pico son el resultado de cambios en el potencial de membrana en reposo.9-12
– Sin embargo, estos cambios no aparecen en orden. Dodge et al. los pacientes encontrados pueden progresar de ritmo sinusal a fibrilación ventricular.13 El ECG muestra una sensibilidad del 34-43% en la predicción de hiperpotasemia, con una especificidad del 85-86%.12,14
– El cambio lento en el potasio sérico puede no producir cambios en el ECG, y los niveles superiores a 9,0 mEq/L pueden no demostrar los hallazgos esperados.12,15
Nuestro paciente presentó debilidad y cambios en el ECG. Usted ha pedido varios medicamentos, y comencemos nuestra inmersión profunda en el tratamiento de la hipercalemia.
Manejo
– El tratamiento no depende de la causa de la hiperpotasemia, sino que debe centrarse en revertir o evitar los efectos disrítmicos y las complicaciones.
– Establezca su red de seguridad de acceso IV, monitoreo continuo y O2.
– El manejo se centra en la estabilización cardíaca, el desplazamiento transcelular y la excreción de potasio. Esto debe comenzar inmediatamente una vez que se sospecha hiperpotasemia, ya sea por cambios en el ECG (incluyendo ondas T pico) o por potasio > 6,5 mmol/L. 4,5,10,11,16

1) Estabilización de membrana cardíaca
El calcio disminuye el efecto de despolarización de la hiperpotasemia y reduce el potencial umbral de los miocitos cardíacos en cuestión de minutos.4,5,17-19 Esto estabiliza la membrana celular cardíaca, pero no produce desplazamiento transcelular ni excreción de potasio, lo que requiere otros medicamentos.
– El calcio se puede administrar en dos formas: sal de cloruro o gluconato. La sal de cloruro de Ca contiene 13,6 meq en 10 ml, mientras que la sal de gluconato de Ca contiene 4,6 meq en 10 ml.El gluconato de 4,5,18,19 Ca se puede administrar a través de una vía INTRAVENOSA periférica. La extravasación de cloruro de Ca puede causar necrosis tisular, y se recomienda la vía central si es posible(a menos que la situación del código.) 4,5
– CaCl 1 g contiene aproximadamente 270 mg de Ca2+, mientras que 3 ampollas de gluconato de calcio contienen la cantidad equivalente (aproximadamente 90 mg de Ca2+ por ampolla).18,19
– La literatura sugiere que el gluconato de Ca tiene un tiempo de inicio similar al del cloruro de Ca y puede no requerir actividad hepática. Varios estudios realizados en pacientes sometidos a trasplante hepático demuestran un aumento similar de la Ac después de cualquiera de las formulaciones.19-21 Un estudio realizado en perros y pacientes pediátricos demuestra hallazgos similares.21
– El inicio de la acción es de menos de 3 minutos, con una duración de 20 a 60 minutos.4,5
Conclusión: 1 g (10 ml) de gluconato de Ca IV debe proporcionarse a los pacientes con hallazgos de ECG (ondas T pico o peor), con reevaluación en 5 minutos. Se debe suministrar más calcio si no se observa ningún cambio o empeoramiento en el ECG. Un paciente en paro cardíaco o con acceso central debe recibir 1 g de cloruro de Ca IV.
¿Hay otra opción para la estabilización cardíaca? La solución salina hipertónica (3%) se puede usar en bolos de 100 ml, aunque esto se ha estudiado predominantemente en pacientes con hiponatremia e hiperpotasemia.22
2) Desplazamiento transcelular
Esto debe ocurrir con o inmediatamente después del calcio para redistribuir el potasio.4,5,23-25

A) Insulina y glucosa: Estas medidas reducen el potasio sérico de forma dependiente de la dosis.4,5,23-26 La activación de la Na-K-ATPasa y el reclutamiento de bombas intracelulares (receptores GLUT4) a la membrana celular son responsables del transporte intracelular de K.27
– Clásicamente, se proporciona insulina regular de 10 a 20 unidades, con dextrosa de 25 g (un amperio de D50) si los niveles de glucosa en sangre son inferiores a 250 mg/dL.4,5,28,29
– La insulina y la glucosa disminuyen el potasio en 0,45-0,61 mmol / L en 15 minutos, 30-32 0.87 mmol/L a 30 minutos,33, 34 y 0,47 mmol/L a una hora.23,24,33,34 Otros estudios sugieren que puede resultar en una disminución de hasta 1,2 mmol / L. 23,24
– La insulina / glucosa tiene un inicio de acción de menos de 15 minutos (más comúnmente 5-10 minutos) y un tiempo de acción máxima de 25-30 minutos.23,24 La duración de la acción es de 2 horas.
– Los riesgos incluyen hipoglucemia, que a menudo se subestima. Esta tasa alcanza el 8,7% con 10 unidades de insulina regular.35 Se sugirió una tasa del 13% en un estudio de pacientes con enfermedad renal terminal,36 que alcanza el 75% a los 60 minutos en pacientes sometidos a hemodiálisis.26 Una revisión sistemática sugiere un 18%.26
– La cantidad de glucosa a proporcionar puede ser difícil de determinar, y la Tabla 1 a continuación ofrece un medio fácil de seguir para determinar lo que se debe proporcionar.
– Los factores incluyen la ausencia de diabetes previa, la ausencia de medicamentos para la diabetes y una glucosa más baja antes del tratamiento. La lesión o enfermedad renal es un factor potencial, ya que la insulina se metaboliza por vía renal.4,5,36
– Un cambio potencial incluye el uso de insulina de acción corta, como lispro o aspart, que poseen semividas más cortas, se absorben más rápidamente y no se prolongan en la insuficiencia renal/lesión. Puede suministrarse en bolo de insulina de acción corta de solo 10 unidades, o en bolo de 6 unidades seguido de perfusión de lispro o aspart de 20 unidades por hora. Estos regímenes proporcionan disminuciones similares en el potasio sérico mientras que resultan en menos hipoglucemia.4,5
– No se recomienda solamente glucosa, lo que puede resultar en hipertonicidad e hiperpotasemia.37,38
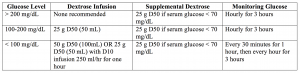
En pocas palabras: Insulina de acción corta 10 unidades IV, con infusión de glucosa como la anterior.

B) Agonistas beta – Catecolaminas aumentan la actividad de la bomba de Na-K-ATPasa y del cotransportador de Na-K-2Cl.1-5,39,40
– El albuterol nebulizado se administra en dosis de 10-20 mg, en lugar de los 5 mg normales para la enfermedad obstructiva.
– El levalbuterol y el albuterol demuestran la misma capacidad para disminuir el potasio.4,5,23,24
-El albuterol se puede administrar por vía intravenosa en dosis de 0,50 mg, y la terbutalina se puede administrar por vía intravenosa en dosis de 0,25 mg. 4,5,23,24,31,41-43
– El potasio disminuye en 0,6 mmol / L con 10 mg y en 1,0 mmol/L con 20 mg a una hora.31,41-43
– El inicio es de 20-30 minutos, con una duración de más de dos horas.31,41-43
– Las formulaciones intravenosas incluyen epinefrina, albuterol 0,5 mg o salbutamol 2,5 mg, aunque los efectos secundarios son más comunes.23,24,34
– Los efectos secundarios incluyen temblor, palpitaciones y ansiedad. Las formas intravenosas tienen un mayor riesgo de aumento de la presión arterial y dolor de cabeza.
– El tratamiento combinado con insulina y glucosa produce una disminución aún mayor del potasio, 1.2-1, 5 mmol / L una hora después de la administración del medicamento.31,41-43
En pocas palabras: Albuterol 20 mg en 4 ml de solución salina normal nebulizada durante 10 minutos.

C) Bicarbonato de sodio-Se ha recomendado bicarbonato de sodio en bolo para el tratamiento agudo de la hiperpotasemia, basado en estudios que evalúan la infusión prolongada de bicarbonato (durante horas).23,24,31,32,44-46
– Sin embargo, la literatura en pacientes con pH normal no apoya el bicarbonato para la hiperpotasemia.4,5,23,24
– En comparación con otros agentes, el bicarbonato no produce una disminución significativa del potasio a los 30 y 60 minutos.23,24,32 Varios estudios controlados indican que el bicarbonato de sodio no disminuye el potasio en 60 minutos.4,5,23,24 Estudios que sugieren una disminución del bicarbonato utilizado infundido durante horas (en lugar de bolo) y en pacientes con acidemia.47,48
Tratamiento combinado
– El uso de múltiples agentes proporciona el mejor medio de redistribución de potasio, con Cochrane review recomendando agonistas combinados de insulina, glucosa y beta.4,5,23-26
– Allon et al. encuentra la disminución máxima de potasio en 1,21 mmol / L con insulina glucosa intravenosa con albuterol nebulizado.31
– No se debe utilizar bicarbonato a menos que el paciente presente acidemia.4,5
En resumen: El bicarbonato de sodio se puede usar en pacientes con acidemia e hiperpotasemia, pero no es útil en otros pacientes. La terapia de combinación es eficaz con agonistas beta e insulina / glucosa para cambiar el potasio.
La glucosa del paciente es 153. Administre gluconato de calcio al 10%, 10 ml por vía intravenosa, seguido de 10 unidades de insulina de acción corta con un amp D50 y 20 mg de albuterol nebulizado. ¿Cuál es tu próximo paso?
3) Excreción de potasio
Los medios de excreción incluyen orina, sistema gastrointestinal y sangre.1-5 Riñones son la vía predominante de excreción. Los médicos deben evaluar el estado del volumen del paciente y la capacidad de producir orina. Si el paciente puede producir orina, un diurético es una opción válida.4,5 Sin embargo, la hemodiálisis es el mejor medio de eliminación definitiva de potasio.

A) Diuresis urinaria: se puede utilizar mientras se prepara al paciente para la hemodiálisis. La diuresis urinaria no es útil si el paciente no puede producir orina, aunque puede ser útil en pacientes con una función renal moderadamente comprometida.4,5
– Los diuréticos de asa, como la furosemida, proporcionan la mayor excreción urinaria de potasio.
– La combinación con acetazolamida puede aumentar aún más la excreción de potasio, aunque no se recomienda este agente solo.49
– Estos agentes son mejores en pacientes con hipervolemia o euvolemia. Si se proporciona, los médicos deben controlar cuidadosamente la producción urinaria y los electrolitos.
– Si es hipovolémico, se deben suministrar líquidos intravenosos. Este artículo no evaluará cuál es el mejor, pero la literatura sugiere que los Ringer Lactados o el plasmalito son mejores que la solución salina normal. Vea este post de Josh Farkas en PulmCrit para más información: https://emcrit.org/pulmcrit/myth-busting-lactated-ringers-is-safe-in-hyperkalemia-and-is-superior-to-ns/.

B) GI: Hay varias opciones disponibles, con varios agentes nuevos que ofrecen mejores opciones que el Kayexalate.
-El sulfonato de poliestireno sódico (SPS), o Kayexalato, es una resina de intercambio iónico que intercambia sodio por amonio, calcio, magnesio y potasio para permitir la eliminación de potasio a través de las heces.4,5,23-26 Desafortunadamente, la literatura detrás del SPS es extremadamente débil, con estudios recientes y revisiones Cochrane que recomiendan no usarlo.50,51 Este medicamento proporciona una carga de sodio al tiempo que pone al paciente en riesgo de estreñimiento, obstrucción y, lo que es peor, isquemia y necrosis intestinales. El medicamento incluso posee una advertencia de caja negra de la FDA.4,5,23,24,52 Para más, véase http://www.emdocs.net/skeptical-em-myths-evidence/ y http://rebelem.com/kayexalate-useful-treatment-hyperkalemia-emergency-department/
– El patiromer es un polímero sintético que consiste en perlas esféricas no absorbibles.52,53 El inicio de acción del medicamento es de 7-48 horas, con una duración de efecto de 12-24 horas. 52-54 Voluntarios sanos demuestran una disminución de potasio relacionada con la dosis de 15-20 mmol.55-57 Dosis de 15-30 g/día parecen efectivas. El efecto secundario más común incluye hipomagnesemia (8,6%), aunque no se encontraron arritmias cardíacas en esos pacientes. Cabe destacar que el medicamento posee una advertencia de caja negra para la separación de al menos seis horas de otros medicamentos orales.4
– El ciclosilicato de sodio y circonio (ZS-9) es un polímero sintético que consiste en perlas esféricas no absorbibles.53,54 El medicamento se une a más de nueve veces la cantidad de potasio en comparación con SPS, ya que un poro de unión dentro de la estructura cristalina se une específicamente al potasio.El inicio de acción de 143,149 ZS-9 es de 1-6 horas, con una duración de efecto de 4-12 horas. Varios estudios apoyan su uso, con 10g/día disminuyendo el potasio en 0,4 mmol/L a una hora y 0,7 mmol/L a 4 horas.58-60
– Un metaanálisis comparó el patiromer y el ZS-9, encontrando que el patiromer disminuye el potasio en 0,36 mEq / L en el día 3 de tratamiento.61 ZS-9 muestra una disminución de 0,17 mEq/L a una hora y de 0,67 mEq/L a 2 días.61

C) Diálisis: Esta es la forma más eficaz de eliminar el potasio, con una disminución de potasio de 1 mmol/L a 1 hora y de 2 mmol/L a 2-3 horas. Un dializato de potasio más bajo y un mayor flujo sanguíneo pueden dar lugar a disminuciones más rápidas de potasio sérico.4,5
– Los aumentos en la velocidad de la bomba de sangre de la máquina y la concentración de plasma a dializado pueden disminuir el potasio en cuestión de minutos; de ahí la importancia de la diálisis (especialmente en paro cardíaco).4,5,41
– Se puede observar hiperpotasemia de rebote después de la diálisis, probablemente relacionada con los niveles de potasio en prediálisis.4,5
– La hemodiálisis debe considerarse en una etapa temprana en pacientes con diagnóstico de insuficiencia renal, incapacidad para producir orina, hiperpotasemia resistente a otros tratamientos, paro cardíaco y destrucción marcada de tejidos.62-64
Línea de fondo: La diálisis es más eficaz en la eliminación definitiva de potasio. El SPS no es eficaz y debe evitarse debido al riesgo de necrosis del colon.
Usted llama al nefrólogo en relación con la diálisis y repite un ECG, que demuestra un ritmo sinusal normal con una frecuencia de 72 lpm. El nefrólogo dice que bajará a ver al paciente.
¿Qué sucede en un paro cardíaco debido a hiperpotasemia?
La hiperpotasemia altera el potencial de reposo de los cardiomiocitos, lo que resulta en la inactivación de los canales de sodio y el bloqueo de la conducción. Los pacientes en detención debido a hiperpotasemia requieren compresiones inmediatas y medidas de ACLS.28,29
– Los pacientes con paro cardíaco con antecedentes de insuficiencia renal conocida, enfermedad crítica o en hemodiálisis justifican una evaluación rápida de la gasometría sanguínea que mide el potasio.
– La sospecha de hiperpotasemia como etiología requiere cloruro de calcio al 10% (1 amperio o 10 ml), con dosis repetidas hasta QRS < 100 ms, a través de vía INTRAVENOSA periférica o vía central.28,29
– Se debe proporcionar epinefrina para seguir, así como insulina y glucosa.
– El bicarbonato de sodio se puede proporcionar como 1 amp.
– Una vez que se confirma la hiperpotasemia en VBG u otras pruebas de laboratorio, la hemodiálisis es esencial.
– El ROSC puede ocurrir después de la estabilización de la membrana de cloruro de calcio, que dura de 20 a 30 minutos. En este punto, el desplazamiento intracelular y la eliminación son objetivos.4,5,28,29,65
Puntos clave
– El potasio juega un papel clave en la fisiología y se encuentra predominantemente intracelular. La hipercalemia produce cambios en los potenciales de membrana celular, principalmente en las células cardíacas y neuromusculares.
– El ECG es la primera prueba esencial, pero no se puede confiar en la ausencia de hallazgos para excluir la hiperpotasemia.
– El manejo incluye estabilización de membrana cardíaca, desplazamiento transcelular y excreción.
– Se puede administrar gluconato de calcio al 10% para la estabilización de la membrana, a menos que el paciente esté en paro cardíaco, en el que se deben administrar 10 ml de cloruro de calcio.
– Los agonistas beta y la insulina de acción corta con glucosa son eficaces para desplazar el potasio intracelularmente. La perfusión de dextrosa debe realizarse a base de glucosa sérica.
– No se recomienda bicarbonato de sodio a menos que el paciente tenga acidemia.
– La excreción incluye diuresis urinaria, eliminación gastrointestinal y hemodiálisis.
– No se recomienda el uso de SPS o kayexalate. Los nuevos medicamentos, como el patiromer y el ciclosilicato de sodio y circonio, son prometedores para la excreción GASTROINTESTINAL.
– La diálisis es el medio definitivo para eliminar el potasio. Los ringer lactados y el plasmalito pueden ser más seguros para la rehidratación de líquidos si es necesario.
Referencias / Lecturas complementarias:
- Faridi AB, Weisberg LS. Anomalías ácido-base, electrolíticas y metabólicas. En: Medicina de Cuidados Críticos: Principios de Diagnóstico y Manejo en Adultos. Parrillo JE, Dellinger RP (Eds). Tercera Edición. Filadelfia, Elsevier,2008; 1203-1243.
- Monte DB, Zandi-Nejad K. Trastornos del equilibrio de potasio. En: Brenner and Rector’s The Kidney, 9th Ed, WB Saunders & Company, Filadelfia 2011. p. 640.
- RS marrón. Homeostasis de potasio e implicaciones clínicas. Am J Med.1984 Nov 5;77 (5A): 3-10.
- Kidney International 2016; 89: 546-554.
- Weisberg LS. Manejo de la hiperpotasemia severa. Medicina de Hematocrito. 2008;36(12):3246-51.
- Gennari FJ: Trastornos de la homeostasis del potasio. Hipopotasemia e hiperpotasemia. Cuidado del Hematocrito 2002;18:273-288
- Stevens MS, Dunlay RW. Hiperpotasemia en pacientes hospitalizados. Int Urol Nephrol 2000; 32: 177-180.
- Mandal AK. Hipopotasemia e hiperpotasemia. Med Clin North Am. 1997;81(3):611-639.
- Fisch C. Relación de las alteraciones electrolíticas con las arritmias cardíacas. Circulation 1973; 47: 408-419.
- Surawicz B. Electrolitos y electrocardiograma. Posgrado Médico 1974; 55:123–129.
- Freeman K,Feldman JA, Mitchell P, et al. Efectos de presentación y electrocardiograma a tiempo para el tratamiento de la hiperpotasemia. Acad Emerg Med. 2008 Mar;15(3): 239-49.
- Mattu A, Brady WJ, Robinson D. Manifestaciones electrocardiográficas de hipercalemia. Am J Emerg Med. 2000; 18: 721–729.
- Dodge HT, Grant RP, Seavey PW. El efecto de la hiperpotasemia inducida en el electrocardiograma normal y anormal. Am Heart J. 1953 May; 45 (5): 725-40.
- Wrenn KD, Slovis CM, Slovis BS. La capacidad de los médicos para predecir la hiperpotasemia a partir del ECG. Ann Emerg Med. 1991 Nov;20 (11): 1229-32.
- Szerlip HM, Weiss J, Singer I. Hipercalemia profunda sin manifestaciones electrocardiográficas. Am J Enfermedad Renal. 1986 Jun; 7 (6): 461-5.
- Montague BT, Ouellette JR, Buller GK. Revisión Retrospectiva de la Frecuencia de Cambios en el ECG en la Hiperpotasemia. Revista Clínica de la Sociedad Americana de Nefrología: CJASN. 2008;3(2):324-330.
- Chamberlain M. Tratamiento de emergencia de la hiperpotasemia. Lanceta. 1964;1:464–467.
- Bisogno JL, Langley A, Von Dreele MM. Efecto del calcio para revertir los efectos electrocardiográficos de la hiperpotasemia en el corazón aislado de rata: Un estudio prospectivo de respuesta a la dosis. Crit Care Med 1994; 22: 697-704.
- Martin T, Kang Y, Robertson K, et al. Ionización y efectos hemodinámicos del cloruro de calcio y el gluconato de calcio en ausencia de función hepática. Anaesthesia 1990; 73: 62-5.
- Davey M, Caldicott D. Sales de calcio en el tratamiento de la hiperpotasemia. Revista de Medicina de Emergencia: EMJ. 2002;19(1):92-93.
- Cote CJ, Drop LJ, Daniels AL, et al. Cloruro de calcio versus gluconato de calcio: comparación de la ionización y los efectos cardiovasculares en niños y perros. Anesthesiology 1987; 66: 465-70.
- Ballantyne F III, Davis LD, Reynolds EW Jr, et al. Base celular para la reversión de los cambios electrocardiográficos hipercalémicos por sodio. Am J Physiol 1975; 229: 935-940.
- Batterink J, Cessford TA, Taylor RAI. Intervenciones farmacológicas para el tratamiento agudo de la hiperpotasemia en adultos. Base de Datos Cochrane de Revisiones Sistemáticas 2015, Número 10. Arte. No.: CD010344. DOI: 10.1002 / 14651858.CD010344. pub2.
- Mahoney BA,Smith WA, Lo DS, et al. Intervenciones de emergencia por hiperpotasemia. Cochrane Database Syst Rev. 2005 Apr 18; (2): CD003235.
- Elliott MJ, Ronksley PE, Clase CM, et al. Manejo de pacientes con hiperpotasemia aguda. 2010;182:1631–1635.
- Harel Z, Kamel KS. Dosis Óptima y Método de Administración de Insulina Intravenosa en el Manejo de la Hiperpotasemia de Emergencia: Una Revisión Sistemática. Barretti P, ed. PLoS UNO. 2016; 11 (5): e0154963.
- Ho K. Una respuesta críticamente rápida: transporte de potasio y glucosa estimulado por insulina en el músculo esquelético. Clin J Am Soc Nephrol. 2011;6:1513–1516.
- Soar J, Perkins GD, Abbas G, et al. Directrices del Consejo Europeo de Reanimación para la Reanimación 2010, Sección 8. Paro cardíaco en circunstancias especiales: anomalías electrolíticas, envenenamiento, ahogamiento, hipotermia accidental, hipertermia, asma, anafilaxia, cirugía cardíaca, trauma, embarazo, electrocución. Resucitación. 2010;81:1400–1433.
- Vanden Hoek TL, Morrison LJ, Shuster M, et al. Parte 12: paro cardíaco en situaciones especiales: Directrices de la Asociación Americana del Corazón de 2010 para Reanimación Cardiopulmonar y Atención Cardiovascular de Emergencia. Circulación. 2010;122 (suppl 3): S829–S861.
- Li Q, Zhou MT, Wang Y, et al. Efecto de la insulina sobre la hiperpotasemia durante la etapa anhepática del trasplante hepático. World J Gastroenterol 2004; 10: 2427-9.
- Allon M, Copkney C. Albuterol e insulina para el tratamiento de la hipercalemia en pacientes en hemodiálisis. Kidney Int 1990; 38 (5): 869-72.
- Allon M, Shanklin N. Efecto de la administración de bicarbonato sobre el potasio plasmático en pacientes dializados: interacciones con insulina y albuterol. Am J Kidney Dis 1996; 28: 508-14.
- Mahajan SK, Mangla M, Kishore K. Comparison of aminophylline and insulin–dextrose infusions in acute therapy of hyperkalemia in end-stage renal disease J Assoc Physicians India 2001;49:1082-5.
- Ngugi NN, McLigeyo SO, Kayima JK. Treatment of hyperkalaemia by altering the transcelular gradient in patients with renal failure: effect of various therapeutic East Afr Med J 1997;74:503-9.
- Schafers S, Naunheim R, Vijayan A, et al. Incidencia de hipoglucemia después de la estabilización aguda del tratamiento de hiperpotasemia a base de insulina. J Hosp Med. 2012;7(3):239-242.
- Apel J, Reutrakul S, Baldwin D. Hipoglucemia en el tratamiento de la hiperpotasemia con insulina en pacientes con enfermedad renal terminal. Clin Kidney J. 2014; 7 (3): 248-250.
- Goldfarb S, Cox M, Singer I, et al. Hipercalemia aguda inducida por hiperglucemia: mecanismos hormonales. Ann Intern Med. 1976;84:426–432.
- Palmer BF. Regulación de la homeostasis del potasio. Clin J Am Soc Nephrol. 2015;10:1050–1060.
- Clausen T, Everts ME. Regulación de la bomba Na, K en el músculo esquelético. Kidney Int 1989; 35: 1-13.
- Moratinos J, Reverte M. Efectos de las catecolaminas sobre el potasio plasmático: el papel de los receptores adrenérgicos alfa y beta. Fundam Clin Pharmacol. 1993;7(3-4):143-53.
- Allon M. Hiperpotasemia en la enfermedad renal terminal: mecanismos y manejo. J Am Soc Nephrol 1995; 6: 1134.
- Allon M, Dunlay R, Copkney C. Albuterol nebulizado para hiperpotasemia aguda en pacientes en hemodiálisis. Ann Intern Med. 1989;110:426-9.
- Allon M, Shanklin N. Efecto del tratamiento con albuterol en la eliminación dialítica posterior de potasio. Am J Kidney Dis 1995; 26: 607-13.
- Blumberg A, Weidmann P, Shaw S, et al. Efecto de diversos enfoques terapéuticos sobre el potasio plasmático y los principales factores reguladores de la insuficiencia renal terminal. American Journal of Medicine. 1988;85(4):507–12.
- Iqbal Z, Friedman EA. Terapia preferida de hipercalemia en insuficiencia renal: encuesta de entrenamiento en nefrología-programa N Engl J Med. 1989 Jan 5; 320 (1): 60-1.
- Blumberg A, Weidmann P, Ferrari P. Efecto de la administración prolongada de bicarbonato sobre el potasio plasmático en insuficiencia renal terminal. Riñón Int. 1992;41:369–374.
- Fraley DS, Adler S. Corrección de la hiperpotasemia mediante bicarbonato a pesar de un pH sanguíneo constante. 1977 Nov; 12 (5): 354-60.
- Gutiérrez R, Schlessinger F, Oster JR, et al. Efecto del bicarbonato sódico hipertónico versus isotónico sobre la concentración plasmática de potasio en pacientes con enfermedad renal terminal. Metab de Electrolitos Mineros. 1991;17(5):297-302.
- Jentzer JC, DeWald TA, Hernandez AF. Combinación de diuréticos del asa con diuréticos del tipo tiazida en la insuficiencia cardíaca. J Am Coll Cardiol. 2010 Nov 2; 56 (19): 1527-34.
- Scherr L, Ogden DA, Mead AW, et al. Manejo de la hiperpotasemia con una resina intercambiadora de cationes. N Engl J Med 1961; 264: 115-119.
- Flinn RB, Merrill JP, Welzant WR, et al. Tratamiento del paciente oligúrico con una nueva resina intercambiadora de sodio y sorbitol; informe preliminar. N Engl J Med. 1961 Jan 19; 264: 111-5.
- Sterns RH, Rojas M, Bernstein P, et al. Resinas de intercambio iónico para el tratamiento de la hipercalemia: ¿son seguras y eficaces? J Am Soc Nephrol. 2010 May;21 (5): 733-5.
- Beccari MV, Meaney CJ. Utilidad clínica del patiromero, el ciclosilicato de sodio y circonio y el sulfonato de poliestireno de sodio para el tratamiento de la hipercalemia: una revisión basada en la evidencia. Pruebas Básicas. 2017;12:11-24.
- Weir MA, Juurlink DN, Gomes T, et al. Bloqueadores beta, trimetoprim sulfametoxazol y el riesgo de hipercalemia que requiera hospitalización en ancianos: un estudio de casos y controles anidado. Clin J Am Soc Nephrol. 2010;5:1544–1551.
- Huang I. RLY5016: un nuevo polímero terapéutico, no absorbido, para el control del potasio sérico. J Am Soc Nephrol. 2010; 21: 482A–483A.
- Bakris GL, Pitt B, Weir MR, et al, para los investigadores de AMATISTA-ND. Effect of patiromer on sérico potassium level in patients with hyperkalemia and diabetic kidney disease: the AMETHYST-DN randomized clinical trial. JAMA. 2015;314:151–161.
- Montaperto AG, Gandhi MA, Gashlin LZ, et al. Patiromer: una revisión clínica. Curr Med Res Opin. 2016;32(1):155-64.
- Packham DK, Kosiborod M. Farmacodinámica y farmacocinética del ciclosilicato de sodio y circonio en el tratamiento de la hipercalemia. Experto en Drogas Opin Metab Toxicol. 2016 May;12 (5): 567-73.
- Ash SR, Singh B, Lavin PT, et al. Un estudio de fase 2 sobre el tratamiento de la hiperpotasemia en pacientes con enfermedad renal crónica sugiere que la trampa selectiva de potasio, ZS-9, es segura y eficiente. Riñón Int. 2015;88:404–411.
- Packham DK, Rasmussen HS, Lavin PT, et al. Ciclosilicato de sodio y circonio en hipercalemia. N Engl J Med. 2015;372:222–231.
- Meaney CJ, Beccari MV, Yang Y, et al. Revisión Sistemática y Metanálisis de Patiromer y Ciclosilicato de Sodio y Circonio: Un Nuevo Arsenal para el Tratamiento de la Hipercalemia. 2017 Apr; 37 (4): 401-411.
- Blumberg A, Roser HW, Zehnder C, et al. Potasio plasmático en pacientes con insuficiencia renal terminal durante y después de la hemodiálisis; relación con la eliminación dialítica de potasio y el potasio corporal total. Trasplante de Nephrol. 1997;12:1629–1634.
- Feig P, Shook A, Sterns R. Efecto de la eliminación de potasio durante la hemodiálisis en la concentración plasmática de potasio. Nefrona. 1981;27:25–30.
- Agar BU, Culleton BF, Fluck R, Leypoldt JK. Cinética de potasio durante la hemodiálisis. Hemodial Int. 2015;19:23–32.
- Alfonzo AV, Simpson K, Deighan C, Campbell S, Fox J. Modifications to advanced life support in renal failure. Resuscitation 2007;73:12–28.