Autores: Brit Longa, MD (@long_brit, SAUSHEC EM Médico) e Justin R. Warix, FAZER, FAAEM (EM Médico, Central Península de Hospital, Soldotna, AK) // Editado por: Alex Koyfman, MD (@EMHighAK, EM Médico, UT Southwestern Medical Center / Parkland Memorial Hospital)
bem-vindo de volta para emDocs Casos! Hoje temos discussão baseada em casos sobre um tema central EM, com um olhar para alguma Controvérsia e tratamentos de ponta.
—————————-
uma mulher de 62 anos com história de doença renal em diálise, hipertensão e CAD apresenta náuseas e fraqueza. Ela faltou à sessão de diálise de hoje. Os seus VS são normais, e o exame também é normal. Qual é o seu primeiro teste?
- o ECG!
- Qual é a literatura por trás deste regime? Há algo melhor?
- Antes de começarmos, vamos cobrir algumas noções básicas.
- Gestão
- 1) Cardíaca Membrana de Estabilização
- 2) Mudança Transcelular
- tratamento combinado
- 3) a excreção de potássio
- o que acontece em paragem cardíaca devido a hipercaliemia?
- Pontos-Chave
- referências / outras leituras:
o ECG!
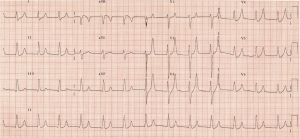
você vê ondas T grandes e altas com ausência de ondas P. O VBG retorna com potássio de 7, 3 mmol/l, com 140 mmol de sódio / L e lactato normal. Este regime consiste classicamente em cálcio (gluconato ou sal cloreto), agonista Beta (10-20 mg de albuterol nebulizado) e/ou bicarbonato (1 amp), insulina (10 unidades de Glucose/normal D50 1 amp), Kayexalato (15-30 g oral ou rectal), diuréticos (40 mg de furosemida) e unidade Renal para diálise do doente.
Qual é a literatura por trás deste regime? Há algo melhor?
Antes de começarmos, vamos cobrir algumas noções básicas.
– o sistema renal desempenha o papel mais importante na regulação do potássio (90% da excreção). Os níveis normais são de 3, 5-5, 0 mEq / L ou mmol / L. 1,2
– as alterações nestes níveis afectam o potencial da membrana celular e resultam em sintomas cardíacos e neuromusculares. A bomba Na-K-ATPase desempenha um grande papel no gradiente da membrana celular.
– hipercaliemia ligeira: 5, 5-6, 5 mEq/L (perto de 10% dos doentes admitidos).4– 7
-níveis moderados são 6, 5-7, 5 mEq/L, e grave > 7, 5 mEq/L. 4-7
etiologia: as causas do potássio elevado incluem:: excessive exogenous potassium, excessive endogenous potassium (hemolysis, rhabdomyolysis, burns, tumor lysis syndrome, trauma), redistribution (acidemia, medications (succinylcholine, beta-blockers), and insulin deficiency), decrease in excretion (renal failure/injury, decreased mineral corticoids, medications), factitious (hemolysis, thrombocytosis, venipuncture issue, leukocytosis).5-8
Clinical Manifestations: Since potassium plays an important role in Na-K-ATPase physiology, hyperkalemia can result in several important effects, primarily cardiac and neuromuscular. No entanto, as características clínicas são não específicas e incluem fraqueza geral, letargia ou confusão. Os reflexos dos tendões profundos podem estar deprimidos ou ausentes, embora os nervos cranianos, a função do diafragma e a sensação sejam normalmente normais. Os efeitos GI incluem náuseas, vómitos e diarreia.
o nosso doente apresentou fraqueza e alterações no ECG. Você pediu vários medicamentos, e vamos começar o nosso profundo mergulho no tratamento de hipercaliemia.
Gestão
– o tratamento não depende da causa da hipercaliemia, mas deve concentrar-se na reversão ou prevenção de efeitos e complicações disritmicos.
– estabeleça a sua rede de segurança de acesso IV, monitorização contínua e O2.
– o controlo centra-se na estabilização cardíaca, no desvio transcelular e na excreção de potássio. Este deve começar imediatamente após a hipercalemia é suspeita, por ECG alterado (incluindo atingiu as ondas T) ou de potássio > 6.5 mmol/L. 4,5,10,11,16

1) Cardíaca Membrana de Estabilização
Cálcio diminui hipercalemia da despolarização efeito e reduz o limiar do potencial de miócitos cardíacos em poucos minutos.4,5,17-19 Isso estabiliza a membrana celular cardíaca, mas não resulta em deslocamento transcelular ou excreção de potássio, o que requer outros medicamentos.
– o cálcio pode ser administrado sob a forma de duas formas: cloreto ou sal de gluconato. O sal de cloreto de Ca contém 13, 6 meq em 10 mL, enquanto o sal de gluconato de Ca contém 4, 6 meq em 10 mL.4,5,18,19 gluconato de Ca pode ser administrado através de uma linha IV periférica. A extravasação de cloreto de Ca pode causar necrose tecidular, e a linha central é recomendada se possível (a menos que a situação de código.) 4,5
– CaCl 1 g contém aproximadamente 270 mg de Ca2+, enquanto 3 ampulos gluconato de cálcio contém a quantidade equivalente (aproximadamente 90 mg de Ca2+ por ampola).18, 19
– a literatura sugere que o gluconato de Ca tem um tempo de início semelhante ao do cloreto de Ca e pode não requerer actividade hepática. Vários estudos realizados em doentes submetidos a transplante hepático demonstraram um aumento semelhante na Ca após qualquer uma das formulações.19-21 um estudo realizado em cães e doentes pediátricos demonstra achados semelhantes.21
– o início da acção é inferior a 3 minutos, com duração de 20-60 minutos.4,5
conclusão: 1g (10 mL) O gluconato de Ca IV deve ser fornecido a doentes com resultados de ECG (ondas t máximas ou piores), com reavaliação dentro de 5 minutos. Deve ser fornecido mais cálcio se não for observada qualquer alteração ou agravamento do ECG. Um doente em paragem cardíaca ou com acesso central deve receber 1 g de cloreto de Ca IV.
existe outra opção para estabilização cardíaca? A solução salina hipertónica (3%) pode ser utilizada em 100 ml de bólus, embora esta tenha sido predominantemente estudada em doentes com hiponatremia e hipercaliemia.22
2) Mudança Transcelular
isto deve ocorrer com ou imediatamente após o cálcio para redistribuir o potássio.4,5,23-25

a) insulina e Glucose – estas medidas reduzem o potássio sérico de forma dependente da dose.4, 5, 23-26 a activação da Na-K-ATPase e o recrutamento da bomba intracelular (receptores GLUT4) para a membrana celular são responsáveis pelo transporte intracelular de K.27
– classicamente, é fornecida insulina regular 10-20 unidades, com dextrose 25 g (uma ampola de D50) se os níveis de glucose no sangue forem inferiores a 250 mg/dL.4,5, 28, 29
– a insulina e a glucose diminuem o potássio em 0, 45-0, 61 mmol/l em 15 minutos, 30-32 0.87 mmol/l a 30 minutos,33,34 e 0, 47 mmol / l a uma hora.Outros estudos sugerem que pode resultar numa diminuição até 1, 2 mmol / L. 23,24
– a insulina / glucose tem início de acção em menos de 15 minutos (mais frequentemente 5-10 minutos) e tempo de Acção máxima em 25-30 minutos.A duração da acção é de 23,24 horas.
– a quantidade de glucose a fornecer pode ser difícil de determinar, e o quadro 1 abaixo oferece um meio fácil de seguir para determinar o que deve ser fornecido.
– os factores incluem ausência de diabetes prévia, ausência de medicamentos para a diabetes e diminuição da glucose antes do tratamento. A lesão ou doença Renal é um factor potencial, uma vez que a insulina é metabolizada por via renal.4, 5, 36
– uma potencial alteração inclui a utilização de insulina de acção curta, tal como a insulina lispro ou aspart, que possuem semi-vidas mais curtas, são mais rapidamente absorvidos, e não se prolongam na insuficiência renal/lesão. Este medicamento pode ser fornecido na forma de bólus de insulina de acção curta, apenas de 10 unidades, ou bólus de 6 unidades, seguido de uma perfusão de 20 unidades por hora de lispro ou aspártico. Estes regimes proporcionam diminuições semelhantes no potássio sérico, enquanto resultam em menos hipoglicemia.Não se recomenda apenas 4,5
– Glucose, o que pode resultar em hipertonicidade e hipercaliemia.37,38
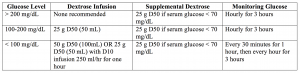
conclusão: insulina de acção curta 10 unidades IV, com perfusão de glucose como acima descrito.

B) agonistas Beta – catecolaminas aumentam a actividade da bomba Na-K-ATPase e do cotransportador Na-K-2CL.1-5,39,40
– o albuterol Nebulizado é administrado em doses de 10-20 mg, em vez dos 5 mg normais para a doença obstrutiva.
-Albuterol pode ser dado IV em doses de 0,50 mg, e terbutaline pode ser dado IM em doses de 0,25 mg. 4,5,23,24,31,41-43
– o potássio diminui 0, 6 mmol/L com 10 mg e 1, 0 mmol/l com 20 mg numa hora.31,41-43
– o início é de 20-30 minutos, com duração superior a duas horas.31,41-43
– as formulações IV incluem epinefrina, albuterol 0, 5 mg, ou salbutamol 2, 5 mg, embora os efeitos secundários sejam mais comuns.23, 24, 34
– os efeitos secundários incluem tremor, palpitações e ansiedade. As formas IV apresentam maior risco de aumento da pressão arterial e dor de cabeça.
conclusão: Albuterol 20 mg em 4 mL de solução salina normal nebulizado durante 10 minutos.

C) bicarbonato de sódio – bólus bicarbonato de sódio foi recomendado para o tratamento agudo da hipercaliemia, com base em estudos que avaliaram a perfusão prolongada de bicarbonato de sódio (durante horas).23,24,31,32,44-46
– no Entanto, a literatura em pacientes com pH normal não suporta bicarbonato de hipercalemia.4,5,23,24
tratamento combinado
– Allon et al. encontra uma diminuição máxima no potássio de 1, 21 mmol/L com insulina IV de glucose com albuterol nebulizado.31
– bicarbonato não deve ser utilizado a menos que o doente esteja acidémico.4,5
conclusão: o bicarbonato de sódio pode ser utilizado em doentes com acidemia e hipercaliemia, mas não é útil em outros doentes. A terapêutica de associação é eficaz com agonista beta e insulina/glucose na Alteração do potássio.A glucose do doente é 153. Administrar gluconato de cálcio 10% 10 mL IV, seguido de 10 unidades de insulina de acção curta com uma ampola D50 e 20 mg de albuterol nebulizado. Qual é o teu próximo passo?
3) a excreção de potássio
as formas de excreção incluem a urina, o sistema GI e o sangue.1-5 rins são a via predominante de excreção. Os médicos devem avaliar o estado do volume do doente e a capacidade de produzir urina. Se o paciente pode produzir urina, um diurético é uma opção válida.4,5 no entanto, a hemodiálise é o melhor meio de remoção definitiva de potássio.

a) diurese urinário – este pode ser usado enquanto prepara o paciente para Hemodiálise. A diurese urinária não é útil se o doente não puder produzir urina, embora possa ser útil em doentes com compromisso moderado da função renal.4,5
– os diuréticos da ansa, tais como a furosemida, fornecem a maior excreção urinária de potássio.
– estes agentes são os melhores em doentes com hipervolemia ou euvolemia. Se fornecido, os médicos devem monitorizar cuidadosamente a saída urinária e os electrólitos.

B) GI – várias opções estão disponíveis, com vários novos agentes oferecendo melhores opções do que Kayexalate.
– sulfonato de poliestireno de sódio (SPS), ou Kayexalato, é uma resina de troca iônica que troca sódio por amónio, cálcio, magnésio e potássio para permitir a eliminação de potássio através de fezes.4,5,23-26 infelizmente, a literatura por trás do SPS é extremamente fraca, com estudos recentes e Revisões Cochrane recomendando contra o seu uso.50,51 este medicamento fornece uma carga de sódio ao colocar o paciente em risco de obstipação, obstrução, e ainda pior, isquemia intestinal e necrose. A medicação até possui um alerta de caixa preta da FDA.4,5,23,24,52 para mais, ver http://www.emdocs.net/skeptical-em-myths-evidence/ ehttp://rebelem.com/kayexalate-useful-treatment-hyperkalemia-emergency-department/
– Patiromer é um polímero sintético constituído por esferas esféricas não absorvíveis.52,53 o início de ação do medicamento é de 7-48 horas, com a duração de efeito 12-24 horas. 52-54 voluntários saudáveis demonstram uma diminuição do potássio, relacionada com a dose, de 15-20 mmol.55-57 Doses de 15-30g / dia parecem eficazes. O efeito secundário mais comum inclui hipomagnesemia (8, 6%), embora não tenham sido encontradas arritmias cardíacas nestes doentes. De notar, a medicação possui uma caixa preta de aviso para a separação de pelo menos seis horas de outros medicamentos orais.4
– ciclosilicato de zircónio sódico (ZS-9) é um polímero sintético constituído por esferas esféricas não absorvíveis.53,54 a medicação liga-se mais de nove vezes a quantidade de potássio quando comparada com SPS, uma vez que um poro de ligação dentro da estrutura cristalina se liga especificamente ao potássio.O início da acção de 143.149 ZS-9 é de 1-6 horas, com a duração de efeito de 4-12 horas. Vários estudos suportam a sua utilização, com 10 g/dia a diminuir o potássio em 0, 4 mmol/L a uma hora e 0, 7 mmol/L a 4 horas.58– 60
-uma meta-análise comparou patiromer e ZS-9, encontrando patiromer diminui o potássio em 0, 36 mEq/L no dia 3 do tratamento.61 ZS-9 demonstra uma diminuição de 0, 17 mEq/L a uma hora e de 0, 67 mEq / L a 2 dias.61

C) diálise – esta é a forma mais eficaz de remover o potássio, com o potássio a diminuir 1 mmol/l a 1 hora e 2 mmol/l a 2-3 horas. A diminuição do dialisato de potássio e o aumento do fluxo sanguíneo podem resultar numa diminuição mais rápida do potássio sérico.4,5
– hipercaliemia de exacerbação pode ser observada após diálise, provavelmente relacionada com os níveis de potássio pré-diálise.4, 5
– a hemodiálise deve ser considerada precocemente no doente com insuficiência renal diagnosticada, incapacidade de produzir urina, hipercaliemia resistente a outro tratamento, paragem cardíaca e destruição marcada dos tecidos.62-64
Conclusão: A diálise é mais eficaz na remoção definitiva de potássio. O SPS não é eficaz e deve ser evitado devido ao seu risco de necrose colónica.
chama o nefrologista relativamente à diálise e repete um ECG, o que demonstra um ritmo sinusal normal com uma taxa de 72 bpm. O nefrologista diz que ela desce já para ver o paciente.
o que acontece em paragem cardíaca devido a hipercaliemia?
hipercaliemia altera o potencial de repouso cardiomiocitário, resultando na inactivação dos canais de sódio e bloqueio da condução. Pacientes em paragem devido a hipercaliemia requerem compressões imediatas e medidas ACLS.28. 29
– Suspeita de hipercalemia como etiologia requer cloreto de cálcio a 10% (1 amp ou 10 mL), com repetição da dosagem até QRS < 100 ms, através de periféricos IV ou linha central.Devem ser fornecidas 28,29
– epinefrina para acompanhamento, bem como insulina e glucose.
– bicarbonato de sódio pode ser fornecido como 1 amp.
– uma vez confirmada a hipercaliemia em VBG ou outros testes laboratoriais, a hemodiálise é essencial.
Pontos-Chave
– Potássio desempenha um papel fundamental na fisiologia e é predominantemente encontrado intracellularly. A hipercaliemia resulta em alterações no potencial da membrana celular, principalmente nas células cardíacas e neuromusculares.
– ECG é o primeiro teste essencial, mas a ausência de resultados não pode ser invocada para excluir hipercaliemia.
– o tratamento inclui a estabilização da membrana cardíaca, o deslocamento transcelular e a excreção.
– gluconato de cálcio 10% pode ser administrado para estabilização da membrana, a menos que o doente esteja em paragem cardíaca, na qual devem ser administrados 10 mL de cloreto de cálcio.
– agonistas Beta e insulina de acção rápida com glucose são eficazes na alteração intracelular do potássio. A perfusão de Dextrose deve ser fornecida com base na glucose sérica.
– bicarbonato de sódio não é recomendado a menos que o doente esteja acidémico.
– a excreção inclui diurese urinária, eliminação GI e hemodiálise.
– SPS ou kayexalato não é recomendado. Novos medicamentos, incluindo patiromer e ciclosilicato de zircónio, prometem a excreção GI.
– a diálise é a última forma de remover o potássio. Ringer lactado e Plasmalyte podem ser mais seguros para rehidratação de fluidos, se necessário.
referências / outras leituras:
- Faridi AB, Weisberg LS. Alterações ácido-base, electrólitos e metabólicas. In: Critical Care Medicine: Principles of diagnostic and Management in Adults. Parrillo JE, Dellinger RP (Eds). Terceira Edição. Philadelphia, Elsevier, 2008;1203-1243.
- Mount DB, Zandi-Nejad K. Disorders of potassium balance. In: Brenner and Rector’s the Kidney, 9th Ed, WB Saunders & Company, Philadelphia 2011. P. 640.
- Brown RS. Homeostase de potássio e implicações clínicas. Am J Med.1984 Nov 5; 77 (5A): 3-10.
- Kidney International 2016; 89: 546-554.
- Weisberg LS. Tratamento de hipercaliemia grave. Hematócrito Med. 2008;36(12):3246-51.Gennari FJ: perturbações da homeostase do potássio. Hipocaliemia e hipercaliemia. Crit Care Clin 2002;18:273-288
- Stevens MS, Dunlay RW. Hipercaliemia em pacientes hospitalizados. Int Urol Nephrol 2000; 32: 177-180.
- Mandal AK. Hipocaliemia e hipercaliemia. Med Clin North Am. 1997;81(3):611-639.Fish C. relação das alterações electrolíticas com arritmias cardíacas. Circulation 1973; 47: 408-419.
- Surawicz B. electrólitos e o electrocardiograma. Pós-Graduação Em 1974; 55:123–129.Freeman K, Feldman JA, Mitchell P, et al. Efeitos da apresentação e electrocardiograma no tempo para o tratamento da hipercaliemia. Acad Emerg Med. 2008 Mar; 15 (3):239-49.
- Mattu a, Brady WJ, Robinson D. manifestações Electrocardiográficas de hipercaliemia. Am J Emerg Med. 2000; 18: 721–729.Dodge HT, Grant RP, Seavey PW. O efeito da hipercaliemia induzida no electrocardiograma normal e anormal. Am Heart J. 1953 May; 45 (5): 725-40.
- Wrenn KD, Slovis CM, Slovis BS. A capacidade dos médicos para prever hipercaliemia a partir do ECG. Ann Emerg Med. 1991 Nov; 20 (11):1229-32.Szerlip HM, Weiss J, Singer I. hipercaliemia profunda sem manifestações electrocardiográficas. Am J Kidney Dis. 1986 Jun; 7 (6):461-5.BT, Ouellette JR, Buller GK. Retrospective Review of the Frequency of ECG Changes in Hyperkalemia. Clinical Journal of the American Society of Nephrology: CJASN. 2008;3(2):324-330.Chamberlain M. Emergency treatment of hipercalemia. Lanceta. 1964;1:464–467.
- Bisogno JL, Langley A, Von Dreele MM. Efeito do cálcio para reverter os efeitos electrocardiográficos da hipercaliemia no coração de rato isolado: um estudo prospectivo de resposta à dose. Crit Care Med 1994; 22: 697-704.
- Martin T, Kang Y, Robertson K, et al. Ionização e efeitos hemodinâmicos do cloreto de cálcio e gluconato de cálcio na ausência de função hepática. Anestesia 1990; 73: 62-5.
- Davey M, Caldicott D. sais de cálcio no tratamento da hipercaliemia. Emergency Medicine Journal: EMJ. 2002;19(1):92-93.
- Cote CJ, Drop LJ, Daniels AL, et al. Cloreto de cálcio versus gluconato de cálcio: comparação de ionização e efeitos cardiovasculares em crianças e cães. Anesthesiology 1987; 66: 465-70.
- Ballantyne F III, Davis LD, Reynolds EW Jr, et al. Base celular para reversão de alterações eletrocardiográficas hipercalémicas pelo sódio. Am J Physiol 1975; 229: 935-940.
- Batterink J, Cessford TA, Taylor RAI. Intervenções farmacológicas para o tratamento agudo da hipercaliemia em adultos. Cochrane Database of Systematic Reviews 2015, Issue 10. Arte. Não.: CD010344. DOI: 10.1002/14651858.CD010344.pub2.
- Mahoney BA,Smith WA, lo DS, et al. Intervenções de emergência para hipercaliemia. Cochrane Database Syst Rev. 2005 Abr 18; (2): CD003235.
- Elliott MJ, Ronksley PE, Clase CM, et al. Tratamento de doentes com hipercaliemia aguda. 2010;182:1631–1635.
- Harel Z, Kamel KS. Dose óptima e modo de Administração de insulina intravenosa no tratamento da hipercaliemia de emergência: A Systematic Review. Barretti P, ed. PLoS um. 2016; 11(5):e0154963.Resposta criticamente rápida: transporte de potássio e glucose estimulados pela insulina no músculo esquelético. Clin J Am Soc Nephrol. 2011;6:1513–1516.
- Soar J, Perkins GD, Abbas G, et al. Orientações do Conselho Europeu de ressuscitação para 2010, Secção 8. Paragem cardíaca em circunstâncias especiais: anormalidades eletrolíticas, envenenamento, afogamento, hipotermia acidental, hipertermia, asma, anafilaxia, cirurgia cardíaca, trauma, gravidez, eletrocussão. Reanimacao. 2010;81:1400–1433.
- Vanden Hoek TL, Morrison Lj, Shuster M, et al. Part 12: cardiac arrest in special situations: 2010 American Heart Association Guidelines for Cardiopulmonary Resuscitation and Emergency Cardiovascular Care. Circulacao. 2010;122 (suppl 3):S829–S861.
- Li Q, Zhou MT, Wang Y, et al. Efeito da insulina na hipercaliemia durante o Estadio anhepático do transplante hepático. World J Gastroenterol 2004; 10: 2427-9.
- Alon m, Copkney C. Albuterol e insulina para o tratamento da hipercaliemia em doentes hemodializados. Kidney Int 1990; 38 (5):869-72.Efeitos da administração de bicarbonato no potássio plasmático em doentes em diálise: interacções com insulina e albuterol. Am J Kidney Dis 1996; 28: 508-14.Mahajan SK, Mangla M, Kishore K. Comparação das perfusões de aminofilina e insulina–dextrose em terapia aguda de hipercaliemia em doença renal terminal J Assoc Physicians India 2001;49:1082-5.
- Ngugi NN, McLigeyo SO, Kayima JK. Tratamento da hipercaliemia através da alteração do gradiente transcelular em doentes com insuficiência renal: efeito de vários terapêuticos East Afr Med j 1997;74:503-9.
- Schafers S, Naunheim R, Vijayan A, et al. Incidência de hipoglicemia após a estabilização aguda baseada em insulina do tratamento de hipercaliemia. J Hosp Med. 2012;7(3):239-242.Apel J, Reutrakul S, Baldwin D. Hipoglicemia no tratamento da hipercaliemia com insulina em doentes com doença renal terminal. Clin Kidney J. 2014;7 (3): 248-250.Goldfarb S, Cox M, Singer I, et al. Hipercaliemia aguda induzida por hiperglicemia: mecanismos hormonais. Ann Intern Med. 1976;84:426–432.
- Palmer BF. Regulação da homeostase de potássio. Clin J Am Soc Nephrol. 2015;10:1050–1060.
- Clausen T, Everts ME. Regulação Da Na, bomba K no músculo esquelético. Kidney Int 1989; 35: 1-13.
- Moratinos J, Reverse M. efeitos das catecolaminas no potássio plasmático: o papel dos alfa e beta-adrenoceptores. Fundam Clin Pharmacol. 1993;7(3-4):143-53.
- Allon M. hipercaliemia in end-stage renal disease: mechanisms and management. J Am Soc Nephrol 1995; 6: 1134.
- Alon m, Dunlay R, Copkney C. Nebulizou albuterol para hipercaliemia aguda em doentes hemodializados. Ann Intern Med. 1989;110:426-9.
- Allon m, Shanklin N. Effect of albuterol treatment on subsequent dialytic potassium removal. Am J Kidney Dis 1995; 26: 607-13.
- Blumberg a, Weidmann P, Shaw S, et al. Efeito de várias abordagens terapêuticas no potássio plasmático e principais factores reguladores na insuficiência renal terminal. American Journal of Medicine. 1988;85(4):507–12.
- Iqbal Z, Friedman EA. Preferredtherapy of hipercalemia in renal insuficiency: survey of nephrology training-program N Engl J Med. 1989 Jan 5; 320 (1): 60-1.
- Blumberg a, Weidmann P, Ferrari P. efeito da administração prolongada de bicarbonato no potássio plasmático na insuficiência renal terminal. Rim Int. 1992;41:369–374.
- Fraley DS, Adler S. Correcção da hipercaliemia por bicarbonato apesar do pH constante no rim. 1977 Nov; 12(5):354-60.
- Gutierrez R, Schlessinger F, Oster JR, et al. Efeito do bicarbonato de sódio hipertónico versus isotónico na concentração plasmática de potássio em doentes com doença renal terminal. Metab De Electrólito Miner. 1991;17(5):297-302.Jentzer JC, Dewald TA, Hernandez AF. Associação de diuréticos da ansa com diuréticos tipo-tiazida na insuficiência cardíaca. J. Am Coll Cardiol. 2010 Nov 2; 56 (19):1527-34.
- Scherr L, Ogden da, Mead aw, et al. Tratamento da hipercaliemia com resina de troca de catiões. N Engl J Med 1961; 264: 115-119.
- Flinn RB, Merrill JP, Welzant WR, et al. Tratamento do doente oligúrico com uma nova resina de permuta de sódio e sorbitol; um relatório preliminar. N Engl J Med. 1961 Jan 19; 264: 111-5.Sterns RH, Rojas M, Bernstein P, et al. Resinas de troca de iões para o tratamento da hipercaliemia: são seguras e eficazes? J Am Soc Nephrol. 2010 May; 21 (5):733-5.
- Beccari MV, Meaney CJ. Clinical utility of patiromer, sodium zirconium cyclosilicate, and sodium polystyrene sulfonate for the treatment of hipercalemia: an evidence-based review. Provas Principais. 2017;12:11-24.Weir MA, Juurlink DN, Gomes T, et al. Beta-bloqueadores, trimetoprim sulfametoxazol e o risco de hipercaliemia que exija hospitalização em idosos: um estudo aninhado de controlo de casos. Clin J Am Soc Nephrol. 2010;5:1544–1551.
- Huang I. RLY5016: um novo polímero terapêutico não absorvido para o controlo do potássio sérico. J Am Soc Nephrol. 2010; 21: 482A-483A.
- Bakris GL, Pitt B, Weir MR, et al, para os investigadores AMETHYST-DN. Efeito do patiromer nos níveis séricos de potássio em doentes com hipercaliemia e doença renal diabética: ensaio clínico aleatorizado com ametista-DN. JAMA. 2015;314:151–161.
- Montaperto AG, Gandhi MA, Gashlin LZ, et al. Patiromer: a clinical review. Curr Med Res Opin. 2016;32(1):155-64.
- Packham DK, Kosiborod M. Farmacodinamia e farmacocinética do ciclosilicato de zircónio de sódio no tratamento da hipercaliemia. Especialista Em Drogas Opin Metab Toxicol. 2016 May; 12(5):567-73.Ash SR, Singh B, Lavin PT, et al. Um estudo de Fase 2 sobre o tratamento da hipercaliemia em doentes com doença renal crónica sugere que a armadilha selectiva de potássio, ZS-9, é segura e eficiente. Rim Int. 2015;88:404–411.
- Packham DK, Rasmussen HS, Lavin PT, et al. Ciclosilicato de zircónio de sódio em hipercaliemia. N Engl J Med. 2015;372:222–231.
- CJ média, variável, Y Y, et al. Systematic Review and Meta-Analysis of Patiromer and Sodium Zirconium Cyclosilicate: A New Armamentarium for the Treatment of Hyperkalemia. 2017 Abr; 37 (4):401-411.
- Blumberg A, Roser HW, Zehnder C, et al. Potássio plasmático em doentes com insuficiência renal terminal durante e após a hemodiálise; relação com a remoção dialítica de potássio e o potássio corporal total. Transplante De Escala De Nephrol. 1997;12:1629–1634.
- Feig P, sacudiu a, Sterns R. efeito da remoção de potássio durante a hemodiálise na concentração plasmática de potássio. Nephron. 1981;27:25–30.
- ágar BU, Culleton BF, Fluck R, Leypoldt JK. Cinética do potássio durante a hemodiálise. Hemodial Int. 2015;19:23–32.
- Alfonzo AV, Simpson K, Deighan C, Campbell S, Fox J. Modifications to advanced life support in renal failure. Resuscitation 2007;73:12–28.